Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salus
versión impresa ISSN 1316-7138
Salus vol.20 no.2 Valencia ago. 2016
Producción de anticuerpos IgA contra componentes proteicos del huevo de Ascaris lumbricoides en el suero de niños infectados
Production of IgA antobodies against protein components of eggs from Ascaris lumbricoides in serum of infected children
Soriuska Mayora1, Aurora Hernán2, Juan Carlos Jiménez1, Leonor Pocaterra2, Elsy Rojas2, Vanessa Aldazoro1, Luz Núñez2
1 Instituto de Inmunología Dr. Nicolás E. Bianco C. Caracas, Venezuela.
2 Cátedra de Parasitología Escuela de Medicina Dr. José María Vargas, Universidad Central de Venezuela, Caracas, Venezuela.
Autor de Correspondencia: Juan Carlos Jiménez.
E-mail: jcjimenez488@hotmail.com
RESUMEN
La ascariasis es una enfermedad causada por el nematodo A. lumbricoides afectando a 1 billón de personas en todo el mundo. En este trabajo se analiza la respuesta de anticuerpos IgA específicos frente a extractos de huevos de A. lumbricoides en el suero de niños de comunidades rurales del estado Miranda. Se evaluaron 100 niños entre 3 y 14 años de edad y se tomaron muestras de suero y el diagnóstico coproparasitológico. Según lo reportado fueron clasificados en: infectados solo por A. lumbricoides (Asc+), no infectados (NSOP), infectados con A. lumbricoides y otros parásitos (Asc+/OP+) e individuos no infectados por A. lumbricoides pero con otros parásitos intestinales (Asc-/OP+). El extracto fue probado por ELISA, Western Blot e inmunocitoquímica. El perfil electroforético del extracto mostró 7 bandas proteicas de 102, 92, 85, 65, 50, 45 y 30kDa. Por la ELISA, el 26% de los pacientes infectados por A. lumbricoides fueron seropositivos, mientras que el 56% en el grupo NSOP fueron seronegativos. El ensayo de inhibición con extracto de A. lumbricoides permitió identificar 3 bandas proteicas especificas reconocidas por la inmunoglobulina IgA de 92, 85 y 65 kDa diferentes a las reconocidas por el extracto de verme adulto. El nivel de anticuerpos fue significativamente mayor en los infectados que en los no infectados. La superficie de los huevos fue reconocida por la IgA en el suero de los individuos infectados. Estos resultados, indican que el huevo de Ascaris induce anticuerpos específicos contra proteínas que podrían ser utilizados como antígenos en pruebas serológicas que complementan el diagnóstico de Ascariasis.
Palabras clave: A. lumbricoides, antígeno, anticuerpos, inmunoglobulina A (IgA), ELISA.
ABSTRACT
Ascariasis is a disease caused by the nematode A. lumbricoides affecting 1 billion people worldwide. In this study the specific response for IgA antibodies against extracts of A. lumbricoides eggs in the serum of children in rural areas of Miranda state. One hundred children were evaluated at ages 3 and 14 and were taken serum samples and diagnosis of stools. According to the reported, were classified into four groups: infected by A. lumbricoides (Asc +), uninfected (NSOP), infected A. lumbricoides and other parasite (Asc +/OP +); and individuals with other parasitic infections without A. lumbricoides (ASC/ OP+). The extract was tested by ELISA, Western blotting and immunocytochemestry. The electrophoretic profile showed 7 bands of 102, 92, 85, 65, 50, 45 and 30kDa. By ELISA, the 26% of patients in group A. lumbricoides were positive, while the 56% in the NSOP group were seronegative. Immune assay by inhibition with A. lumbricoides extract allowed identify three bands for the IgA antibodies of 92, 85 and 65 kDa different to the bands recognized by adult extracts of A. lumbricoiedes. The levels of antibodies were significantly higher in infected than non-infected children. In addition, the protein component on the surface of eggs was recognized by sera of infected individuals. These results indicate that eggs of Ascaris induce specific antibodies against proteins that could be used as antigens in serological diagnosis for complementing the diagnosis for Ascariasis.
Key words: A. lumbricoides, antigen, antibodies, immunoglobulin A (IgA), ELISA.
Recibido: 28/09/2015 Aprobado: 28/06/2016
INTRODUCCIÓN
La ascaridiasis es una infección causada por un helminto, Ascaris lumbricoides el cual es el más grande de los nemátodos que puede parasitar el intestino humano (1). Se estima que en el mundo hay más de 2 billones de individuos infectados con parásitos helmintos que proceden principalmente de las áreas tropicales y países en vías de desarrollo. Allí es donde las condiciones socio-económicas son limitadas, particularmente en comunidades rurales en cuyas áreas generalmente las medidas higiénicas no son aplicadas de manera constante (2). En Venezuela, la infección por Ascaris lumbricoides es la geohelmintiasis de mayor importancia en salud pública, por su alta frecuencia (35%), con una elevada morbilidad y la manifestación de complicaciones graves (3). La infección por Ascaris lumbricoides induce una potente respuesta humoral con la producción de IgE total e IgE específica (4). Han sido identificadas algunas proteínas con propiedades alergénicas tales como la proteína ABA-1(5), la tropomiosina (6) y más recientemente la glutatión transferasa (7). Estas proteínas pueden presentar reactividad cruzada con otros alérgenos ambientales, lo cual podría modificar la respuesta alérgica en los individuos expuestos al parásito (8). Hay estudios que indican que los individuos con títulos elevados de anticuerpos específicos IgE contra Ascaris lumbricoides presentan un bajo número de huevos por gramo de heces (hpg) con respecto a los individuos con baja respuesta de anticuerpos. Sugeriría una inducción de inmunidad para controlar la infección (9). Por otra parte, ha sido señalado que la respuesta IgA está relacionada con la disminución de la fecundidad de la hembra y la viabilidad de los huevos en el modelo de A. suum que lleva a la reducción del número de larvas (10). Actualmente el diagnóstico de ascariosis por pruebas inmunológicas ha sido realizado utilizando como antígeno el extracto total de larvas infectivas (11). Sin embargo, no hay información sobre si la presencia de los huevos estimula una respuesta de anticuerpos específicos de tipo IgA frente a esta forma del parásito. Considerando que la ingestión de los huevos es el primer contacto del parásito con el hospedador, la identificación de antígenos asociados a la respuesta IgA específica contra los huevos de A. lumbricoides seria de gran importancia.
MATERIALES Y MÉTODOS
Población. En el presente estudio fueron evaluados 100 niños de ambos géneros entre 4 y 13 años de las comunidades rurales: La Peica, Los Médanos, Teleférico y el Márquez, ubicadas en el Estado Miranda. Con previa información sobre los detalles de la investigación, los representantes dieron su consentimiento por escrito para la participación de los niños en el estudio. El protocolo de investigación fue aprobado por el Comité de Bioética del Instituto de Inmunología, U.C.V.
Diagnóstico coproparasitológico. Los individuos fueron clasificados según el examen coproparasitológico utilizando técnicas convencionales para el diagnóstico de protozoarios y helmintos. La detección de individuos parasitados fue realizada por examen directo de la muestra con solución salina y lugol, la técnica de Kato para helmintos y Formol- Tritón-Éter, observada al microscopio directo mediante la recolección de una sola muestra.
Preparación del extracto soluble del verme adulto y el huevo de A. lumbricoides. Se tomó un verme adulto hembra expulsado por migración errática de un niño para su disección y recuperación del oviducto para obtener los huevos fértiles y no fértiles. Tanto el verme adulto como la suspensión de huevos fueron lavados en PBS y lisados en 2mL de PBS con Tritón X-100 al 1%, sonicados con 15 ciclos de 40% de amplitud por 10 segundos para luego para ser centrifugados. Los sobrenadantes fueron considerados extractos solubles y utilizados en los experimentos posteriores y almacenados a -80ºC.
Separación de las proteínas del extracto por electroforesis en geles de poliacrilamida. Las proteínas del extracto fueron separadas por electroforesis en geles de poliacrilamida al 10% (12). Los extractos (40 μg/carril) fueron analizados a 100 voltios a temperatura ambiente, en el equipo BIO-RAD mini Protean IV. Al finalizar la corrida electroforética el gel fue teñido con azul de Comassie. Los pesos moleculares de las bandas fueron calculados a partir de un estándar de pesos moleculares (Thermo Scientific) con las siguientes proteínas: miosina (215kDa), fosforilasa B (120 kDa), Albúmina de Suero de Bovino (BSA) (84 kDa), Ovoalbumina (60 kDa), Anhidrasa Carbónica (39,2 kDa), Inhibidor de la tripsina (28 kDa), y lisozima (18,3 kDa). El valor de las masas moleculares de las proteínas se calculó a partir de la comparación según el frente de migración de proteínas con pesos moleculares de referencia conocido.
Evaluación de la reactividad serológica para IgA específica al extracto de huevos de A. lumbricoides por Western blot. Las proteínas separadas mediante electroforesis fueron transferidas a membranas de nitrocelulosa a 180 miliamperios a temperatura ambiente (13), bloqueadas con PBS-leche descremada al 1% durante 1 hora a temperatura ambiente. Lavadas una vez con PBS-Tween-20 al 0,05% durante 10 minutos e incubadas, con una mezcla de sueros de niños infectados únicamente con A. lumbricoides diluidos 1:20, en paralelo otra mezcla de sueros de niños no infectados diluidos en 1:20 con PBS-Tween 20 al 0,1% en agitación constante toda la noche a 4ºC. Las membranas fueron lavadas con PBS-Tween-20 al 0,05% durante 10 minutos e incubadas con un anticuerpo secundario anti-IgA humano (cadena α) acoplado a la peroxidasa (SIGMA ALDRICH) diluido 1:1000 en PBS-Tween-20 al 0,1% durante 1 hora en agitación a temperatura ambiente. Posteriormente las membranas fueron lavadas tres veces con PBS-Tween-20 al 0,1% y reveladas con 3, 3, 5,5-Tetrametilbenzidina (TMB, Vector). Finalmente, las membranas fueron fotografiadas y digitalizadas para su análisis.
Identificación de proteínas específicas por la prueba de inhibición. Para identificar las proteínas específicas para los componentes proteicos del huevo de Ascaris lumbricoides, se realizó una prueba de inhibición. Para ello, fueron utilizados 100 μL del extracto de A. lumbricoides (100μg/mL) e incubados de manera individual con la mezcla de sueros positivos y los sueros negativos diluidos 1/50 en PBS+TWEEN 20 al 0,1% a temperatura ambiente durante 1 hora a temperatura ambiente en agitación durante toda la noche. Posteriormente, las tiras fueron lavadas 3 veces con PBS+TWEEN 20 al 0,1% durante 5 min cada una en agitación constante e incubadas con un anticuerpo secundario anti-IgA humano (cadena α, acoplado a fosfatasa alcalina, SIGMA-ALDRICH) diluido 1:1000 para luego del lavado y revelado con un estuche comercial (BCIP/NBT, Vector) según instrucciones del fabricante para visualizar la aparición de las bandas reactivas.
Cuantificación de la respuesta de anticuerpos IgA anti-Ascaris por ELISA. Los niveles de anticuerpos IgA fueron determinados por ELISA utilizando como antígeno el extracto de huevos de A. lumbricoides. El extracto fue acoplado a placas de 96 pozos a una concentración de 5μg/ pozo en PBS pH 7,2 durante 1 hora a 37°C y luego toda la noche a 4ºC. Las placas fueron bloqueadas en PBS-Leche descremada al 1% durante 1 hora a 37°C. Fueron colocados 100μL/pozo de los sueros de niños infectados o no, diluidos 1:50 en PBS-Tween-20 al 0,1% en leche descremada al 1% durante 1 hora a 37ºC y luego toda la noche a 4°C. Las placas fueron lavadas 3 veces con PBS-Tween-20 al 0,1% e incubadas con 100μL/pozo de anti-IgA humana (cadena α, SIGMA ALDRICH) acoplada a peroxidasa diluido 1:1000 en PBS-Tween-20 al 0,1% durante 1 hora a 37°C. Las placas fueron lavadas tres veces con PBS-Tween-20 al 0,1% y reveladas con 100μL/pozo con TMB. La reacción fue detenida a la media hora con 50μL de H2SO4 1 mol/ kg y la placa fue leída a 450 nanómetros en un lector de ELISA (SUNRISE, modelo serie 801000880) usando el programa Magellan IV. El punto de corte fue obtenido del promedio más o menos 2 veces la desviación estándar de las densidades ópticas de 30 niños no infectados.
Inmunocitoquímica. Con el objetivo de verificar el posible reconocimiento de los anticuerpos IgA presentes en el suero de los individuos infectados a las estructuras de la superficie del huevo de A. lumbricoides, una suspensión de estos fueron incubados previamente con los sueros pre-absorbidos por un extracto de A. lumbricoides, diluidos 1:50. Luego de los lavados, la suspensión de huevos fue incubada con un anticuerpo secundario anti-IgA humana acoplada a la peroxidasa 1:200 durante una hora a temperatura ambiente. Posteriormente, la suspensión fue lavada con PBS, centrifugada para sedimentar los huevos y colocarlos en una lámina, la cual fue revelada con TMB y observada al microscopio óptico a 40X de magnitud para ser fotografiado con una cámara Olympus modelo T-100, 12 mega pixeles.
Análisis Estadístico. Se utilizó la estadística descriptiva de datos, tales como: media y desviación estándar. Se utilizó el programa estadístico GraphPhad Prisma 5.03 con un intervalo de confianza del 95% y la comparación de los valores de p<0,05 fueron considerados estadísticamente significativo.
RESULTADOS
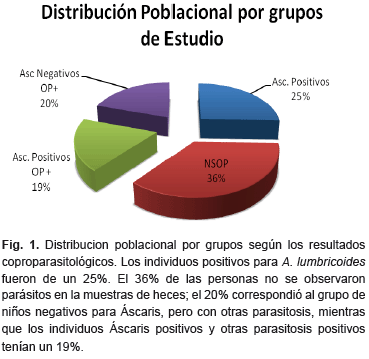
Población estudiada. La prevalencia general de esta parasitosis en las diferentes comunidades fue de 15%. La Peica tuvo una prevalencia de 25,8%, Los medanos de 7,9%, El marquez el 12,30% y finalmente El Teleferico de 13,3%. En el examen coproparasitológico, como se muestra en la Fig. 1, fue observado que el 36% de los niños estaban libres de infección por parásitos intestinales, mientras que el 25% estaban infectados por A. lumbricoides. Solo un 19% de individuos presentó infección mixta con otros parásitos intestinales y finalmente un 20% de los individuos presentó infección por formas evolutivas de otros parásitos intestinales diferentes de Áscaris.
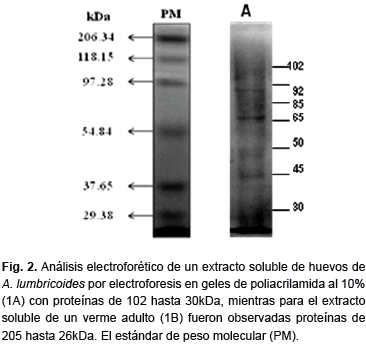
Perfil electroforético del extracto del huevo de A. lumbricoides. El perfil de proteínas del extracto de huevos de A. lumbricoides en geles de poliacrilamida mostró siete bandas visibles con movilidad relativa de 102, 92, 85, 65, 50, 45 y 30 kDa respectivamente (Figura 2). Se detectaron en el extracto de A. lumbricoides un mínimo de 17 proteínas con pesos moleculares de entre 26 y 205 KDa aproximadamente, siendo las proteínas más prominentes las de 205, 148, 75, 45 y 32 kDa respectivamente.
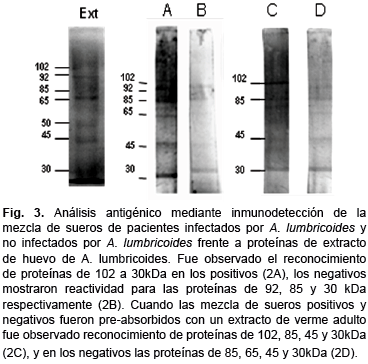
Reactividad al extracto soluble de huevos de A. lumbricoides en el suero de individuos infectados. La reactividad serológica hacia los extractos para la respuesta IgA específica se muestra en la figura 2, la mezcla de sueros de niños infectados únicamente con A. lumbricoides reaccionó con proteínas de 102, 92, 85, 65, 45 y 30KDa (Fig. 3, canal A), la mezcla de sueros de los niños no infectados reconocieron proteínas de 92, 85, 45 y 30kDa respectivamente (Fig 3, canal B). Cuando la mezcla de los sueros de niños infectados y no infectados fueron pre-absorbidos con el extracto de A. lumbricoides, los sueros de los niños infectados aun reaccionaron con las proteínas de 102, 85, 45 y 30kDa (Figura 3, canal C), mientras que los sueros de niños no infectados reconocieron solo proteínas de 85, 65, 45 y 30kDa (Figura 3, canal D).
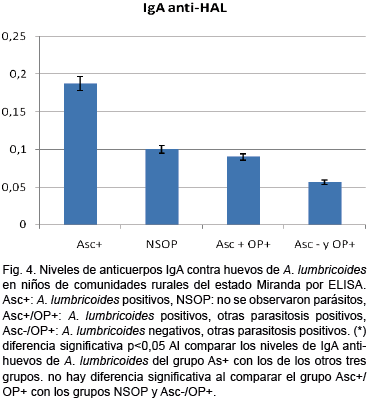
Cuantificación de los niveles de anticuerpos IgA contra el extracto de huevos de A. lumbricoides por ELISA. El grupo de niños infectados por A. lumbricoides mostró un promedio de D.O. significativamente mayor que los individuos no infectados (0,18+0,08 v.s. 0,10+0,04, p<0,05), como se aprecia en la figura 4. Sin embargo, los niños infectados por A. lumbricoides y otras parasitosis mostraron un bajo promedio de anticuerpos con respecto a los niños infectados solo por A. lumbricoides (0,18+0,08 v.s. 0,09+0,03, p<0,05).
El punto de corte se obtuvo a partir de 20 individuos negativos en heces (0,10+0,04). No fueron detectadas diferencias estadisticamente significativas entre los niveles de anticuerpos en el grupo negativo en heces y los no infectados por A. lumbricoides, pero con otras parasitosis intestinales (0,09+0,030 v.s. 0,05+0,04, n.s.).
Inmunoquímica para la respuesta IgA. El suero de los individuos infectados por A. lumbricoides reconocen estructuras proteicas en la superficie del huevo de A. lumbricoides para la respuesta IgA específica (Fig. 5A). Mientras que al incubar la suspensión de huevos de A. lumbricoides en presencia de sueros de niños negativos en heces y seronegativos por ELISA no fue observado marcaje de la superficie como se observa en la figura 5B. Estos resultados indican que en la superficie de los huevos de Ascaris hay componentes proteicos capaces de inducir una respuesta de anticuerpos específicos de tipo IgA.
DISCUSIÓN
La infección por Ascaris lumbricoides presenta una elevada prevalencia en la región tropical y una potente respuesta de anticuerpos caracterizada por una elevada producción de IgE total y específica anti-Ascaris, característico de una respuesta inmunitaria Th2 (14). Se tienen informes que indican que la exposición continua a los huevos de Ascaris lumbricoides podría inducir respuestas inmunitarias. En individuos con una respuesta de anticuerpos baja hay mayor secreción de huevos en las heces, lo que sugiere una baja capacidad para controlar la infección (15). En el presente trabajo se da especial atención a la inmunoglobulina de tipo A (IgA), que representa la clase de anticuerpo más importante en las secreciones como la saliva, las lágrimas, el moco y la leche materna. Diversos estudios han identificado y caracterizado algunos antígenos principalmente aquellos que estimulan la respuesta inmunitaria contra A. lumbricoides, principalmente de la respuesta IgE e IgA anti-A. lumbricoides (16,17). Por ejemplo, existe un grupo de antígenos denominados poliproteínas alergénicas de nematodos (NPA), consideradas como vital para la supervivencia del parásito, la proteína ABA-1 (body fluid allergen-1) principal constituyente del líquido pseudocelómico, considerada una proteína transportadora de retinol (18). Diferentes investigaciones han señalado que, en áreas endémicas para A. lumbricoides, las personas que tienen altos niveles de IgE contra el antígeno ABA-1 están menos infectadas, mientras que las personas con bajos niveles de IgE específica son más susceptibles a la infección, lo que sugiere el posible efecto protector de este antígeno (19). Investigaciones en otros parásitos como Schistosoma mansoni y Strongyloides venezuelensis, han sugerido o demostrado el papel protector de la respuesta IgA (20, 21). Por ejemplo, se observó una correlación negativa entre los niveles de IgA específica y el contaje de huevos en individuos infectados por Schistosoma mansoni, indicando el papel de la IgA en restringir la intensidad de la infección (22). Sin embargo, el papel de la respuesta IgA anti-A. lumbricoides no ha sido aun evaluado. Considerando que la respuesta de anticuerpos IgA podría ser esencial para el control de la infección a nivel de la mucosa y sistémico, el análisis de la respuesta de anticuerpos de tipo IgA y la identificación de los antígenos asociados a esta frente a los huevos del parásito podrían ser útiles para el diseño de pruebas que detecten la presencia de anticuerpos de manera precoz. El perfil electroforético reveló 7 proteínas con pesos moleculares de 102, 92, 85, 65, 50, 45 y 30kDa, sobre este aspecto no existen investigaciones previas donde se hayan identificados las proteínas asociadas a la respuesta IgA utilizando huevos de A. lumbricoides como fuente de antígenos. Sin embargo al ser comparada con el perfil de los extractos de verme adulto se pudieron observar diferencias en el perfil en cuanto al número de bandas visualizadas siendo mayores en el extracto del verme adulto. Recientemente fue reportado por Cabrera y col. (17) un perfil electroforético de un extracto soluble de A. lumbriocides similar al reportado por Alba y col. En el 2009. Cuando fue evaluada la reactividad para la respuesta IgA hacia los extractos por inmunoblots, el suero de niños infectados por A. lumbricoides reaccionaron con proteínas de 102, 92, 85, 65, 45 y 30kDa, mientras que el grupo de niños no infectados reconocieron proteínas de 85, 65, 45 y 30kDa. Con el propósito de descartar una reacción cruzada entre los antígenos del huevo y del verme adulto, se realizaron pruebas de pre-absorción usando un extracto crudo del parásito. La tira incubada con la mezcla de sueros positivos y pre-absorbidos con extractos de A. lumbricoides mantenía una reactividad solo a las proteínas de 102, 85, 45 y 30kDa. Estos resultados sugieren que la infección por A. lumbricoides induce una respuesta de anticuerpos IgA específica contra los componentes proteicos de este estadío del parasito. Por otra parte, la baja producción de anticuerpos IgA en el grupo de niños co-infectados por Ascaris y otras parasitosis intestinales con respecto al grupo de niños infectados solo por Ascaris podría deberse a que las otras parasitosis ejercen un efecto bloqueante sobre la respuesta de anticuerpos específicos de tipo IgA contra los componentes proteicos del huevo. Por otra parte, el suero de los niños infectados contienen anticuerpos de tipo IgA contra las estructuras proteicas del huevo de A. lumbricoides. Evidencias en otros modelos de parasitosis intestinales, específicamente la producida por helmintos, sugieren que la inmunoglobulina IgA tiene un papel principal en la protección de la mucosa gastrointestinal. La importancia de estos resultados radica en que se podrían utilizar estas proteínas como antígenos en modelos de pruebas serológicas en poblaciones con baja o mediana carga parasitaria, que permitan complementar el diagnóstico coproparasitológico y la realización de estudios sobre seroprevalencia de una de las parasitosis más frecuentes en los niños venezolanos.
REFERENCIAS
1. Moncayo AL, Cooper PJ. Geohelminth infections: Impact on allergic diseases. Int J.Biochem Cell Biol. 2006; 38: 1031-1035. [ Links ]
2. Nelson K., Darby J. Inactivacion of viable Ascaris eggs by reagents during enumeration. Appl. Environ. Microbiol. 2001, 67: 5453-5459. [ Links ]
3. Ortiz D, Alfonso C, Hagel I, Rodríguez O, Ortiz C, Palenque M y Lynch NR. Influencia de las infecciones helmínticas y el estado nutricional en la respuesta inmunitaria de niños venezolanos. Rev Panam Salud Publica/Pan Am J Public Health 2000, 3:156-63. [ Links ]
4. Kennedy MW. The nematode polyprotein allergens/antigens. Parasitol Today. 2000; 16(9):373-80. [ Links ]
5. Charles Mc S, Yu X, Celia V.H., Malcom K. Natural Immunity to Ascaris lumbricoides Associated with Immunoglobulin E Antibody to ABA-1 Allergen and Inflammation Indicators in Children. Infection and Immunity, 1999, 67: 484–489. [ Links ]
6. Caraballo L, Acevedo N. New Allergens of Relevance in Tropical Regions: The Impact of Ascaris lumbricoides Infections. World Allergy Organ J. 2011;4:77-84. [ Links ]
7. Acevedo N, Caraballo L. IgE cross-reactivity between Ascaris lumbricoides and mite allergens: possible influences on allergic sensitization and asthma. Parasite Immunol. 2011, 33:309-21. [ Links ]
8. Acevedo N, Mohr J, Zakzuk J, Samonig M, Briza P, Erler A, Pomés A, Huber CG, Ferreira F, Caraballo L. Proteomic and immunochemical characterization of glutathione transferase as a new allergen of the nematode Ascaris lumbricoides. PLoS One. 2013; 8: 1-13. [ Links ]
9. King H., Kim T., Dang E., Michael L., Drake C., Neddham R., Haque D. Immuno-epidemiology of Ascaris lumbricoides infection in a high transmission community: antibody responses and their impact on current and future infection intensity. Parasite Immunology, 2005, 27: 89-96. [ Links ]
10. Eriksen L, Bøgh HO, Loftager M, Lind P. Comparative studies of experimental oral inoculation of pigs with Ascaris suum eggs or third stage larvae. J Vet Med B Infect Dis Vet Public Health, 2004; 51:185-90. [ Links ]
11. Lind P., Eriksen L., Nansen P., Nilsson O., Roepstorff A. Response to repeated inoculations with Ascaris suum eggs in pigs during the fattening period. II. Specific IgA, IgG, and IgM antibodies determined by enzyme linked inmunoabsorbent assay. 1993, 79:204-4. [ Links ]
12. Laemmli U. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227:680–85. [ Links ]
13. Towbin H., Staehelin T., Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc. Nat. Acad. Sci. 1979; 76:4350-54. [ Links ]
14. Cooper PJ. Intestinal worms and human allergy. Parasite Immunol 2004; 26:455-67. [ Links ]
15. Scott M. Ascaris lumbricoides: Una revisión de su epidemiología y su relación con otras infecciones. Instituto de Parasitología, Universidad McGill, Ste-Anne-de-Bellevue, Canadá. Ann Nestlé [Esp]. 2008, 66:7–22. [ Links ]
16. Acevedo N, Erler A, Briza P, Puccio F, Ferreira F, Caraballo L. Allergenicity of Ascaris lumbricoides tropomyosin and IgE sensitization among asthmatic patients in a tropical environment. Int Arch Allergy Immunol. 2011; 154(3):195-206. [ Links ]
17. Cabrera JL, Jiménez JC, Núñez L, Pocaterra L, Rojas E, Hernán A. Evaluación inmunológica de extractos de Ascaris lumbricoides para las inmunoglobulinas IgA en el suero de individuos infectados. Revista Gen, 2014;68:48-52. [ Links ]
18. Riho M, Shinjiro I, Hiroyuki T, Yuko F, Koichiro F. The biological activity of ABA-1-like protein from Ascaris lumbricoides. 2001, 48:95-104. [ Links ]
19. Mc Sharry C., Xia Y., Holland C., Kennedy M. Natural immunity to Ascaris lumbricoides associated with immunoglobulin E antibody to ABA-1 allergen and inflammation indicators in children. Infection and Inmunity. 1999; 67: 484-489. [ Links ]
20. Yinchang Z, Wanquan H, Ming X, Wei H, Xiaoting W, Yang D, Song Z, Jianxia T, Shixia W, Shan L. A novel immunodiagnostic assay to detect serum antibody response against selected soluble egg antigen fractions from Schistosoma japonicum. PLOS ONE, 2012; 7 (8). [ Links ]
21. Ribeiro Gonçalves AL, Alves Rocha C, Tomaz Gonzaga H, Gonçalves-Piresa M do R de Fátima, Tiduko Uetab M, Costa-Cruz JM. Specific IgG and IgA to larvae, parthenogenetic females, and eggs of Strongyloides venezuelensis in the immunodiagnosis of human strongyloidiasis. Diagnostic Microbiology and Infectious Disease, 2012, 72: 79–84. [ Links ]
22. Farias LP, Cardoso FC, Miyasato PA, Montoya BO, Tararam CA, Roffato HK, Kawano T, Gazzinelli A, Correa-Oliveira R, Coulson PS, Wilson RA, Oliveira SC, Leite LC. Schistosoma mansoni Stomatin like protein-2 is located in the tegument and induces partial protection against challenge infection. PLoS Negl Trop Dis. 2010, 9; 4(2):e597. [ Links ]
23. Julisar Elaine Alba, Mary Normandee Comia, Glenn Oyong and Florencia Claveria. Ascaris lumbricoides and Ascaris suum: A comparison of electrophoretic banding patterns of protein extracts from the reproductive organs and body wall. Veterinarski Arhiv, 2009; 79: 281-291. [ Links ]