Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.10 supl.1 Mérida oct. 2012
Tratamiento no farmacológico: aspectos nutricionales, estilo de vida y actividad física. Cirugía bariátrica.
Dra. Imperia Brajkovich, Dra. Melania Izquierdo, Dr. Ramfis Nieto, Dra. Marilin Cordero.
INTRODUCCIÓN
Las intervenciones terapéuticas no farmacológicas representan un pilar fundamental en el tratamiento del paciente con diabetes tipo 2 (DM2) y al efecto hay que considerar dos estrategias clásicamente conocidas (nutrición, estilo de vida y actividad física) y una tercera (cirugía bariátrica) que se ha incorporado recientemente, las cuales serán motivo de revisión exhaustiva en este capítulo.
A.- TRATAMIENTO NUTRICIONAL EN LA DM2
Las recomendaciones nutricionales generales están dirigidas hacia:
Prevención (obesidad y prediabetes), cuyo objetivo es disminuir el riesgo de diabetes y enfermedad cardiovascular (ECV) promoviendo la actividad física y los hábitos nutricionales saludables que resulten en una pérdida de peso moderada que sea mantenida o, como mínimo, prevenir la ganancia de peso1.
Terapia nutricional en diabetes mellitus (DM), cuya meta es tratar y prevenir las complicaciones mediante la atención y mantenimiento de un control metabólico óptimo que incluya niveles de glucosa en sangre, HbA1c, LDL-C, HDL-C y triglicéridos, presión arterial y peso corporal2-6.
Estrategia nutricional en las complicaciones diabéticas (nefropatía, ECV, dislipidemias, hipertensión arterial [HTA])4-6.
A.1. PREVENCIÓN: OBESIDAD Y PREDIABETES7-9,14
Aquellos individuos con prediabetes, obesidad o resistencia a la insulina deben recibir atención nutricional especializada, preferiblemente por nutricionistas entrenadas en el tratamiento de esta condición (nivel de evidencia A).
Una disminución modesta del peso (7 – 10%) mejora los niveles de resistencia insulínica en estos sujetos, reduciendo el riesgo de progresión de la diabetes (nivel de evidencia A).
BALANCE CALÓRICO, SOBREPESO Y OBESIDAD10-14
La disminución moderada de peso en sujetos insulino- resistentes con sobrepeso y obesidad logra mejorar la resistencia a la insulina, por lo tanto se recomienda la pérdida de peso en todos aquellos en esta situación por su mayor riesgo de diabetes (nivel de evidencia A).
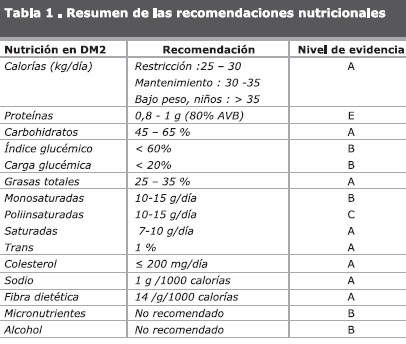
El cálculo calórico debe ser establecido según el peso corporal, si la meta es la reducción se calculan 25 calorías por kg de peso. Para mantenimiento del peso corporal de 30 a 35 calorías/kg y en individuos delgados, niños, adolescentes y con necesidades especiales > 35 calorías/kg.
Las dietas muy restringidas en carbohidratos y calorías pueden ser efectivas para perder peso en períodos no mayores a 1 año (nivel de evidencia A). Para poder implementar una dieta restringida en carbohidratos debe monitorearse el perfil lipídico, función renal y consumo proteico en individuos con nefropatía y ajustar la terapia hipoglucemiante según sea necesario (nivel de evidencia E).
La actividad física y la modificación de conducta deben estar incluidas en los programas de pérdida y mantenimiento de peso (nivel de evidencia B).
A.2. TERAPIA NUTRICIONAL
a. Diabetes tipo 2 insulino-requiriente14-17
Integrar el régimen de insulina al estilo de vida del paciente.
El contenido total de carbohidratos es el principal determinante de la acción de la insulina rápida pre- comida y de la respuesta glucémica.
Educar al paciente sobre la relación insulina/carbohidrato para variar de forma planificada la selección de alimentos y la dosis de insulina pre-comida correspondiente. Se establece la cantidad de insulina requerida para cubrir el consumo habitual de carbohidratos durante un período euglucémico, calculándose la relación unidades de insulina/gramos de carbohidratos.
En personas que tengan esquemas de insulina fijos se recomienda consistencia en el consumo de carbohidratos.
b. Diabetes tipo 2 no insulino-requiriente14,18,19
Enfatizar en los cambios del estilo de vida (dieta, actividad física y educación) que logren mejorar el control de la hiperglucemia, dislipidemia e hipertensión.
Implementar los cambios simultáneamente con el diagnóstico de DM o prueba de tolerancia anormal a la glucosa (prediabetes).
Por su alta asociación con obesidad, la pérdida de peso y grasa abdominal resultan en mejor control de los parámetros metabólicos.
Se sugiere disminuir 500 – 1000 calorías del consumo habitual, acompañado de actividad física para logros a largo plazo.
Educar en la selección de alimentos habituales y ocasionales, conjuntamente con el autocontrol glucémico.
RECOMENDACIONES GENERALES SOBRE LOS COMPONENTES DE LA ALIMENTACIÓN
a. Grasas, ácidos grasos y colesterol14,20-28
El aporte de grasas saturadas debe ser menor al 7% de las calorías totales. La disminución en el consumo de grasas "trans" logra descender el LDL-C y aumentar el HDL-C (nivel de evidencia A).
El consumo diario de colesterol debe ser limitado a 200 mg/día en individuos con diabetes (nivel de evidencia B).
Se recomienda el uso dos o más veces por semana de pescados ricos en ácidos grasos omega-3 (atún, sardinas, caballa y salmón, entre otros), especialmente en aquellos con hipertrigliceridemia (nivel de evidencia B).
Los ácidos grasos monoinsaturados, que se encuentran en el aceite de oliva, el aguacate y algunas oleaginosas, han sido estudiados por sus efectos beneficiosos sobre los lípidos sanguíneos (nivel de evidencia B). Igualmente, el consumo de aproximadamente 2 mg/día de esteroles vegetales bloquean la absorción intestinal de colesterol con la consecuente disminución del colesterol total y del LDL-C circulantes.
B. CARBOHIDRATOS13,14,29,30,31
Se recomienda un patrón dietético saludable cuyos carbohidratos provengan de frutas, vegetales, granos y leche descremada (nivel de evidencia B).
La estimación del contenido total de carbohidratos de la dieta constituye la principal estrategia en el control glucémico, por lo tanto su monitoreo bien sea por la cuenta de carbohidratos, intercambios o cálculo de porciones basados en la experiencia, es la clave en la terapia nutricional (nivel de evidencia A).
El aporte recomendado es de 45 – 65% del valor calórico total, a pesar de constituir el mayor contribuyente de la concentración postprandial de glucosa en sangre. Además, son fuente de energía, vitaminas hidrosolubles, minerales y fibra. No se recomienda un consumo <130 g/día debido al requerimiento absoluto de glucosa por parte del cerebro y el sistema nervioso central.
Tanto la cantidad total como el tipo de carbohidrato del alimento (calidad) influyen el nivel de glucosa en sangre. Sin embargo, se considera que el uso del índice glucémico (IG) y la carga glucémica (CG) brinda un beneficio adicional moderado sobre el control de la glucemia que cuando se considera solamente el total de carbohidratos (nivel de evidencia B).
Se recomienda un consumo de fibra dietética de 14 gramos por cada mil calorías a partir de los cereales, frutas y vegetales preferiblemente no modificados en su forma física (nivel de evidencia A).
C. PROTEÍNAS13,14,32,33,34
Para individuos con diabetes y función renal normal se sugiere un consumo proteico entre 15 a 20% del valor calórico total (nivel de evidencia E).
En sujetos con DM tipo 2, el consumo de proteínas puede aumentar la respuesta de insulina sin incrementar la concentración de glucosa circulante. Por lo tanto, las proteínas no deben ser utilizadas para tratar o prevenir las hipoglucemias nocturnas (nivel de evidencia A).
No se conoce el efecto a largo plazo de las dietas altas en proteínas (>20 % de las calorías totales) sobre la función renal, por tanto sólo deben ser utilizadas por períodos cortos en individuos con función renal normal (nivel de evidencia E).
D. EDULCORANTES, ALCOHOL Y MICRONUTRIENTES14,35-38
El consumo de edulcorantes no nutritivos como acesulfame potásico, aspartame, neotame, sacarina y sucralosa ha sido aprobado por la Administración de Drogas y Alimentos siempre que lo sean dentro de las cantidades recomendadas (nivel de evidencia A). Los alcoholes de azúcar tipo manitol, xilitol y sorbitol se caracterizan por su efecto osmótico y aportan 2 kilocalorías por gramo por lo que al utilizarlos deben contabilizarse dentro de la cantidad total de carbohidratos de la dieta (nivel de evidencia A). En cuanto a la fructosa, si bien produce una respuesta menor de glucemia posprandial en relación a la sacarosa y al almidón, debe limitarse a la naturalmente contenida en las frutas lo cual equivale al 3 a 4% de la energía total. No se recomienda utilizarla como edulcorante en los trastornos del metabolismo de los carbohidratos y de lípidos.
En adultos con DM que deseen consumir alcohol, se debe restringir su consumo a una bebida/día o menos para la mujer y 2 bebidas/día o menos para el hombre (nivel de evidencia B).
La suplementación rutinaria con antioxidantes, como vitamina E, C y β-caroteno no es recomendada debido a la falta de evidencia de su eficacia, así como el efecto de su uso a largo plazo. El beneficio de la suplementación con cromo en personas con DM u obesidad no ha sido demostrado de forma concluyente, por lo tanto, no es recomendado.
E. OTROS NUTRIENTES14,39
Se recomienda limitar el consumo de sal en cantidades menores a 5 gramos diarios o 1.000 mg de sodio por cada 1.000 calorías, pudiendo realizarse una restricción mayor en casos de hipertensión o enfermedad cardíaca sintomática (nivel de evidencia A).
A.3. CONDUCTA NUTRICIONAL ANTE LAS COMPLICACIONES DE LA DIABETES
1. Enfermedad cardiovascular:
Las condiciones más comunes desde el punto de vista cardiovascular la constituyen la hipertensión y la dislipidemia. Aunque no existen estudios controlados sobre dieta y ejercicio e hipertensión en DM, la dieta Dietary Approaches to Stop Hypertension (DASH) baja en sodio y rica en potasio, ha tenido efectos beneficiosos en la disminución de la presión arterial en individuos sin DM40. El control nutricional en individuos con DM, reduce el riesgo de enfermedad cardiovascular a través de una dieta rica en consumo de vegetales, cereales enteros, frutas y nueces.
En individuos normotensos e hipertensos, un consumo de sodio menor de 2.300 mg/día logra mejorar los niveles de presión arterial y en aquellos con insuficiencia cardiaca, un consumo de sodio menor de 2.000 mg/día mejora los síntomas39.
La reducción de peso, disminución del consumo de alcohol y el aumento de actividad física para la mayoría de los sujetos con diabetes, tiene efecto beneficioso en la presión arterial y en la enfermedad cardiovascular39,41,42.
2. Enfermedad renal:
El control de la normoglucemia y de los niveles de presión arterial son primordiales para disminuir la progresión de la enfermedad renal en DM. Luego, la reducción del
consumo de proteínas a 0,8-1,0 g/kg en fase tempranas de la nefropatía y de 0,8 g/kg en fases avanzadas, logra mejorar la función renal14,43-46. La dislipidemia puede incrementar la proteinuria y la progresión de la nefropatía diabética establecida.La elevación de los niveles de colesterol y de triglicéridos, son predictores para indicar tratamiento de protección renal14,47.
RECOMENDACIONES (RESUMIDAS EN LA TABLA 1):
El cambio en el estilo de vida sobre la HTA consiste en la disminución de peso, dieta DASH (reducción de sal y aumento de potasio), moderación del consumo de bebidas alcoholicas y aumento de la actividad física (nivel de evidencia B).
Mejoría del perfil lipídico a través de la reducción del consumo de grasas saturadas, grasas trans y de colesterol; aumento de ácidos grasos omega-3, fibra soluble y esteroles en la dieta (nivel de evidencia A).
Consumo de 0,8-1,0 g/kg de proteínas en fase tempranas de nefropatía y 0,8 g/kg en fases avanzadas (nivel de evidencia B).
HIPOGLUCEMIA (< 70 MG/DL):
Se sugiere administrar 15-20 gramos de glucosa en individuos conscientes que presenten hipoglucemia, aunque cualquier forma de carbohidratos que contenga glucosa puede ser indicado14,48. En caso que a los 15 minutos continúe la hipoglucemia, debe repetirse en tratamiento. Si la glucemia retorna a valores normales, se recomienda el consumo de una merienda para prevenir la recurrencia de hipoglucemia.
B. ESTILO DE VIDA Y LA ACTIVIDAD FÍSICA EN LA PREVENCIÓN DE LA DIABETES
Aunque la actividad física es esencial en el tratamiento de la diabetes mellitus (DM), la mayoría de los pacientes no la cumplen de manera regular49. Se ha establecido que el ejercicio cumplido diariamente mejora el control de la glucemia y puede prevenir la DM en ciertos grupos de pacientes; siendo que la mayoría de sus beneficios se logran por una mejoría aguda o crónica de la resistencia a la insulina, lo cual se ha reportado tanto por el ejercicio aeróbico como por el ejercicio de resistencia. Además, se ha demostrado que el ejercicio regular, reduce los factores de riesgo cardiovascular, contribuye a la pérdida de peso y aumenta la sensación de bienestar del paciente. El Programa de Prevención de Diabetes (DPP, por sus siglas en inglés) estudió 3.234 pacientes con tolerancia glucosada alterada (prediabetes) y por tanto, con alto riesgo de progresar a DM. En este estudio, el grupo de pacientes que siguió una dieta baja
en grasa y 150 minutos semanales de actividad física moderada (caminata rápida) durante 3 años, disminuyó 58% el riesgo de DM50. La pérdida de peso aunque modesta (7%), fue el principal predictor de la reducción de riesgo de DM. En el DPP, 495 sujetos no llegaron a la meta de reducción de peso (sólo bajaron 5 a 7% del peso inicial); sin embargo, en aquellos que cumplieron la meta de ejercicio, también se encontró una reducción de 44% en el riesgo de diabetes.En el estudio finlandés sobre prevención de la diabetes (DPS, por sus siglas en inglés) el estilo de vida también mostró una disminución del 58% del riesgo de DM en aquellos que perdieron peso, bajaron la ingesta de grasa, aumentaron la ingesta de fibra y agregaron 30 minutos de caminata diaria y entrenamiento de resistencia ocasional51. Aquellos sujetos que realizaron caminata de, al menos, 2,5 h/semanales durante el seguimiento, tuvieron de 63 a 69% menos probabilidades de desarrollar DM con respecto a los que caminaron menos de una hora/semana. El menor riesgo de DM estuvo más asociado al incremento de la actividad física total que a la intensidad del ejercicio.
El estudio chino de Prevención de Diabetes DaQing, fue realizado durante 6 años con dieta y ejercicio (sólo o en combinación) diseñado para investigar el desarrollo de DM en una población adulta de 577 sujetos con tolerancia glucosada alterada. Después de un seguimiento de 14 años, el grupo con intervención en estilo de vida mostró43% menos de incidencia de DM52.
BENEFICIOS DE LA ACTIVIDAD FÍSICA EN DIABETES
Estos pueden ser agudos o crónicos. En la mayoría de los pacientes diabéticos ocurre una disminución de la glucemia cuando realizan un ejercicio de leve a moderada intensidad y este efecto se mantiene entre 2 a 48 horas después de finalizado el mismo53,54. Después de una sesión de ejercicio, la depleción de la reserva de glucógeno muscular estimula la captación de glucosa durante las horas siguientes y en este periodo el requerimiento de insulina es mínimo. Los efectos de una sesión de ejercicio pueden durar desde una hora en ejercicio breve y suave, hasta uno o dos días en los ejercicios intensos y prolongados; los cuales se revierten al cabo de 2 a 3 días. Por tanto, es conveniente aconsejar al paciente diabético que realice una sesión de ejercicio al menos cada 48 horas para mantener incrementada la acción de la insulina.
El ejercicio crónico (rutinario) puede aumentar tanto la captación basal de glucosa como la respuesta del músculo esquelético a la insulina, lo cual contribuye a disminuir la glucemia en ayunas y la posprandial. El ejercicio crónico también produce un aumento de la capacidad oxidativa de grasa en el músculo. Una intervención estructurada de ocho semanas con ejercicio ha demostrado reducción de la HbA1c en 0,66% en pacientes diabéticos tipo 2, aún sin cambios significativos en el índice de masa corporal55. También se ha reportado que en hombres jóvenes, 6 semanas de ejercicio moderado durante una hora en bicicleta 5 veces a la semana, aumentó la sensibilidad a la insulina y la capacidad de captación de glucosa durante al menos una semana después del entrenamiento56. Incluso un entrenamiento aeróbico a corto plazo (7 días) puede aumentar la sensibilidad a la insulina en sujetos con DM2, demostrando que el entrenamiento físico regular incrementa la sensibilidad periférica (muscular) a la insulina, aunque no ocurra pérdida de peso ni adaptaciones del músculo al entrenamiento57.
La evidencia ha revelado que la actividad física regular (tanto aeróbica como anaeróbica) puede prevenir no solo la DM, sino las complicaciones (micro y macrovasculares), atenuando el estado de inflamación crónica subclínica asociado a la resistencia la insulina y a la hiperglucemia crónica58,59. Del mismo modo, el entrenamiento con ejercicio aeróbico puede disminuir la progresión o evitar la aparición de neuropatía periférica60, mejorar la función endotelial58, y aumentar la producción de insulina de las células beta de acuerdo a la cantidad remanentes de ellas aún funcionales61.
TIPOS DE EJERCICIO EN EL TRATAMIENTO DE LA DM2
a. Aeróbico: ha sido el más prescrito para estos pacientes. Para que la acción de la insulina se mantenga en niveles óptimos, se recomienda que las sesiones sucesivas estén separadas no más de 72 horas y se hagan al menos 3 veces/semana (no consecutivas). Estas sesiones deberían incluir actividad física de baja a moderada intensidad que duren al menos 10 a 15 minutos por sesión, con una meta total de 30 minutos18.
b. El ejercicio de resistencia también se recomienda a todos los pacientes diabéticos ya que mejora la fuerza y la resistencia muscular, aumenta la flexibilidad, mejora la composición corporal, y disminuye el riesgo de enfermedad cardiovascular; al mismo tiempo que incrementa la masa muscular sensible a la insulina18,58,62-64. El ejercicio de resistencia debería realizarse un mínimo de dos veces por semana dentro de un programa diseñado (incluyendo entrenamiento aeróbico y flexibilidad) e incluir de 8 a 10 ejercicios que involucren la mayoría de los grupos musculares y un mínimo de un conjunto de 10-15 repeticiones hasta llegar cerca de la fatiga de cada grupo muscular18,53.
c. Mixto: Un programa de entrenamiento que combine el ejercicio aeróbico y de resistencia proporciona un mayor beneficio, ya que actúan por mecanismos diferentes65. Un estudio que evaluó los efectos de ejercicio aeróbico, de resistencia o combinado (3 veces por semana durante 22 semanas) en 251 adultos entre 39 y 70 años con DM2 encontró que, comparando con el ejercicio aeróbico y de resistencia solos, el entrenamiento combinado provocó una mejoría adicional del control glucémico66. Cuando se le agregó 4 semanas de ejercicio de resistencia a hombres con sobrepeso que cumplían un plan de ejercicio aeróbico62, la respuesta de los niveles de insulina a una carga de glucosa oral disminuyó 25% con respecto a los que continuaron ejercicio aeróbico solamente. Así que agregar ejercicio de resistencia al ejercicio aeróbico, puede producir un efecto más sustancial sobre la acción de la insulina que el ejercicio aeróbico sólo.
CONTROL DE LA GLUCEMIA DURANTE EL EJERCICIO
El paciente diabético no debe correr riesgos al realizar ejercicio y ha de controlarse los niveles de glucemia durante el mismo. Generalmente, preocupa que presenten hipoglucemia o hiperglucemia durante o después del ejercicio; sin embargo, este riesgo es diferente de acuerdo al tratamiento, a saber:
Los pacientes con DM2 controlados con dieta y ejercicio tienen un riesgo mínimo de desarrollar hipoglucemia con el ejercicio y es innecesario mantener el control de la glucosa sanguínea durante el ejercicio. Sin embargo, se debe medir la glucosa capilar antes y después del ejercicio para evaluar el efecto individual del ejercicio sobre la glucemia y determinar la necesidad de suplementar carbohidratos en la dieta18.
En los tratados con secretagogos o insulina exógena, el ejercicio prolongado podría causar hipoglucemia durante o después del ejercicio. Esto puede ocurrir sobre todo después de una sesión de alta intensidad, particularmente si se aplicó una dosis de insulina o si se usa una sulfonilurea de acción prolongada. Para contrarrestar este efecto, los pacientes deben consumir carbohidratos que se absorban rápidamente y/o reducir la dosis de fármacos antes (y posiblemente después) del ejercicio18,53,63. El consumo de cantidades moderadas de carbohidratos (5 – 30 g) durante y en los 30 minutos posteriores a un ejercicio extenuante, disminuirá el riesgo de hipoglucemia y permitirá una restauración mas eficiente del glucógeno muscular68.
Si el paciente sólo usa insulina de acción larga como glargina, es menos probable la disminución abrupta de la glucemia ya que esta se está absorbiendo permanentemente del tejido subcutáneo69.
RECOMENDACIONES SOBRE LA ACTIVIDAD FÍSICA EN DM
La prescripción de ejercicio en pacientes con DM debe ser individualizada y el tipo de ejercicio dependerá de coexistencia de complicaciones. La Asociación Americana de Diabetes recomienda que los pacientes con DM realicen 150 min/ semanales de actividad física aeróbica de intensidad moderada (50 a 70% de la frecuencia cardiaca máxima). Además, en ausencia de contraindicaciones, se recomienda ejercicio de resistencia 3 veces por semana5. En pacientes con control inadecuado de la glucemia se presentan 2 situaciones diferentes.
a. Hiperglucemia:
En pacientes insulino-requerientes que no han recibido insulina las últimas 24 a 48 horas y están cetósicos, el ejercicio empeora la hiperglucemia y la cetosis. En ellos no se recomienda el ejercicio de alta intensidad. Sin embargo, no es necesario posponer el ejercicio solamente basado en la hiperglucemia. Si el paciente se siente bien y no hay cuerpos cetónicos en orina y/o sangre puede hacer ejercicio.b. Hipoglucemia:
Los pacientes que reciben insulina o secretagogos (sulfonilureas) deben ingerir carbohidratos extras si la glucemia antes del ejercicio es < 100 mg/ dL. Los pacientes que no reciben estos fármacos no necesitan prevenir la hipoglucemia.La coexistencia de complicaciones específicas en pacientes con DM impone tomar algunas precauciones:
a. Retinopatía. El ejercicio aeróbico vigoroso o de resistencia está contraindicado en pacientes con retinopatía diabética proliferativa o retinopatía diabética no proliferativa severa por el riesgo de hemorragia del vítreo y desprendimiento de retina5.
b. Neuropatía periférica. La disminución de la sensación dolorosa en las extremidades incrementa el riesgo de lesiones en la piel, infección y artropatía de Charcot. Por tanto, en estos pacientes no es recomendable el ejercicio de levantamiento de pesas. Se ha demostrado que la caminata de moderada intensidad no aumenta el riesgo de ulceración en pacientes con neuropatía diabética y se puede recomendar5. Todos los pacientes con neuropatía diabética deben usar calzado adecuado y examinar diariamente los pies para detectar alguna lesión oportunamente.
c. Neuropatía autonómica. En tales casos aumenta el riesgo de eventos adversos o lesiones debido a diversos factores, tales como: menor respuesta cardíaca al ejercicio, hipotensión postural, alteración de la termorregulación, menor visión nocturna por mala respuesta pupilar y riesgo de hipoglicemia por gastroparesia70. En estos pacientes se recomienda evaluación cardiológica antes de comenzar un plan de ejercicio o antes de aumentar el nivel de actividad física por encima de lo acostumbrado5.
d. Albuminuria y nefropatía.
Se ha descrito que la actividad física aguda produce proteinuria.Sin embargo, no hay ninguna evidencia de que el ejercicio vigoroso incremente la tasa de progresión de enfermedad renal en DM y, por tanto, no es necesaria la restricción de ejercicio en estos pacientes71.
En cuanto a la evaluación cardiovascular del paciente diabético antes de iniciar un programa de ejercicio, actualmente no se sugiere el despistaje de rutina ya que la evidencia no es clara en cuanto al beneficio del despistaje y tratamiento de enfermedad cardiaca coronaria en pacientes diabéticos asintomáticos72. Cada médico debe usar su juicio clínico en esta área y a los pacientes de alto riesgo se les debe instruir para comenzar con períodos cortos de ejercicio de baja intensidad e incrementar la intensidad y la duración progresivamente. También se debe considerar la edad del paciente y el nivel previo de actividad física.
PUNTOS CLAVES
Los beneficios agudos y/o crónicos del ejercicio aeróbico, de resistencia o combinado tanto en control glucémico como en prevención de DM, justifican plenamente su prescripción y monitoreo en el paciente diabético o con factores de riesgo de desarrollarla.
Aunque el ejercicio aeróbico y de resistencia pueden ejercer sus efectos a través de mecanismos diferentes, ambos se complementan y mejoran la acción de la insulina a nivel del músculo esquelético en individuos con DM.
El paciente diabético no debe correr riesgos al realizar ejercicio, se debe monitorear la glucemia y compensar con ajustes adecuados de la dieta y/o las dosis de medicamentos, sobre todo en pacientes que reciben insulina o secretagogos.
Antes de comenzar un programa de ejercicio, el juicio clínico es la herramienta que permitirá detectar aquellas comorbilidades que pudieran contraindicar ciertos tipos de ejercicio o predisponer a lesiones en el paciente.
La actividad física regular y continua es necesaria en todos los pacientes diabéticos que son capaces de realizarla.
C. CIRUGÍA BARIÁTRICA
Este procedimiento ha demostrado obtener la casi normalización de las cifras de glucemia en 55 a 95% de los pacientes con DM2, dependiendo de la intevención utilizada. Un meta análisis reporto 78% de individuos con DM2 con una completa resolución de la diabetes en ausencia de fármacos y una tasa de resolución en estudios de seguimiento mayor de 2 años73. La tasa de resolución es menor cuando el procedimiento quirúrgico está restringido a una porción del estómago y mayor cuando incluye el bypass del intestino delgado. Además, la evidencia sugiere que los procedimientos del bypass intestinal puedan tener efectos sobre la glucemia aparte del proveniente de la pérdida de peso, pero no existe evidencia suficiente para hablar de curación sino de remisión transitoria de la DM2. La cirugía bariátrica además de ser costosa, a corto plazo la tasa de morbimortalidad se ha reducido a 0,28%74,75; pero deberán ser evaluadas las complicaciones, como anemia, deficiencias vitamínicas, hipoglucemias, etc. y ser comparadas con grupos pares en tratamiento médico convencional75.
PUNTOS CLAVES
La cirugía bariátrica debe ser considerada en adultos con DM2 e IMC ≥ 35 kg/m2, de difícil control a pesar de cumplimiento de tratamiento (nivel de evidencia B).
Pacientes con DM2 con cirugía bariátrica amerita monitoreo de su tratamiento farmacológico (nivel de evidencia E).
No hay suficiente evidencia sustentable de indicar cirugía para lograr el control glucémico en pacientes con DM2 e IMC de 30–35kg/m2 (nivel de evidencia E).
Los beneficios a largo plazo, costo efectivo y riesgos de la cirugía bariatrica en individuos con DM2 deben ser estudiados en protocolos bien diseñados aleatorizados y comparado con un grupo bien controlado en estilo de vida y fármacos (nivel de evidencia E).
La reducción gástrica ya sea por banda gástrica o procedimientos que involucren bypass o transposición de intestino delgado, formando parte de un plan terapéutico multifactorial, puede ser una estrategia efectiva para la pérdida de peso en el paciente con DM2 y obesidad severa con IMC ≥35 kg/m2.
REFERENCIAS BIBLIOGRÁFICAS
1. Norris SL, Zhang X, Avenell A, Gregg E, Bowman B, Schmid CH, Lau J. Longterm effectiveness of weight-loss interventions in adults with pre-diabetes: a review. Am J Prev Med 2005; 28:126–139. [ Links ]
2. Bantle JP, Wylie-Rosett J, Albright AL, Apovian CM, Clark NG, Franz MJ, et al. Nutrition recommendations and interventions for diabetes2006. Diabetes Care 2006;29:2140–2157. [ Links ]
3. Standards of Medical Care in Diabetes2006. Diabetes Care 2006;29 Suppl. 1. [ Links ]
4. Standards of Medical Care in Diabetes2009. Diabetes care 2009;32: supplement 1. [ Links ]
5. Standards of Medical Care in Diabetes2010. Diabetes care, 2010;33: supplement 1. [ Links ]
6. American Diabetes Association. Evidence-Based Nutrition Principles and Recommendations for the Treatment and Prevention of Diabetes and Related Complications. Diabetes Care 2002;25(suppl 1):S50-S60. [ Links ]
7. Gaetke LM, Stuart MA, Truszczynska H. A single nutrition counseling session with a registered dietitian improves short-term clinical outcomes for rural Kentucky patients with chronic diseases. J Am Diet Assoc 2006;106:109–112. [ Links ]
8. Klein S, Sheard NF, Pi-Sunyer X, Daly A, Wylie-Rosett J, Kulkarni K, Clark NG, American Diabetes Association, North American Association for the Study of Obesity, American Society for Clinical Nutrition. Weight management through lifestyle modification for the prevention and management of type 2 diabetes: rationale and strategies: a statement of the American Diabetes Association, the North American Association for the Study of Obesity, and the American Society for Clinical Nutrition. Diabetes Care 2004;27:2067–2073. [ Links ]
9. Franz MJ, VanWormer JJ, Crain AL, Boucher JL, Histon T, Caplan W, Bowman JD, Pronk NP. Weight-loss outcomes: a systematic review and metaanalysis of weight-loss clinical trials with a minimum 1-year follow-up. J Am Diet Assoc 2007;107:1755–1767. [ Links ]
10. Look AHEAD Research Group, Pi-Sunyer X, Blackburn G, Brancati FL, Bray GA, Bright R, et al. Reduction in weight and cardiovascular disease risk factors in individuals with type 2 diabetes: one-year results of the look AHEAD trial. Diabetes Care 2007;30:1374–1383. [ Links ]
11. Foster GD, Wyatt HR, Hill JO, McGuckin BG, Brill C, Mohammed BS, et al. A randomized trial of a low-carbohydrate diet for obesity. N Engl J Med 2003;348:2082–2090. [ Links ]
12. Stern L, Iqbal N, Seshadri P, Chicano KL, Daily DA, McGrory J, et al. The effects of low-carbohydrate versus conventional weight loss diets in severely obese adults: one-year follow-up of a randomized trial. Ann Intern Med 2004;140: 778–785. [ Links ]
13. Institute of Medicine: Dietary Reference Intakes: Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, DC, National Academies Press, 2002. [ Links ]
14. Nutrition Recommendations and Interventions for Diabetes. A position statement of the American Diabetes Association. Diabetes Care 2008;31 (supplement 1):s61 – 78. [ Links ]
15. Rabasa-Lhoret R, Garon J, Langelier H, Poisson D, Chiasson JL. Effects of meal carbohydrate content on insulin requirements in type 1 diabetic patients treated intensively with the basal-bolus (ultralente-regular) insulin regimen. Diabetes Care 1999;22:667– 673. [ Links ]
16. The DAFNE Study Group: Training in flexible, intensive insulin management to enable dietary freedom in people with type 1 diabetes: Dose Adjustment for Normal Eating (DAFNE) randomized controlled trial. BMJ 2002;325:746. [ Links ]
17. Rabasa-Lhoret R, Bourque J, Ducros F, Chiasson JL. Guidelines for premeal insulin dose reduction for postprandial exercise of different intensities and durations in type 1 diabetic subjects treated intensively with a basal-bolus insulin regimen (ultralente-lispro). Diabetes Care 2001;24:625–630. [ Links ]
18. Sigal RJ, Kenny GP, Wasserman DH, Castaneda-Sceppa C. Physical activity/ exercise and type 2 diabetes. Diabetes Care 2004;27:2518–2539. [ Links ]
19. Garg A, Bantle JP, Henry RR, Coulston AM, Griver KA, Raatz SK, et al. Effects of varying carbohydrate content of diet in patients with non-insulin-dependent diabetes mellitus. JAMA 1994;271:1421–1428. [ Links ]
20. Heilbronn LK, Noakes M, Clifton PM. Effect of energy restriction, weight loss, and diet composition on plasma lipids and glucose in patients with type 2 diabetes. Diabetes Care 1999;22:889–895. [ Links ]
21. Parker B, Noakes M, Luscombe N, Clifton P. Effect of a high-protein, high– monounsaturated fat weight loss diet on glycemic control and lipid levels in type 2 diabetes. Diabetes Care 2002;25:425– 430. [ Links ]
22. Trichopoulou A, Orfanos P, Norat T, Bueno-de-Mesquita B, Ocke MC, Peeters PH, et al. Modified Mediterranean diet and survival: EPIC-elderly prospective cohort study. BMJ 2005;330:991. [ Links ]
23. West SG, Hecker KD, Mustad VA, Nicholson S, Schoemer SL, Wagner P, et al. Acute effects of monounsaturated fatty acids with and without omega-3 fatty acids on vascular reactivity in individuals with type 2 diabetes. Diabetologia 2005;48:113–122. [ Links ]
24. Wang C, Harris WS, Chung M, Lichtenstein AH, Balk EM, Kupelnick B, Jordan HS. n-3 fatty acids from fish or fish-oil supplements, but not {alpha}-linolenic acid, benefit cardiovascular outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr 2006;84:5–17. [ Links ]
25. Kris-Etherton PM, Harris WS, Appel LJ. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation 2002;106:2747–2757. [ Links ]
26. Mozaffarian D, Bryson CL, Lemaitre RN, Burke GL, Siscovick DS. Fish intake and risk of incident heart failure. J Am Coll Cardiol 2005;45:2015–2021. [ Links ]
27. Erkkila AT, Lichtenstein AH, Mozaffarian D, Herrington DM. Fish intake is associated with a reduced progression of coronary artery atherosclerosis in postmenopausal women with coronary artery disease. Am J Clin Nutr 2004;80:626 –632. [ Links ]
28. Lee YM, Haastert B, Scherbaum W, Hauner H. A phytosterol-enriched spread improves the lipid profile of subjects with type 2 diabetes mellitus: a randomized controlled trial under free living conditions. Eur J Nutr 2003;42:111–117. [ Links ]
29. Sheard NF, Clark NG, Brand-Miller JC, Franz MJ, Pi-Sunyer FX, Mayer-Davis E, Kulkarni K, Geil P. Dietary carbohydrate (amount and type) in the prevention and management of diabetes: a statement of the American Diabetes Association. Diabetes Care 2004; 27:2266–2271. [ Links ]
30. Jenkins DJ, Wolever TM, Taylor RH, Barker H, Fielden H, Baldwin JM, et al. Glycemic index of foods: a physiological basis for carbohydrate exchange. Am J Clin Nutr 1981;34:362–366. [ Links ]
31. Brand-Miller J, Hayne S, Petocz P, Colagiuri S. Low-glycemic index diets in the management of diabetes: a meta-analysis of randomized controlled trials. Diabetes Care 2003;26:2261–2267. [ Links ]
32. Gannon MC, Nuttall JA, Damberg G, Gupta V, Nuttall FQ. Effect of protein ingestion on the glucose appearance rate in people with type 2 diabetes. J Clin Endocrinol Metab 2001;86:1040–1047. [ Links ]
33. Gannon MC, Nuttall FQ. Effect of a high-protein, low-carbohydrate diet on blood glucose control in people with type 2 diabetes. Diabetes 2004;53:2375–2382. [ Links ]
34. Gannon MC, Nuttall FQ, Saeed A, Jordan K, Hoover H. An increase in dietary protein improves the blood glucose response in persons with type 2 diabetes. Am [ Links ]
35. Raben A, Vasilaras TH, Moller AC, Astrup A. Sucrose compared with artificial sweeteners: different effects on ad libitum food intake and body weight after 10 wk of supplementation in overweight subjects. Am J Clin Nutr 2002;76:721–729. [ Links ]
36. Howard AA, Arnsten JH, Gourevitch MN. Effect of alcohol consumption on diabetes mellitus: a systematic review. Ann Intern Med 2004;140:211–219. [ Links ]
37. Guerrero-Romero F, Rodriguez-Moran M. Complementary therapies for diabetes: the case for chromium, magnesium, and antioxidants. Arch Med Res 2005;36:250–257. [ Links ]
38. Gunton JE, Cheung NW, Hitchman R, Hams G, OSullivan C, Foster-Powell K, McElduff A. Chromium supplementation does not improve glucose tolerance, insulin sensitivity, or lipid profile: a randomized, placebo-controlled, double-blind trial of supplementation in subjects with impaired glucose tolerance. Diabetes Care 2005;28:712–713. [ Links ]
39. Appel LJ, Brands MW, Daniels SR, Karanja N, Elmer PJ, Sacks FM. Dietary approaches to prevent and treat hypertension: a scientific statement from the American Heart Association. Hypertension 2006;47:296 –308. [ Links ]
40. Sacks FM, Svetkey LP, Vollmer WM, Appel LJ, Bray GA, Harsha D, et al. DASH- Sodium Collaborative Research Group. Effects on blood pressure of reduced dietary sodium and the Dietary Approaches to Stop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group. N Engl J Med 2001;344: 3–10. [ Links ]
41. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003;289:2560–2572. [ Links ]
42. WHO Expert Consultation. Appropriate body-mass index for Asian populations and its implications for policy and intervention strategies. Lancet 2004;363:157– 163. [ Links ]
43. Pijls LT, de Vries H, van Eijk JT, Donker AJ. Protein restriction, glomerular filtration rate and albuminuria in patients with type 2 diabetes mellitus: a randomized trial. Eur J Clin Nutr 2002;56:1200–1207. [ Links ]
44. Narita T, Koshimura J, Meguro H, Kitazato H, Fujita H, Ito S. Determination of optimal protein contents for a protein restriction diet in type 2 diabetic patients with microalbuminuria. Tohoku J Exp Med 2001;193:45–55. [ Links ]
45. Hansen HP, Tauber-Lassen E, Jensen BR, Parving HH. Effect of dietary protein restriction on prognosis in patients with diabetic nephropathy. Kidney Int 2002;62:220–228. [ Links ]
46. Meloni C, Morosetti M, Suraci C, Pennafina MG, Tozzo C, Taccone-Gallucci M, Casciani CU. Severe dietary protein restriction in overt diabetic nephropathy: benefits or risks? J Ren Nutr 2002;12:96 –101. [ Links ]
47. Cusick M, Chew EY, Hoogwerf B, Agron E, Wu L, Lindley A, Ferris FL III, the Early Treatment Diabetic Retinopathy Study Research Group. Risk factors for renal replacement therapy in the Early Treatment Diabetic Retinopathy Study(ETDRS), Early Treatment Diabetic Retinopathy Study Report No. 26. Kidney Int 2004;66:1173–1179. [ Links ]
48. Cryer PE, Davis SN, Shamoon H. Hypoglycemia in diabetes. Diabetes Care 2003;26:1902–1912. [ Links ]
49. Morrato EH, Hill JO, Wyatt HR, Ghushchyan V, Sullivan PW. Physical activity in U.S. adults with diabetes and at risk for developing diabetes, 2003. Diabetes Care 2007;30:203-209. [ Links ]
50. Knowler WC, Barrett-Connor E, Fowler SE, Hamman RF, Lachin JM, Walker EA, Nathan DM. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002;346:393-403. [ Links ]
51. Tuomilehto J, Lindström J, Eriksson JG, Valle TT, Hämäläinen H, Ilanne-Parikka P, et al. Finnish Diabetes Prevention Study Group. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001;344:1343-50. [ Links ]
52. Li G, Zhang P, Wang J, Gregg EW, Yang W, Gong Q, et al. The long-term effect of lifestyle interventions to prevent diabetes in the China Da Qing Diabetes Prevention Study: a 20-year follow-up study. Lancet 2008;371:1783-89. [ Links ]
53. Albright A, Franz M, Hornsby G, Kriska A, Marrero D, et al. American College of Sports Medicine position stand. Exercise and type 2 diabetes. Med Sci Sports Exerc 2000;32:1345-60. [ Links ]
54. Hawley JA, Lessard SJ. Exercise training-induced improvements in insulin action. Acta Physiol (Oxf). 2008;192:127-35. [ Links ]
55. Boulé NG, Haddad E, Kenny GP, Wells GA, Sigal RJ. Effects of exercise on glycemic control and body mass in type 2 diabetes mellitus: a meta-analysis of controlled clinical trials. JAMA 2001;286:1218-227. [ Links ]
56. Nishida Y, Higaki Y, Tokuyama K, Fujimi K, Kiyonaga A, et al. Effect of mild exercise training on glucose effectiveness in healthy men. Diabetes Care 2001;24:1008- 13. [ Links ]
57. Winnick JJ, Sherman WM, Habash DL, Stout MB, et al. Short-term aerobic exercise training in obese humans with type 2 diabetes mellitus improves whole- body insulin sensitivity through gains in peripheral, not hepatic insulin sensitivity. J Clin Endocrinol Metab 2008;93:771-78. [ Links ]
58. Cohen ND, Dunstan DW, Robinson CE, Vulikh E, et al. Improved endothelial function following a 14-month resistance exercise training program in adults with type 2 diabetes. Diabetes Res Clin Pract 2008;79:405-11. [ Links ]
59. Kadoglou NP, Iliadis F, Angelopoulou N, Perrea D, Ampatzidis G, Liapis CD, Alevizos M. The anti-inflammatory effects of exercise training in patients with type 2 diabetes mellitus. Eur J Cardiovasc Prev Rehabil 2007;14:837-43. [ Links ]
60. Balducci S, Iacobellis G, Parisi L, Di Biase N, Calandriello E, Leonetti F, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy. J Diabetes Complic 2006;20:216-23. [ Links ]
61. Dela F, von Linstow ME, Mikines KJ, Galbo H. Physical training may enhance beta- cell function in type 2 diabetes. Am J Physiol Endocrinol Metab 2004;287:E1024- 31. [ Links ]
62. Ferrara C.M, McCrone SH, Brendle D, Ryan AS, Goldberg AP. Metabolic effects of the addition of resistive to aerobic exercise in older men. Intl J Sport Nutr Exerc Metabol 2004;14:73-80. [ Links ]
63. Ibanez J, Izquierdo M, Arguelles I, Forgas L, Larrión JL, et al. Twice-weekly progressive resistance training decreases abdominal fat and improves insulin sensitivity in older men with type 2 diabetes. Diabetes Care 2005;28:662-67. [ Links ]
64. Ishii T, Yamakita T, Sato T, Tanaka S, Fujii S. Resistance training improves insulin sensitivity in NIDDM subjects without altering maximal oxygen uptake. Diabetes Care 1998;21:353-55. [ Links ]
65. Poehlman ET, Dvorak RV, DeNino WF, Brochu M, Ades PA. Effects of resistance training and endurance training on insulin sensitivity in nonobese, young women: a controlled randomized trial. J Clin Endocrinol Metabol 2000; 85:2463-68. [ Links ]
66. Sigal RJ, Kenny GP, Boule NG, Wells GA, et al. Effects of aerobic training, resistance training, or both on glycemic control in type 2 diabetes: a randomized trial. Ann Intern Med 2007;147:357-69. [ Links ]
67. Larsen JJ, Dela F, Madsbad S, Galbo H. The effect of intense exercise on postprandial glucose homeostasis in type II diabetic patients. Diabetologia 1999;42:1282-92. [ Links ]
68. Halse R, Bonavaud SM, Armstrong JL, McCormack JG, Yeaman SJ. Control of glycogen synthesis by glucose, glycogen, and insulin in cultured human muscle cells. Diabetes 2001;50:720-26. [ Links ]
69. Colberg SR, Grieco CR. Exercise in the treatment and prevention of diabetes. Curr Sports Med Rep 2009;8:169-75. [ Links ]
70. Vinik A Erbas T, Neuropathy. In Handbook of Exercise in Diabetes. 2nd ed. Ruderman N, Devlin JT, Kriska A, Eds. Alexandria, VA, American Diabetes Association, 2002: p. 463-496. [ Links ]
71. Mogensen CE. Nephropathy. In Handbook of Exercise in Diabetes. 2nd ed. Ruderman N, Devlin JT, Kriska A, Eds. Alexandria, VA, American Diabetes Association, 2002: p. 433-449. [ Links ]
72. Bax JJ, Young LH, Frye RL, Bonow RO, Steinberg HO, Barrett EJ. ADA. Screening for coronary artery disease in patients with diabetes. Diabetes Care 2007;30:2729-2736. [ Links ]
73. Buchwald H, Estok R, Fahrbach K, Banel D, Jensen MD, Pories WJ, Bantle JP, Sledge I. Weight and type 2 diabetes after bariatric surgery: systematic review and meta-analysis. Am J Med 2009;122: 248–256. [ Links ]
74. Buchwald H, Estok R, Fahrbach K, Banel D, Sledge I. Trends in mortality in bariatric surgery: a systematic review and meta-analysis. Surgery 2007;142:621–632. [ Links ]
75. Sjöström L, Narbro K, Sjöström CD, Karason K, Larsson B, Wedel H, et al. Swedish Obese Subjects Study. Effects of bariatric surgery on mortality in Swedish obese subjects. N Engl J Med 2007;357:741–752. [ Links ]