Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.11 no.3 Mérida oct. 2013
Enfoque Diagnóstico Inicial del Paciente con Talla Baja.
Protocolo del Servicio de Endocrinología del Instituto Autónomo Hospital Universitario de Los Andes.
Miguel A. Aguirre, Yubriangel Reyes, Mónica Ramírez, Mariarlenis Lara, Yajaira Briceño, Mariela Paoli, Grupo de Endocrinología Mérida (ENDO-MER).
Unidad de Endocrinología. Instituto Autónomo Hospital Universitario de los Andes. Mérida.
Dirigir correspondencia a: Miguel Aguirre; Email: miguelaguir@gmail.com
RESUMEN
La evaluación del crecimiento constituye un elemento fundamental en la detección y manejo de morbilidades en el área pediátrica ya que la disminución de la velocidad de crecimiento se considera un signo temprano de patologías subyacentes. La talla baja se define como aquella situada por debajo del percentil 3 o -2,5 DE para edad y sexo respecto a la curva de crecimiento de referencia para la población. Los trastornos relacionados con talla baja pueden ser clasificados en tres categorías de acuerdo a su causa; los primarios, que afectan al crecimiento desde etapas tempranas del desarrollo y que implican defectos intrínsecos en el cartílago de crecimiento; los secundarios, que incluyen una serie de cuadros clínicos, generalmente crónicos, que alteran el medio en el cual debe desarrollarse el cartílago de crecimiento, encontrándose en este grupo algunos trastornos endocrinos; y por último se encuentra un grupo de pacientes en los cuales la etiología no puede ser determinada y se conoce como talla baja idiopática (TBI). El proceso de diagnóstico de un paciente con talla baja se realiza a través de una anamnesis exhaustiva, examen físico, pruebas de laboratorio y estudios radiológicos. Sin embargo, existen pocas guías clínicas para el diagnóstico de esta condición, con variaciones sustanciales entre ellas, así como, baja sensibilidad y especificidad en la detección de la patología subyacente. El propósito del siguiente artículo fue examinar la evidencia existente y la experiencia clínica en el Servicio de Endocrinología del Hospital Universitario de los Andes para ofrecer un enfoque diagnóstico del paciente con Talla Baja.
Palabras Clave: Talla baja, crecimiento, hormona del crecimiento.
ABSTRACT
Evaluation of growth is an essential element in the detection and management of morbidities in the pediatric area. The decrease of the growth rate is considered an early sign of underlying pathologies. Short stature is defined as one located below the 3rd percentile or -2.5 SD for age and gender with respect to the reference growth curve for the population. The disorders related to short stature can be classified into three categories according to their cause. Primary causes, which affect the growth from early stages of development and involve intrinsic defects in the growth plate. Secondary causes, which include a number of clinical disorders, usually chronic, that alter the environment in which the growth plate must be developed, being in this group some endocrine disorders. Finally, there is a group of patients in whom the etiology cannot be determined and it is known as idiopathic short stature (ISS). The process of diagnosis of a patient with short stature is made through an exhaustive anamnesis, physical examination, laboratory tests and imaging studies. However, there are few clinical guidelines for the diagnosis of this condition, with substantial variations between them as well as low sensitivity and specificity in the detection of the underlying pathology. The purpose of this article was to review the evidence and clinical experience in the Endocrinology Service, Hospital Universitario de los Andes, to provide a diagnostic approach to patients with Short Stature.
Key Words: Short Stature, growth, growth hormone.
Articulo recibido en: Agosto 2013. Aceptado para publicación en: Septiembre 2013.
INTRODUCCIÓN
El crecimiento y el desarrollo constituyen hechos biológicos complejos a través de los cuales los seres vivos progresivamente aumentan su masa y logran su maduración morfológica, psicológica y reproductiva hasta alcanzar su plena capacidad funcional. La evaluación del crecimiento constituye un elemento fundamental en la detección y manejo de morbilidades en el área pediátrica, ya que la velocidad del crecimiento es uno de los principales indicadores del estado de salud del niño, y una diminución de la misma se considera un signo temprano de patologías subyacentes1.
El proceso de crecimiento involucra la interacción de una serie de factores tanto endógenos (genéticos, hormonales, étnicos, metabólicos, entre otros) como exógenos (nutricionales, afectivos, psicosociales, entre otros) que se inician desde la vida intrauterina hasta la pubertad y que determinarán el ritmo de maduración, así como, el tamaño y formas finales del organismo. En consecuencia, una alteración del crecimiento puede tener múltiples causas desencadenantes2.
Aunque la talla baja constituye un motivo de consulta frecuente a nivel mundial, existen pocas guías clínicas para el diagnóstico de esta condición, las cuales presentan variaciones sustanciales entre ellas, así como, baja sensibilidad y especificidad en la detección de la patología subyacente3,4. El propósito del siguiente artículo fue examinar la evidencia existente hasta el momento y la experiencia clínica en el Servicio de Endocrinología del Hospital Universitario de los Andes para ofrecer un enfoque diagnóstico del paciente con Talla Baja.
PATRÓN DE CRECIMIENTO
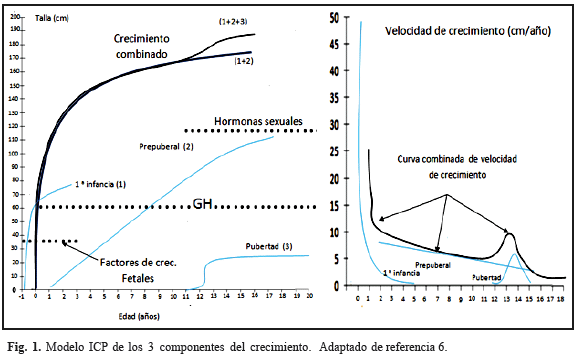
El crecimiento humano normal puede ser descrito como una curva sigmoide caracterizada por presentar dos períodos de crecimiento rápido separados por un período de crecimiento estable. El primero de estos períodos de crecimiento acelerado corresponde al período fetal y aproximadamente los dos primeros años y el segundo al llamado estirón puberal. Entre ambos la velocidad de crecimiento es constante, con un ligero incremento alrededor de los 7 años que se corresponde con la adrenarquia. En el estirón puberal existe una clara diferencia entre género (dimorfismo sexual) siendo más precoz y menos intenso en las mujeres que en los varones5. A finales de la década de los ochenta, Kalberg propone un modelo matemático de la curva de crecimiento humana en la cual se relacionan los distintos componentes de la misma con los elementos biológicos involucrados. El modelo ICP (infancy, childhood, puberty) considera que la curva de crecimiento describe el efecto aditivo de varias fases biológicas que se dividen en fetal y de la primera infancia, prepuberal o de la segunda infancia y la fase puberal6. (Figura 1)
EVALUACIÓN DEL CRECIMIENTO
En la evaluación del crecimiento (longitud en posición supina antes de los 2 años y luego talla en posición erguida) deben ser determinados tres parámetros básicos. En primer lugar, se determina la talla, se relaciona con las referencias para la edad y sexo, y se expresa como un valor de desviación estándar (DE) o una posición en percentiles1. En vista de que cada población presenta una base genética propia, los individuos deben ser evaluados con las gráficas correspondientes a su población. En nuestro país las gráficas de referencia corresponden al Estudio Transversal de la Población Venezolana (Proyecto Venezuela)7 y el Estudio Longitudinal del Área Metropolitana de Caracas (ELAMC)8.
En segundo lugar, debido a que la estatura de los padres es similar a la obtenida en su descendencia, fenómeno determinado genéticamente, la talla para la edad debe ser contrastada con la talla media de los padres corregida según sexo, o también conocido como potencial genético. Varias fórmulas han sido diseñadas para la determinación del potencial genético y éstas deben ser corregidas de acuerdo a la tendencia secular de cada población5.
En nuestro medio se utiliza la siguiente fórmula9:

En tercer lugar, se debe realizar un análisis longitudinal del crecimiento, expresado como velocidad de talla (cm/año o DE) en comparación con las referencias para la edad. Este parámetro se obtiene a través de la relación entre la talla y la edad en dos visitas sucesivas siendo el intervalo ideal un período entre 6 y 12 meses.

CRITERIOS DIAGNÓSTICOS
Existe controversia en cuanto al punto de corte para la definición de talla baja ya que la sensibilidad y especificidad de estos puntos no han sido especificadas en las guías clínicas para el manejo de esta condición10. En nuestro servicio se define como talla baja aquella situada por debajo del percentil 3 o -2,5 DE para edad y sexo respecto a la curva de crecimiento de referencia para la población. Estos pacientes deben ser estudiados, así como, aquellos que presenten un deterioro significativo en la velocidad de crecimiento (inferior al percentil 10) o que disminuyan su percentil de crecimiento incluso antes de que su talla se sitúe por debajo de -2,5 DE de la media5. La sensibilidad y especificidad de estos criterios en nuestra población quedan aún por ser determinadas.
CLASIFICACIÓN DE LOS DESÓRDENES ASOCIADOS CON TALLA BAJA
Al momento de evaluar un paciente que se presenta con talla baja, son muchas las patologías que deben ser consideradas. La Sociedad Europea de Endocrinología Pediátrica (ESPE) divide los trastornos relacionados con talla baja en tres categorías de acuerdo a su causa, trastornos del crecimiento primarios, secundarios y talla baja idiopática (Tabla I)11. Las causas primarias engloban aquellas que afectan al crecimiento desde etapas tempranas de la vida y que implican defectos intrínsecos en el cartílago de crecimiento; entre estas se incluyen, displasias óseas y síndromes genéticos. El retraso del crecimiento secundario engloba una serie de cuadros clínicos, generalmente crónicos, que alteran el medio en el cual debe desarrollarse el cartílago de crecimiento. Entre el grupo de causas secundarias encontramos desde desnutrición y diversas enfermedades sistémicas hasta afectación de la esfera psicosocial como depresión, anorexia entre otros1,5.
Una serie de trastornos endocrinos llevarán a una alteración secundaria del crecimiento. El eje hormona del crecimiento / factor de crecimiento símil a la insulina tipo I (GH/IGF I) es esencial para el crecimiento normal, por su efecto directo en el desarrollo del cartílago de crecimiento. Existen una serie de anormalidades de este eje que se expresan como un continuum desde deficiencia total de GH hasta resistencia periférica a la hormona por defectos en el receptor12,13. Generalmente estos pacientes presentan un enlentecimiento en la velocidad de crecimiento posterior a los 6 meses de vida, cuando la GH comienza a comandar el crecimiento5,12. El hipotiroidismo también es una causa de talla baja ya que las hormonas tiroideas incrementan la síntesis y secreción de GH, estimulan la diferenciación de los condrocitos en el cartílago de crecimiento y la síntesis de factores de crecimiento locales14. La pubertad precoz lleva a un incremento temprano en las hormonas sexuales con aceleración de la maduración ósea y la consecuencia de un cierre temprano de las epífisis que impide que el paciente alcance su potencial genético para la talla15. Asimismo, patologías como síndrome de Cushing y diabetes mellitus en mal control pueden ser responsables de esta condición.
Por último, se encuentra un grupo de pacientes en los cuales la etiología no puede ser determinada y que actualmente se conoce como talla baja idiopática (TBI). Con esta denominación se agrupan una serie de entidades clínicas que tienen en común un retraso crónico del crecimiento con talla inferior a -2 DE, compromiso de la velocidad de crecimiento y retraso de la maduración esquelética, con preservación de la armonía entre los segmentos corporales. Es un diagnóstico de exclusión que exige una evaluación clínica, bioquímica, hormonal y molecular minuciosa con el objetivo de descartar cualquier etiología conocida del retraso de crecimiento. Se deben descartar desórdenes como deficiencia de hormona del crecimiento, hipotiroidismo, síndrome de Turner, enfermedades crónicas, entre otros. Cuando uno o varios miembros de la familia (padres, tíos, abuelos, hermanos, primos) presentan también talla baja, se habla de TBI con componente familiar y cuando esto no ocurre, de TBI sin componente familiar16.
Es importante mencionar las variantes fisiológicas del crecimiento conocidas como talla baja familiar y retraso constitucional del crecimiento y desarrollo (RCCD)17. En el primer caso se refiere a niños con antecedentes familiares de talla baja, disminuyendo su velocidad de crecimiento en los 3 primeros años de vida para ubicarse en el canal correspondiente a su potencial genético, manteniéndose durante toda la infancia en un percentil bajo pero con una velocidad de talla normal y una maduración esquelética adecuada17. En el RCCD existe una historia familiar de retraso en el inicio de la pubertad y en la edad a la cual se alcanzó la talla adulta. Estos pacientes inician la pubertad luego de los 12 años en las niñas y de los 13 años en el varón con una maduración ósea moderadamente retrasada, sin embargo, una vez que se inicia la pubertad tanto la maduración ósea como la velocidad de talla se incrementan alcanzando el paciente una talla final acorde a su potencial genético5,18.
ENFOQUE DIAGNÓSTICO
El proceso de diagnóstico de un paciente con talla baja se realiza a través de una anamnesis exhaustiva, examen físico, pruebas de laboratorio y estudios radiológicos. Si no se encuentran indicios de cualquier etiología conocida para talla baja, es posible hacer el diagnóstico (de exclusión) de talla baja idiopática18.
Anamnesis
Se debe iniciar el interrogatorio con aspectos relacionados al período perinatal incluyendo complicaciones durante el embarazo (infecciones, intoxicación por drogas, preeclampsia, entre otros) edad gestacional al momento del parto, peso y talla al nacer, complicaciones neonatales (asfixia, ictericia). Una historia de retardo del crecimiento es de suma importancia ya que hasta 15% de los niños pequeños para la edad gestacional no alcanzan el catch up para su talla17,19. También se deben recolectar los datos del desarrollo psicomotor (en especial de los primeros años de vida), alimentación, antecedentes patológicos y quirúrgicos de importancia, uso crónico de fármacos que pudieran alterar el crecimiento (esteroides, metilfenidato, entre otros).
Se debe indagar sobre síntomas o signos sugerentes de enfermedades crónicas o sistémicas que condicionen una disminución en la velocidad de talla. Los antecedentes familiares son de vital importancia en el análisis de los trastornos del crecimiento. Presencia de consanguinidad en los padres y afecciones genéticas en el linaje familiar incrementan la probabilidad de trastornos genéticos homocigotos. Se debe obtener la talla de los padres (preferiblemente medida más que reportada), para la determinación de la talla blanco familiar.
Es importante determinar el patrón de desarrollo sexual de los padres para medir la probabilidad RCCD19,20.
En la tabla II se resumen los principales elementos que deben ser investigados al momento del interrogatorio y su interpretación adecuada.
Examen Físico
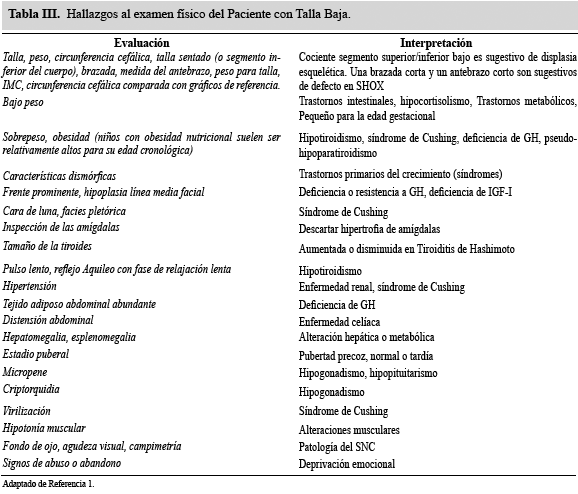
Aunado a las determinaciones ya mencionadas de la talla y su respectiva relación con los patrones de referencia poblacionales y el potencial genético heredado, deben ser realizadas otras mediciones para orientar la etiología de esta condición. Se deben determinar los segmentos corporales (superior, inferior y la relación entre ambos), envergadura, peso para la edad, índice de masa corporal (IMC) en mayores de 2 años y circunferencia cefálica en menores de 4 años, longitud del antebrazo. Proporciones corporales anormales son sugestivas de displasias óseas y un antebrazo corto es un marcador importante de haploinsuficiencia del gen SHOX. Asimismo, una escasa ganancia de peso puede sugerir una alteración nutricional o una enfermedad crónica17,21. Se debe realizar un examen cuidadoso del macizo facial en búsqueda de dismorfias que se asocien con síndromes genéticos específicos y defectos en la línea media que pueden relacionarse con déficit de GH. En el cuello se deben buscar características que sugieran condiciones genéticas (síndrome de Turner, entre otros) y presencia de bocio compatible con hipotiroidismo. La valoración de la maduración sexual se debe realizar por medio de los estadios de Tanner1,19. Ver tabla III.
Estudios de Imágenes
Los estudios de imágenes incluirán la radiografía de mano y muñeca izquierda para el cálculo de la edad ósea en todo paciente con talla baja, y además, radiografías de cráneo, columna, tórax, pelvis, entre otras, en aquellos pacientes con talla baja disarmónica. La resonancia y tomografía cerebral de preferencia contrastadas se realizan ante la sospecha de lesiones en sistema nervioso central en especial aquellas que afectan la hipófisis anterior o el tallo pituitario22.
La maduración esquelética es primordial en la evaluación de los trastornos del crecimiento ya que es un buen reflejo de la edad fisiológica del niño y permite la predicción de talla adulta. Esta se obtiene mediante la comparación de los centros de osificación epifisarios con los estándares para cada edad en individuos normales. Existen varios métodos para su determinación encontrándose entre los más utilizados aquellos que comparan la radiografía de la mano izquierda con los estándares por edad y sexo para una población específica. En caso de niños menores de 2 años se toma como parámetro la edad ósea radiológica de rodilla y pie. Es ideal que sea evaluada por un médico con experiencia ya que presenta una amplia variabilidad interobservador5,20.
La edad ósea debe estar acorde con la edad cronológica entre 6 y 12 meses o no mayor de 2 DE. La no concordancia entre estos parámetros puede orientar al clínico al grupo de patologías que con mayor probabilidad estén ocasionando este desorden. La edad ósea se encuentra retrasada en trastornos del crecimiento secundarios y en muchos casos de talla baja idiopática, por el contrario, en aquellas causas primarias de talla baja, la edad ósea pudiera no verse alterada o presentar solo un ligero retraso. La ausencia de retraso en la edad ósea excluye a la deficiencia de GH18.
Laboratorio
No existe consenso en cuanto a los estudios de laboratorio que deben ser realizados en pacientes con talla baja. De manera ideal, la elección de un estudio de laboratorio debe depender de factores como la prevalencia de la enfermedad, la frecuencia de la asociación de determinada patología con la alteración del crecimiento, la sensibilidad y especificidad de la prueba, entre otros; ante la carencia de dicha información, la selección de las pruebas de cribado se basan en la opinión de expertos18.
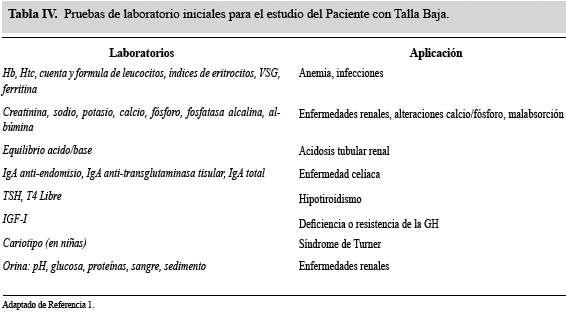
Se solicitarán en primer lugar análisis de rutina con el fin de identificar las causas comunes que conlleven a un déficit en el crecimiento y en caso de sospecha de determinada patología se orientarán los estudios complementarios para la misma (Ver tabla IV). La hematología completa permitirá valorar la presencia de anemia crónica o procesos infecciosos que pueden presentarse con retraso en el crecimiento, siendo en oportunidades la talla baja la primera manifestación de estas alteraciones (en especial en casos de Talasemia) 23,24. La velocidad de sedimentación globular (VSG) incrementada también es un importante parámetro en la detección de enfermedades inflamatorias como la ileítis regional, o neoplásicas como la leucemia5,18.
El perfil bioquímico permitirá la valoración de la función renal y hepática, y del metabolismo fosfo-cálcico, proteico e hidrocarbonado. Aunque niños con enfermedad hepática crónica presentan retraso en el crecimiento, es improbable que el retraso del crecimiento se presente como el único signo de un desorden hepático, por lo que la medición de AST y ALT constituyen una prueba de muy baja sensibilidad y actualmente no está recomendada en pacientes con talla baja18,25. En el caso de enfermedad renal y trastornos del metabolismo fosfo-cálcico, existe consenso en que la talla baja y el retardo del crecimiento están presentes aún en ausencia de otros síntomas, por lo que están recomendadas las pruebas de cribado para dichas patologías26.
La medición de un pH y gases venosos postprandiales está indicada, ya que estudios en pacientes con acidosis tubular renal distal evidencian que la talla baja y el retraso en el crecimiento constituyen el síntoma principal y de aparición temprana en esta patología. La acidosis tubular renal es infrecuente en niños mayores de 3 años27,28. En presencia de signos de desnutrición, debe realizarse un coproanálisis (incluyendo sangre oculta en heces), ferritina sérica y albúmina18. En alrededor del 2-8% de los niños con talla baja sin síntomas gastrointestinales, la enfermedad celíaca puede ser la causa subyacente, incrementando el porcentaje a medida que otras causas son descartadas. Por tanto la determinación de IgA total, anti-endomisio y anti-glutaminasa tisular está indicada; si alguno de estos estudios es positivo se deberá realizar biopsia para confirmar el diagnóstico1,29.
El estudio hormonal básico de un paciente con talla baja requiere la evaluación del eje tiroideo y somatotropo. Aunque no existe data de revisiones sistemáticas que examinen la prevalencia de talla baja en pacientes con hipotiroidismo, la experiencia clínica y la alta frecuencia de hipotiroidismo avalan la inclusión de esta prueba en el cribado diagnóstico inicial. Se debe medir T4L y TSH, y en caso de estar alterados se recomienda la medición de anticuerpos antitiroideos para pesquisa de tiroiditis autoinmune1,5. La medición del eje GH/IGF-I se inicia con la determinación de las concentraciones séricas de IGF-I las cuales deben valorarse dentro del rango propio para la edad. Concentraciones bajas de IGF-I pueden sugerir una deficiencia en la secreción de GH19. La IGFBP-3 es otro parámetro que evalúa la actividad del eje GH/IGF-I; es una proteína dependiente de la secreción y acción de GH. Aunque IGFBP-3 se considera menos útil que el IGF-I, puede tener una ventaja en los niños muy pequeños (menores de 3 años), ya que hay menos solapamiento en este parámetro entre niños normales y aquellos con deficiencia de GH que el evidenciado para las concentraciones de IGF-I30,31.
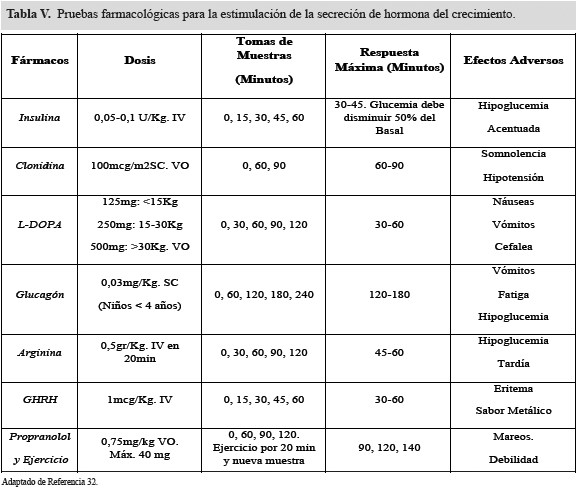
Se recomienda la realización de las pruebas de estimulación para GH en aquellos pacientes que presenten talla baja, velocidad del crecimiento por debajo del percentil 25, edad ósea retrasada y concentraciones séricas de IGF-I bajas, luego que otras causas de retraso en el crecimiento han sido descartadas19,20.
La determinación de las concentraciones de GH luego de la estimulación con diversos agentes constituye el método para la detección de deficiencia GH (Ver tabla V)32. En cuanto a la interpretación de los resultados, se ha establecido a manera de consenso que el pico de respuesta mínimo que debe obtenerse es de 10 ng/mL para considerar que la respuesta es normal; una concentración menor de 5ng/mL sugiere el diagnóstico de déficit de GH y entre 5 a 10 ng/dL de déficit parcial de GH2,17. Para hacer el diagnóstico se necesitan dos pruebas con estímulos diferentes con respuesta deficiente.
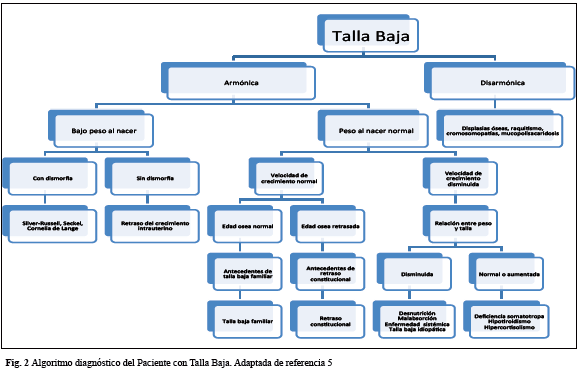
En niñas con talla baja que presenten un protocolo de cribado inicial sin anormalidad, debe llevarse a cabo un análisis cromosómico para el descarte de Síndrome de Turner. Asimismo, se recomienda el análisis molecular del gen SHOX, donde se tenga disponibilidad, en aquellos pacientes con hallazgos clínicos compatibles de haploinsuficiencia de este gen19. En la figura 2 se presenta un algoritmo en el que se resume el enfoque diagnóstico del paciente con talla baja.
CONCLUSIONES
La talla baja es un trastorno frecuente en pediatría, sin embargo, son escasos análisis que incluyan sensibilidad y especificidad de las pocas guías clínicas para el diagnóstico de esta condición. Por lo antes expuesto, la mayoría de las recomendaciones se basan en consideraciones teóricas y experiencia clínica más que en estudios que valoren el costo beneficio de los elementos diagnósticos recomendados, no obstante, esta guía constituye una buena herramienta para el abordaje inicial en el paciente con tan compleja alteración.
REFERENCIAS BIBLIOGRÁFICAS
1. Oostdijk W, Grote FK, de Muinck Keizer-Schrama SMPF, Wit JM. Diagnostic approach in children with short stature. Horm Res 2009; 72:206-217. [ Links ]
2. Pombo M, Castro-Feijóo L, Cabanas Rodríguez P. El niño de talla baja. Protoc Diagn Ter Pediatr 2011; 1:236-54. [ Links ]
3. Grote FK, Oostdijk W, de Muinck Keizer-Schrama SMPF, Dekker FW, Verkerk PH, Wit JM. Growth monitoring and diagnostic work-up of short stature: an international inventorization. J Pediatr Endocrinol Metab 2005; 18:1031-1038. [ Links ]
4. Grote FK, Oostdijk W, De Muinck Keizer-Schrama SM, van Dommelen P, van Buuren S, Dekker FW, Ketel AG, Moll HA, Wit JM. The diagnostic work up of growth failure in secondary health care; an evaluation of consensus guidelines. BMC Pediatr 2008; 8:21. [ Links ]
5. Cassorla F, Gaete X. Clasificación y valoración de la talla baja. En: Pombo M. Tratado de Endocrinología Pediátrica, 4.ª ed. McGraw-Hill. Interamericana. Madrid, 2009; 152-174. [ Links ]
6. Karlberg J. A biologically-oriented mathematical model (ICP) for human growth. Acta Paediatr Scand 1989; 350:70-94. [ Links ]
7. Proyecto Venezuela. Estado Carabobo. Tomo II. Caracas Alpha: 1981; 17-232. [ Links ]
8. Lopez Blanco M, Izaguirre Espinoza I, Macías Tomei C. Estudio longitudinal del área metropolitana de Caracas. Arch Venez Puer Ped 1986; 49:156-171. [ Links ]
9. Lopez Blanco M, Landaeta Jiménez M. Manual de crecimiento y desarrollo. Fundacredesa. Caracas 1991; 1-8. [ Links ]
10. Grote FK, van Dommelen P, Oostdijk W, de Muinck Keizer-Schrama SM, Verkerk PH, Wit JM, van Buuren S. Developing evidence-based guidelines for referral for short stature. Arch Dis Child 2008; 93:212-217. [ Links ]
11. Wit JM. ESPE classification of paediatric endocrine diagnoses. Basel [u.a.]: Karger; 2007, 1-9. [ Links ]
12. Savage MO, Burren CP, Rosenfeld RG. The continuum of growth hormone-IGF-I axis defects causing short stature: diagnostic and therapeutic challenges. Clin Endocrinol (Oxf) 2010; 72:721-728. [ Links ]
13. Brooks AJ, Waters MJ. The growth hormone receptor: mechanism of activation and clinical implications. Nat Rev Endocrinol 2010; 6:515-525. [ Links ]
14. Tarim Ö. Thyroid Hormones and Growth in Health and Disease. J Clin Res Pediatr Endocrinol 2011; 3:51-55. [ Links ]
15. Carel J-C, Léger J. Clinical Practice. Precocious Puberty. N Engl J Med 2008; 358:2366- 2377. [ Links ]
16. Carrascosa A, Fernández Longás A, Gracia Bouthelier R, López Siguero JP, Pombo Arias M, Yturriaga R. Talla baja idiopática. Revisión y puesta al día. An Pediatría 2011;75:204.e1-e11. [ Links ]
17. Allen DB, Cuttler L. Clinical practice. Short stature in childhood--challenges and choices. N Engl J Med 2013; 368:1220-1228. [ Links ]
18. Wit JM, Clayton PE, Rogol AD, Savage MO, Saenger PH, Cohen P. Idiopathic short stature: definition, epidemiology, and diagnostic evaluation. Growth Horm Igf Res 2008; 18:89-110. [ Links ]
19. Cohen P, Rogol AD, Deal CL, Saenger P, Reiter EO, Ross JL, Chernausek SD, Savage MO, Wit JM; 2007 ISS Consensus Workshop participants. Consensus statement on the diagnosis and treatment of children with idiopathic short stature: a summary of the Growth Hormone Research Society, the Lawson Wilkins Pediatric Endocrine Society, and the European Society for Paediatric Endocrinology Workshop. J Clin Endocrinol Metab 2008; 93:4210-4217. [ Links ]
20. Lopera Cañaveral MV, Campuzano-Maya G, Balthazar-Gónzalez V, Alfaro-Velásquez JM. Estudio del paciente con talla baja. Med & Lab 2009; 15:511- 531. [ Links ]
21. Rappold G, Blum WF, Shavrikova EP, Crowe BJ, Roeth R, Quigley CA, Ross JL, Niesler B. Genotypes and phenotypes in children with short stature: clinical indicators of SHOX haploinsufficiency. J Med Genet 2007; 44:306-313. [ Links ]
22. Chaudhary V, Bano S. Imaging in short stature. Indian J Endocrinol Metab 2012; 16:692-697. [ Links ]
23. Nunlee-Bland G, Rana SR, Houston-Yu PE, Odonkor W. Growth hormone deficiency in patients with sickle cell disease and growth failure. J Pediatr Endocrinol Metab 2004; 17(4):601-606. [ Links ]
24. Stephensen CB. Burden of infection on growth failure. J Nutr 1999; 129:534S-538S. [ Links ]
25. Sokol RJ, Stall C. Anthropometric evaluation of children with chronic liver disease. Am J Clin Nutr 1990; 52:203-208. [ Links ]
26. Warady BA. Growth retardation in children with chronic renal insufficiency. J Am Soc Nephrol 1998; 9:S85-89. [ Links ]
27. Bajpai A, Bagga A, Hari P, Bardia A, Mantan M. Longterm outcome in children with primary distal renal tubular acidosis. Indian Pediatr 2005;42:321-328. [ Links ]
28. Caldas A, Broyer M, Dechaux M, Kleinknecht C. Primary distal tubular acidosis in childhood: clinical study and long-term follow-up of 28 patients. J Pediatr 1992; 121:233-241. [ Links ]
29. Van Rijn JCW, Grote FK, Oostdijk W, Wit JM. Short stature and the probability of coeliac disease, in the absence of gastrointestinal symptoms. Arch Dis Child 2004; 89:882-883. [ Links ]
30. Jensen RB, Jeppesen KA, Vielwerth S, Michaelsen KF, Main KM, Skakkebaek NE, Juul A. Insulin-like growth factor I (IGF-I) and IGF-binding protein 3 as diagnostic markers of growth hormone deficiency in infancy. Horm Res 2005; 63:15-21. [ Links ]
31. Cianfarani S, Liguori A, Boemi S, Maghnie M, Iughetti L, Wasniewska M, Street ME, Zucchini S, Aimaretti G, Germani D. Inaccuracy of insulin-like growth factor (IGF) binding protein (IGFBP)-3 assessment in the diagnosis of growth hormone (GH) deficiency from childhood to young adulthood: association to low GH dependency of IGF-II and presence of circulating IGFBP-3 18-kilodalton fragment. J Clin Endocrinol Metab 2005; 90(11):6028-6034. [ Links ]
32. Lanes R, Palacios A. Consenso Venezolano Sobre el Uso de la Hormona de Crecimiento. Pfizer Venezuela. Caracas 2006, 19-33. [ Links ]