Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.14 no.3 Mérida oct. 2016
Perfil lipídico en pacientes con síndrome de ovario poliquístico.
Melissa Fermín, Rita Pizzi, Liliana Fung, María Auxiliadora Curiel, Yohana Pérez, Indira Centeno, Alexander Mendoza
Servicio de Endocrinología y Metabolismo, Unidad de Endocrinología Ginecológica, Hospital Universitario de Caracas. Caracas, Venezuela.
Dirigir correspondencia a: Rita Pizzi. Email: pizzi.rita@gmail.com
RESUMEN
Objetivo: Analizar en pacientes con síndrome de ovario poliquístico (SOP), alteraciones del metabolismo lipídico y su correlación con el índice de masa corporal y resistencia insulínica.
Métodos: Estudio observacional descriptivo de 30 pacientes con SOP, que cumplieron los criterios de inclusión, entre marzo y septiembre de 2013. Se evaluó el perfil lipídico y se correlacionó con índice de masa corporal (IMC), circunferencia abdominal (CA) y HOMA-IR, empleándose el Coeficiente V de Cramer.
Resultados: El 36,67% (11/30 pacientes) tuvieron colesterol total (CT) >200 mg/dL; 86,67% (26/30 pacientes) cHDL <50 mg/dL.; 63,33% (19/30 pacientes) cLDL >130 mg/dL y el 73,33% (22/30 pacientes) triglicéridos (TG) >150 mg/dL. El 93,33% (28/30 pacientes) presentaron alteraciones de al menos uno de los factores del perfil lipídico. Se observó una correlación baja entre IMC y CT (0,20), moderada entre IMC y cHDL (0,48) y muy baja entre IMC y TG (0,12). La relación entre perfil lipídico y CA demostró una correlación baja entre CA y CT (0,25), CA y cHDL de 0,45 (correlación moderada) y CA y TG de 0,23 (correlación baja). Las correlaciones entre HOMA-IR y perfil lipídico reflejaron una correlación moderada entre HOMA-IR y CT (0,52), HOMA-IR y cHDL de -0,34 (correlación inversa baja) y HOMA-IR y TG de 0,30 (correlación baja).
Conclusión: La dislipidemia es común en pacientes con SOP; las alteraciones más frecuentes fueron disminución del cHDL (87,10%) y elevación de TG (74,19%), las cuales son factores de riesgo cardiovascular en la mujer.
Palabras clave: Síndrome de ovario poliquístico, dislipidemia, perfil lipídico.
Lipid profile in patients with polycystic ovary syndrome
ABSTRACT
Objective: To analyze in patients with polycystic ovary syndrome (PCOS), abnormal lipid metabolism and its correlation with body mass index and insulin resistance.
Methods: Observational, descriptive study of 30 patients with PCOS, who met the inclusion criteria between March and September 2013. Lipid profile was evaluated and correlated with body mass index (BMI), waist circumference (WC) and HOMA-IR, using the Cramer V coefficient.
Results: The 36.67% (11/30 patients) had total cholesterol (TC)> 200 mg/dL; 86.67% (26/30 patients) HDL-C <50 mg/dL; 63.33% (19/30 patients) LDL-C >130 mg/dL and 73.33% (22/30 patients) triglycerides (TG) >150 mg/dL. The 93.33% (28/30 patients) showed abnormalities at least one factor lipid profile. We observed a low correlation between BMI and CT (0.20), BMI and HDL-C of 0.48 (moderate correlation) and BMI and TG 0.12 (very low correlation). The relationship between lipid profile and WC demonstrated a low correlation between WC and CT (0.25), WC and HDL-C 0.45 (moderate correlation), and WC and TG 0.23 (low correlation). The correlations between HOMA-IR and lipid profile showed a moderate correlation between HOMA-IR and CT (0.52), HOMA-IR and HDL-C of -0.34 (low inverse correlation), and HOMA-IR and TG 0,30 (low correlation).
Conclusion: Dyslipidemia is common in patients with PCOS. The most frequent alterations were decreased HDL cholesterol (87.10%) and elevated TG (74.19%), which are cardiovascular risk factors in women.
Key Words: Polycystic ovary syndrome, dyslipidemia, lipid profile.
Articulo recibido en: Marzo 2015. Aceptado para publicación en: Agosto 2016.
INTRODUCCIÓN
El Síndrome de Ovario Poliquístico (SOP) es una alteración frecuente con manifestaciones sistémicas; su etiología es compleja, heterogénea y no está completamente entendida1. En la actualidad hay varios consensos de diferentes Instituciones y Sociedades para el diagnóstico de SOP. Según los criterios de Rotterdam el SOP se diagnostica con la presencia de dos de los tres siguientes criterios: 1) oligoanovulación, 2) hiperandrogenismo clínico y/o bioquímico, 3) ovarios poliquísticos por ecosonografía2. El SOP se relaciona con alteraciones hormonales del eje hipófisis-ovario (disfunción menstrual, hiperandrogenismo, infertilidad y ovarios poliquísticos) y resistencia a la insulina3,4. Las mujeres con esta condición también muestran un perfil cardiovascular característico del síndrome metabólico o de resistencia a la insulina (hiperinsulinismo, obesidad, dislipidemia, hipertensión arterial) y un estado protrombótico, lo cual las coloca en una condición de mayor riesgo de desarrollar Diabetes Mellitus tipo 2 (DM2) y enfermedad cardiovascular5
El hiperandrogenismo, la anovulación y la resistencia a la insulina afectan el metabolismo de lípidos en el SOP6, evidenciándose un patrón aterogénico, caracterizado por aumento de los triglicéridos (TG), disminución de las lipoproteínas de alta densidad (HDL) y aumento de las de baja densidad (LDL) pequeñas y densas7,8. Este perfil aterogénico se asocia a un aumento en el riesgo de enfermedad cardiovascular9. Este patrón de lípidos es similar al encontrado en pacientes con DM2, y esto se debe principalmente a la resistencia a la insulina, que deteriora la capacidad de la insulina para suprimir la lipólisis, lo que aumenta la movilización de los ácidos grasos libres del tejido adiposo. En consecuencia, el aumento de ácidos grasos libres en el hígado y la resistencia hepática a la insulina, conlleva a alteraciones en la síntesis y catabolismo de lipoproteínas de muy baja densidad10
En un grupo de pacientes con diagnóstico de SOP evaluadas en la consulta de endocrinología ginecológica del Hospital Universitario de Caracas, en el período comprendido entre marzo y septiembre de 2013, se planteó analizar la relación existente entre dicha patología y las alteraciones del metabolismo lipídico. Para ello, se evaluaron los niveles de colesterol total, cHDL, cLDL y triglicéridos, se determinó la frecuencia y las características de las alteraciones del perfil lipídico, y se correlacionaron los niveles de colesterol total, cHDL y triglicéridos con índice de masa corporal (IMC), circunferencia abdominal (CA) y niveles de HOMA-IR.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional, descriptivo. Se obtuvo una muestra de 30 pacientes con diagnóstico de SOP confirmado a través de los criterios de Rotterdam con edades comprendidas entre los 18 y 40 años, vistas en la consulta de endocrinología ginecológica del Hospital Uni versitario de Caracas, dentro del período de estudio. Se excluyeron aquellas pacientes con hiperandrogenismo por otras causas, como hiperplasia suprarrenal congénita, tumores secretores de andrógenos y síndrome de Cushing; pacientes con uso de medicamentos con potencial para afectar la función reproductiva o metabólica, tales como anticonceptivos orales, drogas antiandrogénicas, hipoglucemiantes orales, estatinas o terapia con glucocorticoides (hasta 60 días antes de ingresar al estudio) y mujeres embarazadas.
Las pacientes fueron incluidas en el estudio previo consentimiento informado por escrito y una vez aceptadas las condiciones del mismo. Se les registró en una ficha de recolección de datos diseñada para ello, que incluía datos de identificación, edad, antecedentes familiares, personales y gineco-obstétricos de importancia. Posteriormente se les realizó el examen físico completo, donde se incluían como parte de su evaluación, la toma de tensión arterial, peso, talla, IMC, CA, evaluación de la escala de hirsutismo de Ferriman y Gallway, evaluación de presencia de acné, acantosis nigricans, alopecia y seborrea. Dicha evaluación fue realizada por el mismo observador y con el uso de los mismos instrumentos (tensiómetro, peso y cinta métrica). Se midió la CA con cinta métrica flexible colocada en el punto medio de la línea entre el último arco costal y la cresta iliaca, y en base a los valores obtenidos, se clasificaron a las pacientes según el criterio de la Adult Treatment Panel III (ATP III) en: CA normal (≤88 cm) y obesidad abdominal (>88 cm)11. Se determinó el IMC, mediante la fórmula peso/talla2. Según los valores obtenidos, y bajo las categorías de IMC según la Organización Mundial de la Salud12, se agruparon a las pacientes en 5 categorías: Bajo peso (<18,5 kg/m2), Normopeso (18,5-24,9 kg/ m2), Sobrepeso (25-29,9 kg/m2), Obesidad grado I (30-34,9 kg/m2), Obesidad grado II (35-39,9 kg/ m2) y Obesidad grado III (>40 kg/m2).
A cada paciente se le realizó la evaluación ultra-sonográfica transvaginal (entre el día 1 a 3 del ciclo menstrual o en amenorrea) con el equipo ALOKA IPC-1530, empleando transductor transvaginal de 5 MHz, para determinar la presencia o no de criterios ultrasonográficos de ovarios poliquísticos, volumen ovárico mayor de 10 cc y/o más de 12 folículos menores de 10 mm, dicha evaluación fue realizada por el mismo observador. Este mismo día se les realizó la toma de muestras de sangre venosa, para lo cual las pacientes debían cumplir entre 10 a 12 horas de ayuno, se determinó: hematología completa, glucemia e insulina basal, 60 y 120 minutos post-carga de 75 g de glucosa, aspartato aminotransferasa (AST), alanina aminotransferasa (ALT), colesterol total (CT), colesterol de la lipoproteína de alta densidad (cHDL), colesterol de la lipoproteína de baja densidad (cLDL) y triglicéridos (TG), testosterona libre, 17-OH progesterona, tirotropina (TSH) y prolactina.
La concentración plasmática de TG y CT se analizó por método enzimático con auto analizador Olympus AU640e, con reactivos de Beckman Coulter. El cHDL se cuantificó por método enzimático después de precipitación con heparina y cloruro de manganeso. El cLDL se estimó a través de la ecuación de Friedewal cLDL=CT- (cHDL+TG/5). Para la determinación de la prueba de tolerancia oral glucosada en cuanto a los valores de glucemia, se utilizó el kit de glucemia reactiva con el método glucosa oxidasa con auto analizador Olympus AU640e. Para los valores de insulina se estudió la insulina ultrasensible a través del inmunoensayo de electroquimioluminiscencia, y fue realizado en el analizador automático TOSOH. Obtenidos estos valores se calculó el HOMA-IR (insulin ratio or homeostatic model assesment), mediante la fórmula: Insulina en ayunas (μU/mL) x glucemia en ayunas (mmol/L)/22,5 siendo el valor normal < 2,5.
Análisis estadístico: el análisis estadístico se fundamentó en las técnicas de estadística descriptiva y el análisis clásico de tablas de contingencia con apoyo del paquete SPSS Statistics 19. Para evaluar las posibles relaciones entre variables de escala planteadas en este estudio, se calcularon los respectivos Coeficientes de asociación V de Cramer. Para su interpretación se tomaron como criterio orientador las indicaciones de Morales13: valor de 0 a 0,20 relación muy baja, de 0,20 a 0,40 baja, 0,40 a 0,60 moderada, de 0,60 a 0,80 apreciable alta y de 0,80 a 1 alta o muy alta. Dado que la muestra es no probabilística, se desconoce el grado de representatividad que tiene la misma y, en consecuencia, no se puede medir o controlar el error probable de muestreo sobre cualquier generalización acerca de la población, por lo que no es adecuado utilizar técnicas de estadística inferencial y las conclusiones de esta investigación se circunscriben a la muestra estudiada.
RESULTADOS
Caracterización de la muestra: La muestra estuvo constituida por un total de 30 pacientes que reunieron los criterios de inclusión, con edades comprendidas entre los 18 y los 39 años, media (ẋ)=27,73, desviación estándar (s)=4,76 y mediana=27. En cuanto a su distribución, 8 pacientes (26,67%) oscilaban entre los 18 y 25 años; 15 pacientes (50%) tenían entre 26 y 30 años y 7 (23,33%) entre 31 y 39 años. El IMC osciló entre 19 y 48 kg/m2, ẋ=27,70 kg/m2; s=5,88, mediana=26,10 kg/m2. En cuanto a su distribución, se encontró lo siguiente: 12 pacientes (40%) se encontraban en el rango de normopeso, 9 pacientes (30%) en sobrepeso y 9 pacientes (30%) tenían obesidad; de ellos, 7 pacientes grado 1, una paciente grado 2 y una paciente grado 3. La CA osciló entre 62 y 125 cm, ẋ=91,70 cm; s=13,88, mediana=90,50 cm. En cuanto a su distribución, 13 pacientes (43,33%) tenían una CA inferior a 88 cm, mientras que la de 17 pacientes (56,67%) supera este valor.
Perfil lipídico: Los niveles de CT oscilaron entre 120 y 286 mg/dL, ẋ=184,20 mg/dL; s=45,88 y mediana=182,50 mg/dL. En cuanto a su distribución, puede observarse en la Tabla I, que 19 pacientes (63,33%) tenían CT inferior a 200 mg/dL, mientras que las 11 pacientes restantes (36,67%) superaban este valor. El cHDL osciló entre 28 y 66 mg/dL, ẋ=42,14 mg/dL; s=9,13 y mediana=43 mg/dL. En cuanto a su distribución, 26 pacientes (86,67%) tenían niveles de cHDL por debajo de 50 mg/dL, mientras que las 4 pacientes restantes (13,33%) lo tienen por encima de este valor. El cLDL oscilaba entre 44 y 209,80 mg/dL, ẋ=114,19, s=40,78 y mediana=110,90 mg/dL. En cuanto a su distribución, 11 pacientes (36,67%) tenían niveles de cLDL por debajo de 130 mg/dL y las 19 pacientes restantes (63,33%) valores ≥ 130 mg/dL. Los TG oscilaban entre 64 y 312 mg/dL, ẋ=168,17 mg/dL; s=64,59 y mediana=160,50 mg/dL. En cuanto a su distribución, 8 pacientes (26,67%) tenían valores inferiores a 150 mg/dL, mientras que las 22 pacientes restantes (73,33%) los tienen por encima de este valor. Visto en su conjunto, 28 pacientes (93,33%) presentaban alteraciones en al menos uno de los factores del perfil lipídico. Sólo dos pacientes (6,67%) no presentaron alteraciones en ningún parámetro del perfil lipídico.
Al evaluar los diferentes parámetros del perfil lipídico según el IMC, puede apreciarse en la Tabla II, que de las 30 pacientes con diagnóstico de SOP que integran la muestra, 19 (63,33%) tenían valores normales de CT y 11 (36,67%) alterados, mientras que 12 pacientes (40%) presentaban valores normales de IMC y 18 (60%) alterados, distribuyéndose éstas últimas en partes iguales en los rangos de sobrepeso y obesidad. El CT se encontró alterado en 3 de las 12 pacientes (25%) con IMC normal, en 4 de las 9 pacientes (44,44%) con sobrepeso y en 4 de las 9 pacientes (44,44%) con obesidad. Al correlacionar cada uno de los rangos de la variable IMC y colesterol total calculando el valor del coeficiente V de Cramer, fue de 0,20, lo que sugiere una relación baja entre ambas variables. En cuanto a los valores de cHDL según el IMC, 8 pacientes (36,36%) tenían IMC normal, 7 pacientes (31,82%) sobrepeso y 7 pacientes (31,82%) presentaban obesidad. El valor del coeficiente V de Cramer fue de 0,12, lo que sugiere una relación muy baja entre ambas variables.
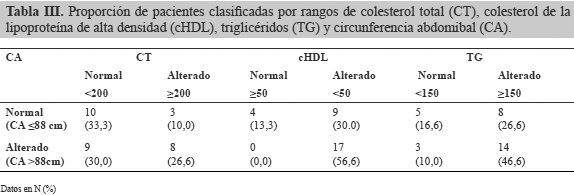
Al evaluar la variable CA y perfil lipídico (Tabla III), se aprecia que 13 pacientes (43,33%) tenían CA dentro de límites normales, mientras que las 17 restantes (56,67%) tenían valores que reflejaban obesidad abdominal. De las pacientes con niveles de CT alterado, 3 (27,27%) tenían CA normal y 8 pacientes (72,73%) alterado. El valor del coeficiente V de Cramer fue de 0,25 lo que sugiere una relación baja entre ambas variables. Al evaluar CA y niveles de cHDL, se observa que la totalidad de pacientes con CA >88 cm tenían valores alterados. Al correlacionar ambas variables calculando el valor del coeficiente V de Cramer, éste fue de 0,45, lo que sugiere una relación moderada entre ambas variables. Al relacionar niveles de TG y CA, se observa que de las 17 pacientes con CA >88 cm, 14 (82,35%) tenían valores alterados y 3 (17,65%) dentro de límites normales; mientras que de las 13 pacientes con CA normal, 8 (61,5%) tenían TG alterados y 5 (38,46%) normales. El valor del coeficiente V de Cramer al correlacionar ambas variables fue de 0,23, lo que sugiere una relación directa baja entre ambas variables.
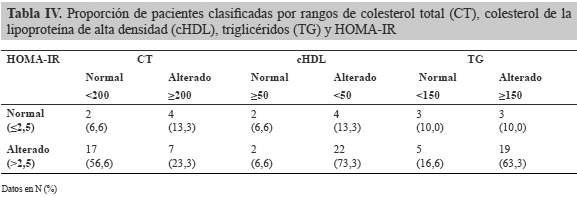
En la tabla IV se evalúan los diferentes parámetros del perfil lipídico y el HOMA-IR. De las 30 pacientes con diagnóstico de SOP que integran la muestra, 6 (20%) tenían valores de HOMA-IR dentro del rango normal y 24 (80%) alterados. De estas últimas, 17 pacientes (70,83%) tenían valores normales de colesterol total y 7 pacientes (29,17%) los tenían alterados. El coeficiente de correlación entre colesterol total y HOMA-IR refleja, un valor de 0,52 del coeficiente V de Cramer, lo cual sugiere una relación directa moderada. Al evaluar niveles de cHDL y HOMA-IR, se observa que de las 24 pacientes con HOMA-IR alterados, sólo 2 pacientes (8,33%) tenían valores normales de cHDL y 22 pacientes (91,67%) los tenían alterados. El coeficiente de correlación V de Cramer entre cHDL y HOMA-IR fue de -0,34, lo cual sugiere una relación inversa baja. Por último, al relacionar valores de TG y HOMA-IR, se obtuvo que de las 24 pacientes con HOMA-IR alterados, 5 (20,83%) tenían valores normales de TG y 19 pacientes (79,17%) alterados. El coeficiente de correlación entre triglicéridos y HOMA-IR refleja una correlación baja (coeficiente de correlación V de Cramer de 0,30).
DISCUSIÓN
El SOP no es sólo una condición ginecológica que afecta a las mujeres en edad reproductiva, sino también un amplio síndrome con una variedad de desórdenes metabólicos asociados como la resistencia a la insulina y la dislipidemia14,15.
En este estudio se pudo demostrar que la mayor proporción de niveles alterados de CT, TG y cHDL se encontró en pacientes en rango de sobrepeso y obesidad. Resultado similar al obtenido por el estudio de Roa Barrios y col16, quienes demostraron que los niveles de TG aumentaban y de cHDL disminuían en relación con el incremento de la masa corporal. De igual forma, Wild y col17, reportaron que en las mujeres con SOP, las concentraciones de cHDL eran 6 mg/dL (IC 95%: 17-35) menores en comparación con pacientes sanas, y dichos valores se hacían menores a medida que aumentaba el IMC.
Al analizar los parámetros del perfil lipídico en nuestras pacientes, se encontró que el 73,3% de ellas presentaron niveles de TG por encima de 150 mg/dL. Estos resultados son similares a los de Wild y col17, quienes al realizar una revisión sistemática y metanálisis de los niveles de lípidos en diferentes estudios transversales de pacientes con SOP, demostraron que los niveles de TG fueron 26 mg/dL (IC 95%: 17-35) más altos en las pacientes con SOP. A diferencia de los resultados presentados por Berneis y col18, quienes observaron que la mayoría de pacientes tuvieron niveles de TG normales, y sólo 2 de las 30 pacientes estudiadas tuvieron niveles de triglicéridos por encima de 150 mg/dL.
En nuestro estudio se encontró que 28 pacientes (93,33%) presentaron alteraciones en al menos uno de los factores del perfil lipídico, y sólo dos pacientes (6,67%) tuvieron un perfil lipídico sin alteraciones. Resultados similares fueron los obtenidos por García y col19, quienes reportaron alteraciones lipídicas en el 95,7%, siendo la disminución del cHDL la alteración lipídica más frecuente (91,3%). En este mismo orden de ideas, Rocha y col20, encontraron anormalidad en el perfil lipídico en el 76,1% de los casos. Las anormalidades más frecuentes encontradas en nuestro estudio, por orden de frecuencia, fueron: niveles de cHDL bajos (86,67%), TG elevados (73,33%) y CT elevado (36,67%). Estas alteraciones fueron observadas por Rocha y col20 con el mismo orden de frecuencia: cHDL bajos (57,6%), TG elevados (28,3%) y CT elevado (23%).
Al correlacionar los niveles de colesterol total, cHDL y TG con el IMC, pudo demostrarse sólo entre los niveles de cHDL e IMC una relación moderada (coeficiente V de Cramer de 0,48). Según los resultados de Rocha y col20, los niveles de cHDL disminuyeron significativamente para cada nivel de IMC, siendo más bajos en la categoría de sobrepeso que en pacientes normopeso (p=0,571), en obesas más que en pacientes con sobrepeso (p=0.021) y en obesas más que en pacientes normopeso (p≤0.001).
El papel de la obesidad en el perfil de lípidos en pacientes con SOP es controversial. Algunos investigadores no lograron encontrar diferencias en el perfil lipídico en pacientes con SOP en comparación con grupos controles, mientras que otros encontraron que las mujeres obesas con SOP tienen niveles más elevados de TG y niveles más bajos de cHDL que las mujeres delgadas17. En nuestro estudio, el IMC tuvo un mayor impacto sobre el cHDL en comparación con los otros parámetros del perfil lipídico.
En relación con SOP y riesgo cardiovascular, se ha dado especial importancia a la obesidad central21-23. De esta forma, la utilización de medidas antropométricas para diagnóstico de obesidad central asume importancia en el enfoque clínico de individuos expuestos a mayor riesgo cardiovascular, como es el caso de mujeres con SOP24,25. Dentro de las variables antropométricas para la evaluación de la obesidad central se encuentra la medida de la CA26, variable evaluada en este trabajo. Al correlacionarla con los parámetros del perfil lipídico, pudo observarse correlación baja con CT (coeficiente V de Cramer: 0,25) y con TG (coeficiente V de Cramer: 0,23), y sólo con cHDL pudo observarse una correlación moderada (coeficiente V de Cramer: 0,45); a diferencia de los resultados obtenidos por Caldas y col26, quienes observaron que al correlacionar CA con perfil lipídico, se obtuvieron correlaciones positivas sólo con los niveles de TG.
García y col19 reportaron que las pacientes con resistencia insulínica tuvieron un patrón lipídico más desfavorable a expensas del aumento del cLDL, de las Apo B y disminución de las Apo A–I, en comparación con las pacientes sin resistencia insulínica. En nuestro estudio, se observó que la mayor proporción de pacientes con alteraciones del perfil lipídico, tenían además valores de HOMA-IR por encima de 2,5. De hecho, el 95,83% de las pacientes con insulino resistencia (24 pacientes), tenían además, alteraciones en al menos uno de los parámetros del perfil lipídico evaluados en este estudio. Estos resultados concuerdan con los obtenidos por Hong y col27, quienes encontraron que la prevalencia de dislipidemia fue significativamente más alta en el grupo de SOP con resistencia insulínica que en el grupo de SOP sin resistencia insulínica (39,9 vs 15,5%, p<0,05). Además, encontraron correlación positiva del HOMA-IR con TG, CT y cLDL, y una correlación negativa con cHDL. En nuestro estudio, el parámetro del perfil lipídico que obtuvo una correlación moderada con HOMA-IR fue el CT (coeficiente V de Cramer: 0,52), mientras que TG y cHDL arrojaron correlaciones bajas (coeficiente V de Cramer de 0,30 y -0,34 respectivamente).
En este mismo orden de ideas, Anuradha y col28 en su estudio demostraron que las pacientes con SOP y resistencia insulínica tenían niveles más elevados de CT, TG, así como cHDL más bajos que el grupo de pacientes con SOP sin resistencia insulínica, siendo estadísticamente significativas estas diferencias entre los dos grupos para el CT (p=0,002), TG (p=<0,001) y cHDL (p=<0,001).
Las limitaciones de este estudio incluyen el tamaño de la muestra y que no se pudieron realizar otros parámetros para la evaluación del metabolismo lipídico (apolipoproteínas) en estas pacientes.
Se concluye que la dislipidemia es frecuente en pacientes con SOP; en nuestra investigación se demostraron niveles elevados de CT y TG, así como bajos niveles de cHDL en la mayor proporción de las pacientes estudiadas; esta mayor proporción de alteraciones del perfil lipídico se encontró en pacientes con sobrepeso y obesidad comparados con las mujeres no obesas con el síndrome. Se ha sugerido que la obesidad está generalmente asociada con perfiles lipídicos más aterogénicos en mujeres con SOP29-32. Además, los hallazgos de alteraciones del perfil lipídico se correlacionan con indicadores de resistencia a la insulina, fortaleciendo el concepto de que la obesidad y la resistencia a la insulina son contribuyentes importantes en el desarrollo de las alteraciones metabólicas y lipídicas en el SOP 7.
Las alteraciones lipídicas, unidas a otros factores de riesgo que con frecuencia coexisten con el SOP, aumentan el riesgo cardiovascular de estas mujeres; sin embargo, no está bien definida la evolución de estos trastornos a mediano y largo plazo, ni la mortalidad por enfermedad cardiovascular33-35. No obstante, se considera que la intervención temprana de estas pacientes tendría un impacto positivo en la disminución del riesgo cardiovascular al cual están sometidas, justificando así la evaluación metabólica en mujeres con SOP para indicar las medidas terapéuticas no sólo desde el punto de vista hormonal y de fertilidad, sino también desde el aspecto metabólico36 .
REFERENCIAS BIBLIOGRÁFICAS
1. Legro RS, Arslanian SA, Ehrmann DA, Hoeger KM, Murad MH, Pasquali R, Welt CK, Endocrine Society. Diagnosis and treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2013;98:4565-4592. [ Links ]
2. The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril 2004;81:19- 25. [ Links ]
3. Dunaif A, Segal K, Futterweit Q, Dobransky A. Profound peripheral insulin resistance, independent of obesity, in polycystic ovary syndrome. Diabetes 1989;38:1165- 1174. [ Links ]
4. Franks S. Polycystic ovary syndrome: A changing perspective. Clin Endocrinol 1989;31:87-120. [ Links ]
5. Cho LW, Randeva HS, Atkin SL. Cardiometabolic aspects of polycystic ovarian syndrome. Vasc Health Risk Manag 2007;3:55-63. [ Links ]
6. Ibáñez L, Potau N. Hiperandrogenismo ovárico funcional y síndrome del ovario poliquístico en la adolescencia. Endocrinol Nutr 2006;53:34-40. [ Links ]
7. Cheang K, Nestler J, Futterweit W. Risk of cardiovascular events in mothers of women with polycystic ovary syndrome. Endocr Pract 2008;14:1084-1094. [ Links ]
8. Pardo R. Síndrome de ovarios poliquísticos: una disfunción metabólica de alto riesgo cardiovascular. Rev Obstet Ginecol Venez 1999;59:117-136. [ Links ]
9. Quintero-Castillo D, Luz-Araujo H, Guerra-Velázquez M, Reyna-Villasmil E, Santos Bolívar J, Torres-Cepeda D, et al. Perfil lipídico en mujeres obesas y no obesas con síndrome de ovarios poliquísticos tratadas con metformina. Endocrinol Nutr 2010;57:262-267. [ Links ]
10. Wild RA, Carmina E, Diamanti-Kandarakis E, Dokras A, Escobar-Morreale HF, Futterweit W, Lobo R, Norman RJ, Talbott E, Dumesic DA. Assessment of cardiovascular risk and prevention of cardiovascular disease in women with the polycystic ovary syndrome: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society. J Clin Endocrinol Metab 2010;95:2038-2049. [ Links ]
11. National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation 2002;106:3143-3421. [ Links ]
12. WHO Obesity: prevention and managing the global epidemic. Report of a WHO Consultation. World Health Organ Tech Rep Ser 2000;894:1-253. [ Links ]
13. Morales, P. Estadística aplicada a las Ciencias Sociales. Universidad Pontificia Comillas; 2008:1-364. [ Links ]
14. Dejager S, Pichard C, Giral P, Bruckert E, Federspield MC, Beucler I, Turpin G. Smaller LDL particle size in women with polycystic ovary syndrome compared to controls. Clin Endocrinol (Oxf) 2001;54:455-462. [ Links ]
15. Wu X, Zhou S, Liu J, Pöllänen P, Sallinen K, Mäkinen M, Erkkola R. Selective ovary resistance to insulin signaling in women with polycystic ovary syndrome. Fertil Steril 2003;80:954-965. [ Links ]
16. Roa M, Arata G, Valeri L, Velázquez E. Relación entre el cociente triglicéridos/cHDL, índices de resistencia a la insulina y factores de riesgo cardiometabólico en mujeres con síndrome del ovario poliquístico. Endocrinol Nutr 2009; 56:59-65. [ Links ]
17. Wild R, Rizzo M, Clifton S, Carmina E. Lipid levels in polycystic ovary syndrome: systematic review and meta-analysis. Fertil Steril 2011;95:1073-1079. [ Links ]
18. Berneis K, Rizzo M, Lazzaroni V, Fruzzetti F, Carmina E. Atherogenic Lipoprotein Phenotype and Low- Density Lipoproteins Size and Subclasses in Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metab 2007;92:186-189. [ Links ]
19. García Y, Monteagudo G, Padrón R, González R. Evaluación de las alteraciones lipídicas en el síndrome de ovarios poliquísticos y su relación con la resistencia a la insulina. Rev Cubana Endocrinol 2010;21:145- 153. [ Links ]
20. Rocha MP, Marcondes JA, Barcellos CR, Hayashida SA, Curi DD, da Fonseca ÂM, Bagnoli VR, Baracat EC. Dyslipidemia in women with polycystic ovary syndrome: incidence, pattern and predictors. Gynecol Endocrinol 2011;27:814-819. [ Links ]
21. Diamanti-Kandarakis E. Role of obesity and adiposity in polycystic ovary syndrome. Int J Obes (Lond) 2007;31:S8-S13. [ Links ]
22. Hoeger KM. Obesity and lifestyle management in polycystic ovary syndrome. Clin Obstet Gynecol 2007;50:277-294. [ Links ]
23. Escobar-Morreale HF, San Millán JL. Abdominal obesity and the polycystic ovary syndrome. Trends Endocrinol Metab 2007;18:266-272. [ Links ]
24. Pitanga F, Lessa I. Anthropometric indexes of obesity as an instrument of screening for high coronary risk in adults in the city of Salvador-Bahia. Arq Bras Cardiol 2005;8:26-31. [ Links ]
25. Azevedo G, Duarte J, Souza M, Costa-E-Silva T, Soares E, Maranhão T. Menstrual cycle irregularity as a marker of cardiovascular risk factors at postmenopausal years. Arq Bras Endocrinol Metab 2006;50:876-883. [ Links ]
26. Caldas E, Mafaldo E, Araujo T, De Oliveira T, Dantas G. Índices de Obesidad Central y factores de riesgo cardiovascular en el Síndrome de ovario poliquístico. Arq Bras Cardiol 2010;94:615-620. [ Links ]
27. Hong Y, Yang D, Liu W, Zhao X, Chen X, Li L. Dyslipidemia in relation to body mass index and insulin resistance in Chinese women with polycystic ovary syndrome. J Biol Regul Homeost Agents 2011;25:365-374. [ Links ]
28. Karla A, Nair S, Rai L. Association of obesity and insulin resistance with dyslipidemia in Indian women with polycystic ovarian syndrome. Indian J Med Sci 2006;60:447-453. [ Links ]
29. Birdsall M, Farquhar C, White H. Association between polycystic ovaries and extent of coronary artery disease in women having cardiac catheterization. Ann Intern Med 1997;126:32-35. [ Links ]
30. Sánchez L, Azziz R. Síndrome de ovario poliquístico, evaluación, diagnóstico, tratamiento y pronóstico. Rev Obstet Ginecol Venez 2000;60:47-57. [ Links ]
31. Tang T, Glanville J, Hayden C, White D, Barth J, Balen A. Combined lifestyle modification and metformin in obese patients with polycystic ovary syndrome. A randomized, placebo-controlled, double-blind multicentre study. Hum Reprod 2006;21:80 -89. [ Links ]
32. Pardo R. Síndrome de ovario poliquístico: una disfunción metabólica de alto riesgo cardiovascular. Rev Obstet Ginecol Venez 1999;59:117-136. [ Links ]
33. Lo JC, Feigenbaum SL, Yang J, Pressman A, Selby J, Go AS. Epidemiology and adverse cardiovascular risk profile of diagnosis polycystic ovary syndrome. J Clin Endocrinol Metab 2006;91:1357-1363. [ Links ]
34. Azziz R. How prevalent is metabolic syndrome in women with polycystic ovary syndrome. Nat Clin Endocrinol Metab 2006;2:132-133. [ Links ]
35. Talbott EO, Zborowskii JV, Boudraux MY. Do women with polycystic ovary syndrome have an increased risk of cardiovascular disease? Review of the evidence. Minerva Ginecol 2004;56:27-39. [ Links ]
36. Villaseca P, Hormaza P, Cárdenas I, Oestereicher E, Manzur A, Arteaga E. Frecuencia de insulin-resistencia y dislipidemia en mujeres jóvenes con síndrome de ovario poliquístico. Rev Chil Obstet Ginecol 1999;64:431-437. [ Links ]