Boletín de Malariología y Salud Ambiental
versión impresa ISSN 1690-4648
Bol Mal Salud Amb vol.53 no.1 Maracay ene. 2013
Brote de enfermedad de Chagas agudo de posible transmisión oral en Mérida, Venezuela
Néstor Añez*1, Gladys Crisante1, Agustina Rojas1 & Diego Dávila2
1 Investigaciones Parasitológicas J.F.Torrealba, Universidad de Los Andes, Facultad de Ciencias, Departamento de Biología, Mérida, 5101, Venezuela
2 Instituto de Cardiología, Hospital Universitario de Los Andes, Mérida, 5101, Venezuela
*Autor de correspondencia: nanes@ula.ve
RESUMEN
Se registra un brote de enfermedad de Chagas agudo, en una localidad rural de Mérida-Venezuela, asociado con transmisión oral por ingesta contaminada con Trypanosoma cruzi dada la masiva y simultanea infección detectada en 5 miembros de una familia. La masiva transmisión de T. cruzi generó cuadros clínicos severos causando miocarditis aguda en 2 pacientes (40%) incluyendo un caso fatal. La severidad clínica en todos los pacientes involucrados mostró correspondencia con los hallazgos parasitológicos, serológicos y moleculares (PCR) con los cuales se evidenció presencia de tripomastigotes sanguícolas de T. cruzi, anticuerpos anti-T. cruzi con niveles variables de IgM e IgG específicas y ADN de T. cruzi, respectivamente. Asimismo, el perfil clínico reveló 17 signos o síntomas con un promedio por paciente de 12±3 (rango=9-16) con simultaneidad en 8 de los síntomas más frecuentemente detectados. Resalta en la sintomatología la presencia de edema facial interno con manifiesta tumefacción y parestesia lingual en ausencia del cuadro típico de edema bipalpebral (signo de Romaña) y/o chagoma de inoculación comúnmente registrados en la infección chagásica por vía vectorial. Se argumenta la posibilidad de la transmisión oral y se discute la potencial importancia epidemiológica del presente hallazgo.
Palabras claves: Enfermedad de Chagas, Trypanosoma cruzi, Transmisión oral, Venezuela.
Acute Chagas disease outbreak of possible oral transmission in Merida, Venezuela
SUMMARY
An acute Chagas disease outbreak associated with oral transmission, detected in a rural village of Merida- Venezuela, is reported. The massive transmission due to ingestion of food contaminated with Trypanosoma cruzi generated, in 5 members of the same family, severe clinical features causing acute myocarditis in two of them (40%) including a fatal case. Parasitological, serological and molecular (PCR) examination of samples from the 5 patients involved in the outbreak, revealed T.cruzi blood circulating tripomastigotes, anti-T. cruzi specific antibodies (IgM; IgG) and the presence of T. cruzi respectively. The recorded clinical pattern detected a total of 17 signs or symptoms with an average ± SD 12±3 per patients (range = 9-16) showing simultaneity in 8 symptoms and a 20% mortality. A remarkable characteristic detected during the study was the presence of internal facial swollen with paresthesia in tongue in absence of the typical Romaña's sign or chagoma commonly found in Chagas disease-infection caused by vector transmission. The possible oral transmission and the potential of the findings from the epidemiological viewpoint are discussed.
Key words: Chagas disease, Trypanosoma cruzi, Oral transmission, Venezuela
Recibido el 24/04/2013 Aceptado el 19/05/2013
INTRODUCCIÓN
Trypanosoma (Schizotrypanum) cruzi es el agente etiológico del a enfermedad de Chagas , considerada una de las más importantes parasitosis en América Latina. La íntima asociación de este parásito con especies de insectos hematófagos de la subfamilia Triatominae constituye un vínculo fundamental para la transmisión de la infección a vertebrados susceptibles, permitiendo el mantenimiento de la parasitosis en sus nidos o focos naturales. Es bien conocida la forma de transmisión de T. cruzi al hospedador mamífero por contaminación de membranas mucosas o piel con heces de triatominos infectados depositadas cuando se alimentan sobre el vertebrado. Sin embargo, se ha considerado que esta ruta indirecta de transmisión pareciera ser un mecanismo poco eficiente, lo cual pudiera comprometer la circulación del parásito y el mantenimiento del mismo en focos naturales (Miles, 2010). Asimismo, se ha sostenido que el proceso de transmisión de T. cruzi al hospedador natural podría haber estado llevándose a cabo más eficientemente por vía oral, tomando en consideración la posibilidad que tienen los animales que actúan como reservorios de ingerir triatominos infectados con toda su carga parasitaria o por el canibalismo entre ellos en el foco enzoótico, un comportamiento que revela lo primitivo de este modo de transmisión posiblemente previo a la asociación del parásito con los actuales triatominos vectores (Pipkin, 1969;Diotaiutiet al.,1995;Stevenset al.,2000;Schofield, 2000).
El desplazamiento de triatominos infectados con T. cruzi hasta la vivienda humana ha permitido, a través del tiempo, la generación y posterior ampliación de focos microepidémicos, endémicos y/o epidémicos de la enfermedad de Chagas en poblaciones establecidas en las cercanías de focos naturales, como consecuencia de la colonización intradomiciliar de los insectos. Asimismo, el desplazamiento de triatominos silvestres ha podido contribuir al reforzamiento de colonias de algunas especies ya existentes en el domicilio y a la adaptación de otras especies al ámbito domiciliar, lo que en conjunto con el movimiento de animales sinantrópicos mantendría una activa transmisión intra domiciliar. Otro factor que permite comprender la compleja dinámica de transmisión de la infección chagásica es la incursión ocasional de triatominos adultos a las viviendas, ocasionando casos esporádicos de enfermedad de Chagas en los individuos que la habitan sin que se produzca colonización intradomiciliar del insecto transmisor (Añez et al., 1999; Feliciangeli et al.,2007;Miles,2010). Además de la clásicamente conocida vía vectorial de transmisión de T. cruzi al hombre, existen otras maneras de diseminación del parásito que igualmente provocan cuadros clínicos de rangos variables. Estas incluyen la vía transfusional, la transmisión congénita o transplacentaria, la contaminación por transplante de órganos y la transmisión por vía oral.
La infección en humanos causada por T. cruzi adquirido por la vía oral, luego de la ingesta de comidas o bebidas contaminadas, es conocida en Latinoamérica desde la primera mitad del siglo XX (Mazza et al., 1936). Sin embargo, es durante la última década del presente siglo cuando se ha registrado el mayor número de brotes agudos de enfermedad de Chagas en la región amazónica brasilera, en Colombia y Venezuela como consecuencia de ingestas contaminadas con T. cruzi (Días et al., 2008; Shikanai-Yasuda et al., 1991; Ríos et al., 2011; Alarcón de Noya et al., 2010; Pereira et al., 2013). En el presente estudio se registra un brote de enfermedad de Chagas agudo detectado en miembros de una misma familia en una localidad rural del estado Mérida al occidente de Venezuela, posiblemente generado por ingesta contaminada con T. cruzi a juzgar por las características clínicas y epidemiológicas observadas. En el mismo se incluye, además de los detalles sobre las manifestaciones clínicas en los cinco individuos infectados, información sobre osaspectossero- parasitológicos observados durante el seguimiento de la infección chagásica y se caracterizan molecularmente los aisladosdeT. cruzi obtenidos de cada uno de los pacientes. Asimismo, la descripción de las manifestaciones clínicas primarias y su secuencia sintomática se incluyen como testimonio de pacientes, lo que en combinación con el diagnóstico médico, pudiera ofrecer una versión más apegada a la realidad sobre esta microepidemia familiar.
MATERIALES Y METODOS
Procedencia de los casos estudiados
Todos los pacientes estudiados, miembros de una misma familia, procedían de la localidad de El Bordo, parroquia Mesa Bolívar, municipio Antonio Pinto Salinas, estado Mérida, Venezuela, ubicada a 895 m.s.n.m, con registros de temperatura promedio de 25°C y humedad relativa (HR)>80%, localizada en las coordenadas 08°29′21″N y 71°38′52″W. Los cinco miembros de la familia, dos adultos: un hombre de 58 años (01-12) y su hija de 26 años (02-12); más tres niños (hijos de 02-12): 2varonesde7y3años(04-12y05-12,respectivamente) y una hembra de 3 años (03-12) compartían el mismo espacio en una vivienda rural de una habitación, con paredes de bloques frisados y techos de lámina metálica. Al examen de los alrededores de la vivienda se constató la presencia de cría y mantenimiento de animales porcinos y bovinos en corrales cercanos al domicilio, rodeado de vegetación relativamente abundante. Asimismo, se detectó la presencia de perros en el domicilio. En los ambientes domiciliares cercanos a la habitación eran mantenidos productos de consumo diario como frutos maduros y otros vegetales, donde no era raro sorprender la presencia de animales como marsupiales (Didelphis albiventris) y roedores de los géneros Mus y Rattus. Finalmente, la indagación sobre triatominos en la vivienda reveló la presencia de tres ejemplares adultos,2(♀y♂) de la especie Panstronylus geniculatus y 1 de Triatoma maculata, los cuales fueron colectados para su análisis respectivo. Asimismo, la búsqueda de triatominos en viviendas vecinas fue realizada en varias oportunidades después de la parecimiento de los casos clínicos reportados aquí.
Diagnóstico parasitológico
Muestras de sangre de cada uno de los pacientes antes descritos fueron enviadas desde el hospital Universitario de Los Andes, Mérida, Venezuela y recibidas en nuestro laboratorio siendo inmediatamente examinadas microscópicamente para la detección de formas sanguícolas de T. cruzi. En caso de ser detectados flagelados en la muestra fresca, alícuotas de 5µL fueron tomadas para realizar extendidos en láminas portaobjetos de vidrio. Una vez secada la muestra extendida e identificada la lámina con el código del paciente, lamisma fue fijada con metanol durante tres minutos y coloreada con Giemsa al 10% en buffer fosfato pH 7,2. Tanto las muestras frescas como las láminas coloreadas fueron examinadas en microscopio Axioscop (Zeiss-Germany) acoplado a cámara Noticam 480 conectada a computador Laptop-HP para realizar registro de actividad y morfología de parásitos, respectivamente. De resultar positivas cualquiera de las muestras examinadas, un volumen de sangre de 0,5mL fue colocado, bajo condiciones de esterilidad, en tubos de cultivo conteniendo medio difásico NNN. Los hemocultivos fueron revisados cada 5 días hasta lograr la observación de flagelados para ser luego transferidos a nuevos cultivos con la finalidad de amplificar la población y estabilizar el aislado en condiciones de laboratorio. De la misma manera, muestras de sangre fueron inoculadas por vía intradérmica en ratones albinos NMR de 20gr de peso, los cuales fueron periódicamente examinados para detectar positividad por T. cruzi.
Diagnóstico molecular
La identificación molecular de los aislados obtenidos por hemocultivo fue llevada a cabo mediante Añez N. et al. la demostración de la presencia de ADN de T. cruzi en muestras de cultivos estabilizados utilizando un ensayo de PCR específico (ADNk) con los iniciadores 121 (5´-AAATAATGTACGGGGGAGATGCATGA-3´) y 122 (5´-GGTTCGATTGGGGTTGGTGTAATATA-3´) siguiendo protocolo previamente establecido y estandarizado (Schijman et al., 2011).
Diagnóstico serológico
Las pruebas serológicas utilizadas para la detección de anticuerpos (Ac) circulantes anti-T. cruzi fueron el test de aglutinación directa (TAD) y el de inmunofluorescencia indirecta (IFI) cuyas condiciones y procedimientos han sido previamente descritas (Añez et al., 1999; 2011). Además, todas las muestras fueron procesadas para la detección de inmunoglobulinas (IgM; IgG) específicas para T. cruzi, utilizando la técnica de IFI con el procedimiento y propósito descritos en previas publicaciones (Añez et al., 2001; 2011). En todos los casos autorización por escrito incluyendo un consentimiento previa información (CPI) fue obtenido de los pacientes o sus representantes en caso de niños menores antes de la toma de muestras y la realización de los estudios aquí reportados.
Consideraciones éticas
El presente estudio ha sido realizado respetando las Normas de la Comisión de Ética del Hospital Universitario de los Andes, Mérida, con conocimiento por parte de las Unidades de Infectología y Cardiología del mismo.
RESULTADOS
Manifestaciones clínicas y secuencia sintomática según testimonios de pacientes
Las primeras manifestaciones clínicas fueron observadas en el grupo familiar con una diferencia entre ellos de 3-5 días, sin que hubiera precisión en los testimonios recogidos sobre la ingestión de lo que se sospecha pudo haber sido una posible ración alimenticia contaminada con formas infectivas de T. cruzi. Los síntomas iniciales fueron notados en el paciente 01-12, seguido tres días más tarde con una similar sintomatología en los niños identificados aquí como 03-04-05/12 para finalmente tornarse sintomática 2 días más tarde la paciente 02-12. Con la idea de aportar una descripción sobre la secuencia sintomática en el tiempo, lo más apegado a la realidad vivida por el grupo infectado, a continuación se ofrece el testimonio de uno de los pacientes que sobrevivió a la infección y se encargó del cuidado de los otros infectados. 01-12 Como primer perfil sintomático se refiere fiebre persistente durante 20 días acompañado de cefalea y mialgia sospechándose inicialmente de un cuadro de dengue. El paciente fue recluido en clínica de atención prioritaria durante 11 días manteniendo el cuadro febril sin respuesta a terapia antibiótica y cefalea sin respuesta a analgésicos. Durante su reclusión y persistiendo el cuadro inicial, el paciente desarrolla hepato-esplenomegalia con dolor abdominal intenso, sospechándose de un cuadro de hepatitis. Seguidamente aparece edema facial en el área perimaleolar con inflamación manifiesta en la cara interna de los carrillos y parestesia lingual con vómitos frecuentes e intolerancia a ingestión de alimentos, seguido de edema en miembros superiores e inferiores culminando con anasarca. En las condiciones descritas el paciente es referido a un centro hospitalario donde se le aplica placa de tórax, eco-abdominal y estudio eco-cardiográfico reflejando este último, miocarditis aguda con derrame pericárdico y aneurisma del ventrículo derecho. El paciente fallece a los siete días de reclusión hospitalaria, sin haber recibido terapia anti chagásica.
02-12
El paciente refiere que la primera manifestación clínica fue una cefalea intensa y progresiva sin respuesta a analgésicos seguido de fiebre persistente por 15 días que nunca cedió con la aplicación de antipiréticos, acompañada de mialgia generalizada. Casi simultáneamente refiere haber sentido una sensación de hormigueo o parestesia lingual, sin dolor, sin presencia de puntos de entrada y con ligera inflamación. Posterior a los frecuentes vómitos, apareció edema facial bilateral en la cara interna de los carrillos. Ocho días después de comenzado los síntomas antes descritos el paciente refiere hepato- esplenomegalia con intenso dolor abdominal, seguido de edema generalizado. Asimismo, refiere taquicardias frecuentes en reposo de duración variable. Luego de reclusión hospitalaria y aplicación de estudio eco-cardiográfico fue detectado un cuadro de miocarditis aguda con derrame pericárdico. Los síntomas fueron cediendo progresivamente una vez aplicado tratamiento con Benznidazol.
03-12; 04-12; 05-12
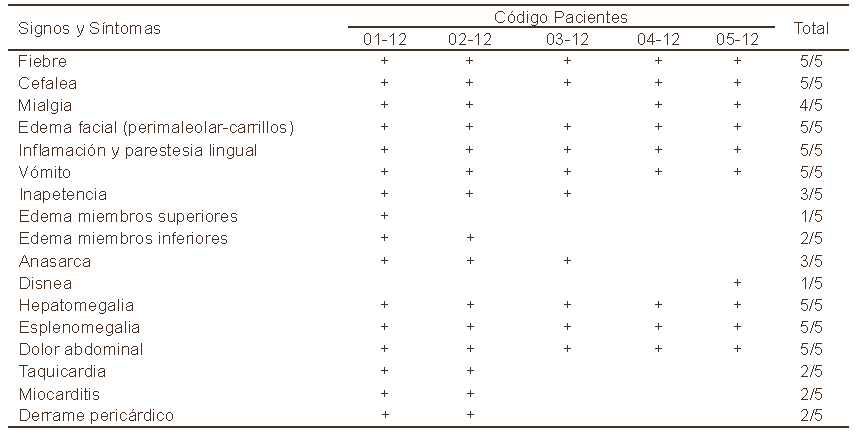
Tres días después de comenzados los síntomas en uno de los pacientes adultos (01-12) los tres niños presentaron simultáneamente cuadro febril (39°C) prolongado por 15 días con manifestaciones de cefalea y mialgia sin respuesta a la terapia antibiótica o analgésica. Un examen de sangre revela conteo plaquetario relativamente bajo por lo que se sospecha de un cuadro viral. Similar al cuadro antes descrito para ambos adultos de la familia los niños presentaron edema facial interesando la parte interna de los carrillos con manifiesto escozor, con ligera tumefacción, parestesia lingual y vómitos frecuentes. Similarmente, en los tres niños un cuadro de hepatomegalia con dolor abdominal fue revelado seguido en uno de ellos(03-12)por anasarcayen otro con disnea(05-12).Todos respondieron al tratamiento con Benznidazol. Es de hacer notar que en ningún caso fue detectado edema bipalpebral o signo de Romaña, ni inflamación localizada como chagoma de inoculación, típico en las infecciones por T. cruzi causadas por vía vectorial, según testimonio de la paciente 02-12, madre de los tres niños infectados e hija del paciente 01-12.Un resumen de los principales signos y síntomas detectados en los pacientes aquí referidos se presentan en la Tabla I.
Hallazgos parasitológicos y moleculares
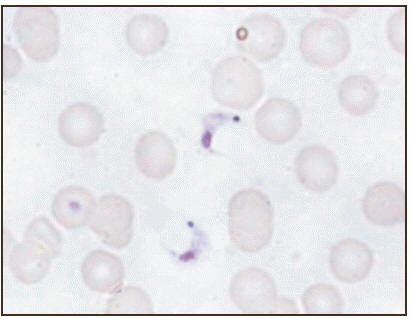
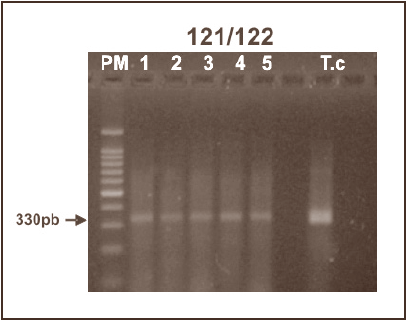
El examen microscópico de muestras frescas de sangre periférica proveniente del grupo familiar, reveló la presencia de tripo mastigotes sanguícolas en todos los 5 pacientes clínicamente afectados detectándose mayor cantidad de parásitos en los pacientes adultos (01-12; 02-12). La identificación morfológica de las formas sanguícolas de T. cruzi fue corroborada mediante la observación microscópica en láminas coloreadas (Fig.1). Las mismas fueron detectadas en muestras de los pacientes 01-12; 02-12; 03-12 y 04-12 mientras que en 05-12, no se logró detectar parásitos con esta metodología. La verificación diagnóstica fue definitivamente lograda con la observación de resultados positivos en todas las muestras sometidas a hemocultivo en medio NNN y en inoculaciones en animales de laboratorio, los cuales desarrollaron altas parasitemias e invasión tisular en diferentes órganos detectada por exámenes histopatológicos (no mostrado). Adicionalmente, la utilización de ensayos de PCR permitió la identificación de parte del genoma de T. cruzi. Estos resultados confirmaron la especificidad del ADN de T. cruzi procesado de las muestras de cada paciente mediante la amplificación de una banda de 330pb cuando fueron utilizados en los ensayos de PCR oligo nucleótidos (121/122) de la región variable del mini-círculo del ADN kinetoplástico. Detalles sobre los hallazgos parasitológicos y la caracterización molecular para todos los aislados obtenidos de los pacientes agudos se presentan en la Tabla II y Fig. 2.
Tabla I. Signos y síntomas detectados en pacientes chagásicos con infección oral.
Hallazgos serológicos
La reactividad de las pruebas serológicas realizadas en muestras de sangre de los 5 pacientes estudiados, reveló seropositividad a la infección por T. cruzi. Todos los sueros diagnosticados mostraron la presencia de Ac anti-T. cruzi con títulos que oscilaron entre 1:128 y 1:4096 y entre 1:64 y 1:256 para las pruebas de TAD e IFI polivalente, respectivamente. Asimismo, la condición clínica de los seropositivos fue inmunológicamente corroborada luego de procesar por la técnica de inmunofluorescencia indirecta cada muestra de suero positiva para la detección de niveles de IgM e IgG específica anti-T. cruzi. La Tabla III muestra los niveles de Ac revelados con las diferentes pruebas diagnósticas para cada paciente.
Fig. 1. Tripomastigotes sanguícolas de Trypanosoma cruzi detectados en muestra de sangre de paciente chagásico agudo. Coloración Giemsa al 10%. 1000X.
Hallazgos entomológicos
La búsqueda de triatominos en el domicilio donde ocurrió el brote agudo de enfermedad de Chagas y en algunas viviendas vecinas, permitió la captura de ejemplares de las especies Panstrongylus geniculatus, Eratyrus mucronatus, Triatoma maculata y Rhodnius prolixus, todos en estadío adulto. Es interesante hacer notar que tanto en los alrededores de la habitación compartida por los pacientes estudiados como en alguna de las viviendas vecinas fueron encontrados ejemplares de P. geniculatus y R. prolixus o P. geniculatus y T. maculata en asociación en el mismo lugar. La disección de los ejemplares encontrados reveló infección por T. cruzi en P. geniculatus.
Tabla II. Despistaje parasitológico, identificación de Trypanosoma cruzi en muestras de pacientes chagásicos agudos infectados por vía oral.
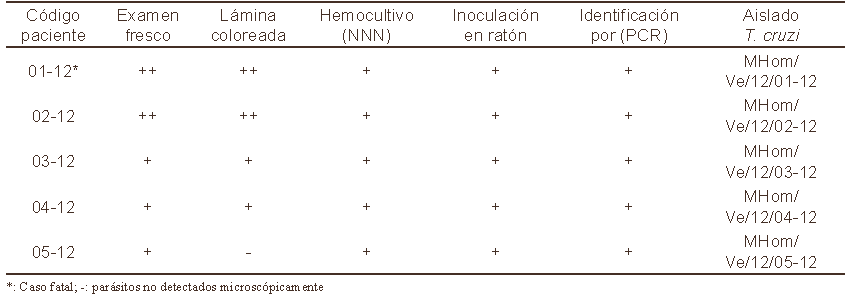
Fig. 2. Caracterización de aislados de Trypanosoma cruzi obtenidos de casos agudos de enfermedad de Chagas por contaminación oral. 1-5: pacientes; Tc: ADN control de T. cruzi; PM: Marcador de peso molecular.
Tratamiento y seguimiento post-tratamiento
Todos los sobrevivientes del brote familiar recibieron tratamiento oral con Benznidazol en presentación de comprimidos de 100mg a dosis de 5mg/ kg de peso para el paciente adulto (02-12) y de 10mg/ kg de peso para los niños (03-12; 04-12; 05-12) durante 60 días consecutivos. La mejoría clínica se hizo evidente a los 7 días post-tratamiento. Habiendo desaparecido la sintomatología, los pacientes fueron dados de alta hospitalaria para finalizar el tratamiento en su domicilio. La primera evaluación post-tratamiento fue realizada 60 días después de haberse confirmado el Fig.2.Caracterización de aislados de Trypanosoma cruzi obtenidos de casos agudos de enfermedad de Chagas por contaminación oral. 1-5: pacientes; Tc: ADN control de T. cruzi; PM: Marcador de peso molecular. diagnóstico de infección por T. cruzi, la cual consistió en una valoración clínico-cardiológica y el correspondiente despistaje sero-parasitológico utilizando las mismas técnicas descritas para establecer el diagnóstico primario. Para la fecha de la valoración todos los pacientes se encontraban asintomáticos ,lo cual fue confirmado con la evaluación clínica, electrocardiográfica y ecocardiográfica arrojando resultados de normalidad en todos los casos.
Asimismo, la observación sistemática de los hemocultivos correspondientes a la primera re-evaluación no reveló en ningún caso presencia de flagelados. Sin embargo, el despistaje serológico reflejó seropositividad en todos los pacientes, detectándose Ac circulantes anti-T. cruzi y mayores niveles de IgG indicando la superación de la fase aguda de la infección chagásica. En una segunda re-evaluación serológica realizada tres meses más tarde, aún cuando fueron detectados Ac anti-T. cruzi, los mismos correspondieron a títulos muy bajos notándose la desaparición de las señales de IgM y conservando títulos relativamente bajos de IgG. Detalles de la valoración serológica referida durante el seguimiento de los pacientes, se muestran en la Tabla III.
DISCUSIÓN
En el presente estudio se analiza desde el punto de vista clínico, epidemiológico, sero-parasitológico y molecular una microepidemia de enfermedad de Chagas agudo, ocurrida en una localidad rural del estado Mérida al occidente de Venezuela, en la cuales tuvieron involucrados 5miembrosdeunamismafamiliaresultandoun20%(1/5) de letalidad. El registro de este brote agudo, de posible transmisión oral por contaminación de ingestas con formas infectivas de T. cruzi, es el primero en su género
Tabla III. Niveles de anticuerpos anti-T. cruzi detectados al inicio de la infección y seguimiento serológico post-tratamiento en pacientes chagásicos agudos infectados por vía oral.

registrado en esta parte de la geografía venezolana. La primera razón que conduce a la sospecha de esta forma de transmisión es la detección de una masiva infección en todos los miembros de una familia que vivían en el mismo domicilio, compartían los mismos alimentos, desarrollaron simultáneamente signos y síntomas agudos de similar gravedad, presentaron parasitemia patente fácilmente detectable y altos niveles de Ac anti-T. cruzi con apreciables valores de IgM específica. Otro indicador, y quizás uno de los más significativos, que permite sospechar sobre una posible transmisión vía oral por contaminación de ingestas con formas meta cíclicas infectivas de T.cruzi, es el desarrollo de una sintomatología aguda simultánea en ausencia del cuadro típico de edema bipalpebral o signo de Romaña y de induraciones o tumefacciones localizadas reconocidas como chagomas de inoculación comúnmente encontradas en los casos de infección por vía vectorial. Estas características generales coinciden con las descripciones de brotes agudos de enfermedad de Chagas como producto de infecciones por vía oral reportadas por previos investigadores en distintas regiones de Latinoamérica (Pereira et al., 2013; Alarcón de Noya et al., 2010; Hernández et al., 2009; Nicholls, 2006; Shikanai-Yasuda et al., 1991).
En relación con los signos y síntomas clínicos detectados en los cinco pacientes, quienes refieren como una constante el cuadro febril prolongado durante un período de 15-20 días antes de solicitar consulta médica, el análisis revela la detección de un perfil clínico de 17 síntomas, que en mayor o menor grado, se manifestaron durante el proceso agudo de la infección primaria. La presencia de los mismos en los pacientes permitió la identificación de 5 grupos de acuerdo a la frecuencia de los síntomas detectados. Esto incluye un primer grupo con los 8 signos clínicos más frecuentemente detectados en todos los 5 (100%) pacientes, los cuales incluyen fiebre, cefalea, edema facial (cara internadelos carrillos), inflamación y/o parestesia lingual, vómitos, hepatomegalia, es pleno megalia y dolor abdominal intenso. Un segundo grupo en el que la mialgia fue detectada en el 80%(4/5)de los pacientes. El tercer grupo incluye 3 de los 5 pacientes (60%) manifestándose anasarca e inapetencia; otro grupo conformado por 2 de los pacientes (40%) en quienes se detectó la presencia de edema en los miembros inferiores, además de taquicardia, miocarditis y derrame pericárdico; y un último grupo de un solo paciente (20%) en el que fue detectado edema de los miembros superiores. Asimismo, el análisis del perfil clínico detectado en cada uno de los pacientes estudiados, reveló que el paciente 01- 12presentó16delos17(94%)signos clínicos totalizados en todos los componentes del brote, resultando el caso fatal aquí reportado. Seguidamente en relación con la complicación clínica la paciente 02-12 presentó un perfilclínicocompuestode15delos17(88%)síntomas registrados, sufriendo un cuadro de miocarditis severa con derrame pericárdico. El grupo de niños presentó cuadros clínicos menos severos que el sufrido por los dos adultos, detectándose en 03-12; 05-12 y en 04-12 un total de 10 y 9 síntomas, respectivamente correspondiendo a 59% y 53% de los 17 signos clínicos registrados. La detección de complicaciones clínicas diferenciales entre adultos y niños, podrían ser utilizadas como un argumento más en apoyo de la transmisión por vía oral por contaminación de ingestas contaminadas con formas infectivas de T. cruzi asumiendo que a mayor volumen corporal mayor es la ingesta. Esto explicaría la severidad de los cuadros clínicospresentadosporlospacientesadultos01-12(fatal)
Brote oral de enfermedad de Chagas y 02-12, ambos presentando severas complicaciones cardiovasculares incluyendo taquicardia, miocarditis y derrame pericárdico, y quienes consumirían mayor cantidad de alimento conteniendo un mayor número de meta cíclicos infectivos de T. cruzi que los niños involucrados en la microepidemia familiar. Otro indicador de la posible transmisión oral de T. cruzi es la presencia, en todos los miembros de la familia involucrada en el brote agudo aquí descrito, de edema facial o perimaleolar en la cara interna de los carrillos, además de inflamación y parestesialingual, indicando posible penetración y desarrollo del parásito en la cavidad bucal con el consecuente cuadro clínico, lo cual apoya los resultados de Alarcón de Noya et al. (2010) en el estudio del mayor brote urbano de transmisión oral de enfermedad de Chagas en Venezuela. Un aspecto más, de relevante importancia, que caracteriza la transmisión por vía oral, además de lo masivo de su presentación, es la gran cantidad de signos y síntomas detectados y el alto tenor de letalidad observado. En este sentido al comparar el presente brote agudo con un previo registro de 59 casos agudos en el occidente de Venezuela ocasionados por transmisión vectorial (Añez et al., 1999) puede observarse que la cantidad de signos y síntomas detectados en el presente estudio(17)supera significativamentelos8síntomasdiagnosticadosenel trabajo previo. Asimismo, mientras en el presente brote se registra un 20% de letalidad, en el otro referido se registró un 2% de casos fatales, apoyando previos reportes (Benchimol-Barbosa, 2006). En resumen las características clínicas descritas en el presente estudio orientan hacia la demostración de una transmisión por vía oral, mucho más eficiente que la tradicionalmente conocida vía vectorial de transmisión.
Análisis parasitológicos y moleculares llevados a cabo en muestras sucesivas de los pacientes estudiados corroboran fehacientemente la etiología de los síntomas presentados, atribuyéndose a una severa infección por T. cruzi a juzgar por la presencia de tripomastigotes sanguícolas detectados microscópicamente en muestras de sangre periférica fresca y en láminas coloreadas. Asimismo, el resultado obtenido con muestras de sangre de cada paciente inoculadas en animales experimentales y cultivadas in vitro hablan a favor de la presencia de considerables cantidades de parásitos circulantes, lo cual explicaría la gran cantidad de signos y síntomas observados durante el curso de la infección primaria. La obtención de aislados de T. cruzi a partir de cada uno de los pacientes involucrados en la microepidemia familiar aquí registrada, ha permitido su mantenimiento en el laboratorio una vez corroborada su identidad por ensayos de PCR específicos. Similarmente, la utilización de esta misma metodología molecular permitió la obtención de resultados concordantes a partir de las muestras de todos los pacientes estudiados. Como puede observarse la parasitemia patente por T. cruzi determinada por métodos parasitológicos y moleculares (PCR) reveló un 100% de positividad en los pacientes, indicando que en esta forma de transmisión se detectan altos rangos de parásitos circulantes como quedó demostrado en un previo brote de transmisión oral en Venezuela (Alarcón de Noya et al., 2010). Este hecho es de relevante importancia ya que demuestra que la masiva y simultánea infección sufrida por los pacientes es del mismo origen etiológico y probablemente debida a la misma ingesta contaminada por formas infectivas de T. cruzi previamente depositadas con heces de triatominos infectados oconorinao fluidos de glándulas perianales de animales sinantrópicos de circulación domiciliar como sugerido previamente (Deane et al., 1984).
Los constantes y elevados niveles de Ac anti-T. cruzi revelados en todos los pacientes durante la evaluación serológica inicial, permitió constatar la etiología de la infección corroborando el diagnóstico clínico y parasitológico descrito durante la fase aguda. Estos hallazgos parecen ser consecuencia de una parasitemia activa provocando una respuesta humoral con presencia de IgM anti-T. cruzi en pleno incremento. Esta aseveración parece confirmarse durante las dos sucesivas re-evaluaciones realizadas 60 y 90 días post-tratamiento cuando los pacientes habían superado la fase aguda, habiéndose instaurado la fase crónica de la infección chagásica con la consecuente detección de un nivel mayor de IgG específica con detrimento de los niveles de IgM, aun cuando se mantiene la reactividad con las pruebas polivalentes para anticuerpos aglutinantes (TAD) y fluorescentes (IFI).
La aceptación de la transmisión de la infección chagásica por vía oral es, en principio, generalmente cuestionada dada la dificultad para poder demostrarla (Valente et al., 1999). Entre las razones que justifican el escepticismo inicial sobre el alojamiento de T. cruzi en el hospedador humano pueden citarse, entre otras, i. el tiempo que transcurre entre el principio de los síntomas y el momento del diagnóstico específico en el paciente sintomático; ii. Las variaciones de las condiciones epidemiológicas desde el encuentro hospedador-parásito hasta la confirmación diagnóstica del paciente chagásico y iii. La imprecisión de la información sobre el tiempo y la naturaleza de la ingesta contaminada conteniendo las formas infectivas de T. cruzi que causó la infección chagásica. La primera razón expuesta parece justificarse en el presente trabajo dada la confusión diagnóstica inicial testimoniada por los pacientes, quienes refieren que en todos los casos sus perfiles clínicos fueron confundidos con cuadros de dengue u otras virosis, lo cual demoró significativamente el tiempo para obtener el diagnóstico específico con la demostración de la gente etiológico en sangre circulante. Este hecho, sin duda, pudo influir en el agravamiento de los síntomas del paciente 01-12 teniendo un desenlace fatal. En relación con la variación de las condiciones epidemiológicas en el lugar de ocurrencia de la infección primaria, pareciera un comportamiento típico, observado en este caso y en otros similares, tratar de ocultar los factores de riesgo más próximos al domicilio al percatarse de la causa de la enfermedad padecida, aun cuando hayan estado conviviendo con ellos largos períodos sin considerarlos peligrosos para su salud. Este comportamiento a posteriori confunde cuando se trata de relacionar la presencia de factores de riesgo in situ con el cuadro clínico primario detectado, creando incertidumbre en la definición del origen del brote. Finalmente, la imprecisión sobre el alimento ingerido que pudo ser la fuente de infección, es quizás lo más comúnmente escuchado cuando se indaga al respecto de la infección chagásica. Precisar el momento cuando inadvertidamente fue ingerido un líquido o un alimento contaminado por tripo mastigotes de T. cruzi es una interrogante sin respuesta. Asimismo, precisar si fueron formas infectivas depositadas sobre los alimentos o bebidas a ingerir, o sobre utensilios utilizados para su preparación, luego de la defecación de triatominos infectados o de la eyección de orina y/o secreciones perianales de reservorios que como Didelphis o Rattus deambulan en los alrededores del domicilio, son hechos de difícil comprobación. Sin embargo, dada la presencia comprobada en el presente trabajo de ejemplares de P. geniculatus, E. mucronatus, T. maculata y R. prolixus, en los alrededores del domicilio de la familia afectada, algunos de ellos con infección con metacíclicos de T. cruzi, además de la presencia ocasional de ratas, ratones y Didelphis cerca de los sitios donde los habitantes de la casa mantenían frutas maduras (Musa paradisiaca y Carica papaya) expuestas a contaminación, la posibilidad de ocurrir infección por transmisión oral no debería ignorarse. Esto último encuentra apoyo en un previo trabajo experimental demostrando que metacíclicos de T. cruzi, obtenidos de la ampolla rectal de R. prolixus y depositados sobre una variedad de alimentos y bebidas, pueden sobrevivir períodos de 10 horas o más en los alimentos contaminados conservando su actividad típica y su capacidad infectiva para el vertebrado (Añez et al., 2009). Este hecho advierte sobre otro factor de riesgo epidemiológicamente importante en la transmisión de la infección chagásica.
El análisis anterior sobre una microepidemia de enfermedad de Chagas agudo registrada, por primera vez, en una localidad rural de Mérida, Venezuela, causada por T. cruzi en miembros de un mismo grupo familiar que compartía el mismo domicilio y la misma alimentación, quienes desarrollaron simultáneamente una gran cantidad de signos y síntomas clínicos de similar severidad, resaltando la presencia de inflamación facial interna y parestesia lingual en ausencia de edema bipalpebral-signo de Romaña- y/o chagoma de inoculación, sugiere que el brote pudo haber ocurrido por transmisión oral como consecuencia de ingesta contaminada por formas infectivas del parásito.
Conflicto de intereses
Los autores declaramos que en la realización del presente trabajo no se presentó ningún conflicto de intereses.
AGRADECIMIENTOS
Trabajo financiado parcialmente por CDCHTA- ULA proyecto C-1821-13-07-AA (NA). Los autores agradecen profundamente la colaboración de la familia Zerpa y al personal del ambulatorio rural de El Bordo, especialmente a la enfermera Mireya Zerpa.
REFERENCIAS
1.Alarcón de Noya B., Díaz-Bello Z., Colmenares C., Ruíz-Guevara R., Mauriello L., Zavala-Jaspe R., et al. (2010). Large urban outbreak of orally acquired acute Chagas disease at a school in Caracas, Venezuela. J. Inf. Dis. 201: 1308-1315. [ Links ]
2.Añez N., Carrasco H., Parada H., Crisante G., Rojas A., González N., et al. (1999). Acute Brote oral de enfermedad de Chagas Chagas disease in Western Venezuela. A clinical, seroparasitological and epidemiological study. Am. J. Trop. Med. Hyg. 60: 215-22. [ Links ]
3.Añez N., Crisante G., Rojas A., Carrasco H., Parada H., Yépez Y., et al. (2001). Detection and significance of inapparent infections in Chagas disease in western Venezuela. Am. J. Trop. Med. Hyg. 65: 227-232. [ Links ]
4.Añez N., Crisante G. & Romero M. (2009). Supervivencia e infectividad de formas metacíclicas de Trypanosoma cruzi en alimentos experimentalmente contaminados. Bol. Mal. Salud Amb. 49: 91-96. [ Links ]
5.Añez N., Crisante G., Caraballo F., Delgado W. & Parada H. (2011). Trypanosoma cruzi persistence at oral inflammatory foci in chronic chagasic patients. Acta Tropica. 117: 207-211. [ Links ]
6.Benchimol-Barbosa P. R. (2006). The oral transmission of Chagas disease: An acute form of infection responsible for regional outbreaks. Int. J. Cardiol. 112: 132-133. [ Links ]
7.Deane M. P., Lenzi H. L. & Jansen A. M. (1984). Trypanosoma cruzi: vertebrate and invertebrate cycles in the same mammal host, the opossum Didelphis marsupialis. Mem. Inst. Oswaldo Cruz. 79: 513-515. [ Links ]
8.Dias J. P., Bastos C., Araujo E., Mascarenhas A.V., Netto E. M., Grassi F., et al. (2008). Acute Chagas disease associated with oral transmission. Rev. Soc. Brasil. Med. Trop. 41: 296-300. [ Links ]
9.Diotaiuti L., Pereira A. S., Loiola C. F., Fernandes A. J.,SchofieldC.J.,DujardinJ.P.,et al. (1995). Inter-relation of sylvatic and domestic transmission of Trypanosoma cruzi in areas with and without domestic vectorial transmission in Minas Gerais, Brazil. Mem. Inst. Oswaldo Cruz. 90: 443-448. [ Links ]
10.Feliciangeli M. D., Sánchez-Martín M. J., Suárez B., Marrero R., Torrellas A., Bravo A. et al. (2007). Risk factors for Trypanosoma cruzi human infection in Barinas state, Venezuela. Am. J. Trop. Med. Hyg. 76: 915-921. [ Links ]
11.Hernández L. M., Cano A. N. R., Cucunubá Z. & Zambrano P. (2009). Brote de Chagas agudo en Lebrija, Santander, 2008. Rev. Observat. Sal. Pub. Santander. 4: 28-36. [ Links ]
12.Mazza S., Montana A., Benítez C. & Janzi E. Z. (1936). Transmisión del Schizotrypanum cruzi al niño por leche de la madre con la enfermedad de Chagas. MEPRA. 28: 41-46. [ Links ]
13.Miles M.A. (2010).Orally acquired Chagas disease: Lessons from an urban school outbreak. J. Inf. Dis. 201: 1282-1284. [ Links ]
14.Nicholls R. S. (2006). Enfermedad de Chagas como enfermedad transmitida por alimentos: La experiencia en Colombia. Informe de la consulta técnica en epidemiología, prevención y manejo de la transmisión de la enfermedad de Chagas como enfermedad transmistida por alimentos. OPS/ WHO,RíodeJaneiro: http://bvs.panaftosa.org..br/textoc/informe_eta.pdf . [ Links ]
15.Pereira K. S., Barbosa R. L., Passos L. A. C., Aguiar F. S., Rogez H., Alarcón de Noya B. & Noya O. (2013). Trypanosoma cruzi. Chapter VII In: Foodborne protozoan parasites. Robertson, L.J. & Smith, H.V. Editors. Nova Science Publishers, Inc. New York. [ Links ]
16.Pipkin A. C.(1969). Transmission of Trypanosoma cruzi by arthropod vectors: anterior versus posterior route infection. Intern. Rev. Trop. Med. 3: 1-47. [ Links ]
17.Ríos J. F., Arboleda M., Montoya A. N., Alarcón E. P. & Parra-Henao G. J. (2011). Probable brote de transmisión oral de enfermedad de Chagas en Turbo, Antioquia. Biomédica. 31: 185-195. [ Links ]
18.Schijman, A.G., Bisio, M., , Crisante, G., Añez, N., et al., (2011). International study to evaluate PCR methods for detection of Trypanosoma cruzi DNA in blood samples from Chagas disease patients. PLOS Neglected Tropical Diseases. 5: 1-13. [ Links ]
19.Schofield C. J. (2000). Trypanosoma cruzi- The vector-parasite paradox. Mem. Inst. Oswaldo Cruz. 95: 535-544. [ Links ]
20.Shikanai-Yasuda M. A., Brisola Marcondes C., Guedes L. A., Siqueira G. S., Barone A. A., Dias J. C. P., et al. (1991). Possible oral transmission of acute Chagas disease in Brazil. Rev. Inst. Med. Trop. São Paulo. 33: 351-357. [ Links ]
21.Stevens J. R., Noyes H. A., Schofield C. J. & Gibson W. (2000).The molecular evolution of Trypanosomatidae. Adv. Parasitol. 48: 1-53. [ Links ]
22.Valente S. A. S., Valente V. C. & Fraiha Neto H. (1999). Consideration on the epidemiology and transmission of Chagas disease in the Brazilian Amazon. Mem. Inst. Oswaldo Cruz. 94: 395-398. [ Links ]












 uBio
uBio 
