Introducción
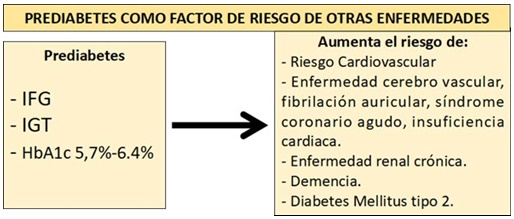
El interés por la prediabetes se ha incrementado notoriamente en las dos décadas de este siglo visto su trascendencia como estado metabólico y condición predisponente para la progresión futura a la diabetes tipo 2 (DM2) y enfermedad cardiovascular aterosclerótica (ECVA), además de que confiere una alta probabilidad de desarrollar muchas de las patologías normalmente asociadas a esa enfermedad, tales como retinopatía diabética, neuropatía periférica, enfermedad renal diabética y complicaciones macrovasculares1. La prediabetes representa una etapa intermedia de disglucemia a lo largo del continuo que va desde el estado normal a la Diabetes, se identifica mediante mediciones de laboratorio: valor de glucosa en ayuna, valor de glucosa 2 horas después de una carga de 75 grs de glucosa.2,3
Representa una excelente oportunidad para poner en práctica conductas preventivas para reducir la incidencia y/o progresión de esta temida afección. Sin embargo, es conveniente acotar la discrepancia existente entre el criterio del punto de corte de la Organización Mundial de la Salud4 (OMS) y a la Asociación Americana de Diabetes5 (ADA, por sus siglas en inglés) para el diagnóstico de la hiperglucemia prediabética, siendo que para la OMS no reconoce dos entidades distintas sino solamente a la TAG con un rango más elevado (Tabla 1).
Tabla 1 Criterios de la OMS y la ADA para diagnóstico de la hiperglicemia prediabética.
| OMS2 | ADA3 | |
|---|---|---|
| GAA | 110 a 125 mg/dL | 100 a 125 mg/dL |
| (6,1 a 6,9 mmol/L) | (5,6 a 6,9 mmol/L) | |
| TAG | 110 a 125 mg/dL | 140 a 199 mg/dL |
| (6,1 a 6,9 mmol/L) | (7,8 a 11 mmol/L) | |
| A1C | No | 5,7 a 6,4% |
A1C: hemoglobina glucosilada; GAA: glucemia alterada en ayunas; TAG: tolerancia alterada a la glucosa.
No sólo existen diferencias en el punto de corte tampoco existe consenso en el término, la Organización Mundial de la Salud (OMS) ha definido la prediabetes como un estado de hiperglucemia intermedia, y no aconseja el termino de prediabetes, utiliza dos parámetros la glucosa en ayuna alterada (GAA) que es definida como glucosa plasmática en ayuna de 110 a 125 mg/dL y tolerancia a la glucosa alterada (TAG) definida como glucosa plasmática de 140-200 mg/dL durante 2 h después de la ingestión de una carga 75 g de carga de glucosa o una combinación de los dos basada en una glucosa oral de 2 h prueba de tolerancia (OGTT). La Asociación Americana de Diabetes (ADA), por otro lado, tiene el mismo valor de corte para TAG (140-200 mg/dL) pero tiene un valor de corte más bajo para GAA de 100 a 125 mg/dL y tiene criterios basados en la hemoglobina A1c (HbA1c) de un nivel de 5,7 % a 6,4 % para la definición de prediabetes.3
Aunque las diferentes definiciones de prediabetes o hiperglucemia intermedia conducen a diferentes riesgo de desarrollar diabetes y enfermedad cardiovascular, el riesgo de mortalidad por todos las causas aumenta sólo en el grupo que desarrolla Diabetes.6 En las conclusiones derivadas del análisis de la población del estudio de Rotterdam identificados con prediabetes según el criterio de la OMS y de la ADA se estimó el riesgo de 10 años y el riesgo de por vida de progresión a la DM2 manifiesta, tanto en hombres como en mujeres.7
Los resultados mostraron que las mujeres tienen un riesgo de por vida mayor que el hombre para la progresión a DM2, pero con el criterio de la ADA se obtuvo el doble de la prevalencia de prediabetes en comparación al de la OMS para ambos sexos y por grupo de edad. Además, el riesgo de por vida de progresar a diabetes resultó sustancialmente más bajo en mujeres y hombres con la definición de la ADA frente al criterio de la OMS (la mitad frente a dos tercios, respectivamente). De este modo, cabe resaltar que la definición de la ADA tiende a ser más utilizada.7
Los estudios de observación y de intervención han demostrado que la prediabetes es un factor directo e independiente para la ECVA y renal8-10. Uno de estos estudios es un análisis de corte transversal de la encuesta NHANES durante los años 1988 a 94, 1999 a 2004, 2005 a 2010 y 2011 a 2014 para examinar el perfil de riesgo cardiovascular y renal de adultos con prediabetes y su desarrollo en el tiempo7. Vale acotar que para la definición de prediabetes tomaron en cuenta los criterios de la OMS y ADA. Cerca del 50% de los sujetos con prediabetes tenían otras comorbilidades que incrementaban el riesgo de enfermedad cardiovascular y renal y este hallazgo no se modificó con las definiciones diferentes de prediabetes; lo cual, de acuerdo con los autores, significa que la identificación de los sujetos con prediabetes puede ampliar la ventana de oportunidades para reducir el riesgo cardiovascular y renal. 9,10
En el estudio DECODE (Diabetes Epidemiology: Collaborative Analysis of Diagnostic Criteria in Asia), el riesgo para ECVA e ictus se incrementó progresivamente de la etapa de GAA a TAG a DM211, indicando que la hiperglucemia es un factor de riesgo de mortalidad cardiovascular. Incluso, la relación entre glucemia y riesgo cardiovascular comienza dentro del mismo rango normal de la glucemia con una relación lineal10,11. Además, las respuestas con hiperglucemia a la prueba de tolerancia oral a la glucosa, (PTOG) están fuertemente asociadas con eventos macrovasculares futuros y mortalidad total en pacientes con infarto agudo del miocardio e insuficiencia cardíaca.12,13
Los resultados del estudio STOP-NIDDM (Study to Prevent Non- Insulin-Dependent Diabetes Mellitus) demostraron que tratar la TAG con acarbosa (inhibidor de la alfa glucosidasa intestinal), el cual reduce específicamente la hiperglucemia posprandial, disminuyó significativamente la tasa de conversión de TAG a DM2 asociado con una reducción del 49% en los eventos cardiovasculares, 34% menos en la incidencia de nuevos casos de hipertensión arterial (HTA) y se redujo en 50% el incremento anual en el grosor de la mioíntima arterial14,15. Por otro lado, pioglitazona redujo significativamente la presión arterial diastólica y la velocidad de progresión del grosor de la mioíntima arterial en conjunción con la menor conversión de TAG a DM2.16
Sin lugar a duda, la diabetes mellitus se ha convertido en una seria amenaza para la salud pública visto el incremento acelerado en los últimos años. Los datos aportados de la Federación Internacional de Diabetes en el año 2019 estimaron una prevalencia del 9,3% (463 millones de personas), ascendiendo al 10,2% (578 millones) para el 2030 y 10,9% (700 millones) para el año 204517. Para Latinoamérica las estimaciones son alarmantes ya que se pasaría de una prevalencia de 32 millones en el año 2019 a 49 millones en el año 2045, lo que representa un incremento del 55%. La prevalencia es mayor en las áreas urbanas (10,8%) que en las rurales (7,2%), en los países de ingresos elevados (10,4%) que en los de ingresos bajos (4,0%). Uno de cada dos personas (50,1%) es portadora de diabetes, pero lo desconoce. En cuanto a la prevalencia de la TAG se estimó en 7,5% (374 millones) en el año 2019 y proyectada para alcanzar 8,0% (454 millones) para el año 2030 y 8,6% (548 millones) para el 2045.18
Estudios clínicos de prevención que han incluidos pacientes prediabéticos no tratados, han demostrado en ellos un 11% de riesgo anual de desarrollar DM2, como también enfermedad macro y microvascular, las cuales son más prevalentes al comparar con los sujetos normoglucémicos controles.18
Un aspecto todavía más inquietante es el avasallante crecimiento de la obesidad en la población infantil y en adolescentes, lo cual ha traído aparejado un incremento en la prevalencia de la prediabetes en estos grupos de pacientes. De hecho, en una muestra de adolescentes (12 a 18 años) y adultos jóvenes (19 a 34 años) estadounidenses se encontró que cerca de 1 de cada 5 adolescentes y 1 de cada 4 adultos jóvenes eran portadores de prediabetes y a su vez poseían una elevada carga de factores de riesgo cardiometabólicos, lo que se traduce en un mayor riesgo de ECVA y DM2 desde temprana edad.19
La mayoría de las sociedades científicas internacionales definen a la prediabetes como una condición con dos etapas o categorías: glucemia alterada en ayunas (GAA) y tolerancia alterada a la glucosa (TAG) en la prueba de la tolerancia oral a la glucosa (PTOG). La OMS la denomina hiperglucemia intermedia la categoría con valores entre 110 a 125 mg/dL. 18-19
Hiperglucemia y agresión vascular
Es bien conocido que la DM2 posee un tiempo de latencia entre siete a diez años antes de ser descubierta. Durante esos años la anormalidad bioquímica predominante es la hiperglucemia, usualmente en los límites marcados por la GAA, es decir entre 100 y 125 mg/dL. Estos valores de glucemia, que para algunos clínicos son intrascendentes, ejercen una serie de efectos deletéreos sobre territorios micro y macrovasculares, donde el blanco primario es la célula endotelial, acelerando el proceso normal de glicosilación de la membrana basal con degradación y regeneración de monocitos y macrófagos.17 Experimentalmente, se ha podido comprobar la degradación del óxido nítrico por la hiperglucemia, disminuyendo así la vasodilatación inducida por este elemento junto a una menor biodisponibilidad de prostaciclina, un compuesto conocido como potente vasodilatador y antiagregante plaquetario.20-23 Otras acciones deletéreas de la hiperglucemia se listan en la tabla 2.
Tabla 2 Impacto de la hiperglucemia sobre el endotelio vascular.20-22
| • Aumento en la liberación de hormonas vasoactivas como endotelina y prostanoides. |
| • Incremento en la expresión de componentes de la membrana basal (fibronectina) |
| • Aumento en la permeabilidad a las macromoléculas |
| • Incremento en las propiedades adhesivas de los leucocitos y plaquetas |
| • Disminución en la producción de tPA con menoscabo de la capacidad fibrinolítica |
| • Replicación celular retardada y apoptósis |
| • Estrés oxidativo |
| • Promoción de marcadores inflamatorios como proteína C reactiva ultrasensible, interleuquina-6, factor alfa de necrosis tumoral |
Adicionalmente, todavía se desconocen algunas de las funciones de la célula endotelial teniendo en cuenta que esta es una barrera dinámica que separa la sangre del intersticio que segrega factores angiocrinos que “gobiernan” la función de las células parenquimatosas adyacentes de forma específica y se conoce que las células endoteliales modulan la transferencia de nutrientes y hormonas a las células parenquimatosas en respuesta a las alteraciones en el perfil metabólico, pudiendo ser también actores de primera línea en situación de desregulación metabólica sistémica.23,24
Estos cambios han podido ser comprobados en la clínica mediante la exploración de la hiperreactividad vascular donde, en comparación con sujetos normales, aquellos con GAA y TAG tenían deterioro en la vasodilatación inducida por flujo y este cambio era más pronunciado en los portadores de DM2 y, a su vez, esta vasodilatación inducida por flujo tenía una relación inversa y poderosa con el valor de la hiperglucemia.24 Un entorno adaptativo inmunitario caracteriza un fenotipo inflamatorio que se observa en la diabetes y ahora en la prediabetes y se cree que la epigenética juega un papel importante en estos cambios.25
Como típicamente se ha descrito en la patología vascular de la diabetes hay que separar las complicaciones en las grandes y medianas arterias que conducen a la aterosclerosis, pudiéndose expresar como enfermedad arterial coronaria, vascular cerebral o periférica (especialmente de miembros inferiores) y la enfermedad de los pequeños vasos o complicaciones microvasculares que afectan fundamentalmente riñón, retina y la neuropatía.24
Afectación microvascular en la prediabetes
Aunque no hay datos relacionados con la prediabetes en cuanto al impacto de la enfermedad microvascular sobre el pronóstico, se ha podido establecer en pacientes con DM2 que los sujetos con una complicación microvascular tienen un incremento del 35 al 40% en el riesgo de mortalidad cardiovascular (muerte cardiovascular, infarto de miocardio no fatal e ictus), independiente del tipo de repercusión, por lo que un mayor número complicaciones microvasculares resulta en un incremento escalonado en el riesgo de eventos cardiovasculares, hospitalización por insuficiencia cardíaca y mortalidad total.26,27
Por consiguiente, es de capital importancia la pesquisa de la enfermedad microvascular y su tratamiento precoz en los pacientes con prediabetes, especialmente en aquellos con otro factor de riesgo cardiometabólico, por tratarse de una condición independiente de riesgo para eventos cardiovasculares y metabólicos con repercusión negativa sobre la calidad de vida individual y del grupo familiar.26,27
Daño renal en la prediabetes
La DM2 es la principal causa de enfermedad renal diabética (ERD) en el mundo, tanto en naciones desarrolladas como emergentes, y es el diagnóstico primario de enfermedad renal en el 20-40% de las personas que inician tratamiento dialítico.27,28 Desde las investigaciones de Sechi y colaboradores26 se había aceptado que las alteraciones del metabolismo de la glucosa y la hiperinsulinemia estaban asociadas con disfunción renal y progresión a ERD y podrían contribuir al desarrollo de complicaciones ateroscleróticas, lo cual fue comprobado por Fox y colaboradores27 quienes evaluaron 2.398 sujetos, de los cuales el 29% tenían prediabetes; 3,4% nuevos casos de DM2, y se encontró un disminución de la tasa de filtración glomerular (TFG) en 9 y 24 mL/min/1,73 m2, respectivamente; el 7% de los pacientes con prediabetes progresó a ERD y su prevalencia se incrementó de acuerdo a la glucemia basal.
Por otro lado, el 31% de los pacientes tenía síndrome metabólico (SMet) y durante el seguimiento, 9% desarrollaron ERD. El análisis de regresión y ajuste por las covariables reveló que la GAA o la TAG confirió un 65% incremento en el Odds Ratio (OR) para desarrollar ERD.27 Plantinga y colaboradores28 en la encuesta NHANES, 1999-2006, demostraron que la prevalencia de albuminuria y proteinuria se incrementaba con los niveles de glucemia, pasando de 6% y 0,6 % en normoglucemia, a 10% y 1,1 % en el grupo con TAG, aumentando a 29% y 3,3% en la diabetes no diagnosticada y 29% y 7,7% en la DM diagnosticada, respectivamente.
Por distintos mecanismos, la prediabetes condiciona un conjunto de cambios generalmente asintomáticos que conllevan a un estado de hiperfiltración glomerular, precursora de la hipertensión intraglomerular, del inicio de la injuria renal y predecesores de la albuminuria29-31. Más aun, la prevalencia de la hiperfiltración glomerular se incrementa en la medida que se pasa de GAA a TAG y a DM2 con OR de 1,29; 1,58 y 2,47, respectivamente.31
Sin embargo, no solo la hiperglucemia es responsable de la hiperfiltración glomerular y se ha podido establecer otros actores de primera línea como edad, género, índice de masa corporal, hiperinsulinemia y resistencia a la insulina, hiperleptinemia, mayor estrés oxidativo, incremento en la presión arterial, activación del sistema nervioso simpático y del sistema renina angiotensina 31. Es necesario resaltar que el endotelio glomerular es una estructura vascular única en el organismo y altamente fenestrada, lo cual permite su elevada permeabilidad al agua, necesaria para los grandes volúmenes de filtración manejados por el glomérulo.32-34
La hiperglucemia conlleva a la disfunción de la célula endotelial glomerular, lo cual se caracteriza por una o más de las siguientes alteraciones:32-35
Disminución en la disponibilidad de óxido nítrico.
Reducción de la vasorrelajación inducida por el endotelio.
Desregulación hemodinámica.
Deterioro en la capacidad fibrinolítica.
Favorecimiento del retorno y sobreproducción de factores de crecimiento.
Incremento en la expresión de moléculas de adhesión y genes inflamatorios.
Generación excesiva de especies reactivas de oxígeno.
Mayor permeabilidad de la barrera de capa celular.
Otro aspecto, recientemente conocido, es la estrecha interacción entre las células endoteliales del glomérulo y los podocitos y el equilibrio de esta relación es imprescindible para el mantenimiento de la barrera de filtración a través de la vía de señalización del factor de crecimiento del endotelio vascular (VEGF, por sus siglas en inglés), y al parecer niveles reducidos de VEGF pueden resultar en daño de la célula endotelial con pérdida de podocitos y engrosamiento de la membrana basal; por el contrario, el exceso en VEGF resulta en neovascularización que conlleva a la microangiopatía.36
Siendo la prediabetes causante de lesión y daño renal, es importante el enfoque preventivo para evitar la progresión a ERD. Es imprescindible la determinación de la función renal por métodos confiables y no basta la determinación de creatinina sérica ya que la relación entre la concentración sérica de creatinina y la función renal no es lineal sino hiperbólica, lo que se traduce en una baja sensibilidad diagnóstica. Se precisa de descensos del flujo glomerular de, al menos, 50% para que la creatinina se eleve por encima del intervalo de referencia.37
Cualquier fórmula de estimación de la función renal es precisa y exacta siendo la de Cockcroft-Gault la más fácil de recordar, aunque sobreestima el flujo glomerular para valores inferiores de 15 mL/min/1,73 m2. La Modification of Diet in Renal Disease (MDRD-4) presenta mayor exactitud diagnóstica, para estadios 3 y 4; mientras que la de mayor exactitud y precisión es la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI).37
Un método sencillo y práctico para la determinación de la excreción urinaria de albúmina (EUA) es a través de la medición del cociente albúmina/creatinina o de proteínas/creatinina en una muestra aislada de orina, preferiblemente de la mañana, ofrece una estimación adecuada de la excreción urinaria de proteínas o albúmina en 24 horas, los resultados se expresan como mg/g de creatinina urinaria. (criterio de ERC ≥30 mg/g o ≥3 mg/mmol)34. Este método es recomendable como primera opción, porque evita la recolección de orina de 24 horas, uno de los problemas de este método, es el cociente de la ecuación (creatinina urinaria) que puede modificarse por causas no inherentes a la función renal, por ejemplo en sujetos con mayor masa muscular, resultando en una subestimación, en el caso de mujeres y de ancianos en quienes la creatinina es menor, debido a menor masa muscular, puede haber sobrestimación. El cociente albuminuria/creatinina predice la presencia de proteinuria de rango nefrótico con una buena sensibilidad y especificidad.35
La polineuropatía distal en la prediabetes
Según lo descrito por Ziegler y colaboradores, en el estudio MONIKA/KORA, la polineuropatía distal está presente en un 11 a 13% de los sujetos con prediabetes versus un 26 a 28% en pacientes diabéticos y 4 a 8% en sujetos no diabéticos36. Una revisión sistemática más reciente mostró que, a pesar en el amplio rango reportado de prevalencia (2% a 77%), la mayoría de los estudios información de un valor ≥10%.36-38
Obviamente, estas cifras serán distintas según el método de estudio neurológico, siendo que las prevalencia estimadas más elevadas de 77% (IC 95%: 54% a 100%), 71% (IC 95%: 55% a 88%) y 66% (IC 95%: 53% a 78%) fueron informadas utilizando termografía plantar, prueba sensorial multimodal cuantitativa y pruebas de conducción nerviosa, respectivamente. En general, los estudios que evaluaron parámetros de pequeñas fibras nerviosas obtuvieron una prevalencia más elevada de neuropatía periférica. Debido a la variedad de las poblaciones en estudios y de los métodos de detección de la neuropatía, hubo una marcada heterogeneidad en los estimados de la prevalencia.38
Desde otro punto de vista, Singleton y colaboradores encontraron en 107 pacientes con neuropatía simétrica distal idiopática que el 34% tenía GAA, un porcentaje tres veces superior a los pacientes con TGN. En los pacientes con GAA, el patrón principalmente afectado fue el sensorial en un 81%; el síntoma principal fue el dolor en un 92%; las pruebas electrofisiológicas mostraron que un 61% de los pacientes con GAA presentaron disminución de la amplitud de la onda del nervio sural y el 21% disminución de la amplitud de onda del nervio motor peroneo.38
Como se ha mencionado, la hiperglucemia favorece la generación de ROS (especies reactivas de oxígeno por sus siglas en ingles), inflamatorios y tóxicos, que conducen a la depleción de ON, activando la enzima aldosa reductasa, la cual, convierte el exceso de glucosa en sorbitol, por la vía de los polioles (a través, de la activación de la sorbitol deshidrogenasa).39
El médico de atención primaria debe recordar que uno de los síntomas principales es la presencia de neuropatía en los pacientes diabéticos; en los casos de pacientes con prediabetes, hay que descartar neuropatía de fibras pequeñas si existe relación entre dolor y/u otro síntoma de disfunción de fibras pequeñas como la pérdida de la percepción a la temperatura, con reducción de la percepción dolorosa (monofillamento de Semmes Weintein de 10 gramos), y conservación de los reflejos osteotendinosos y de la sensibilidad vibratoria (fibras largas).39
11-13% de los pacientes con TGA, presentan neuropatía.
10-18% de los pacientes diabéticos recién diagnosticados presentan neuropatía, y esto puede ser explicado como la presencia de la complicación desde etapas prediabeticas.
La base fisiopatológica es la hiperglucemia, en su ausencia, factores como la obesidad, la hipercolesterolemia y síndrome metabólico deben ser consideradas.
Entre los cambios patogénicos se describen; el estrés oxidativo, la injuria endotelial y disfunción vascular. Principalmente por activación de la vía de los polioles, aumento de los ROS, PFGA y defectos en la señales de ON.
La característica clínica principal es la presencia de dolor neuropático, disminución de la sensibilidad protectora y térmica; sin cambios en la sensibilidad vibratoria y reflejos, denominada neuropatía prediabética o de neuropatía de fibras cortas.
No existen, evidencias concluyentes de la existencia de un método diagnóstico efectivo que permita su diagnóstico precoz, solo prevalece la sospecha y juicio clínico.
Retinopatía
Es la complicación microvascular más específica de la DM2 y gracias a estudios pioneros que revelaron signos de retinopatía se estableció el umbral de 126 mg/dL (7 mmol/L) para la GAA por su elevada sensibilidad y especificidad para el diagnóstico de DM2. La prediabetes puede estar asociada con un mayor riesgo de la retinopatía diabética, sin embargo, las evidencias varían dependiendo del procedimiento diagnóstico.1,40,41
Las mediciones en los cambios vasculares de la retina, como una disminución de la relación arterio- venosa y el aumento en el calibre de las arteriolas y venas retinianas, también se han relacionado con prediabetes o aumento del riesgo de la diabetes, aunque la evidencia no es del todo consistente. Además, cabe resalta que en un metanálisis sobre la asociación existente entre prediabetes y retinopatía, en donde incluyeron nueve estudios transversales con 14.751 participantes adultos que vivían en la comunidad; 3.847 de ellos con diagnóstico de prediabétes, se insta a través de los resultados que la prediabetes se asocia con mayor prevalencia de retinopatía en comparación con aquellos con normoglucemia (odd ratio, OR 1,55; intervalo de confianza 95%, p=0.01).40-42
El impacto macrovascular de la prediabetes
Al enfocarnos en el daño subclínico a órgano blanco desde el punto de vista de enfermedad macrovascular en prediabéticos existen pocos estudios reportados hasta la actualidad. El más resaltante fue el realizado en el Hospital General de Atenas, donde se incluyó a 524 personas (264 hombres y 260 mujeres) con sobrepeso y obesos (IMC mayor de 27 kg/m2) con edad promedio entre 53,6 +/- 10,3 años. En todos se realizó test de tolerancia a la glucosa con insulina, ecocardiografía, ultrasonido carotideo, análisis de la onda de pulso. Se utilizaron igualmente los criterios diagnósticos NCEP- ATP III y criterios del ADA para síndrome metabólico (SMet) y prediabetes.43
El resultado de la investigación reportó que la prevalencia del SMet y la prediabetes fue 38,7 y 25,4%, respectivamente. De ellos, 129 individuos (24,6%) eran portadores SMet sin diabetes (grupo M) y otro 59 (11,3%) prediabéticos sin SM (grupo P). El grupo P (prediabéticos) presenta una disminución de la excreción de albúmina (p= 0,033) y mayor engrosamiento de la íntima-media de la carótida común en comparación con el grupo M (p= 0.032). Aún más, el grupo M se asoció a niveles más alto de proteína C reactiva. El análisis de regresión logística múltiple reveló que la edad avanzada (p<0,0001, OR 1,11, IC 95%: 1,06 a 1,16), la secreción baja de insulina (p<0,0001, OR 0.05, IC 95%: 0,02 a 0,18 para el índice insulinogénico), y la resistencia a la insulina (p= 0,0003, OR 3.22, IC 95%: 1,71 a 6,07 para el HOMA-IR) se asociaron con el grupo P.43
Por otro lado, en un análisis transversal del estudio Multi-Ethnic Study of Atherosclerosis (MESA), donde evaluaron la relación en diferentes grupos étnicos con prediabetes y la presencia de daño de órgano blanco, que involucró 6814 participantes entre 45-84 años, incluidos sujetos de raza negra, blancos e hispanos con un examen inicial en el año 2000, sin antecedentes conocidos de un ataque al corazón, ictus o diabetes.44
Se evaluaron marcadores para calcificación arterial coronaria (CAC), estenosis carotidea mayor al 25%, índice tobillo-brazo (ITB) inferior a 1,0 y la presencia de proteína en la orina (>30 mg/gr) entre los participantes con glucemia normal (GAN) e ITG, y entre los grupos étnicos con prediabetes/ITG. Se incluyeron 2.457 blancos, 1.548 negros y 1.229 participantes hispanos.44
Después de los ajustes, no hubo diferencias para cada resultado entre los sujetos normales y prediabéticos negros e hispanos, mientras que los participantes de raza blanca con prediabetes tenían probabilidades significativamente mayores de estenosis carotidea (OR: 1,50), del ITB bajo (OR: 1,77) y albuminuria (OR: 1,66) en comparación con los blancos con GAN. Cuando se comparan aquellos con ITG/prediabetes por grupo étnico, los negros y los hispanos tenían menos estenosis carotidea y CAC. Además, los hispanos tenían menor reducción del ITB (OR: 0,35, IC 95% 0.19 a 0.65) en comparación con los blancos con ITG. Por lo que la prediabetes está relacionada con la presencia de diversos indicadores para daño de órgano blanco en sujetos blancos, pero no en sujetos negros o hispanos.44-45
Conclusiones
La prediabetes, no es una situación clínica premonitoria de la DM2, más bien debe ser tenida en cuenta como una entidad asociada a alteraciones típicamente consideradas en la DM2 establecida, las cuales incluyen la ECVA en todo su abanico de manifestaciones, la enfermedad periodontal, disfunción cognitiva, enfermedad microvascular, elevación y/o anormalidades de la presión arterial, apnea obstructiva del sueño, baja concentración de testosterona, hígado graso no alcohólico y cáncer. Más complicado aún es que en la vasta mayoría de los sujetos con prediabetes, no se valora en la consulta la dimensión de tales alteraciones, de modo de intervenir eficazmente en la prevención precoz.
Otro aspecto destacado a ser tomado en cuenta es que, al igual que en otras enfermedades crónicas no transmisibles, comúnmente los factores de riesgo no existen aislados, sino en combinación con dos o tres componentes adicionales, tradicionalmente el sedentarismo y la alimentación hipercalórica como es el caso de las enfermedades cardiometabólicas; a su vez cabe resalrta que no se debe menospreciar el hallazgo de GAA en pacientes pediátricos, niños y adolescentes, con obesidad, en donde debe ser tomado como un punto de importancia para su estudio por su futura repercusión carciovascular.












 uBio
uBio