Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agronomía Tropical
versión impresa ISSN 0002-192X
Agronomía Trop. v.52 n.4 Maracay oct. 2002
Cultivo de hongos comestibles utilizando desechos agrícolas e industriales
Anna A. Grodzínskaya1, Diógenes Infante H.2 y Nickolai M. Piven3
1Investigadora. Instituto de Botánica N.G. Jolodni de la Academia Nacional de Ciencias de Ucrania, GSP-1 Calle Tereshchenko 2252601 Kiev, Ucrania
2Investigador. Centro de Biotecnología Instituto de Estudios Avanzados-IDEA. Apdo. 1760. Parque Central, Caracas 10151-A. Venezuela
3Investigador Titular. Centro de Investigación Científica de Yucután (CICY). Unidad de Biotecnología. Calle 43, Nº 130, Col. Chubumá de Hidalgo. C.P. 97200. Mérida, Yucután México
RESUMEN
El trabajo tuvo como finalidad estudiar el crecimiento micelial y la obtención de fructificación de 3 especies de hongos comestibles orejas blancas, Pleurotus ostreatus (Jacq.:Fr.) Kumm., shiitake japonés, Lentinus edodes (Berk.) Sing y strofaria gigante, Stropharia rugosoannulata Farl.ex Murr, en los 20 diversos substratos provenientes de desechos agrícolas. Los micelios fueron inoculados en frascos de vidrio donde se mezclaron y esterilizaron los componentes de los substratos, evaluándose el crecimiento micelial dos o tres veces para cada especie. Todos los substratos ensayados fueron apropiados a la fructificación en orejas blancas, mientras que shiitake japonés prefiere mezclas de paja o cáscara de arroz con tusa de maíz, bagazo de caña de azúcar, fibra de coco y desechos de café colado. En el caso de strofaria gigante, la fructificación sólo se obtuvo en substratos con paja de arroz, cáscara de arroz y tusa de maíz. Los resultados del trabajo demuestran la factibilidad del cultivo de hongos comestibles de interés comercial utilizando desechos industriales ricos en celulosa lignocelulosa, lo cual puede permitir su aprovechamiento en la alimentación humana y animal.
Palabras Clave: Agaricales; fructificación; hongos comestibles; Lentinus edodes; micelio; Pleurotus ostreatus; Stropharia rugosoannulata; substratos.
SUMMARY
The aim of the present work was to study mycelium growth (spawn) and fruit body production of three valuable edible mushroom species: oyster, Pleurotus ostreatus (Jacq.:Fr.) Kumm, shiitake japonés, Lentinus edodes (Berk.) Sing and giant strofaria, Stropharia rugosoannulata Farl.ex Murr, on 20 different substrates from agricultural wastes. The components of substrates were placed into glass jars, sterilized and inoculated with mushroom mycelium. Mycelium growth was evaluated two or three times for each mushroom species. All tested substrates were suitable for fruit body formation of P. ostreatus while L. edodes prefers a mixture of rice straw and husk with corn cobs, bagasse from sugarcane, coconut fiber and coffee wastes. Fruit bodies of S. rugosoannulata were formed only on substrates containing straw and husks of rice and corncobs.
Key Words: Agaricales; fructification; Lentinus edodes; mycelium; Pleurotus ostreatus; Stropharia rugoannulata; substrates.
Recibido: Febrero 19, 2002
INTRODUCCIÓN
Los hongos comestibles se conocen desde tiempos remotos como una fuente tradicional de nutrición entre diversos pueblos (Guzmán et al., 1993). Su incomparable gusto y aroma, alto contenido de proteínas, así como la presencia de vitaminas y minerales atestiguan su valor en la dieta humana. Datos recientes indican la presencia en los hongos comestibles de compuestos biológicamente activos como anticancerígenos, estimulantes de la función hepática, inmunomoduladores y anticolesterol (Wasser y Weiss, 1999; Stamets, 2000).
El consumo per cápita de los hongos se incrementa anualmente de una manera sostenida, llegando en algunos países a 2,5 - 3 kg por persona (Jablonsky y Sasek, 1997).
El desarrollo de la producción industrial de hongos es especialmente importante para América Latina (Guzmán et al., 1993), incluyendo Venezuela, ya que la creciente demanda de consumo por parte de la población en algunos casos no puede ser satisfecha por la producción doméstica, teniendo muchas veces que acudirse a la importación del champiñón, Agaricus bisporus (J. Lge) Imbach. También la producción de hongos representa una alternativa para el desarrollo de nuevas áreas de producción, con un impacto benéfico en el crecimiento económico. Por otra parte, la producción de hongos representa una importante alternativa para la utilización de desechos ricos en lignocelulosa, material que representa cerca del 40% de la biomasa producida por la fotosíntesis y que no puede ser aprovechada en forma directa para la alimentación humana y animal, debido a su baja digestión. El cultivo de los hongos representan un proceso de bioconversión de estos desechos.
Los hongos comestibles colaboran al enriquecimiento de los substratos vegetales haciendo asequibles los hidratos de carbono, albúminas, fermentos, vitaminas y elementos minerales, ya que en el proceso de su crecimiento el hongo degrada la lignina y la celulosa. Otro de los rasgos importantes del cultivo de hongos comestibles, es la posibilidad de la posterior utilización del substrato como abono orgánico, debido a que el micelio es fuente de fitohormonas y otras sustancias biológicamente activas.
Uno de los problemas más importantes asociados con el proceso de cultivo de hongos es la producción de los micelios de siembra y la selección de substratos nutritivos que resulten óptimos para la obtención de la biomasa de hongos y su posterior fructificación, así como el desarrollo de variedades o clones más productivas (Maggie et al., 1988).
El objetivo del trabajo es el estudio del crecimiento de 3 especies de hongos comestibles, orejas blancas, Pleurotus ostreatus (Jacq.:Fr.) Kumm., shiitake japonés, Lentinus edodes (Berk.) Sing y strofaria gigante, Stropharia rugosoannulata Farl. ex Murr., sobre diferentes substratos que provienen de desechos de la producción agroindustrial en Venezuela, la evaluación de su productividad y la elaboración de recomendaciones prácticas para el cultivo de las especies antes mencionadas en condiciones tropicales y subtropicales.
MATERIALES Y MÉTODOS
Los experimentos se realizaron durante 1994-1995 en el laboratorio del Núcleo Experimental de Biotecnología Agrícola del Instituto Venezolano de Investigaciones Científicas (Caracas, Venezuela), a 1.600 m.s.n.m. con cepas de cultivos puros de los hongos de orejas blancas, shiitake japonés y strofaria gigante provenientes del Instituto de Botánica N. G. Jolodni (Kiev, Ucrania).
La multiplicación, incubación y transplante de los micelios se ha realizado en condiciones de esterilidad. La formación de los cultivos maternales se efectuó en probetas y placas de Petri sobre medios nutritivos (mosto de cerveza agarizado) incubados a 25-28 ºC.
Se ensayaron distintos medios de producción de micelios de siembra, utilizando frascos de vidrio en el estudio del crecimiento micelial y botellas de 1 1 con el propósito de producir el micelio maternal para la fructificación. Con ese fin se aplicó tecnología recomendada por Dúdka et al. (1978, 1987), la cual incluye el siguiente procedimiento: 1) blanqueo del substrato (grano de trigo, sorgo, maíz), 2) mezclado con yeso y tiza para equilibrar el pH a 6,0-6,5,3) colocación del substrato en botellas de 1 1 y 4) esterilización por autoclave.
En el trabajo se investigó la posibilidad de cultivar los micelios de los hongos orejas blancas, shiitake japonés y strofaria gigante sobre 20 substratos diferentes, utilizando mezclas de bagazo de caña de azúcar, desechos de café, hojas de plátano, paja y cáscara de arroz, fibra de coco, tusa de maíz, entre otros.
El Cuadro 1 muestra las diferentes combinaciones de substratos utilizados en las distintas experiencias. Se realizaron 2 series de experimentos con los distintos substratos a fin de determinar el crecimiento de los micelios para cada especie. Para cada combinación de substrato se realizaron varias repeticiones (entre 3 y 5). El crecimiento micelial tuvo lugar en ambientes con temperatura controlada a 25 ºC. Para medir el crecimiento del hongo se empleó la medida del aumento lineal y de la espesura de micelio sobre los diferentes substratos durante el período de cultivo.
| CUADRO 1. Combinaciones de substratos utilizados en los experimentos de cultivo de hongos comestibles. | ||
| | ||
| Substratos | Abreviación | Proporción |
| | ||
| 1 Paja y cáscara de arroz | A | 1 |
| 2 Paja y cáscara de arroz + fibra de coco | A + C | 1:1 |
| 3 Paja y cáscara de arroz + caña de azúcar1 | A + Az | 1:1 |
| 4 Paja y cáscara de arroz + tusa de maíz | A + M | 1:1 |
| 5 Caña de azúcar | Az | 1 |
| 6 Caña de azúcar + tusa de maíz | Az + M | 1:1 |
| 7 Caña de azúcar + mosto de cerveza | Az + Ce | 1:1 |
| 8 Fibra de coco | C | 1 |
| 9 Fibra de coco + tusa de maíz | C + M | 1:1 |
| 10 Tusa de maíz | M | 1 |
| 11 Aserrín2 + tusa de maíz | 2As + M | 2:1 |
| 12 Aserrín2 + caña de azúcar | 2As + Az | 2:1 |
| 13 Aserrín3 + caña de azúcar | Ap + Az | 1:1 |
| 14 Aserrín3 + tusa de maíz | Ap + M | 2:1 |
| 15 Tusa de maíz + borra de café4 | M +Ca | 1:1 |
| 16 Hojas de plátano (verde, lavado) | P1 | 1 |
| 17 Hojas de plátano + borra de café | P1 + Ca | 1:1 |
| 18 Hojas de plátano (seca) | P2 | 1 |
| 19 Granos de sorgo | S | 1 |
| 20 Granos de sorgo + borra de café | S + Ca | 1:1 |
| | ||
| 1) Bagazo de caña de azúcar; 2) Bombacopsis sepium + Tecoma pentaphylla;3) Pinus caribeae; 4) Desecho de café colado exprimido;5) 1-10(serie de experimentos 1) y 6) 11-20 (serie de experimentos 2). | ||
Una etapa importante en la tecnología de cultivo es la preparación de un substrato adecuado para obtener los cuerpos fructíferos (Biskó y Dúdka, 1987). Como primer punto es necesario obtener la mayor difusión del hongo dentro del substrato, para lo cual es importante desmenuzar los componentes que van a ser utilizados hasta un tamaño de 3-5 cm y luego proceder a combinarlos adecuadamente hasta obtener una mezcla uniforme.
Posteriormente, los substratos colocados para su siembra en bolsas de plástico transparente fueron tratados por pasteurización con el propósito de eliminar la microflora competidora, lo que permite asegurar la aclimatación del micelio del tipo de hongo que se desea cultivar. Para el desarrollo de los medios de fructificación fueron probadas distintas combinaciones de substratos vegetales, provenientes de desechos industriales que mostraban un mejor crecimiento micelial y formación de cuerpos fructíferos en frascos de cultivo para orejas blancas y shiitake japonés.
A fin de demostrar que la fructificación en bolsas plásticas, (en el caso de orejas blancas) o en cajas de madera (strofaria gigante) con substratos seleccionados se aplicaron diferentes tratamientos térmicos, como calentamiento en estufa a 60–70 ºC durante 24,60 y 72 h y esterilización con radiación utilizando una fuente de 60Co (40.000 Ci, 0,8 MRad/h). Para ello se colocó el material a esterilizar cerca de la fuente durante 3 h para alcanzar 2,5 MRad.
A continuación del tratamiento, los substratos se dejaron enfriar a temperatura ambiente, humedeciéndose hasta alcanzar aproximadamente 75% de humedad, para proceder luego con la inoculación. En cuanto a la inoculación se utilizaron en todos los casos entre un 3 y 5% de micelio maternal en relación con la masa del substrato, cultivados en condiciones no asépticas. Después de la cobertura completa de substratos con micelios las bolsas fueron colocadas en la cámara de enfriamiento, conservándose en las mismas durante 48 h con temperaturas de 2-4 ºC para inducir la fructificación. Posteriormente las bolsas fueron trasladadas al local de cultivo con lámparas de luz diurna, manteniéndolas a 15-18 ºC y humedad del 80-90%, con un régimen de luminosidad de 10 h diarias a 3-4 µmol m-2 s-1
En esta etapa del cultivo de hongos comestibles, es muy importante prevenir la entrada de las plagas en bolsas perforadas y la contaminación de los micelios. En estas experiencias se utilizó la limpieza del piso con cloro, la aplicación de insecticidas revisando periódicamente la presencia de algunas plagas o contaminación.
En el caso del estudio de fructificación de orejas blancas en bolsas, la cosecha se realizó cortando cuerpos fructíferos maduros o más grandes en los mismos períodos de cultivo. En experimentos con shiitake japonés y strofaria gigante la producción total de carpóforos y el rendimiento de cosecha no fue evaluado.
El análisis estadístico de los resultados se realizó con programas de SigmaPlot y SigmaStat (JANDEL SCIENTIFIC SOFTWARE) con presentación de los valores promedio (x), desviación estándar, error estándar, etc. Cada valor representa la proporción mediana y la desviación estándar de 3-5 réplicas de dos experimentos (crecimiento de micelios); cada réplica consistió de un solo frasco. Se comparó los grupos con distintos substratos por cada día de evaluación usando el método del análisis de varianza (Friedman Repeated Measures Analysis of Variance on Ranks) y el método de comparación múltiple (Student-Newman-Keuls Method). En el caso del estudio de fructificación de orejas blancas se usó también la comparación de los valores medianos entre los grupos por separado (Mann-Whitney Rank Sum Test).
RESULTADOS Y DISCUSIÓN
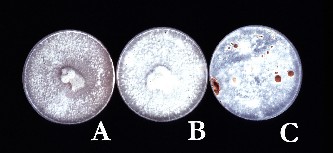
La producción de micelios graniformes de siembra es el problema primordial en un plan de introducción y cultivo para la producción de los hongos comestibles. En la Figura 1 se muestra el paso inicial de preparación de las cepas de los distintos hongos comestibles en las placas de Petri sobre cultivo en el mosto de la cerveza con agar para elaborar los experimentos.
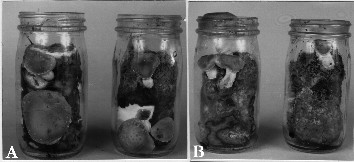
Los distintos hongos estudiados presentaron diferencias en la rapidez de crecimientos sobre los diferentes substratos utilizados. En la Figura 2 se observan los micelios graniformes producidos especialmente en botellas a partir de los substratos A+M, A+S, Az+S, M+S (Cuadro 1) para siembra en bolsas.
Cultivo de orejas blancas
En el caso de orejas blancas, el micelio se desarrolló más activamente sobre los substratos A, A+M, Az+M, M+Ca, 2As+Az, Ap+Az, Ap+M, P+Ca, S+Ca; siendo especialmente espeso sobre C+M y M, por lo que se escogieron algunos para evaluar la producción de cuerpos fructíferos en bolsas plásticas.
FIGURA 1. Crecimiento de los micelios de S. rugosoannulata (A), P. ostreatus (B) y L. edodes (C) sobre mosto de cerveza agarizado en placas de Petri incubados a 25-28 ºC.
FIGURA 2. La formación de los micelios maternales de S. rugosoannulata (A), P. ostreatus (B) y L. edodes (C) sobre medios producidos a partir del substrato (A + S) en botellas de 1 l incubados a 25-28 ºC.
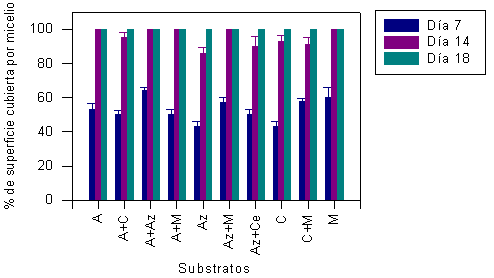
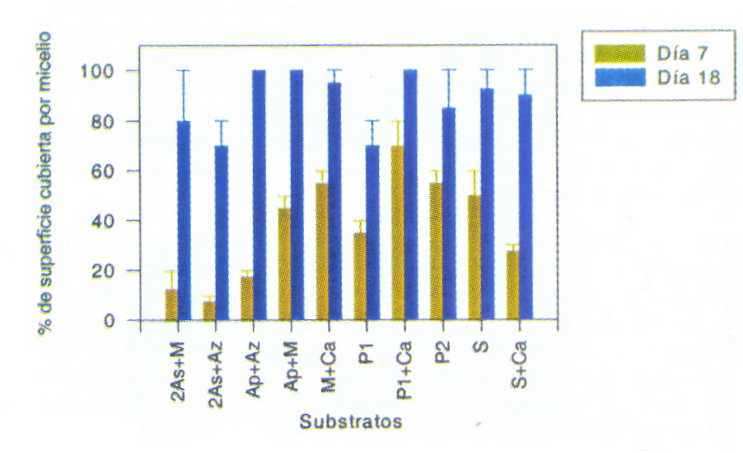
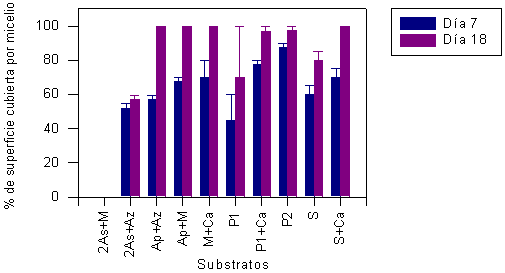
En la Figura 3 se muestra el resultado de la observación del crecimiento micelial de orejas blancas medido a los 7, 14 y 18 días después de la inoculación (DDI) en los experimentos de la serie 1. Durante el período de los 14 DDI, el micelio de orejas blancas cubre casi totalmente los substratos. La diferencia del crecimiento micelial en distintos substratos, entre 14 y 18 DDI, no es significativa (P<0,05). Esto sugiere que la mayor cantidad de micelio germinó durante los primeros 14 DDI; el incremento de los micelios germinados después de 18 DDI no fue significativo para todos los substratos de serie 1 (Cuadro 2). En la Figura 4 se muestran los resultados de la observación durante 7 y 18 d del crecimiento micelial, en los experimentos de la serie 2. El análisis estadístico también mostró las diferencias entre los 7 y los 18 DDI para todos substratos evaluados (P<0,05), a excepción el substrato P1 (Cuadro 2).
FIGURA 3. Crecimiento del micelio de P. ostreatus sobre los diferentes substratos (serie 1) medido a los 7, 14 y 18 días después de la inoculación
| CUADRO 2. Análisis estadístico de crecimiento micelial de los hongos comestibles por el método de Student-Newman-Keuls (comparación múltiple) | ||||
| | ||||
| Especie, | Comparación días | Resultados | ||
| Diferencia | Valor P | Valor q | ||
| | ||||
| P. ostreatus | .. | .. | .. | .. |
| Serie 1 | 7 vs. 14 | 12,50 | 2 | 29,3* |
| . | 7 vs. 18 | 17,50 | 2 | 32,7* |
| . | 14 vs.18 | 5,00 | 2 | 3,58 |
| Serie 2 | 7 vs.18 | 8,65 | 2 | 23,59* |
| | ||||
| L. edodes | . | . | . | . |
| Serie 1 | 14 vs. 22 | 11,30 | 2 | 6,90* |
| Serie 2 | 7 vs.18 | 47,50 | 2 | 26,9* |
| S. rugosoannulata | . | . | . | . |
| Serie 1 | 14 vs. 22 | 18,00 | 2 | 5,69* |
| . | 14 vs. 28 | 37,50 | 3 | 8,39* |
| . | 22 vs. 28 | 19,50 | 2 | 6,17* |
| Serie 2 | 7 vs.18 | 38.00 | 2 | 6,52* |
| | ||||
| * Nivel de significancia estadística es P<0,05. | ||||
Para la mayoría de los substratos indicados se comenzó a notar la formación de las estructuras primordiales y los cuerpos fructíferos en los frascos a los 18-20 DDI. En el Cuadro 3 se presentan los resultados obtenidos en el caso del estudio de fructificación de orejas blancas en bolsas plásticas. La primera fue obtenida después de 20 d de la colocación de las bolsas en el local de cultivo sobre el substrato 2As+C+M en proporción de 1:1:1 tratado por irradiación. En esta variante del experimento, el rendimiento de orejas blancas fue de 19,75 ± 0,75 kg m-3 .
FIGURA 4. Crecimiento del micelio de P.ostreatus sobre los diferentes substratos (serie 2) medido alos 7 y 18 días después de la inoculación
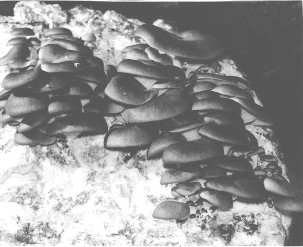
Varios días más tarde se obtuvo el rendimiento sobre 2As+C+M (1:2:2) y fue en promedio de 15,70 ± 2,40 kg m-3 (Cuadro 3). Sobre el substrato Az+M (3:1) tratado térmicamente en 60-70 ºC durante 24 h, el rendimiento estaba 11,65 ± 4,75 kg m-3 y sobre el Az+M (1:1) tratado por irradiación < de 11,60 ± 3,10 kg m-3. Sobre los substratos de C+M con diferentes proporciones de fibra de coco y tusa de maíz (1:7, 1:5, 1:3) y con tratamiento térmico de 60–70 ºC durante 60 h, el rendimiento fue de 15,35 ± 1,75; 13,95 ± 1,40 y 12,20 ± 2,00 kg m-3, respectivamente. La Figura 5 muestra la formación de cuerpos fructíferos sobre este substrato. Sobre el substrato con sólo tusa de maíz molida, tratado con 60–70 ºC durante 72 h el rendimiento fue de 14,55 ± 2,05 kg m-3.
| CUADRO 3. Fructificación de P. ostreatus obtenida sobre los diferentes substratos | |||||
| | |||||
| No. | Substrato | Proporción | Tratamientos | Cosecha | Rendimiento Total |
| | |||||
| 1 | 2As+C+M | 1:1:1 | Irradiación | 19,75 ± 0,75 | 30,50 |
| 2 | 2As+C+M | 1:2:2 | Irradiación | 15,70 ± 2,40 | 31,40 |
| 3 | Az+M | 3:1 | 60-70 ºC, 24 h | 11,65 ± 4,75 | 23,30 |
| 4 | Az+M | 1:1 | Irradiación | 11,60 ± 3,10 | 23,20 |
| 5 | C+M | 1:3 | 60-70 ºC, 60 h | 12,20 ± 2,00 | 24,40 |
| 6 | C+M | 1:5 | 60-70 ºC, 24 h | 13,95 ± 1,40 | 27,90 |
| 7 | C+M | 1:7 | 60-70 ºC, 60 h | 15,35 ± 1,75 | 30,70 |
| 8 | M | 1 | 60-70 ºC, 72 h | 14,55 ± 2,05 | 29,10 |
| | |||||
| EE= error estándard. | |||||
La diferencia entre los valores medianos de los distintos substratos y tratamientos no es significativa (hipótesis nula, P= 0,427, H= 7,01). La comparación de los valores medianos entre los grupos (Mann-Whitney Rank Sum Test) también mostró que las diferencias no son significativas entre 1 y 2: P (estimada) = 0,245 < P (teórica = 0,333; 3 y 4: P(estimado)= 0,698 < P (teórica) 1.000; 5, 6 y 7: (P(est) = 0,565 y < P (teórica) = 0,667. Esto sugiere que todas las combinaciones de los substratos provenientes de desechos agrícolas e industriales usados en esta experiencia con tratamientos aplicados son aceptables y recomendables para el cultivo de orejas blancas en condiciones de Venezuela.
Cultivo de shiitake japonés
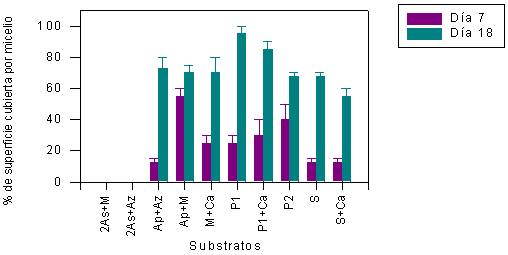
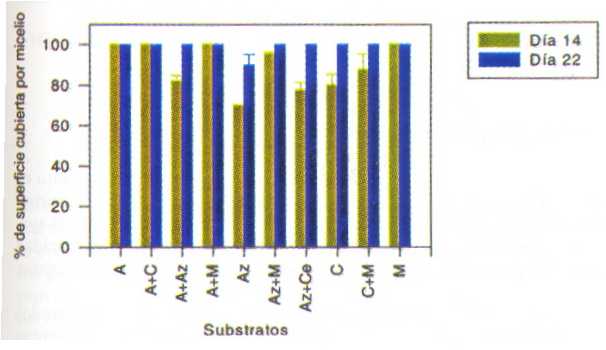
Para shiitake japonés, la rapidez del crecimiento micelial ha sido algo menor que para orejas blancas. En general la completa cobertura de los substratos se percibía después de 20–30 d. En la Figura 6 se muestran los resultados obtenidos a los 14 y 22 DDI para experimentos de serie 1, y en la Figura 7, a los 7 y 18 DDI para la serie 2. El crecimiento micelial ha sido más intenso en los substratos de serie 1. Por el contrario, el crecimiento micelial ha resultado menor casi en todos los substratos de la serie 2. El análisis estadístico (Cuadro 2) mostró las comparaciones de crecimiento micelial entre los 14 y 22 DDI para todos los sustratos en experimentos de serie 1, y confirmó que la diferencia de germinación de los micelios no fue significativa. La diferencia entre los 7 versus 18 DDI para todos substratos evaluados en experimentos de serie 2 fue significativa (P<0,05) y esto siguere que para un mayor incremento de los micelios germinados en todos los substratos de serie 2, es necesario un período más largo.
El inicio de la fructificación de shiitake japonés, en frascos de cultivo tardaron más y las primeras estructuras primordiales aparecieron a los 2,5 meses siguientes a la inoculación sobre una combinación de substratos Az+M y Az+A, tal como se muestra en la Figura 8. También se observaron las fructificaciones en frascos de cultivo sobre los substratos A, A+M y M. Pasados algunos días se obtuvo la fructificación sobre los substratos A+C, M+Ca, P+Ca y Ap+M y generalmente el ciclo de fructificación de shiitake japonés se continúe durante 3-4 meses.
FIGURA 5. Formación de cuerpos fructíferos de P.ostreatus obtenido sobre el substrato C + M.
FIGURA 6. Crecimiento del micelio de L. edodes sobre los diferentes substratos (serie 1) medido a los 14 y 22 días después de la inoculación.
FIGURA 7. Crecimiento del micelio de L. edodes sobre los diferentes substratos (serie 2) medido a los 7 y 18 días después de la inoculación.
Cultivo de strofaria gigante
En el caso de strofaria gigante la rapidez de cobertura del substrato es más lenta en comparación con los anteriores, lo cual se debe en primer lugar a las características fisiológicas de esta especie (Grodzínskaya, 1992). Sin embargo, los datos obtenidos muestran una buena capacidad de aclimatación del micelio sobre algunos substratos probados en el trabajo.
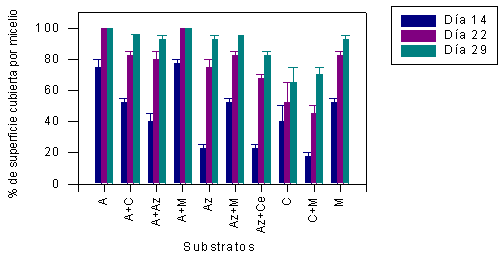
Los resultados de crecimiento del micelio de strofaria gigante sobre los diferentes substratos (serie 1) medido a los 14, 22 y 29 DDI se presentan en la Figura 9 y los resultados de otro experimento (serie 2) medido a los 7 y 18 DDI aparecen en la Figura 10. En la mayoría de los casos, la cobertura completa del substrato como promedio se observó a los 28 DDI y el mayor crecimiento se presentó solamente sobre los substratos A, A+C, A+Az, A+M, Az+M, M (Figura 9), P y P+Ca (Figura 10).
FIGURA 8. Fructificación de L. edodes después de 2 meses de cultivo sobre los substratos Az+M (A) y A+Az (B).
En el caso de los substratos combinados con sorgo (Cuadro 1) se observó una inhibición del crecimiento vegetativo del micelio de strofaria (Figura 10), lo cual posiblemente depende de los inhibidores naturales presentes en los granos de este cereal. Para los substratos combinados con aserrín provenientes de diferentes maderas (2As+Az, 2As+M) el crecimiento del micelio fue muy débil.
Para separar el grupo o los grupos que tienen distintos días de crecimiento de los micelios sobre diferentes substratos, se utilizó también el método de comparación múltiple (Cuadro 2). La diferencia fue significativa (P<0,05) entre los grupos de crecimiento de los micelios de strofaria gigante sobre diferentes substratos en experimentos de serie 1 a los 14, 22 y 28 DDI y también entre los substratos de serie 2 en los 7 y 18 DDI.
FIGURA 9. Crecimiento del micelio de S. rugosoannulata sobre los diferentes substratos (serie 1) medido a los 14, 22 y 29 días después de la inoculación.
FIGURA 10. Crecimiento del micelio de S. rugosoannulata sobre los diferentes substratos (serie 2) medido a los 7 y 18 días después de la inoculación.
La fructificación de strofaria gigante se logró en este experimento después de 2–2,5 meses de inoculación únicamente sobre el substrato Aa+A+M (2:1:1) donde Aa - paja de arroz, tratada a 55–60 ºC durante 72 h (Figura 11). El rendimiento total de esta cosecha no fue evaluado en virtud de que el crecimiento de strofaria gigante fue abatido por la microflora competidora que proviene de la cubierta de tierra.
FIGURA 11. Formación de los cuerpos fructíferos de S. rugosoannulata después de 3 meses de cultivo sobre el substrato Aa (paja de arroz)+Az+M con cubierta de tierra abonada.
Aplicación de medidas fitosanitarias
La utilización de procedimientos que eviten la contaminación y la aplicación correcta de medidas fitosanitarias en las materias primas, durante todo el proceso de producción de micelios y fructificación, es de mucha importancia, ya que los ataques de insectos y otras plagas pueden tener una incidencia negativa en la productividad, incluso impidiendo totalmente fructificación (Dúdka et al., 1987; Guzmán et al., 1993).
Los substratos utilizados, así como los micelios y cuerpos fructíferos de los hongos comestibles, constituyen un medio excelente para el desarrollo de bacterias, mohos y colonias de insectos. Los insectos que pueden atacar a los hongos cultivados son varios, especialmente las moscas de hongos pertenecientes al género Lycoriella, Megaselia y Sciaria, los mosquitos pertenecientes al género Licoria, mosca de frutas del género Drosophyla además de arañas (géneros Tylogliphus y Linopodes).
Resultan particularmente dañinos el ataque de arañas, ya que éstas penetran dentro de las estructuras primordiales y evitan fructificación, con agravante de que no existe ningún método efectivo para eliminarlas; solamente funciona la profilaxis. Así que la prevención, y no la cura, es el método más efectivo para prevenir estos ataques de plagas. Esto implica que para que el combate sea efectivo deben esterilizarse los cuartos de cultivo antes de introducir los micelios que serán utilizados para obtener posteriormente los cuerpos fructíferos.
En estas experiencias, se utilizó la limpieza del piso con cloro y la aplicación regular de insecticidas y no se observó ningún ataque grave de insectos, ya que estos experimentos se realizaron en condiciones controladas de laboratorio, en volúmenes pequeños no destinados a la comercialización. Sólo hubo cierta contaminación con insectos durante la etapa de cultivo en bolsas plásticas, donde se detectaron cucarachas, Periplanetaria americana y moscas de frutas cuando se trasladaron las bolsas fuera del cuarto de cultivo después de 1 mes.
Los insectos entraron a las bolsas en los lugares de cortes que se realizaron para obtener las fructificaciones. Durante este período se logró obtener dos ciclos de cosechas, presentándose la contaminación con moscas de frutas a partir del primer mes, por lo cual ésta no incidió en la producción. No se desarrolló ninguna contaminación con bacterias y hongos patógenos durante el tiempo en que se realizaron los estudios de fructificación de orejas blancas en bolsas plásticas. En el caso de strofaria gigante se tomó registro de la apariencia de los hongos patógenos del género Aspergillus y micelio de hongo competitivo del género Coprinus en 3 de las 5 cajas utilizadas, ocurriendo esta contaminación después que los micelios fueron cubiertos con tierra abonada. Este problema ha podido tener su origen en la falta de una ventilación adecuada y el exceso de humedad de la tierra, y del ambiente en general. También se observó la presencia de moscas, pero no en gran cantidad, ya que las condiciones de temperatura 15-20 ºC no permiten el buen desarrollo de las larvas.
Los resultados del estudio de crecimiento micelial sobre algunos substratos en condiciciones tropicales coinciden generalmente con estudios previos (Guzmán et al., 1993; Salmones et al., 1996 a y b).
CONCLUSIONES
Los estudios realizados en este trabajo demuestran la factibilidad de la utilización de los desechos de la agricultura en Venezuela como substratos para el cultivo de los hongos comestibles orejas blancas, shiitake japonés y strofaria gigante. Una de las características comunes encontrada en los tres hongos comestibles fue que la fructificación se presenta por ondas o ciclos lo cual permite realizar varios ciclos en un año. Para elevar la producción de hongos se hace necesario la selección de variedades de alto rendimiento, la aplicación del grupo de los tipos cultivados y el perfeccionamiento de la tecnología del cultivo. AGRADECIMIENTO Los autores extienden un sincero reconocimiento a la cervecería Polar (Caracas) por el apoyo prestado con el mosto de cerveza para la preparación del medio de cultivo. Asimismo, agradecen a Pedro Martínez y José Borges por su ayuda durante las experiencias en el IVIC (Caracas, Venezuela) y por último, al MC Miguel A. Herrera y Francisco López (CICY, México) por la asistencia brindada en la preparación del manuscrito. BIBLIOGRAFÍA 1. Biskó, N. A. y I. A. Dúdka. 1987. Biología y cultivo de hongos comestibles tipo Véshenka. Kiev, Naukova Dumka, 148 pp. (en ruso). 2. Dúdka, I. A., S. P. Wasser y A. S. Bujálo. 1978. Cultivo industrial de hongos comestibles. Kiev, Naukova Dumka. 246 pp. (en ruso). 3. Dúdka, I. A., S. P. Wasser y N. A. Biskó. 1987. Recomendaciones metodológicas para el cultivo industrial de hongos comestibles. Kiev, Naukova Dumka. 71 pp. (en ruso). 4. GrodZínskaya, A .A. 1992. Stropharia rugosoannulata Farlow ex Murr. Culture. Micología y Fitopatología. 26:233-243. (en ruso). 5. Guzmán, G., G. Mata, D. Salmones, L. Soto-Velasco y L. Guzmán-Dávalos. 1993. El cultivo de los hongos comestibles: con especial atención a especies tropicales y subtropicales en esquilmos y residuos agro-industriales. 1ª ed. México, Instituto Politécnico Nacional. 245 pp. 6. Jablonsky, I. and V. Sasek. 1997. Pestovani hub ve velkem i v malem. Praha Nakladatelstvi Brazda. 145 pp. (en checo). 7. MagGIe, Y., Y. Matsubara, T. Shiratori and T. Sasaki. 1988. Variation in fruiting body production of protoclones of oyster mushroom. HortScience 23(6):1.065-1.066. 8. Salmones, D., K. Waliszewski and G. Guzmán. 1996a. Use of some agroindustrial lignocelluloses by–products for edible mushroom Volvariella volvaceae cultivation. Rev. Int. Contam. Ambient. 12:69-74. 9. Salmones, D., R. Gaitán-Hernández, R. Pérez and G. Guzmán. 1996b. Estudios sobre el género Pleurotus. VIII. Interacción entre crecimiento micelial y productividad. Rev. Iberam. Micol.14:173-176. 10. Stamets, P. 2000. Growing gourmet and medicinal mushrooms. Third Ed. Ten Speed Press. 574 p. 11. Wasser S. P. and A. L. Weis. 1999. Therepeutic effects of substances occurring in higher Basidiomycetes mushrooms: a modern perspective//Critical Reviews in Immunology. 19:65.
[ Links ]