Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agronomía Tropical
Print version ISSN 0002-192X
Agronomía Trop. vol.52 no.4 Maracay Oct. 2002
Embriogénesis somática en onoto *
Claret C. Michelangeli de Clavijo1, Paola I. Artioli G.2 y Ada M. Medina M.2
1Directora y 2Asistentes de Investigación
Centro de Investigaciones en Biotecnología Agrícola (CIBA)
Apdo. 4579. Maracay 2101, estado Aragua. Venezuela
RESUMEN
Con la finalidad de inducir la formación de callos, embriones somáticos y regeneración de plántulas a partir de anteras de onoto, Bixa orellana L., se tomaron botones florales mayores de 0,7 cm, con granos de polen uninucleados de 19 genotipos del campo experimental del Instituto de Agronomía, Universidad Central de Venezuela. Las anteras fueron sometidas a cinco regímenes de temperatura (8 °C durante 0, 2, 4, 6 y 8 días) removidas asépticamente. Se evaluó el efecto de tres medios de cultivo: Murashige Skoog (MS) Nitsch y Nitsch y B5, con diferentes combinaciones de reguladores de crecimiento: ácido naftalenacético (ANA), Kinetina (Kin), 2,4-dichlorophenoxiacético (2,4-D), Picloram (Pic), ácido indolbutírico (AIB), 6-bencilaminopurina (BA) y Thidiazuron (TDZ) solos o en combinación, probándose condiciones de iluminación y oscuridad para cada tratamiento. En los casos donde se utilizaron las sales MS suplementado con 4 mg l-1 de ANA y 2 mg l-1 de BA, bajo oscuridad y a una temperatura de 30 ± 1 °C, para los genotipos identificados como G1, 41 e I, se indujo la formación de embriones somáticos. No se observaron diferencias en la respuesta de los tratamientos a cinco regímenes de temperatura. Por otra parte, la germinación de embriones hasta el desarrollo de plántulas se logró en el medio MS, sacarosa (20 g l-1), sin regulador de crecimiento. El protocolo obtenido permitió la regeneración eficiente de plántulas mediante la embriogénesis somática a partir de cultivo de anteras.
Palabras Clave: Antera; Bixa orellana; cultivo in vitro; embriogénesis somática; embrión.
SUMMARY
Floral buds 0.7 cm in length with uninucleate pollen grains, were removed from 19 annatto, Bixa orellana L., genotypes from the Agronomy Institutes experimental field, Faculty of Agronomy, Universidad Central de Venezuela, in order to induce callus, somsatic embryos and plantlet regeneration. Anthers were aseptically removed and subjected to five temperature regimes: 8 °C during 0, 2, 4, 6 and 8 days. The effect of three medium cultures Murashige and Skoog (MS), Nitsch and Nitsch and B5 and different growth regulators alone or in combination (naftalenacetic acid (ANA), Kinetine (Kin), 2,4-dichlorophenoxiacetic (2,4-D), Picloram (Pic), indolbutyric acid (AIB), 6-bencilaminopurine (BA) y Thidiazuron (TDZ)) were tested both under ilumination and dark conditions. Somatic embryos were formed on MS medium supplemented with ANA (4 mg l-1) and BA (2 mg l-1), under dark conditions at 30 ± 1 °C from the genotypes identified as G1, 41 and I. There were no differences among thermal shock treatments. On the other hand, the development of somatic embryos to plantlets was achieved on half MS medium, sugar (20 g l-1), without growth regulators. Therefore, the efficient regeneration to plantlets through somatic embryogenesis from annatto anthers was achieved with the protocol obtained.
Key Words: Anther; Bixa orellana L.; in vitro culture; embryo; somatic embryogenesis.
RECIBIDO: Marzo 12, 2002
INTRODUCCIÓN
El onoto, Bixa orellana L., es una especie leñosa tropical originaria de la cuenca Amazónica con un amplio margen de adaptación a suelos y climas tropicales (Smith y Schultes, 1990). Presenta una gran variedad de usos como colorante natural y es utilizado por empresas procesadoras de alimentos, cosméticos y ungüentos, pues resulta inofensivo para el consumo y aplicaciones en la piel (Arce, 1990).
Por ser una planta alógama, surge el inconveniente de una amplia variabilidad en la descendencia y en consecuencia desuniformidad al tiempo de la cosecha, en los rendimientos y en la calidad del producto comercial. El uso de un programa de mejoramiento que incluya la producción de haploides ha sido utilizado para disminuir este tipo de variabilidad (Roca et al., 1991).
La técnica del cultivo in vitro con el uso de anteras representa además una herramienta muy útil en plantas perennes como el onoto, ya que la producción de haploides y posterior generación de individuos homocigotas en una sola generación, permite acortar el tiempo en los programas de mejoramiento genético, comparado con las técnicas convencionales (Luna, 1987; Moraes-Fernandes et al., 1999).
Hasta el presente, los estudios de regeneración in vitro presentados en onoto se han limitado a la morfogénesis y la micropropagación usando como explantes hipocótilos y ápices (Michelangeli y Atacho, 1996; Tamayo, 1997) así como segmentos nodales y apicales (DSouza y Sharon, 2001) a partir de plántulas obtenidas por semilla.
El trabajo tuvo como objetivo inducir la formación de callos, embriogénesis somática y regeneración de plántulas de onoto a partir del cultivo de anteras, examinándose factores como la composición del medio, tipo de explante, genotipo, ambiente físico y pretratamientos con baja temperatura.
MATERIALES Y MÉTODOS
El trabajo se llevó a cabo en el laboratorio de cultivo de tejidos del Centro de Investigaciones en Biotecnología Agrícola (CIBA) en el Instituto de Genética, situado en la Facultad de Agronomía de la Universidad Central de Venezuela, Maracay.
Se utilizaron botones florales procedentes de 19 plantas adultas (segundo año de floración) del jardín de onoto existente en el campo experimental del Instituto de Agronomía, provenientes de semillas colectadas en las regiones andinas, centrales y orientales del país (Cuadro1).
Se seleccionaron botones con longitudes mayores a 0,7 cm para cada uno de los genotipos evaluados por presentar microsporas en estado uninucleado (Michelangeli et al., 2002). Estos fueron sometidos a cinco regímenes de temperatura: 8 ºC durante 0, 2, 4, 6 y 8 días, lavados con agua jabonosa (jabón azul) para eliminar restos de tierra y polvo, colocándose luego en etanol 70% durante 3 min. Posteriormente, fueron sumergidos en cloro comercial (ingrediente activo: hipoclorito de sodio) al 5,25% durante 5 min., seguido de tres lavados con agua destilada. Se eliminaron los pétalos externos y sumergieron de nuevo en una solución de hipoclorito de sodio al 2,5% durante 5 min. Bajo cámara de flujo laminar se realizaron tres lavados más de agua destilada previamente esterilizada. Finalizado el proceso de desinfección, fue eliminado el resto de los pétalos quedando las anteras al descubierto.
| Cuadro 1. Procedencia geográfica de los 19 genotipos de onoto utilizados en la inducción de embriogénesis somática. | |
| | |
| Genotipo | Origen |
| | |
| 25,37 | Guárico |
| 26 | Mérida |
| G1, G6, G8, 21, 29, I | Aragua |
| 7, 8, 9, 10, 18 | Sucre |
| 30, 40 | Cojedes |
| 35 | Carabobo |
| 41 | Portuguesa |
| 44 | Nueva Esparta |
| | |
Medios de cultivo
Para inducir la formación de callo embriogénico (medio I) se evaluó el efecto de tres medios de cultivo, a saber: MS (Murashige y Skoog, 1962), Nitsch y Nitsch (1969) y B5 (Gamborg et al., 1968), suplementado con myo-inositol (100 mg l-1), tiamina-HCl (0,1 mg l-1), ácido nicotínico (0,5 mg l-1), piridoxina (0,5 mg l-1), caseína hidrolizada (250 mg l-1), sacarosa (20 a 160 g l-1), pH ajustado a 5,8 ± 2 y solidificado con Phytagel (2,5 g l-1). Asimismo, diferentes combinaciones de reguladores de crecimiento: ácido naftalenacético (ANA), Kinetina (Kin), 2,4-dichlorophenoxiacético (2,4-D), Picloram (Pic), ácido indolbutírico (AIB), 6-bencilaminopurina (BA) y Thidiazuron (TDZ), observados en el Cuadro 2. Adicionalmente, se probaron tres tiempos de cultivo en el medio I (21, 28 y 42 d), para determinar el tiempo óptimo de inducción de callo embriogénico.
Posteriormente, los callos embriogénicos formados fueron transferidos a un medio de inducción de embriones (medio II). El medio estuvo compuesto por las sales MS, suplementado con myo-inositol (100 mg l-1), tiamina-HCl (0,1 mg l-1), ácido nicotínico (0,5 mg l-1), piridoxina (0,5 mg l-1), caseína hidrolizada (250 mg l-1), sacarosa (60 g l-1), pH ajustado a 5,8 ± 2 y solidificado con Phytagel (2,5 g l-1). Se probaron los siguientes reguladores de crecimiento: BA (0,1 y 4,0 mg l-1), 2-ip (0,1 y 4,0 mg l-1), Kin (0,1 y 4,0 mg l-1) y medio básico.
Una vez que ocurrió la formación de embriones en el medio II (a los dos meses de cultivo aproximadamente), se seleccionaron aquellos que estuvieran en estado globular transfiriéndose individualmente a un medio sin reguladores (medio III). El mismo estuvo conformado por las sales MS y vitaminas, suplementado con sacarosa (20 g l-1), ajustando el pH a 5,8 ± 2. La transferencia a medio fresco se mantuvo durante ocho meses con subcultivos en el mismo medio cada 60 d, para un total de cuatro subcultivos.
Los embriones en estado de torpedo y cotiledonar obtenidos en el medio III fueron colocados en un medio de germinación de embriones (medio IV) que contenía las sales MS y vitaminas (a la mitad de su concentración), sacarosa (20 g l-1) y pH ajustado a 5,8 ± 2; probándose tres reguladores de crecimiento, combinados de la siguiente forma: AIB (0,1 y 1,0 mg l-1) + BA (0,1y 1,0 mg l-1); AIA (0,1 y 1,0 mg l-1) + BA (0,1 y 1,0 mg l-1) y AIB (0,1 mg l-1) solo y medio básico sin regulador de crecimiento.
| Cuadro 2. Composición del medio de cultivo utilizado para la inducción de callo embriogénico a partir de anteras de onoto. | ||||||||
| | ||||||||
| Medio | Reguladores de crecimiento (mg l-1) | |||||||
| | ||||||||
| ANA | BA | AIB | AIA | TDZ | Kim | 2,4-d | Pic | |
| | ||||||||
| . | 4 | 2 | . | . | . | . | . | . |
| .. | .. | .. | .. | .. | .. | .. | .. | 0,1 |
| . | . | . | 3 | . | . | . | . | . |
| . | 1 | 2 | . | . | . | . | . | . |
| . | 1 | 6 | . | . | . | . | . | . |
| . | 5 | 2 | . | . | . | . | . | . |
| . | 5 | 6 | . | . | . | . | . | . |
| Murashige | . | 2 | 4 | . | . | . | . | . |
| y Skoog | . | 3 | . | 1,5 | . | . | . | . |
| (1962) | . | . | 0 | . | 0,5 | . | . | . |
| . | . | . | 0,5. | . | 0,5 | . | . | . |
| . | . | . | 1,5 | . | 0,5 | . | . | . |
| . | . | . | 3 | . | 0,5 | . | . | . |
| . | . | . | 0 | . | 1,5 | . | . | . |
| . | . | . | 0,5 | . | 1,5 | . | . | . |
| . | . | . | 1,5 | . | 1,5 | . | . | . |
| . | . | . | 3 | . | 1,5 | . | . | . |
| . | 4 | . | . | . | . | 1 | . | . |
| . | . | . | . | . | . | 0,5 | 1 | . |
| Gamborg | . | 2 | 3 | . | . | . | . | . |
| et. al. | . | 6 | 3 | . | . | . | . | . |
| (1968) | . | 2 | 4 | . | . | . | . | . |
| . | . | 6 | 4 | . | . | . | . | . |
| . | . | 1,5 | . | 0,5 | . | . | . | . |
| . | . | 3 | . | 0,5 | . | . | . | . |
| . | . | 1,5 | . | 1 | . | . | . | . |
| . | . | 3 | . | 1 | . | . | . | . |
| . | . | 1,5 | . | 1,5 | . | . | . | . |
| . | . | 3 | . | 1,5 | . | . | . | . |
| . | . | 2 | . | 3 | . | . | . | . |
| . | . | 4 | . | 3 | . | . | . | . |
| . | . | 2 | . | 4 | . | . | . | . |
| . | . | 4 | . | 4 | . | . | . | . |
| | ||||||||
| ANA: ácido naftalenacético; BA: 6-bencilaminopurina; AIB: ácido indolbutírico; AIA: ácido indolacético; TDZ: Thidiazuron; Kin: Kinetina; 2,4-D: 2,4-dichlorophenoxiacético y Pic: Picloram | ||||||||
Siembra
Con la ayuda de un bisturí y agujas de disección se eliminaron los filamentos del androceo sembrando las anteras, bien sea completas o separadas (tecas), en cápsulas de Petri que contenían 30 ml de medio. Cada cápsula contaba con 10 explantes e igual cantidad de repeticiones. Ambos tipos de explantes fueron incubados en los medios de cultivo (medio I), colocados en diferentes cámaras de crecimiento bajo iluminación (32 µmol m2s-1 con un fotoperíodo de 12 horas y 23 ± 3 ºC) y de oscuridad a 30 ± 1 ºC.
La inducción de los embriones somáticos, transferencia y germinación (medios II, III y IV) se llevó a cabo bajo condiciones de iluminación de 32,5 µmol m-2 s-1 con un fotoperíodo de 12 h, temperaturas en un rango entre 20 y 27 ºC y una humedad relativa de 60 a 70%.
Fueron evaluados aspectos cualitativos y cuantitativos: dentro de las variables cualitativas se consideró la textura, color y forma de los callos, también la descripción morfológica de los embriones y plántulas tanto normales como anormales. Dentro de las variables cuantitativas se evaluó el número de anteras que produjeron callos (porcentaje de eficiencia), el número de embriones en estado globular, torpedo y cotiledonar, también el número de embriones normales y anormales y el número de plántulas obtenidas a partir de los embriones somáticos.
RESULTADOS Y DISCUSIÓN
Bajo las condiciones de estos ensayos no hubo diferencias en la respuesta de los tratamientos al aplicar shock térmico. Sólo se obtuvo la formación de embriones somáticos cuando las anteras se separaron en tecas. De todos los reguladores de crecimiento utilizados en el medio I, ya sea solos o combinados, el callo embriogénico apareció en aquellos tratamientos donde se utilizaron las sales MS suplementado con 40 g l-1 de sacarosa, 4 mg l-1 de ANA y 2 mg l-1 de BA, así como 4 mg l-1 AIB y 2 mg l-1 BA, bajo oscuridad y a una temperatura de 30 ± 1 ºC. De estos dos tratamientos, sólo se indujo la formación de embriones cuando se utilizó un tiempo de inducción de 21 y 28 días en el medio suplementado con 4 mg l-1 ANA y 2 mg l-1 BA.
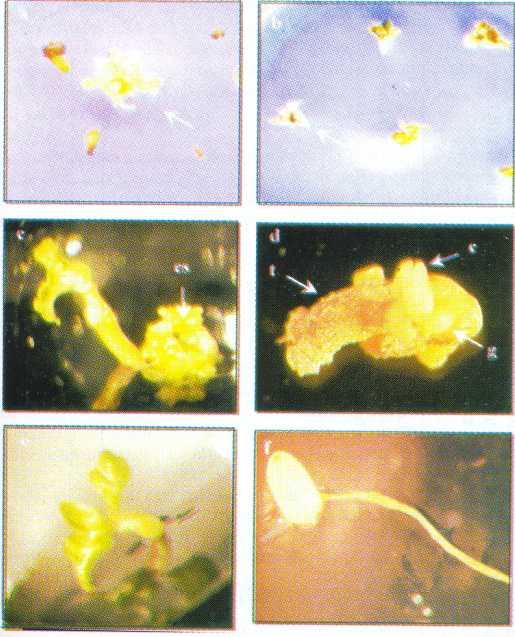
Los callos formados fueron friables, de color crema amarillento y superficie irregular (Figura 1a). A los 42 d de cultivo aunque también hubo formación de callo embriogénico no se observó el desarrollo de embriones.
Bajo las condiciones experimentales de esta investigación, sólo se formaron embriones somáticos a partir de los genotipos identificados como G1, 41 e I, colectados en los estados Aragua y Portuguesa, siendo la respuesta morfogénica genotipo dependiente.
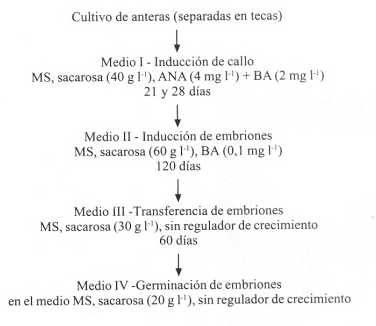
El porcentaje de eficiencia de formación de callos en el medio I fue del 65% ya que de 100 tecas sembradas se formaron 65 callos embriogénicos. De todos los medios de inducción de embriones (medio II) empleados, aquel suplementado con BA (0,1 mg l-1) fue el único donde se detectó la presencia de embriones (Figura 1b). La representación esquemática de las etapas sucesivas de la embriogénesis somática en onoto obtenidas en la investigación se resumen en la Figura 2.
Cuando los embriones obtenidos fueron subcultivados en medio básico se presentaron embriones normales en diferentes estados de desarrollo (globulares, corazón, torpedo y cotiledonares, Figura 1 c-f), así como embriones anormales (Figuras 3 y 4). Una característica común en los sistemas de embriogénesis somática in vitro es su asincronía, por lo tanto es usual que en un cultivo embriogénico se observen embriones en todas las etapas de su desarrollo (Ammirato, 1987).
Generalmente, esta presencia de embriones se ha atribuido a que la embriogénesis en células cultivadas es altamente repetitiva y los embriones somáticos pueden producir embriones adicionales más pequeños a lo largo de su eje. También sucede que, además de los embriones individuales, pueden encontrarse gemelos, tripletes y agregados múltiples de embriones, lo cual genera vástagos múltiples cuando se forman las plantas (Menéndez, 1993). En el trabajo, todos los embriones en estado cotiledonar desarrollaron hipocotilos y cotiledones bien definidos con un diámetro promedio entre 0,5 y 1,0 cm con una coloración crema y verde claro, respectivamente. Por otra parte, los embriones en estado de torpedo formaron un eje cotiledonar bien desarrollado de color crema.
Dentro de los embriones anormales, unos presentaron formación de embriones secundarios que posteriormente se desarrollaron en plántulas normales (Figura 3a-d), otros con formaciones cotiledonares extras que afectaron el cultivo de anteras (separadas en tecas) desarrollo posterior de la plántula. Dentro de las anormalidades más comunes, se encuentran ejes caulinares ramificados, embrión con múltiples cotiledones, dos ejes radiculares, embriones fusionados, agrupaciones en forma de racimo, entre otros (George, 1993; Chi et al., 1994).
FIGURA 1. Embriogénesis somática y regeneración de plantas de onoto utilizando anteras como explante, (a) callo embriogénico formado entre 21 y 28 días de cultivo en medio I; (b) masa de embriones en diferentes estados de desarrollo formados en medio MS suplementado con 0,1 mg l-1 BA (medio II) después de 120 días de subcultivo; (c) embrión en estado globular; (d) embrión en estado de corazón; (e) embrión en estado de torpedo; (f) embrión en estado cotiledonar.
FIGURA 2. Representación esquemática de las etapas sucesivas de la embriogénesis somática en onoto.
En el caso de onoto, se observaron embriones de forma arrepollada con numerosos cotiledones unidos en roseta (Figura 4a), embriones en forma de paraguas con cotiledones unidos en la base (Figura 4b), formación de embriones fusionados en diferentes estados de desarrollo (Figura 4c-d), formación de hojas cotiledonares adicionales (Figura 3e) y embrión con ausencia de eje caulinar (Figura 4f).
Por otra parte, las fases iniciales de la embriogénesis somática (globular y corazón) aunque presentes, no fueron fácilmente diferenciables debido a la textura del callo que por su friabilidad las enmascaró, por tanto se cuantificaron en un mismo grupo. El número de embriones normales (en sus diferentes estados de desarrollo) y anormales por subcultivo se muestran en el Cuadro 3.
FIGURA 3. Secuencia del desarrollo de dos embriones fusionados de onoto dando origen a una plántula normal, (a) dos embriones en estado de torpedo temprano fusionados, presentando un solo eje radicular, (b) embriones fusionados en estado cotiledonar a los 30 días de cultivo en medio básico de MS; (c) embriones fusionados en estado cotiledonar a los 40 a 50 días de cultivo en medio MS y (d) plántula a los 60 días de cultivo en medio básico MS.
FIGURA 4. Anormalidades observadas en embriones somáticos obtenidos a partir de cultivo de anteras de onoto, (a) embrión de forma arrepollada con numerosos cotiledones unidos en roseta, (b) embrión aparaguado con 3 o 4 cotiledones unidos en la base y separados en el ápice, (c - d) formación de embriones fusionados en diferentes estados de desarrollo, (e) embrión con más de dos hojas cotiledonares, (f) embrión torpedo con una raíz sin desarrollo del eje caulinar.
c: embrión cotiledonar, g: embrión globular, t: torpedo
| Cuadro 3. Cantidad de embriones formados en cada subcultivo en medio básico usando ANA (4 mg l-1) y BA (2 mg l-1) como medio de inducción de callo, BA (0,1 mg l-1), como medio de inducción de embriones en onoto. | ||||||
| | ||||||
| Tiempo en medio de | Subcultivo | Embriones normales | Embriones anormales | |||
| | ||||||
| Globular | Torpedo | Cotiledonar | Total | |||
| | ||||||
| 21 | 1 | 40 | 16 | 16 | 72 | 20 |
| 2 | 31 | 16 | 2 | 49 | - | |
| 3 | - | 1 | 4 | 5 | - | |
| 4 | 8 | 37 | 12 | 57 | 4 | |
| . | ||||||
| 28 | 1 | 42 | 8 | 5 | 55 | 41 |
| 2 | 45 | 21 | 39 | 105 | 13 | |
| 3 | - | 35 | 8 | 43 | - | |
| 4 | 9 | 10 | 17 | 36 | - | |
| | ||||||
| Total (t + c) = 247 | ||||||
| | ||||||
La cantidad total de embriones contabilizados en los subcultivos fue de 183 normales y 24 anormales para 21 d en el medio de inducción y 239 normales con 54 anormales para 28 d en el medio de inducción. Esto representa en ambos casos un alto porcentaje de embriones normales (88,4% y 81,5%, respectivamente) en relación con los anormales (11,6% y 18,4%, respectivamente).
Asimismo, pudo observarse que a medida que se realizaba un mayor número de subcultivos a medio básico, el número de embriones anormales disminuyó, asociándose con la disminución del contenido endógeno de reguladores de crecimiento al que fueron expuestos los explantes.
En el primer subcultivo con 21 d en el medio de inducción de callo se logró un total de 72 embriones normales, mientras que en los subcultivos siguientes (segundo al cuarto) este valor alcanzó un total de 111 embriones. Considerando que cada subcultivo tiene una duración aproximada de 60 d, puede notarse que la cantidad total de embriones producidos en el primer subcultivo es relativamente alta con relación al tiempo (72 embriones en 60 d vs. 111 en 180 d). Tomando en cuenta este aspecto en programas de mejoramiento de onoto, sería innecesario el uso de subcultivos para la formación de embriones secundarios ya que con un solo subcultivo se obtiene un número relativamente alto, logrando así reducir tiempo y costos.
Todos los embriones somáticos maduros obtenidos en el medio IV donde sólo se usó medio básico, mostraron tanto expansión cotiledonar como elongación de raíces. Las primeras hojas verdaderas (nomófilos) se desarrollaron a los dos meses siguientes de su cultivo en el medio IV.
De los embriones normales en fase de torpedo y cotiledonar, que sumaron 247, se obtuvieron 73 plántulas normales, de las cuales 31 alcanzaron un desarrollo completo (con la presencia de ambos ejes: caulinar y radicular) y 42 incompleto (con ausencia de uno de los ejes). Las completas presentaron buen desarrollo del ápice caulinar, con nomófilos totalmente expandidos y desarrollo radicular bien definido con una raíz principal y formación de raíces secundarias simultáneamente (Figura 5a, b). En promedio, la longitud de la parte aérea alcanzó un valor de 2,27 cm, la longitud de la raíz principal 5,77 cm y el número de hojas por plántula fue de 5,55.
Por otra parte, las incompletas, fueron de dos tipos, 14 con presencia del eje caulinar sin formación de raíces, con una longitud promedio de 2,25 cm y 3 hojas (Figura 5c) y 28 con formación de raíz principal sin el eje caulinar promedio de 3,75 cm de largo (Figura 5d, e). La falta de un meristema apical y un polo radicular es común en los embriones somáticos, tanto en dicotiledóneas como en monocotiledóneas (Barwale et al., 1986) y ello está asociado con una supresión del desarrollo (Goebel-Tourand et al., 1993).
FIGURA 5. Plántulas normales obtenidas a partir de embriones somáticos de onoto, (a, b) plántula completa con formación de ambos ejes, (c) plántula con eje caulinar sin formación de raíces, (d, e) plántula con desarrollo de raíz sin eje caulinar.
Aunque la morfogénesis de plantas vía embriogénesis somática presenta en su etapa inicial de desarrollo una estructura bipolar con raíz y vástago en polos opuestos en un mismo eje (Gómez, 1998; Menéndez, 1993), los protocolos para la embriogénesis somática pueden presentar limitaciones en programas de propagación clonal y mejoramiento de plantas debido a la baja frecuencia de conversión en plantas normales (Chengalrayan et al., 1997). Esta limitante generalmente ha sido atribuida a anormalidades morfológicas o inmadurez de los embriones somáticos (Ammirato, 1987).
Para incrementar la frecuencia de recuperación de plantas se han probado diferentes medios de germinación de embriones. En maní, Arachis hipogea L., se logró que embriones somáticos morfológicamente anormales germinaran y produjeran raíces en un medio libre de reguladores; asimismo, se observó la emergencia de brotes caulinares a partir de embriones enraizados con plumulas no desarrolladas, en un medio que presentaba la combinación de BA y Kin, así como TDZ sólo (Chengalrayan et al., 1997). En el caso de onoto, se deberán probar nuevas combinaciones de reguladores de crecimiento en el medio de germinación de embriones para incrementar la frecuencia de conversión en plantas normales completas.
También se observaron 30 plántulas anormales, las cuales presentaron ápices dobles, hojas alargadas gruesas y arrepolladas, raíces bifurcadas, sin la presencia de una estructura bipolar claramente definida. En otros cultivos también se han presentado anormalidades morfológicas en las plántulas obtenidas tales como fasciación de cotiledones, fasciación de embriones en el extremo radicular y/o fasciación a lo largo del eje embrional (Chengalrayan et al., 1997).
Al comparar el número de plántulas obtenidas a partir de los embriones torpedo y cotiledonar, de 247 embriones de plantas de onoto, se desarrollaron 73 plántulas normales y 30 anormales, lo que representa un 30% de eficiencia de formación de plántulas normales. En cultivos Vitis latifolia L., se han presentado valores de 13,7% de conversión de embriones somáticos a plántulas completas (Salunke et al., 1999). Aunque esto podría considerarse un valor relativamente bajo, se debe tomar en cuenta que bajo condiciones in vitro se optimiza el espacio.
En el trabajo se pudo comprobar que la embriogénesis somática en onoto a partir de cultivo de anteras estuvo afectada por diversos factores. El tipo de explante y ambiente físico usado fue determinante en la respuesta observada, evidenciándose una respuesta embriogénica exclusivamente cuando las anteras fueron separadas en tecas y bajo condiciones de oscuridad a una temperatura de 30 ± 1 ºC, respectivamente. Asimismo, se demostró que es genotipo-dependiente porque de 19 genotipos evaluados en sólo tres se evidenció la presencia de embriones somáticos.
Es importante destacar el papel de los medios de cultivo y los reguladores de crecimiento, ya que su efecto sobre la formación de callo e inducción de embriones únicamente estuvo presente cuando se utilizaron las sales MS suplementadas con 4 mg l-1 de ANA y 2 mg l-1 de BA. En otros trabajos también se ha demostrado el efecto de diversos factores sobre la respuesta androgénica. En tomate, Lycopersicon esculentum Mill., por ejemplo, se probaron más de 20 medios de cultivo que incluyeron la combinación de nueve reguladores de crecimiento, de los cuales sólo dos fueron más favorables para la inducción de callo, organogénesis y regeneración de plántulas.
Igualmente se consideraron otros factores como condiciones de crecimiento de la planta madre, tamaño de antera, estado de desarrollo de la microspora y pretratamientos a los botones florales con diferentes temperaturas (Shtereva et al., 1998). En onoto, el protocolo obtenido permitió la regeneración eficiente de plántulas mediante la embriogénesis somática a partir de cultivo de anteras.
AGRADECIMIENTO
Los autores desean expresar su agradecimiento al Centro de Investigaciones en Biotecnología Agrícola (CIBA) de la Facultad de Agronomía, UCV, donde se llevó a cabo el trabajo.
BIBLIOGRAFÍA
1. AMMIRATO, P. 1987 Organizational events during somatic embryogenesis. In: Plant tissue and cell culture. C.E. Green, D.A. Somers, W. P. Hackett y D. D. Biesboer (Eds.). Ed. Ala R. Liss, Inc., New York. pp. 57-81. [ Links ]
2. ARCE, P. 1990. Recomendaciones para el cultivo del achiote (Bixa orellana L.). Programa de mejoramiento de cultivos tropicales. Turrialba, CATIE. 70 p. [ Links ]
3. BARWALE, U., H. KERNS and J. WIDHOLM. 1986. Plant regeneration from callus culture of several soybean genotypes via embryogenesis and organogenesis. Planta 167:473-481. [ Links ]
4. CHENGALRAYAN, K., V. MHASKE and S. HAZRA. 1997. High-frecuency conversion of abnormal peanut somatic embryos. Plant Cell Reports 16:783-786. [ Links ]
5. CHI, C., H. VITS, J. ESTABA, T. COOKE and W. HU. 1994. Morphological kinetics and distribution in somatic embryo cultures. Biotechnology and Bioengineering 44:368-378. [ Links ]
6. DSOUZA, M. and M. SHARON. 2001. In vitro clonal propagation of annatto (Bixa orellana L.). In Vitro Plant 37(2):168-172. [ Links ]
7. GAMBORG, O., R. MILLER and J. OJIMA. 1968. Nutrient requirements of suspension cultures of soybean root cells. Exp Cell Res 50:151-158. [ Links ]
8. GEORGE, E. 1993. Plant propagation by tissue culture. Part 1. The technology. Exegetics Ltd., 2nd edition. Great Britain. 574 p. [ Links ]
9. GOEBEL-TOURAND, I., M. MAURO, L. SOSSOUNTZOV, E. MIGINIAC and A. DELOIRE. 1993. Arrest of somatic embryo development in grapevine: histological characterization and the effect of ABA, BAP and zeatin in stimulating plant development. Plant Cell Tissue Organ Cult 33:91-103. [ Links ]
10. GÓMEZ, R. 1998. Embriogénesis somática. In: Propagación y mejora genética de plantas por biotecnología. J. N. Pérez Ponce (ed.). Santa Clara, Cuba. pp. 57-79. [ Links ]
11. LUNA, S. 1987. Cultivo de anteras y polen. In: Cultivo de tejidos vegetales. Daniel Hurtado y María Eugenia Merino. Editorial Trillas. México. [ Links ]
12. MENÉNDEZ, A. 1993. Estudio de los eventos morfogénicos en la embriogénesis somática del café. Tesis de Doctorado en Ciencias. Caracas, Ven. Universidad Central de Venezuela. Facultad de Ciencias. 169 p. [ Links ]
13. MICHELANGELI, C. and M. ATACHO. 1996. Plant regeneration and micropropagation of annatto (Bixa orellana L.). Part II. Journal of the Society for in Vitro Biology. In Vitro Cellular and Developmental Biology 32(3):106 A. [ Links ]
14. MICHELANGELI, C., A. MEDINA, P. ARTIOLI y J. MATA. 2002. Microsporogénesis y microgametogénesis de onoto (Bixa orellana L.). Acta Científica Venezolana 53(3) (en prensa). [ Links ]
15. MORAES-FERNANDES, M., A. STIVAL, S. PATUSSI e M. FERRARI. 1999. Haplodiploidização: genética y melhoramento. In: Cultura de tecidos e transformação genética de plantas. Volume 2. Antonio Carlos Torres, Linda Styer Caldas y José Amauri Buso, eds. Empresa Brasileira de Pesquisa Agropecuária. pp. 613-650. [ Links ]
16. MURASHIGE, T. and F. SKOOG. 1962. A revised medium for rapid growth and bioassay with tobacco tissue cultures. Physiol. Plant. 15:473-497. [ Links ]
17. NITSCH, J. and C. NITSCH. 1969. Haploid plants from pollen grains. Science 163:85-87. [ Links ]
18. ROCA, W., V. NÚÑEZ y K. MORNAN. 1991. Cultivo de anteras y mejoramiento de plantas. In: Cultivo de tejidos en la agricultura. Fundamentos y aplicaciones. Roca, W. y Mroginski, L. (eds). CIAT, Cali, Colombia. pp. 271-294. [ Links ]
19. SALUNKE, C., P. RAO and M. MHATRE. 1999. Plantlet regeneration via somatic embryogenesis in anther callus of Vitis latifolia L. Plant Cell reports 18: 670-673. [ Links ]
20. SMITH, J. and R. SHULTES. 1990. Deforastation and shrinking crops genepools in Amazonia. Environmental Conservation 17(3):227-234. [ Links ]
21. SHTEREVA, L., N. ZAGORSKA, B. DIMITROV, M. KRULEVA and H. OANH. 1998. Induced androgenesis in tomato (Lycopersicon esculentum Mill.). II: Factors affecting induction of androgenesis. Plant Cell reports 18:312-317. [ Links ]
22. TAMAYO, N. 1997. Efecto del tidiazurón y el picloram sobre la morfogénesis in vitro del onoto (Bixa orellana L.). Tesis de Grado. Maracay, Ven. Universidad Central de Venezuela. Facultad de Agronomía. 67 p. [ Links ]
Nota:
*Trabajo financiado por el Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT)