Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agronomía Tropical
versión impresa ISSN 0002-192X
Agronomía Trop. v.58 n.3 Maracay sep. 2008
Micorrizas arbusculares y bacterias promotoras de crecimiento vegetal, biofertilizantes nativos de sistemas agrícolas bajo manejo conservacionista 1
Marcia Toro*, Ignacio Bazó* y Marisol López**
1 Trabajo financiado por FONACIT y del Proyecto de Manejo de Suelos Ácidos del INIA, financiado por la Agencia Internacional de Energía Atómica (AIEA). Estos resultados forman parte del proyecto S1-2000000649.
* Profesores. UCV. Facultad de Ciencias. Laboratorio de Estudios Ambientales. Instituto de Zoología Tropical, Caracas 1041-A
** Investigadora. INIA-CENIAP). Maracay-Venezuela. Email: mlopez@inia.gob.ve
RESUMEN
Los suelos de sabanas poseen baja fertilidad natural: pH ácido, bajos tenores de P, N y materia orgánica, son Oxisol o Ultisol con sistemas agrícolas que han recibido fertilización química para la productividad de los cultivos, agotando las propiedades biológicas de los suelos. Para mejorar ésta condición se aplicaron prácticas conservacionistas: siembra de abonos verdes y fertilización química con roca fosfórica, de lenta solubilidad en un sistema agrícola de Espino, Guárico. El impacto del manejo sobre la microbiota se utilizó como indicadores a microorganismos tipo biofertilizante: hongos de micorriza arbuscular (Glomales) y bacterias solubilizadoras de fosfato cálcico; se evaluó su presencia en la rizósfera de Sorghum bicolor como cultivo tipo en 2 períodos separados por 3 años de manejo. El control más favorable a estos microorganismos propiciará su presencia en la rizósfera y la colonización por micorrizas del sorgo (MS). La MS mostró valores bajos (2-8% LRM) durante el 1er año de medición. Posiblemente el impacto del manejo y la fertilización química disminuyó el potencial infectivo de micorrizas en el suelo. Al cabo de 3 años la colonización por MS incrementó levemente (6-15% LRM), y el número de esporas disminuyó (169-315 esporas/100 g suelo). Un incremento, aunque leve, de este valor (169-235 esporas/ 100 g suelo) se registró en ausencia de residuos, resaltando la importancia de la vegetación natural como fuente de colonización por MS. A 3 años de manejo incrementó la proporción de bacterias solubilizadoras de fosfato cálcico en la rizósfera del sorgo en presencia de las leguminosas (1,8.105 ufc/g suelo). Se identificaron las bacterias Pseudomonas fluorescens, Bacillus circulans y Burkholderia cepacia como solubilizadoras de fósforo autóctonas de estos suelos.
Palabras Clave: Micorriza arbuscular; biofertilizantes; rhizobacterias; suelos ácidos; manejo conservacionista; sorgo.
Arbuscular mycorrhizae and plant growth promoting rhizobacteria, biofertilizers from sustainable agricultural systems 1
SUMMARY
Savanna soils have natural low fertility, acid pH and low levels of N, P and organic matter content. Most of these soils are Oxisols or Ultisols and sustain agricultural systems that have been intensively fertilized affecting biological properties of soils. To improve this condition, conservation practices like green manures and addition of slow release phosphate fertilizers (rock phosphates) have been applied in an agroecosystem located in Espino, Guárico state. To observe the impact of this management practice on the soil we monitored Glomalean arbuscular mycorrhizal (AM) fungi and calcium phosphate solubilizing bacteria in Sorghum bicolor rhizosphere after three years of cultivation under these conditions. Most favorable management will increase phosphate solubilizing bacteria populations and intensity of Sorghum mycorrhizal colonization. Sorghum mycorrhizal colonization was low during the first year (2-8% Root Length Mycorrhization, RLM). Former fertilization and management could influence the low colonization capacity of soil natural inoculums. After three years, Sorghum mycorhizal colonization slightly increased (6-15% RLM) and number of spores decreased (169-315 spores/100 g soil). A slight increase of this parameter was only observed when green manure was absent (169-235 spores/100 g soil), meaning that natural vegetation positively affected AM fungal spores abundance. When legume manure was applied, phosphate solubilizing bacteria populations increased in Sorghum rhizosphere (1,8.105 cfu/g soil). Pseudomonas fluorescens, Bacillus circulans y Burkholderia cepacia were identified as acid soils autochthonous phosphate solubilizing bacteria.
Key Words: Arbuscular mycorrhiza; biofertilizers; rhizobacterias; acid soils; sustainable management.
RECIBIDO: agosto 16, 2006 APROBADO: enero 24, 2008
INTRODUCCIÓN
En Venezuela los ecosistemas de sabana constituyen las zonas de uso potencial para la agricultura. Sus suelos se caracterizan por tener baja fertilidad natural: pH ácido, bajos tenores de P y N y poca materia orgánica. Son en mayoría del tipo Oxisol ó Ultisol (López-Gutiérrez et al., 2001). El manejo tradicional de estos ecosistemas ha involucrado la fertilización química con fuentes solubles, el uso de maquinaria para acondicionamiento del suelo y el establecimiento de monocultivos, esto ha llevado a un desgaste y erosión de los suelos de sabana.
Una alternativa de manejo para mejorar el estado nutricional de los suelos es el uso de mecanismos biológicos que permitan restituir su fertilidad, sin perturbar y/o empeorar su condición (Dodd et al., 1990). Entre estos mecanismos se podrían nombrar las asociaciones simbióticas como las micorrizas arbusculares (MA) especializadas en la captación de fósforo de la solución del suelo; la asociación con Rhizobium, bacterias gram negativas que se asocian a las leguminosas, especializadas en la captación del N2 y otros microorganismos habitantes de la rizósfera, con capacidad de movilizar a través de la solubilización elementos poco abundantes, como el fósforo (Barea y Azcón-Aguilar, 1983; Kucey et al., 1989).
Con la finalidad de estudiar la presencia de estos microorganismos en sistemas agrícolas tropicales y determinar el impacto que podría tener el tipo de manejo aplicado al sistema sobre las poblaciones, se estudio la riqueza de simbiontes: MA y de bacterias solubilizadoras de fosfato en una sabana natural ubicada en la localidad de Espino, estado Guárico.
El manejo conservacionista aplicado consistió en sembrar coberturas como abonos verdes: leguminosas, gramíneas, vegetación natural y aplicar fertilización química: roca fosfórica, fosfato diamónico y una mezcla de azufre con roca fosfórica, en combinaciones diferentes. Una vez cortadas las coberturas sus residuos se incorporan al suelo, y posteriormente se siembra el cultivo problema: Sorghum bicolor, cultivar Chaguaramas VII.
Este manejo se aplicó durante cuatro años, comparando este tiempo con el relacionado al primer año de manejo la colonización por MA del cultivo, el número de esporas de hongos Glomales y las poblaciones de bacterias con capacidad de solubilizar fosfatos. El manejo más favorable a la biología del suelo favorecerá la reproducción de los propágulos de la MA, la colonización por MA del sorgo y la abundancia de las bacterias solubilizadoras de fosfato en la rizósfera del cultivo S. bicolor.
MATERIALES Y MÉTODOS
Área de estudio: una altiplanicie de mesa en el municipio Espino, Finca "El Silbón", estado Guárico aproximadamente entre las coordenadas: 8°32" N y 66°05".
Establecimiento de las parcelas experimentales: se sembraron los abonos verdes de la leguminosa Crotalaria juncea y de la gramínea S. bicolor, cultivar Chaguaramas VII. Estos abonos se dejaron sobre la superficie del suelo y se incorporan al mismo antes de sembrar el cultivo indicador: S. bicolor, cultivar Chaguaramas VII. Dicha incorporación se realizó mediante un pase de rotocultor calibrado a aproximadamente 10 cm de profundidad. Posteriormente se aplicaron los tratamientos de fertilización: T1, T2, T3 y T4 los cuales se especificarán más adelante. Se utilizó un diseño de bloques al azar y parcelas divididas, con 4 repeticiones para cada tratamiento.
Los tratamientos orgánicos o de abonos verdes fueron los siguientes:
Sin Residuos (SR): en esta parcela no se incorporan coberturas utilizadas como abono orgánico. Después de la cosecha, la biomasa aérea es extraída. El suelo queda descubierto al inicio del período de lluvias, simulando el sobrepastoreo.
Residuos Gramínea (RG): Consiste en sembrar el S. bicolor cultivar Chaguaramas VII y al llegar la floración, se corta la biomasa aérea y se deja sobre la superficie hasta ser incorporada al suelo por el rotocultor antes de la siembra del cultivo indicador para el próximo ciclo.
Residuos de Leguminosa (RL): En ésta parcela la especie C. juncea fue la leguminosa introducida como abono verde.
Residuos Naturales (RN): Consiste en cortar la parte aérea de la vegetación natural y dejarla en el suelo para ser incorporados por el rotocultor. Este tratamiento sólo se aplicó a partir del segundo año, por lo cual no mostramos sus resultados en el año 1 de medición.
Las parcelas de los tratamientos SR, RG, RL y RN recibieron la siguiente fertilización inorgánica: T1: N+K+0P; T2: N+K+P (Roca Fosfórica Riecito); T3: N+K+P (Roca Fosfórica Acidulada) y T4: N+K+P (Fosfato Diamónico). Adicionalmente se aplicaron las fuentes de nutrimentos siguientes: Nitrógeno: en forma de urea; Potasio: como cloruro de potasio; Fósforo: en las formas siguientes, Roca Fosfórica de Riecito (RFR baja solubilidad), Fosfopoder (RFA, mediana solubilidad) y Fosfato diamónico (FDA, alta solubilidad).
Determinaciones sobre MA y microbiológicas: Para determinar el impacto de las prácticas agronómicas aplicadas durante los años 2001 y 2004 se estudiaron en la rizósfera del sorgo sembrado en cada parcela: el % longitud de raíz micorrizada (%LRM) según la tinción de raíces (Phillips y Hayman, 1970) y la cuantificación según Giovanetti y Mosse (1980), número de esporas hongos glomales/100 g suelo (Sieverding, 1991). También las poblaciones de bacterias solubilizadoras de fosfato (Toro et al., 2001).
Análisis estadístico: Se realizó la prueba de homogeneidad de varianza para analizar las variables de cuantificación de micorrizas y poblaciones microbianas, aplicando un ANOVA de una vía. Las diferencias significativas se evidenciaron colocando un asterisco al lado de cada resultado.
RESULTADOS Y DISCUSIÓN
La longitud de raíz micorrizada en S. bicolor mostró valores muy bajos (2-8% LRM) durante el primer año de medición (Cuadro 1) e incrementó ligeramente luego de 3 años de aplicación de los tratamientos (Cuadro 2).
CUADRO 1. Porcentaje de longitud de raíz micorrizada (%LRM) y número de esporas viables en 100 g de suelo rizosférico de Sorghum bicolor para el año 2001.
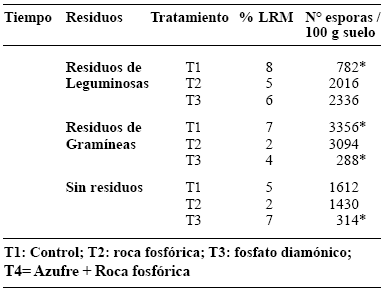
* Indica diferencias significativas a través de la prueba de ANOVA por la desviación estándar registrada.
CUADRO 2. Porcentaje de longitud de raíz micorrizada (%LRM) de Sorghum bicolor y número de esporas viables en 100 g de suelo para el año 2004, a tres años de establecido el cultivo.
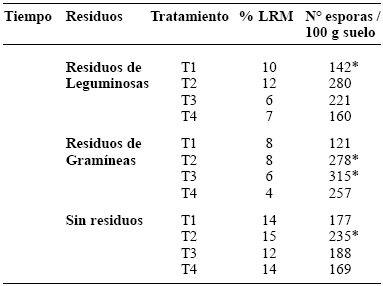
* Indica diferencias significativas a través de la prueba de ANOVA por la desviación estándar registrada.
A pesar del leve incremento (hasta 15% LRM) de algunos tratamientos después de 3 años de medición (todos los sembrados en la condición SR), en ninguna de las mediciones se obtuvieron valores que permitan considerar una colonización notable en las raíces del sorgo (50% o mayor de LRM).
La colonización radical por MA puede producirse a partir de los siguientes propágulos infectivos: esporas y micelio de los hongos Glomales; raicillas de las plantas colonizadas por micorrizas presentes en el suelo (Sieverding, 1991).
Considerando el bajo valor de %LRM que alcanzó el sorgo en cada caso (2-8% LRM), se concluye que: 1) la densidad natural de propágalos infectivos de la MA en la sabana eran originalmente bajos.
2) el manejo agronómico al que estuvo sometido el agrosistema antes de la implantación del manejo sustentable al que se somete ahora, habría sido perjudicial a dichos propágulos afectando su cantidad inicial, no siendo evidente aún el efecto de la aplicación de los abonos verdes.
La preparación del suelo para el establecimiento de las parcelas con los tratamientos de abonos verdes y fertilización requirió de un pre-tratamiento que incluyó deforestación de la vegetación y acondicionamiento del suelo, lo cual puede causar un impacto negativo en la abundancia de los propágulos de MA (Toro y López-Hernández, 1998).
Todo lo expuesto anteriormente junto con el efecto de fertilización química, puede haber disminuido el potencial infectivo de MA en el suelo, incidiendo en el bajo %LRM registrado en el sorgo en todos los tratamientos (Cuadro 1).
En sus trabajos, Dodd et al. (1990), Bethlenfalvay y Linderman (1992), Sieverding (1991) y Tarafdar y Rao (2002) indicaron que el tipo de manejo agronómico que haya recibido el sistema puede favorecer o no la abundancia de propágulos de la MA. El tenor de este valor está directamente relacionado con el %LRM de las plantas.
El número de esporas de hongos Glomales/100 g suelo disminuyó en todos los tratamientos para la medición a los 3 años de manejo, lo cual también indicaría la afectación de este propágulo por el manejo aplicado.
También es importante considerar que la presencia de la MA está relacionada con el contenido de fósforo en el suelo (Barea, 2001; López-Gutiérrez et al., 2001). Por lo general, bajos contenidos de fósforo en el suelo favorecen el establecimiento de la simbiosis micorrízica incrementando la colonización de las raíces de las plantas y favoreciendo la reproducción de las esporas; por el contrario, un alto contenido de fósforo en el suelo incide en la disminución de la simbiosis en las raíces de las plantas (Bowen y Rovira, 1999; Barea, 2001).
En este caso, se considera que los tratamientos de fertilización fosforada pudieron afectar el establecimiento de la MA en el sorgo, lo cual en combinación con la intensidad de manejo agronómico aplicado habría incidido en el bajo % de colonización por MA (2-8% LRM durante el primer año de medición) y la disminución del número de esporas (hasta 121 esporas/ g suelo, en el tratamiento T1 con residuo de gramíneas).
Un leve incremento del %LRM del sorgo se registró en todos los tratamientos SR (Cuadro 2) en la segunda medición, indicando que aún en ausencia de siembra de abonos verdes y aplicación de tratamientos de fertilización, la micotrofía de la vegetación natural puede haber favorecido la colonización por MA del cultivo problema.
El manejo conservacionista tiene efectos importantes sobre la condición del suelo, que serían más evidentes a medida que pase el tiempo de aplicación. Desde el punto de vista nutricional, al incrementarse el contenido de elementos y materia orgánica del suelo. Desde el punto de vista biológico afectando positivamente a las MA. La siembra de coberturas, el corte de la parte aérea y su posterior incorporación al suelo dejando in situ las raíces de las plantas, traerá como consecuencia inmediata el enriquecimiento progresivo del banco de raicillas colonizadas por MA en la zona de siembra del cultivo.
En la medida en que la planta tenga una mayor micotrofía ó afinidad por la MA, la colonización por MA de las raicillas será mayor; por lo tanto, una selección adecuada de las especies utilizadas como coberturas o abonos verdes permitirá incrementar el banco de raicillas en el suelo y su poder de micorrización (Toro y López-Hernandez, 1998). Asimismo, ello permitiría producir un incremento del número de esporas de los hongos Glomales y de su micelio en la rizósfera de las plantas. En consecuencia se incrementó el potencial infectivo por MA del suelo, así al paso del tiempo, en el suelo manejado de manera conservacionista habrá una condición cada vez más favorable a la colonización por MA de las raíces de las plantas que vayan a sembrarse como cultivo problema (Sieverding, 1991).
En este caso, muy posiblemente sea necesario un mayor tiempo de aplicación de las prácticas conservacionistas y la disminución de las dosis de fósforo aplicadas como fertilizante para observar un efecto positivo en los propágulos infectivos de la MA en las diferentes parcelas, particularmente el %LRM y el número de esporas.
Es importante considerar que aunque las prácticas conservacionistas aplicadas puedan favorecer la presencia de las MA en los suelos, el conocido efecto positivo sobre los cultivos: incremento de biomasa y producción de la planta, se lograría aplicando micorrizas nativas como biofertilizantes (Dodd, 1999; Sylvia, 1999). Ello permitiría que una mayor cantidad de propágulos infectivos de MA estén en contacto con la raíz y el establecimiento exitoso de la simbiosis.
Aunque el manejo conservacionista aplicado favoreció algunos de los parámetros biológicos del suelo considerados en este estudio, éste debe venir acompañado de la aplicación de la MA como inoculante (Sylvia, 1999) y de la regulación de la cantidad de fósforo en el suelo para facilitar que el cultivo establezca la simbiosis micorrízica y tenga mayor productividad (Hamel, 1996; Sánchez y Salinas, 1983). Este hecho comprende la aplicación de nuevas tecnologías en la agricultura que redundarán en la obtención de agroecosistemas sustentables con suelos más sanos y en beneficio económico para los productores.
A 3 años de manejo se determinó un incremento en la proporción de bacterias solubilizadoras de fosfato cálcico en la rizósfera del sorgo (Cuadro 3). La presencia de este tipo de bacterias resulta altamente favorecedora para el movimiento de elementos en el suelo, pues gracias a su capacidad de solubilización de fosfatos insolubles como el fosfato cálcico, aumenta el contenido de fósforo disponible en la solución del suelo y mejora la condición nutricional de la planta (Bowen y Rovira, 1999; Curl y Truelove, 1986; Casanova et al., 2002).
CUADRO 3. Abundancia de bacterias totales y solubilizadoras de fosfato cálcico (ufc/g suelo) en la rizósfera del cultivo indicador: Sorghum bicolor, antes del corte en los años 2001 y 2004 (a 1 y 3 años, respectivamente, de establecido el cultivo).
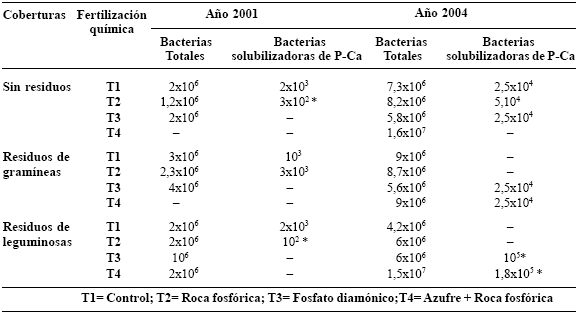
* Indica diferencias significativas a través de la prueba de ANOVA por la desviación estándar registrada.
La presencia de las leguminosas como cobertura incidió en las poblaciones de éstas bacterias. Probablemente la riqueza en exudados rizosféricos de las leguminosas y/ o en nutrimentos minerales favoreció este aspecto (Andrade, 1999). Se identificaron las especies Pseudomonas fluorescens, Bacillus circulans y Burkholderia cepacia como bacterias capaces de solubilizar fosfato cálcico. Estas bacterias han sido descritas por varios autores con alta capacidad solubilizadora de fosfatos (Curl y Truelove, 1986; Kucey et al., 1989; Kloepper y Beauchamp, 1992) y de eficiente interacción con las MA (Andrade, 1999; Toro et al., 1997). Su presencia en los suelos estudiados indicarían la idoneidad de su utilización como biofertilizantes en los agroecosistemas tropicales de suelos ácidos.
CONCLUSIONES
-A tres años de aplicación del manejo conservacionista, los parámetros %LRM y número de esporas de hongos Glomales no se favorecieron significativamente. Posiblemente se requiera un mayor lapso de tiempo de observación para que estos parámetros muestren un incremento.
-El manejo aplicado favoreció la presencia de bacterias solubilizadoras de fosfato en la rizósfera de S. bicolor, las cuales pudieron ser identificadas y aisladas para su futura utilización como biofertilizantes.
-La presencia de estas bacterias en la rizósfera de los cultivos es beneficiosa, pues favorecen la movilización de nutrimentos poco disponibles como el fósforo para el consumo de la planta. Estos resultados permiten sugerir la aplicación de un manejo conservacionista integrado que involucre el mejoramiento de las condiciones biológicas del suelo, la aplicación de MA como inoculante en combinación con la disminución de los tenores de fósforo en el suelo a través de la fertilización química.
-Una combinación de la fertilización química y biológica que permita evidenciar el efecto de los microorganismos y una racional aplicación de las enmiendas químicas conducirán hacia el verdadero manejo sustentable de los agroecosistemas.
BIBLIOGRAFÍA
1. Andrade, G. 1999. Interacciones microbianas en la rizósfera. In: Soil fertility, soil biology and plant nutrition interrelationships. Siqueira, J.; Moreira, F.; Lopes, A.; Guilherme, L.; Faquin, V.; Furtini Neto, A. and Carvalho, J. Editors. Sociedade Brasileira de Ciência do solo, Lavras, Brasil. 551-576 p. [ Links ]
2. Barea, J. M. 2001. Interacciones ecológicas de los microorganismos en el suelo y sus implicaciones en agricultura. In: Labrador Moreno, J. y Altieri, M.A. Agroecologìa y desarrollo. Aproximación a los fundamentos agroecològicos para la gestión sustentable de agroecosistemas mediterráneos. Ediciones Mundiprensa, Cáceres, 165-184 p. [ Links ]
3. Barea, J. M and C. Azcón-Aguilar. 1983. Mycorrhizas and their significance in nodulating nitrogen-fixing plants. Advances in Agronomy 36:1-54 p. [ Links ]
4. Bethlenfalvay, G. J. and R. G. Linderman. 1992. Mycorrhizae in sustainable agriculture. ASA. Spec. Publ, Madison, Wisconsin. [ Links ]
5. Bowen, G. D. and A. D. Rovira. 1999. The rhizosphere and its management to improve plant growth. Advances in Agronomy 66:1-102 p. [ Links ]
6. Casanova, E., A. M. Salas and M. Toro. 2002. The use of nuclear and related techniques for evaluating the agronomic effectiveness of phosphate fertilizers, in particular rock phosphate, in Venezuela: initial available P and its changes in soils amended with rock phosphate. Nutrient Cycling in Agroecosystems. 63:13-20. [ Links ]
7. Curl, E.A. and B. Truelove. 1986. The rhizosphere. Springer-Verlag (Eds). Berlín. 323 p. [ Links ]
8. Dodd, J. C. 1999. Recent advances in understanding the role of arbuscular micorrizas in plant production. In: Soil fertility, soil biology and plant nutrition interrelationships. Siqueira, J.; Moreira, F.; Lopes, A.; Guilherme, L.; Faquin, V.; Furtini Neto, A. and Carvalho, J. Editors. Sociedade Brasileira de Ciência do solo, Lavras, Brasil. 687-704 p. [ Links ]
9. Dodd. J.C., I. Arias, I. Koomen, D.S. Hayman. 1990. The management of populations of vesicular arbuscular mycorrhizal fungi in acid-infertile soils of a savanna ecosystem. Plant and Soil. 122:229-240. [ Links ]
10. Giovanetti. M., B. Mosse. 1980. An evaluation of techniques for measuring vesicular-arbuscular infection in roots. New Phytologist. 84:489-500. [ Links ]
11. Hamel, C. 1996. Prospects and problems pertaining to the management of arbuscular mycorrhizae in agricultura. Agric. Ecosyst. Environm. 60:197-210. [ Links ]
12. Kloepper, J.W., C. Beauchamp. 1992. A review of issues related to measuring colonization of plants roots by bacteria. Canadian Journal of Microbiology 38:1 219-1 232. [ Links ]
13. Kucey R. M.N., H.H. Janzen, Leggett, M.E. 1989. Microbially mediated increases in plant-available phosphorus. Advances in Agronomy. 42:199-228. [ Links ]
14. López-Gutiérrez. J.C., M. Toro, D. López-Hernández. 2001. Micorrizas arbusculares y actividades enzimáticas en la rizósfera de Trachypogon plumosus Ness en tres sabanas de suelos ácidos. Acta Biológica Venezuelica. 21:49-57. [ Links ]
15. Phillips. J.M., D.S. Hayman. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society. 55:158-161. [ Links ]
16. Sánchez. P., G. Salinas. 1983. Suelos ácidos y estrategias para su manejo con bajos insumos en América Tropical. SCCS. Bogota, Colombia. 93 p. [ Links ]
17. Sieverding, E. 1991. Vesicular-Arbuscular mycorrhiza management in tropical agrosystems. GTZ, Germany, 371 p. [ Links ]
18. Sylvia, D. 1999. Fundamentals and applications of arbuscular mycorrhizae: a biofertilizer perspective. In: Soil fertility, soil biology and plant nutrition interrelationships. Siqueira, J.; Moreira, F.; Lopes, A.; Guilherme, L.; Faquin, V.; Furtini Neto, A. and Carvalho, J. Editors. Sociedade Brasileira de Ciência do solo, Lavras, Brasil. 705-724 p. [ Links ]
19. Tarafdar, J. C. and A. Rao. V. 2002. Possible Role of Arbuscular Mycorrhizal Fungi in Development of Soil Structure. In: Arbuscular Mycorrhizae. Interactions in Plants, Rhizosphere and Soils. Sharma, A.K. and Johri, B.N. Editores. Science Publishers, Inc. Enfield, USA. 186-206 p. [ Links ]
20. Toro. M., Azcón, R., J.M. Barea. 1997. Improvement of Arbusular Mycorrhizal development by inoculation with Phosphate Solubilizing Rhizobacteria to benefit rock phosphate bioavailability (32P) and nutrient cycling. Applied and Environmental Microbiology. 63(11):4 408-4 412. [ Links ]
21. Toro. M., Blones, J., I. Hernández-Valencia. 2001. Dinámica del fósforo y actividad biológica en las micorrizósferas de dos ecosistemas adyacentes con vegetación y suelos contrastantes. Acta Biol. Venez. 21(2):21-28. [ Links ]
22. Toro, M. y D. López-Hernández. 1998. Potencialidades del manejo de las Micorrizas Arbusculares para el desarrollo sostenido de los sistemas agrícolas de bajos insumos del ecotono sabana-bosque amazónico. In: Carrillo, R J. (Compilador). Memorias del IV Congreso Interamericano sobre el medio ambiente realizado en Caracas, Venezuela, entre el 8 y 11 de diciembre de 1997. Colección Simposia. p. 222-227. [ Links ]













