Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agronomía Tropical
versão impressa ISSN 0002-192X
Agronomía Trop. v.60 n.2 Maracay jun. 2010
Efecto de Fusarium Sp. en la germinación, fenología y supervivencia de plántulas de Leucaena leucocephala (lam.) de wit
Jorge A. Borges* y July Urdaneta*
*Investigadores. INIA. CIAE Yaracuy. San Felipe, estado Yaracuy. E-mail: jborges@inia.gob.ve; jurdaneta@inia.gob.ve
RESUMEN
La semilla de Leucaena leucocephala (Lam.) de Wit es infectada por diversos hongos, destacando Fusarium sp. En el presente trabajo se evaluó el efecto de este hongo sobre la germinación, fenología y supervivencia en plántulas emergidas de semillas de L. leucocephala colonizadas . El material fue colectado y llevado al laboratorio donde se procedió a determinar el organismo, resultando ser Fusarium sp. Se distribuyeron muestras de semillas en dos tratamientos: semillas sana (T1) y semilla colonizada (T2), sembrándose en bandejas con sustrato bajo arreglo completamente al azar con cinco repeticiones . Se evaluó diariamente la germinación y semanalmente el número de hojas (NH), número de nudos (NN), ramas primarias (RP), altura de plántulas (AP) y tasa absoluta de crecimiento (TAC). Paralelamente, se evaluó la supervivencia de las plántulas emergidas (SPE). Para la germinación se observaron diferencias altamente significativas entre los tratamientos , con mayor porcentaje de semillas sanas germinadas 80% en relación a las colonizadas por el hongo 46,6%. En cuanto a fenología se encontraron diferencias entre T1 y T2 en NN (3,0 y 2,6), RP (2,7 y 2,4) y AP (11,10 y 10,66 cm), respectivamente. La TAC para RP y NN presentó un crecimiento lento durante el período de evaluación. También se observó mortalidad de plántulas en el T2 asociada con sintomatología característica del patógeno. Se concluye que Fusarium sp., tiene un efecto negativo al disminuir en más de un 50% la germinación de semillas de L. leucocephala colonizadas y retrasar el crecimiento de las plántulas emergidas.
Palabras Clave: Fusarium sp.; germinación; Leucaena leucocephala (Lam.) de Wit; patógeno; variables fenológicas.
Effect of Fusarium Sp. in the germination, fenology and survival of Leucaena leucocephala (lam.) de wit seedling
SUMMARY
Seeds of Leucaena leucocephala (Lam.) of Wit is infested by diverse fungi, among which Fusarium sp. In this study it was evaluated the effect of this fungus on germination, fenology and seedling survival emerged from seeds of L. leucocephala colonized. The material was collected and taken to the laboratory where proceeded to determine the fungus, proving Fusarium sp. Seed samples were distributed in two treatments: healthy seeds (T1) and colonized seeds (T2), planted in germination trays under a completely randomized design with fi ve replications. Germination was evaluated daily and weekly the number of leaves (NL), number of nodes (NN), primary branches (PR), seedling height (SH) and absolute rate of growth (ARG). We also evaluated the survival of seedlings emerged. Highly signifi cant differences were observed for germination between treatments, with greater healthy percentage of seeds germinated (80%) in relation to the colonized by the fungus (46.6%). Phenology differences were found between T1 and T2 in NN (3.0 and 2.6), RP (2.7 and 2.4) and SH (11.10 and 10.66), respectively. The ARG for RP and NN presented a slow growing during the evaluation period. It was also noted seedling mortality in T2 associated with the symptoms of the pathogen. We conclude that Fusarium sp. has a negative effect by reducing more than 50% germination of seeds of sL. leucocephala colonized and slow growth seedlings emerged.
Key Words: Fusarium sp.; germination; Leucaena leucocephala (Lam.) de Wit; pathogen; phenological variables.
RECIBIDO: julio 19, 2009 ACEPTADO: junio 04, 2010
INTRODUCCIÓN
La Leucaena leucocephala (Lam.) de Wit. constituye actualmente una de las leguminosas arbóreas más utilizadas en los sistemas de producción animal. Su propagación se realiza mediante semillas sexuales, las cuales están dotadas de una testa dura e impermeable al agua. A pesar de su alta viabilidad, hasta un 100% de aquellas semillas de L. leucocephala no sometidas a tratamiento de escarificación, apenas alcanzan un porcentaje de germinación entre 7 a 12%, incrementándose su dureza con el tiempo de almacenamiento (Arriojas, 1986).
Sin embargo, la semilla botánica es infectada por diversos microorganismos entre los que sobresalen los hongos (Lezcano, 2005). Las infecciones producidas en sus tejidos internos pueden ser generadas por hongos que contagian la testa al encontrar condiciones de alta humedad y puntos de penetración (heridas). En el caso de hongos colonizadores de semillas , se requieren que éstas posean un contenido de agua de 23% y una humedad relativa ambiental entre el 90 y 100% para que los mismos puedan crecer con un amplio rango de temperatura entre 0 y 30 ºC, aunque algunos pueden desarrollarse a 35 ºC o más (Christensen, 1987).
Así mismo, entre estos hongos se destaca el género Fusarium, que además de ser un organismo saprófito, también es considerado patógeno de esta leguminosa forrajera (Arguedas et al., 1999).
Varios autores señalan la presencia de Fusarium sp. en semillas de Leucaena, formando parte de la micoflora de éstas (Chagas y Oliveira, 1983; Lezcano, 2005), afectando el poder germinativo y desarrollo de las plántulas (Chaluat y Perris, 1994). También es responsable de causar pudrición en semillas germinadas, plántulas y vainas (Moreno et al., 1988; Alonso et al., 1996; Arguedas et al., 1999; Lezcano, 2005).
Ante lo expuesto, surge la necesidad de evaluar el efecto Fusarium sp. sobre la germinación, fenología y supervivencia de las plántulas emergidas (SPE) de L. leucocephala colonizadas por el hongo.
MATERIALES Y MÉTODOS
Las vainas de Leucaena se recolectaron de un banco de proteína establecido dentro de una finca ubicada en el municipio Manuel Monge, estado Yaracuy, zona caracterizada como bosque seco tropical, según la clasificación de Holdridge (1967).
El banco de Leucaena se estableció en febrero del 2007, en un área total de 2.700 m2.
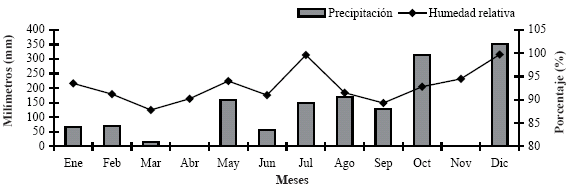
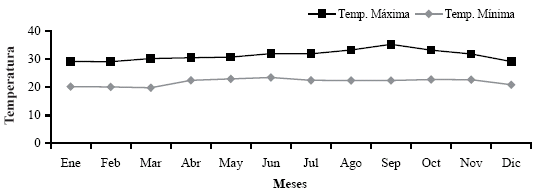
Para el 2008 se contó con una precipitación total anual de 1.479,8 mm y promedio mensual de 134,5 mm, humedad relativa de 92,9%, con temperatura anual de 25,3 ºC, distribuidas mensualmente como se indican en las Figuras 1 y 2.
FIGURA 1. Comportamiento de la precipitación y humedad relativa durante el año 2008, para el municipio Manuel Monge, estado Yaracuy.
FIGURA 2. Rangos de temperatura observada durante el año 2008 para el municipio Manuel Monge, estado Yaracuy.
La recolección de vainas se realizó en mayo del 2008, aproximadamente para la segunda temporada reproductiva de la plantación, donde se observaron síntomas de presencia fúngica en la mayoría de ellas, procediéndose a realizar un muestreo aleatorio en la totalidad del área sembrada, eligiendo las maduras que aún cerradas, presentaron síntomas o signos de colo ni zación fúngica (presencia de micelio y esporas).
El material colectado se llevó al Laboratorio Integral Agropecuario del Instituto Nacional de Investigaciones Agrícolas, ubicado en el estado Yaracuy (INIA-Yaracuy), colocando muestras de vainas y semillas en cámara húmeda durante 8 d, en condiciones de 12 h luz más 2 h oscuridad, induciendo la producción de estructuras fúngicas que permitieron su posterior determinación.
Transcurrido este tiempo, se observó el crecimiento de micelio algodonoso con variaciones de color entre crema -amarillo-naranja. Se revisó este material bajo el microscopio de luz a 40X de aumento , evidenciando la formación de estructuras miceliales entramadas con presencia de células conidiógenas y clamidosporas, macroconidios sueltos y delgados en forma de agujas, pluriseptados entre cinco y seis. Se empleó la clave descrita por Carrillo (2003) para identificar las estructuras reproductivas, las cuales coincidieron con las características para el género Fusarium.
Una vez determinado el patógeno, se extrajeron las semillas de las vainas y se tomaron muestras que se distribuyeron en dos tratamientos, T1: unas aparentemente sanas y T2: otras colonizadas por Fusarium sp. Por cada tratamiento se utilizaron cinco repeticiones con 10 semillas en representación del 100% de la muestra.
La escarificación de las semillas se realizó sumergiéndolas en agua a 80 ºC durante 3 min y luego se dejaron hidratar en agua a temperatura ambiente durante 90 min; ésto, mejoró la germinación debido a sus características tegumentarias. En este período se procedió a sembrarlas por tratamiento en bandejas de germinación para hortalizas , empleando el sustrato comercial Sogemix VT-M y colocando una por celda.
Al día siguiente, luego de la siembra se comenzó a evaluar la germinación de ambos tratamientos con frecuencia diaria, para determinar la tasa de emergencia de las plántulas (TG), empleando la siguiente ecuación: TG = (N1*T1 + N2*T2 + Nn*Tn x número de semillas germinadas), donde N: número de semillas germi nadas no acumuladas y T: tiempo en días).
Posterior a la germinación y durante seis semanas consecutivas se evaluaron: número de hojas (NH), número de nudos (NN), ramas primarias (RP) y altura de las plántulas (AP); así como, la SPE a lo largo del estudio.
Así mismo, se evaluó la tasa absoluta de crecimiento para las variables en ambos tratamientos, utilizando la fórmula descrita por Sánchez et al. (2003):
Unidad de variable (t2) – unidad de variable (t1) TAC= t2-t1
Donde:
TAC: tasa absoluta de crecimiento
Unidad de variable: altura de plántulas, número de hojas , ramas primarias y número de nudos.
t2: fecha del último muestreo (días)
t1: fecha del primer muestreo (días)
El diseño experimental fue hecho completamente al azar con cinco repeticiones. Para el procesamiento de los datos se empleó un análisis de varianza, aplicando la prueba de Tukey para la separación de medias.
RESULTADOS Y DISCUSIÓN
La germinación fue del tipo epigea, se inició a los 4 días después de la siembra (DDS), estabilizándose a los 15 DDS, presentando diferencias altamente significativas (P<0,001) entre los tratamientos y mayor porcentaje de semillas sanas germinadas con relación a las colonizadas por el hongo (Cuadro 1), coincidiendo este resultado con Moreno et al. (1988).
CUADRO 1. Efecto de Fusarium sp. sobre la germinación de semillas de L. leucocephala.

No obstante , este comportamiento difiere a lo indicado por Alonso et al. (1996), evidenciando que no hubo efecto alguno de Fusarium sp. sobre la germinación y viabilidad de las semillas contaminadas; apreciándose que T2 se acerca a la reportada por Razz y Clavero (1996), quienes reportaron un 49,71% de germinación en semillas sanas con un tratamiento pregerminativo similar al empleado en este trabajo, permitiendo inferir que un bajo nivel de infección del hongo sobre el embrión pudiera estar relacionado con la dura e impermeable testa que lo protege.
En las semillas no germinadas correspondientes al T2 se evidenció pudrición y la aparición de micelio blancocrema, posteriormente en aislamiento se determinó la presencia de Fusarium sp. en concordancia con lo señalado por Lezcano (2005) para semillas de esta especie forrajera.
En cuanto a las variables fenológicas se observaron diferencias entre los tratamientos para las variables en estudio , excepto para NH (Cuadro 2). Valores de NH y AP aquí encontrados coinciden con los indicados por Sánchez y Ramírez (2006), quienes aplicando un tratamiento pregerminativo similar, obtuvieron valores de 11,16 cm para AP y 4,17 para NH.
CUADRO 2. Promedios generales, frecuencias y tasa absoluta de crecimiento en plántulas de L. leucocephala provenientes de semillas sanas y colonizadas por Fusarium sp.
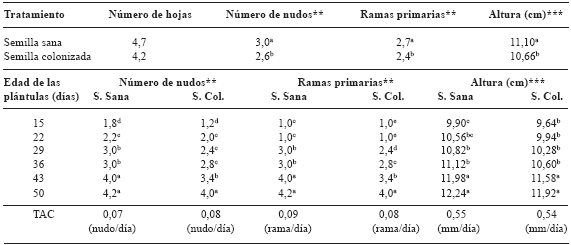
En contraposición, Guevara y Guenni (2004) señalaron alturas promedios para plántulas de L. leucocephala entre 5,42 y 5,82 cm a los 15 DDS, valores bajos en comparación con los encontrados en este trabajo a la misma edad, aún en plántulas provenientes de semillas afectadas por Fusarium sp.
Esto coincide con los últimos autores quienes señalan que a más altura de plántulas, no indica un mayor número de estructuras vegetativas presentes; observándose que la tasa absoluta de crecimiento para RP y NN, muestran un desarrollo lento durante la etapa de estable cimiento en ambos tratamientos, con promedios de 0,075 nudo/día para NN y 0,085 rama/día para RP; este último es igual o superior a los indicados por Sánchez et al. (2003) en la fase de establecimiento, confi riéndole una baja capacidad de competencia por la disponibilidad de nutrimentos con respecto a otras plantas más agresivas.
La supervivencia de las plántulas nacidas de semillas colonizadas, se ve comprometida al presentar mortalidad, ocurridas entre los 36 y 43 DDS, relacionada directamente con el patógeno, mediante comprobación por reaislamiento del mismo, en cuya sintomatología se aprecian lesiones blancas en los cotiledones y hojas verdaderas , así como pudrición en la base del tallo.
Esta sintomatología coincide con lo señalado por Arguedas et al. (1999), quienes concluyeron que sembrar semillas contaminadas con Fusarium sp., que favorece la aparición del mal del talluelo postemer gente mejor conocido como Damping off, así como, la contaminación del sustrato y la diseminación de enfermedades en el campo, considerando principalmente que éste es un hongo saprófito del suelo.
CONCLUSIÓN
- Se concluye que Fusarium sp., como organismo saprófito facultativo colonizando semillas de L. leucocephala, tiene un efecto negativo al disminuir en más de un 50% la germinación y retardar el crecimiento de las plántulas emergidas, comprometiendo su estabilidad durante las primeras etapas de evolución, así como su posterior desarrollo y supervivencia en condiciones de campo.
- Se comprobó su patogenicidad en las plántulas al presentarse pudrición y muerte de las mismas, asociadas directamente a la aparición de este hongo.
BIBLIOGRAFÍA
1. Alonso, O., A. Delgado y S. Sánchez. 1996. Hongos asociados a las semillas de una leguminosa tropical (Leucaena leucocephala cv. Perú). Pastos y Forrajes 19(2):161-168. [ Links ]
2. Arguedas M., M. Jiménez y C. Millar. 1999. Microorganismos asociados a semillas de especies forestales en Costa Rica. In: Salazar R. (Ed.). Segundo Simposio sobre Avances en la Producción de Semillas Fores tales en América Latina. Sto. Domingo, Repú blica Dominicana. 18 al 22 Octubre, 1999. CATIE. [ Links ]
3. Arriojas, L. I. 1986. Leucaena leucocephala como planta forrajera. In: Rodríguez I. 2002. Leucaena leucocephala, uso y bondades. Talleres de Universo Gráfico C. P. Valera – Venezuela. 61 p. [ Links ]
4. Carrillo, L. 2003. Los hongos de los alimentos y forrajes . Ediciones Universidad Nacional de Salta, Argentina . ISBN 987-9381-19-X. 128 p. [ Links ]
5. Chagas, D. y D.P. Oliveira. 1983. Fungos asociados a sementes de gramineas e leguminosas forrageiras. Fitopatología Brasileira 8(1):131-135. [ Links ]
6. Chaluat, M. M. y S. Perris. 1994. Hongos patógenos en semillas de especies forrajeras tropicales. Pasturas Tropicales. 16(1):41-43. [ Links ]
7. Christensen, C. M. 1987. Field and storage fungi. In: Carrillo L. 2003. Los hongos de los alimentos y forrajes . Ediciones Universidad Nacional de Salta, Argentina. ISBN 987-9381-19-X. 128 p. [ Links ]
8. Guevara, E. y O. Guenni. 2004. Acumulación de biomasa y patrón de crecimiento en Leucaena leucocephala (Lam.) de Wit., durante la fase de esta blecimiento. II. Estructura y patrón de crecimiento aéreo. Zootecnia Trop. 22(3):231-240. [ Links ]
9. Holdridge, L. R. 1967. Life zone ecology. Tropical Science Center. San José, Costa Rica. [ Links ]
10. Lezcano, J. C. 2005. Micoflora asociada a semillas almacenadas de Leucaena leucocephala cv. Perú. Revista de Protección Vegetal 20(2):140. (Resumen) [ Links ]
11. Moreno, J., C.G. Torres y J.M. Lenné. 1988. Reconocimiento y evaluación de enfermedades de Leucaena en el Valle del Cauca, Colombia. Pasturas Tropicales 9(3):30-35. [ Links ]
12. Razz, R. y T. Clavero. 1996. Métodos de escarifi cación de semillas de Humboldtiella ferruginea y Leucaena leucocephala. Rev. Fac. Agron. (LUZ) 13(1):73-77. [ Links ]
13. Sánchez, A., O. Miquilena y R. Flores. 2003. Comportamiento de Leucaena leucocephala durante el establecimiento regada por goteo artesanal en ambiente semiárido. Rev. Fac. Agron. (LUZ) 20(3):352-363. [ Links ]
14. Sánchez-Paz, Y. y M. Ramírez-Villalobos. 2006. Tratamientos pregerminativos en semillas de Leucaena leucocephala (Lam.) de Wit. y Prosopis julifl ora (Sw.) DC. Rev. Fac. Agron. (LUZ) 23(3):257-272. [ Links ]