Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622versión On-line ISSN 2309-5806
ALAN v.56 n.1 Caracas mar. 2006
Disminución de homocisteína plasmática con vitaminas B6, B12 y ácido fólico. Su efecto en la concentración de los lípidos en pacientes con hiperlipoproteinemia secundaria tipo IV, con y sin tratamiento con Lovastatina.
Garcés P Antonio, Morón de Salim Alba, Garcés Anthony y Garcés Albert
Universidad de Carabobo. Dpto. de Bioquímica. Escuela de Medicina. Facultad de Ciencias de la Salud - Valencia. Venezuela.
Correspondencia: Centro de Investigaciones en Nutrición. (CEINUT) Apartado Postal 3458. Valencia 2002-A Edo Carabobo. Tef. 8210157.
Resumen
Se disminuyó la concentración de homocisteina plasmática mediante el uso oral de vitaminas B6 (300 mg/día), B12 (250μg/dνa) y ácido fólico (10 mg/día), y se estudió su efecto en los lípidos de pacientes con hiperlipoproteinemia secundaria tipo IV, durante 120 días, en 30 pacientes, de 45 a 70 años de edad, con infarto al miocardio. Se dividieron en grupo A (n=15) sin tratamiento con Lovastatina y grupo B (n=15) con el hipolipemiante. La homocisteina basal fue de 17,4±1,0 μmol/L y 16,7±1,0 µmol/L para los grupos A y B respectivamente, disminuyendo un 24% al final del tiempo experimental, en ambos grupos. El colesterol total se redujo por debajo de 220 mg/dl, mientras que los triglicéridos disminuyeron 25,4 mg/dl y 27,0 mg/dl en los grupos A y B respectivamente, por cada µmol/L de homocisteina catabolizada. Las lipoproteínas de baja densidad (LDL) y de muy baja densidad (VLDL) disminuyeron significativamente (p<0,005), mientras que las de alta densidad (HDL) se incrementaron en 1,0 mg/dl para el grupo A y 1,15 mg/dl para el grupo B, por cada μmol/L de homocisteina metabolizada, disminuyendo el riesgo coronario en un 28,5% grupo A y 35,9% grupo B. Se concluye que estas vitaminas disminuyen la concentración de homocisteína plasmática, promoviendo la disminución de la concentración de lípidos y lipoproteínas en este tipo de pacientes; mientras que la Lovastatina no reduce la concentración plasmática del aminoácido; pero si ejerce un efecto sinérgico con las vitaminas en la disminución de la concentración de los lípidos, en el grupo B.
Palabras claves: homocisteina, lípidos, Lovastatina
Lowering plasma homocysteine with vitamins B6, B12 and folic acid. Effect on lipids concentration in patients with secondary hyperlipoproteinemia type IV, with and without Lovastatina treatment
Summary
The concentration of plasma homocysteine was diminished by the oral use of vitamins B6 (300 mg/day), B12 (250μg/day) and folic acid (10 mg/day), and the effect was studied in the lipids of patient with hiperlipoproteinemia secondary type IV, during 120 days, in 30 patients, 45 to 70 years old, with myocardial heart attack. They were divided in group A (n=15) without treatment with Lovastatin and group B (n=15) with Lovastatin. Basal homocysteine concentration was 17,4±1,0 µmol/L and 16,7±1,0 µmol/L for the groups A and B respectively, diminishing 24% at the end of the experimental time, in both groups. Total cholesterol decreased below 220 mg/dl, while the triglycerides diminished 25,4 mg/dl and 27,0 mg/dl in groups A and B respectively, by each µmol/L of homocysteine catabolissed. Low density lipoproteins (LDL) and very low density (VLDL) diminished significantly (p<0,005), while the high-density (HDL) increased 1,0 mg/dl in group A and 1,15 mg/dl in group B, for each μmol/L of homocysteine metabolized, lowering the coronary risk factor in 28,5% group A and 35,9% group B. We concluded that these vitamins decreased plasma homocysteine concentration, promoting the lowering of lipids and lipoprotein concentratation in this type of patients; while Lovastatin doesn't reduce homocysteine, but it had a synergic effect with the vitamins, dincreasing the lipid concentration, in group B.
Key words: homocysteine, lipids, Lovastatina
Recibido: 24-08-2005 Aceptado: 29-03-2006
Introducción
Durante muchos años se ha pensado que el colesterol es el causante de las obstrucciones de las arterias; sin embargo, nunca se estableció una correlación definitiva entre los altos niveles de colesterol y los padecimientos del corazón, pues la mayoría de los infartos ocurren en personas con niveles de colesterol normal o ligeramente elevados (1), por lo que se ha relacionado a la homocisteína con los procesos proliferativos de la intima arterial que con frecuencia culminan en cardiopatía isquémica (2). La homocisteina es un aminoácido que proviene del catabolismo de la metionina; al ser transferido a la sangre éste se oxida rápidamente en el plasma liberándose en el proceso radicales de oxigeno libre en forma de iones superóxido y peróxido de hidrógeno, los cuales a su vez desencadenan la cascada del estrés oxidativo lo que conlleva a la oxidación de los lípidos de las membranas celulares endoteliales y en las LDL, alterando la estructura de las glicoproteinas que protegen la pared arterial (3-5). El primer estudio clínico que soportó esta teoría fue publicado por Wilcken y Wilcken en 1976 (6), quienes encontraron en pacientes con enfermedades de las arterias coronarias (EAC), elevadas concentraciones de homocisteina y sus derivados disulfuros. En 1996 McCully (7) reportó un ligero incremento de homocisteína en más de un 6% de la población en general, y demostró que este aminoácido daña las células del revestimiento vascular e interfiere en la dilatación y constricción de los vasos sanguíneos, favoreciendo de esta manera el endurecimiento de las arterias e impidiendo la irrigación de sangre al propio corazón. Posteriormente, una serie de estudios clínicos y epidemiológicos, asocian a la homocisteina con las enfermedades de las arterias coronarias, cerebrales y periféricas y de igual modo a las venas, demostrando que la homocisteina es un factor de riesgo independiente en las EAC (8-10).
Karmín y col. (11) demostraron que este aminoácido interfiere con la inhibición alostérica de la enzima hidroximetil-glutaril CoA (HGMCoA) reductasa por las LDL, por lo que un pequeño incremento en la concentración plasmática de homocisteina estimula la producción de colesterol, aumentando la citotoxicidad en las células endoteliales (12)(13); proliferación de células musculares lisas y plaquetas, así como la oxidación y modificación de las partículas LDL (14). La alteración de las lipoproteínas plasmáticas, debido al incremento de los niveles de homocisteina, ha sido observada en más de un 30% de los individuos diabéticos no insulino dependientes con enfermedades vasculares; siendo la ateroesclerosis la principal causa de muerte en estos pacientes (15)(16).
Se ha demostrado que dosis altas de vitaminas B6, B12 y ácido fólico, cofactores de las enzimas metionina sintetasa, 5-metil-tetrahidrofolato-homicisteina-S-metil transferasa, y cistationina β-sintetasa, incrementan el catabolismo de la homocisteína plasmática (17); de igual manera, el uso de altas dosis vitamínicas no sólo disminuye la concentración de homocisteina plasmática sino también los niveles de lípidos y lipoproteínas (18).
Se ha sugerido que el uso de algunos hipolipemiantes pudiesen incrementar los niveles de homocisteína (19) por lo que se investigó la disminución de la concentración de homocisteina plasmática con altas dosis de las vitaminas B6, B12 y ácido fólico y su efecto en los lípidos y lipoproteinas, en pacientes con hiperlipoproteinemia secundaria tipo IV, sin y con tratamiento con Lovastatina.
Materiales y Métodos
Se estudiaron 30 pacientes con hiperlipoproteinemia secundaria tipo IV, con edades entre 45 y 70 años. Por indicación médica, habían estado por varios años en tratamiento con Lovastatina, para reducir los niveles de colesterol mediante la inhibición de la enzima HMGCoA reductasa (20), ya que habían sufrido infarto al miocardio. De los 30 pacientes 15 habían dejado de tomar el hipolipemiante por mas de seis meses, por lo que fueron seleccionados para el estudio como grupo A (n=15) sin Lovastatina; el grupo considerado con Lovastatina, grupo B (n=15) mantenía un tratamiento con control médico particular, con 20 mg de Lovastatina por día, el cual se mantuvo durante el periodo experimental de 120 días. A los pacientes se les informó el objetivo del trabajo y dieron su consentimiento. Ambos grupos recibieron, a través de su médico tratante, cápsulas de vitamina B6 (300 mg); vitamina B12 (250 μg) y αcido fólico (10 mg) diarios por 120 días. En este estudio se utiliza la mitad de la dosis vitamínica utilizada en estudio previo (18), con el fin de observar la efectividad de la dosis, debido a que concentraciones bajas de estas vitaminas (dosis dietéticas) no se logra reducir efectivamente los niveles de homocisteina (21). Se mantuvo restringido el consumo excesivo de carbohidratos, los cuales se controlaron mediante la Hb-glicosilada, mensualmente.
Análisis de la muestra.
La sangre de los pacientes se extrajo después de un ayuno de 12 horas y se colectó en tubos que contenían una solución de ácido etilendiamino tetraacetico (EDTA) al 10%. Se tomaron muestras al inicio del suplemento vitamínico y a los 30, 60, 90 y 120 días siguientes. El plasma se separó centrifugando a 1800g. durante 15 minutos a temperatura ambiente, el sobrenadante fue colectado y se procedió a la determinación cuantitativa del colesterol total, colesterol de la LDL, colesterol de la HDL y triglicéridos; mediante el uso de los Kit de Wiener Lab. El colesterol VLDL se obtuvo por diferencia (C-total = C-LDL + C-HDL + C-VLDL). La determinación de homocisteina se realizó según el método de inmunoensayo enzimático de Frantzen y col (22) con el Kit de Bio-Rad Laboratories,USA.
Análisis estadístico.
Los resultados obtenidos fueron presentados como la media aritmética de los valores individuales obtenidos por duplicado en los grupos A (n=15) y B (n=15). Se usaron análisis estadísticos descriptivos, distribución de frecuencia, chi cuadrado, prueba de "t", y matriz de correlación de Pearson. Se aplicó un grado de confianza de p<0.005. Todos los datos fueron procesados mediante el programa estadístico SPSS versión 8.0.
Resultados
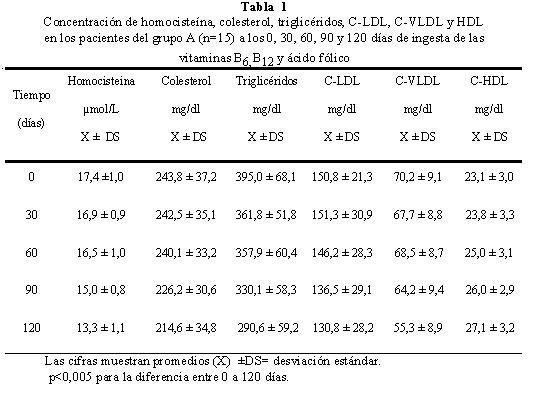
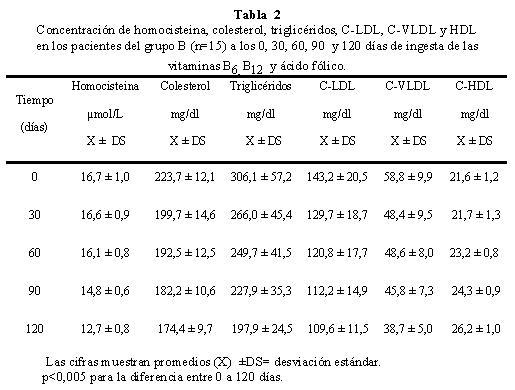
La concentración basal (día 0) promedio de homocisteina fue de 17,4 ± 1,0 μmol/L y 16,7± 1,0 μmol/L disminuyendo a los 120 días de iniciado el estudio, a 13,3 ± 1,1 μmol/L y 12,7 ± 0,8 μmol/L en los grupos A y B respectivamente. Para el colesterol total, el promedio basal fue de 243,8 ± 37,2 mg/dl para el grupo A y de 223,7 ± 12,1 mg/dl para el grupo B; después de 120 días las concentraciones de colesterol fueron de 214,6 ± 34,8 mg/dl y 174,4 ± 9,7 mg/dl respectivamente. (Tablas 1 y 2).
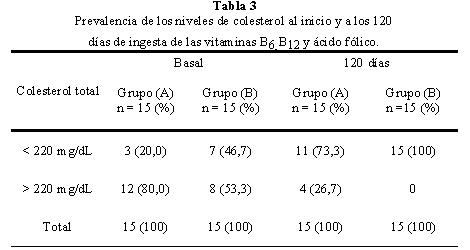
Se pudo observar, al inicio del periodo experimental, que la prevalencia de los niveles de colesterol por encima de 220 mg/dl fue de un 80% para el grupo A y de 53,3 % para el grupo B; transcurridos los 120 días, la prevalencia del colesterol fue del 26,7 % para el grupo A y del 0 % para el grupo B respectivamente (Tabla 3). La Figura 1 muestra el efecto de la disminución de la concentración plasmática de homocisteina en los niveles de colesterol, se observa que la disminución de los niveles de homocisteína en presencia del hipolipemiante (grupo B) ejerce un mayor efecto en los niveles de colesterol durante los primeros 30 días, a diferencia de los pacientes del grupo A, donde no se observaron cambios significativos durante el mismo periodo de tiempo. Sin embargo, tomando en cuenta el efecto durante el periodo experimental, por cada μmol/L de homocisteina que se reduce por acción de las vitaminas, la concentración de colesterol disminuye 8,5 mg/dl en el grupo A y 12,3 mg/dl en el grupo B, con una correlación de r=0,991 y r= 0,669 para el grupo A y B respectivamente, con p<0,005 para ambos grupos. Se observa que el efecto de la disminución de la homocisteina sobre el colesterol es mayor que el de la Lovastatina, posiblemente debido a la baja concentración del hipolipemiante utilizado.
La concentración promedio basal de triglicéridos fue de 395,0 ± 68,1 mg/dl para el grupo A y 306,1 ± 57,2 mg/dl para el grupo B. A los 120 días de iniciado el suplemento vitamínico las concentraciones promedio fueron de 290,6 ± 59,4 mg/dl y 197,9 ± 24,5 mg/dl respectivamente (Tablas 1 y 2). La prevalencia de los niveles de triglicéridos por encima de 165 mg/dl fue de 100% para ambos grupos (A y B) al inicio del estudio; transcurridos los 120 días fue de 100% para el grupo A y de 86,7% para el grupo B (Tabla 4).
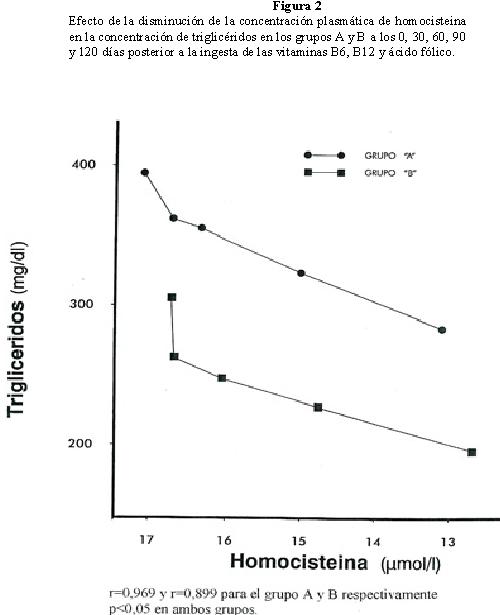
La correlación entre los niveles de homocisteina y la concentración de triglicéridos se presenta en la Figura 2; se observa un comportamiento similar en ambos grupos; por cada μmol/L de homocisteina que disminuye, la concentración de triglicéridos se reduce a 25,4 mg/dl en el grupo A y 27,0 mg/dl en el grupo B. La Lovastatina ejerció poco efecto sobre la concentración de los triglicéridos, con r=0,969 y r=0,899 para el grupo A y B respectivamente, y p<0,05 en ambos grupos.
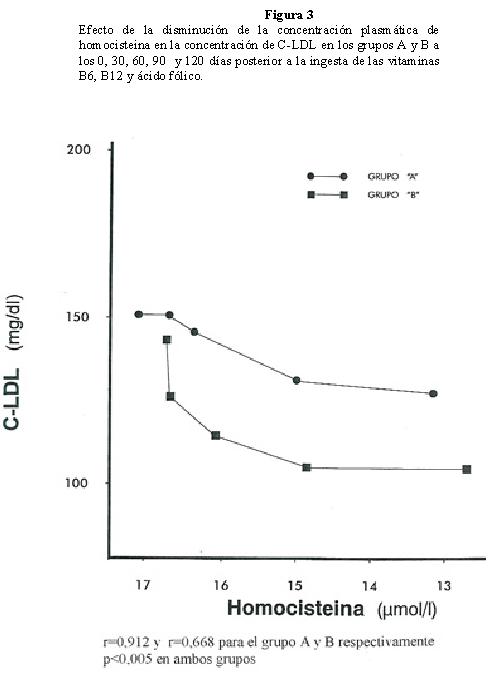
La concentración de colesterol de las C-LDL del grupo A disminuyó de un promedio de 150,8 ± 21,3 a 130,8 ± 28,2 mg/dl y en el grupo B de 143,2 ± 20,5 mg/dl, a 109,6 ± 11,5 mg/dl, al finalizar el periodo experimental (Tablas 1 y 2). Se observo una marcada reducción en el grupo B, con respecto al grupo A como consecuencia del efecto del hipolipemiante. En el grupo A no se observaron cambios significativos durante los primeros 30 días (p=0,753) y poco significativos hasta los 60 días (p=0,02), posteriormente, la disminución de la concentración de C-LDL fue más significativa (p<0,001), obteniéndose un promedio de 130,8 ± 28,2 mg/dl al finalizar los120 días. El efecto de la Lovastatina en el grupo B fue evidente desde el inicio hasta los 90 días, no siendo así entre los 90 y 120 días, cuyo cambio no fue significativo (p=0,217) (Figura 3). Se observó correlación entre los niveles de homocisteina y la concentración de C-LDL, con un r=0,912 para el grupo A y r=0,668 para el grupo B, p<0,005 para ambos grupos. La disminución de un μmol/L de homocisteina incide en la reducciσn de 4,8 mg/dl en las C-LDL en ausencia de Lovastatina, mientras que en presencia del hipolipemiante el efecto fue de 8,4 mg/dl.
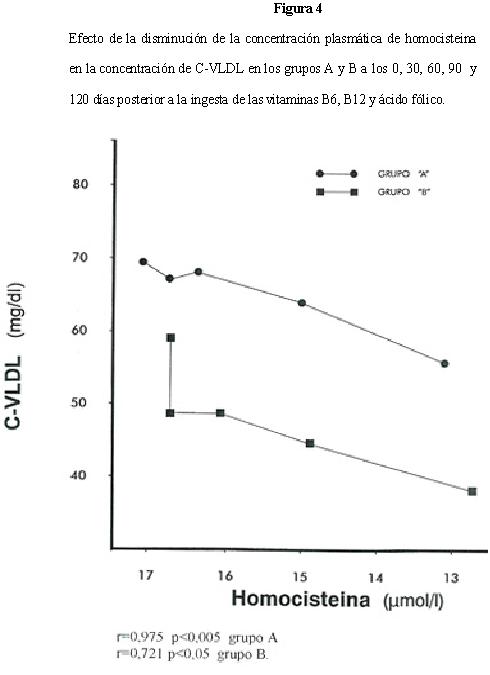
Los niveles de C-VLDL basal para los grupos A y B fueron de 70,2 ± 9,1 mg/dl y 55,8 ± 9,9 mg/dl respectivamente. Al finalizar los 120 días, la C-VLDL del grupo A fue de 55,3 ± 8,9 mg/dl y 38,7 ± 5,0 mg/dl para el grupo B (Tablas 1 y 2). En el grupo A, la variación no fue significativa p=0,286 durante los primeros 60 días, mientras que en el grupo B, la disminución fue proporcional en los primeros 30 días; no así, durante los 30 días siguientes p=0,923; observando una disminución hasta finalizar los 120 días (Figura 4). El efecto de la concentración de homocisteina sobre las niveles de C-VLDL fue lineal y proporcional en ambos grupos, lo que podemos inferir que el metabolismo de las C-VLDL no estuvo muy influenciado por la Lovastatina; ya que se observó una disminución de 3,6 mg/dl para el grupo A y 5,0 mg/dl para el grupo B por cada μmol/L de homocisteina que disminuye, con una correlación de r=0,975 y p<0,005 para el grupo A y de r=0,721 con una p<0,05 para el grupo B.
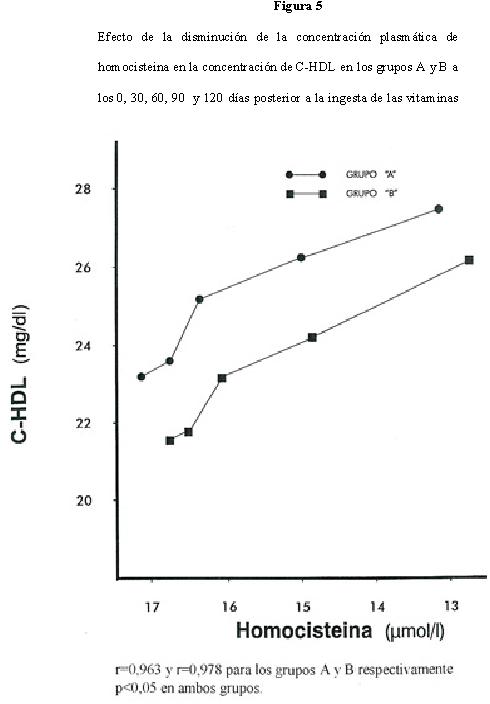
El valor de C-HDL basal para el grupo A fue de 23,1 ± 3,0 mg/dl y 21,6 ± 1,2 mg/dl para el grupo B alcanzando a los 120 días valores de 27,1 ± 3,2 mg/dl y 26,2 ± 1,0 mg/dl para los grupos A y B respectivamente. Los cambios de concentración durante el periodo experimental se muestran en la Tabla 1 y 2. No hubo variación significativa en los promedios de las concentraciones de C-HDL en los primeros 30 días en ambos grupos; posteriormente, el incremento de las C-HDL fue significativo (p<0,05). El efecto de la disminución de la homocisteina sobre la concentración de C-HDL fue lineal e inversamente proporcional para ambos grupos (Figura 5), con un coeficiente de correlación de r=0,963 y r=0,978 para los grupos A y B respectivamente y p<0,05 en ambos grupos. Por cada μmol/L de homocisteina que disminuye, se incrementa la C-HDL en l,0 mg/dl.
En cuanto a la relación colesterol total / C-HDL, considerado de alto riesgo cuando es > 7; el grupo A presentó un riesgo coronario basal de 10,5 ± 1,2 y el grupo B de 10,4 ± 0,8 disminuyendo progresivamente hasta alcanzar un valor de 7,9 ± 0,9 para el grupo A y 6,7 ±.0,5 para el grupo B al finalizar los 120 días del suplemento vitamínico.
Discusión
Resulta de vital importancia disminuir los niveles de homocisteina circulante en plasma, ya que existe una relación directa entre los altos niveles de homocisteína y los lípidos con la enfermedad arterial coronaria (23). Con las dosis de las vitaminas empleadas, la homocisteina en los pacientes estudiados disminuyó más de un 23% en ambos grupos durante el periodo de 120 días; resultados que concuerdan con estudios previos Morón de Salim y Garcés P (18), quienes utilizaron el doble de la concentración vitamínica, y con los observados por Franklin y col (24) y Meta-análisis (25), que utilizaron las vitaminas B6, B12 y ácido fólico para reducir los niveles de homocisteina plasmática en pacientes con enfermedades vasculares; mientras que Lobo y col (26) observaron una reducción del 30%, aunque Julios y col (27) reportaron una disminución de los niveles de homocisteina del 33% en pacientes hipercolesterolemicos. En el grupo B no se observó variación en la concentración de homocisteína en presencia de Lovastatina, lo que difiere de lo observado por Logerril y col (19) quienes sugirieron que algunos hipolipemiantes incrementan los niveles de este aminoácido.
Los elevados niveles de colesterol basal observados en el grupo A, pudieran deberse a que la homocisteina estimula la producción y secreción de colesterol en las células hepáticas (11), mientras que en el grupo B, la concentración de colesterol fue inferior debido al tratamiento previo con Lovastatina. Por otra parte el efecto de la disminución tardía del colesterol observado en el grupo A, pudiera deberse a la activación de la enzima cistationina sintetasa por el fosfato de piridoxal para formar cistationina que posteriormente se transforma en taurina, compuesto que activa la enzima 7-alfahidroxilasa hepática e incrementa el catabolismo del colesterol, vía ácidos biliares (28)(29), observando una reducción del colesterol del 12% para el grupo A y del 22% para el grupo B por el posible efecto sinérgico de las vitaminas y la Lovastatina.
El incremento basal de triglicéridos plasmáticos observado en ambos grupos, se traduce en un aumento de las VLDL, lo que concuerda con lo observado por De La Hoya y col. (1) en pacientes con hipertrigliceridemias endógenas, que incide negativamente en la síntesis de HDL (30). Se observó un incremento de C-HDL en 28,6% para el grupo A y 35,9% para el grupo B; la variación de un 7,3% pudiera deberse al efecto de la Lovastatina.
Podemos inferir que el uso de las vitaminas B12, B6 y ácido fólico no sólo disminuyen los niveles de homocisteina plasmática, sino que también ofrece un equilibrio entre los procesos de síntesis y degradación de las moléculas para la reproducción celular. Este equilibrio permite un uso controlado del colesterol para la función especifica en las membranas celulares y una utilización del colesterol remanente en la vía de la degradación biliar, lo que puede permitir conjuntamente con la Lovastatina la reducción del riesgo coronario, con un aumento de las HDL y una disminución de las LDL. En consecuencia, el colesterol total plasmático disminuye; mejorando la calidad de vida de los pacientes, que pudiera deberse al incremento del flujo sanguíneo (31).
Se puede concluir que la variabilidad del perfil lipídico es consecuencia del efecto de la concentración de homocisteína en plasma, el cual puede ser controlado con dosis vitamínicas mayores a los requerimientos en individuos normales. Por otra parte, la disminución de los niveles de colesterol plasmático por combinación de las vitaminas y la Lovastatina ejercerá un efecto preventivo más efectivo en reducir los niveles de LDL, para prevenir la formación de los procesos proliferativos de la intima arterial que con frecuencia culminan en cardiopatía isquémica.
Referencias
1. De La Hoya M., Mata P., Alvarez-Sala L., Rubio M., Zulueta P., Mariño M. y Castellon M. (1988). Alteraciones en la composición lipidica de las lipoproteínas en la hiperlipemia Drugs of Today 24:99-111 [ Links ]
2. Zylberstein DE, Bengtsson C., Bjorkelund C., Landaas S., Sundh V., Thelle D. and Lissner L (2004) Serum homocysteine in relation to mortality and morbidity from coronary heart disease: a 24-year follow-up of the population study of women in Gothenburg. Circulation. Feb 10; 109(5):601-606. [ Links ]
3. Hankey GJ. and Eikelboom J. (1999). Homocysteine and vascular disease. Lancet 354:407-413 [ Links ]
4. Jakubowski H (2000) Homocysteine thiolactone: Metabolic origin and protein homocysteinylaction in humans. Journal of Nutr. 130:3775-3815 [ Links ]
5. Nonaka H., Tsujino T., Watari Y., Emoto N., and Yokoyama M. (2001). Taurine prevents the decrease in expression and secretion and secretion of extracellular superoxide dismutase induce by homocysteine. Circulation 104:1165-1170 [ Links ]
6. Wilcken D. and Wilcken B. (1976) The pathogenesis of coronary artery disease. A possible role for methionine metabolism. J. Clin. Invest. 57:1079-1082 [ Links ]
7. McKully (1996) Homocysteine and vascular desease. Nat. Med 2:386-389 [ Links ]
8. Willinck W., Ludwig M., Lennrz M., Holler T. and Stumpe KO.(2000). High-normal serum homocysteine concentration are associated with an increased risk of early atherosclerotic carotid artery wall lesions in healthy subjects. J. Hypertens. 18(4): 425-430 [ Links ]
9. Vollset SE, Refsum H, Tverdal A, Nygard O, Nordrehaug JE, Tell GS. and Ueland PM. (2001) Plasma total homocysteine and cardiovascular and noncardiovascular mortality: the Hordaland Homocysteine Study. Am J Clin Nutr. 74(1):130-136 [ Links ]
10. Retterstol L, Paus B, Bohn M, Bakken A, Erikssen J, Malinow MR and Berg K. (2003) Plasma total homocysteine levels and prognosis in patients with previous premature myocardial infarction: a 10-year follow-up study. J Intern Med. 253(3):284-292 [ Links ]
11. Karmin O., Lynn E., Chung YH., Soiw YL., Man RY. and Choy PC. (1998). Homocysteine stimulates the production and secretion of cholesterol in hepatic cells. Bioch. Biophy. Acta 1393:317-324 [ Links ]
12. Wang X. (1999). A theory for the mechanism of homocysteine-induced vascular pathogenesis. Med. Hypotheses 53(5):386-394 [ Links ]
13. Stanger O. and Weger M. (2003) Interactions of homocysteine, nitric oxide, folate and radicals in the progressively damaged endothelium. Clin Chem Lab Med. Nov;41(11):1444-454. [ Links ]
14. Dardik D., Varon D., Tamarin I., Ziivelin A., Salomón O., Shenkman B. and Sabino N. (2000). Homocysteine and oxidized low density lipoprotein enhance platelet adhesion to endothelial cells under flow conditions: Distinct mechanisms of thrombogenic modulations. Thromb Haemost 83:338-344 [ Links ]
15. Becker A, Kostense PJ, Bos G, Heine RJ, Dekker JM, Nijpels G, Bouter LM and Stehouwer CD. (2003). Hyperhomocysteinaemia is associated with coronary events in type 2 diabetes. J Intern Med. Mar; 253(3):293-300 [ Links ]
16. Soinio M, Marniemi J, Laakso M, Lehto S. and Ronnemaa T. (2004). Elevated plasma homocysteine level is an independent predictor of coronary heart disease events in patients with type 2 diabetes mellitus. Ann Intern Med. Jan 20; 140(2):94-100 [ Links ]
17. Willems FF, Aengevaeren WR, Boers GH, Blom HJ. and Verheugt FW. (2002) Coronary endothelial function in hyperhomocysteinemia: improvement after treatment with folic acid and cobalamin in patients with coronary artery disease. J Am Coll Cardiol. Aug 21;40(4):766-772 [ Links ]
18. Morón de Salim AR y Garcés Pasamontes A. (2005) Efecto de la suplementación con las vitaminas B12, B6 y ácido fólico en los niveles de homocisteína y lípidos plasmáticos en pacientes con hiperlipoproteinemia secundaria tipo IV. Arch. Latinoamericanos de Nutr.55(1):28-33 [ Links ]
19. Lorgeril M., Salen P., Paillard F. Lacan P., Richard G. (1999). Lipid-lowering drugs and homocysteine. The Lancet 353(16):209-210 [ Links ]
20. McKenny JM. (1998a) Lovastatina: Anew cholesterol-lowering agent. Clin. Pharm. 7:21-36. [ Links ]
21. Scheneede J., Refsum H., Ueland P (2000) Biological environmental determinants of plasma homocysteine. Seminars in trombosis and hemostasis 26:263-280 [ Links ]
22. Frantzen F., Faaren AL., Alfheim I., Nordhei AK. (1998) Enzyme conversion immunoassay for determining total homocysteine in plasma or serum. Clin Chem 44:311-316 [ Links ]
23. Refsum H., Ueland P., Nygard O., Vollset S. (1998) Homocysteine and cardiovascular disease. Ann. Rev. Med. 49:31-62 [ Links ]
24. Franklin H. and Epstein M. (1998) Homocysteine and Atherothrombosis. The New England J. Med. 338:1042-1050 [ Links ]
25. Meta-analysis. (2000) Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis. JAMA 288(16):2015-2022. [ Links ]
26. Lobo A. Naso A. Arheart K., Kruger WD., Abou-ghazala T., Alsous F., Nahlawi M., Gupta A., Moustapha A., Van Lente F., Jacobsen DW. and Robinson K. (1999) Reduction of homocysteine levels in coronary artery disease by low-dose folic acid combined with vitamins B6 and B12. Am. J. Cardiol. 83(6):821-825. [ Links ]
27. Julius U., Pietzsch J., Gromeier S., Schorr H. and Herrmann W. (2001) Homocysteine levels in patients treated with lipid aphoresis: effect of a vitamin therapy. Eup J Clin Invest 31(8):667-671. [ Links ]
28. Murakami S., Kondo-Ohta Y. and Tomisawa K. (1999) Improvement in cholesterol metabolism mice given chronic treatment of Taurine and fed a high-fat diet. Life Sci 64:83-91 [ Links ]
29. Yokogoshi H. Mochizuki H. Manami K., Hida Y., Miyachi F. and Oda H. (1999) Dietary Taurine enhances cholesterol degradation and reduces serum and liver cholesterol concentracion in rats fed a high-cholesterol diet. J. Nutr 129:1705-1712 [ Links ]
30. Mathley RN. (1982) The cellular and molecular biology of plasma lipoproteins; altered by dietary fat and cholesterol. Med. Clin. Of North America 68:212-218. [ Links ]
31. Izzo M. (1995) Homocysteine and coronary artery disease. American Heart Association Meeting. Anaheim, Calif. Nov. 15 [ Links ]