Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos Latinoamericanos de Nutrición
Print version ISSN 0004-0622On-line version ISSN 2309-5806
ALAN vol.56 no.2 Caracas June 2006
Revisión de los métodos de evaluación de la actividad antioxidante in vitro del vino y valoración de sus efectos in vivo.
Mª Soledad Fernández-Pachón, Débora Villaño, Ana Mª Troncoso, Mª Carmen García-Parrilla
Facultad de Farmacia, Universidad de Sevilla. Sevilla. España
Resumen
El objetivo de esta revisión es el estudio de la actividad antioxidante del vino, analizando los distintos métodos que se han empleado en su evaluación. Esta actividad se relacionará, tanto desde el punto de vista cualitativo como cuantitativo, con el perfil de compuestos polifenólicos presentes en el vino. Los vinos tintos presentan actividades superiores a los blancos y la magnitud de dichos valores varía en función del método de análisis empleado. No existe un único compuesto polifenólico responsable mayoritariamente de la actividad antioxidante del vino, sino que ésta se explica por el conjunto de todos ellos. Para evaluar la influencia del consumo de vino tinto en el organismo humano se ha utilizado como biomarcador más frecuente la capacidad antioxidante del plasma, que incrementa su valor tras la ingesta del vino. Se expone que la evaluación de la actividad antioxidante in vitro del vino requiere el uso de diversos métodos que proporcionen una información diferente y complementaria. Los métodos in vivo tienen la ventaja de valorar las transformaciones metabólicas que sufren los fenoles en el organismo y que modifican su actividad. De los estudios realizados hasta la fecha se concluye que el vino interviene en la capacidad antioxidante del plasma de forma directa a través de sus compuestos polifenólicos e indirecta al aumentar la concentración plasmática de ácido úrico.
Palabras clave: Compuesto fenólico, vino, método de medida de actividad antioxidante, capacidad antioxidante del plasma, humano, ácido úrico
Review of the different methods for the evaluation of the in vitro antioxidant activity of wine and study of in vivo effects
Summary
There are many methods to evaluate the antioxidant activity of wine, both in vitro and in vivo. The aim of this paper is to evaluate the significance of these methods, as well as to correlate the antioxidant activity of wines with their phenolic profile, both in qualitative and quantitative terms. Red wines show higher antioxidant capacities than white ones and the magnitude of these differences depends on the method used. The antioxidant activity of wine can not be mainly ascribed to a particular phenolic compound, instead it is explained by the global interaction of all of them. To evaluate the influence of red wine consumption in the human organism, plasma antioxidant capacity has been frequently used as biomarker, and studies have shown that it increases after wine ingestion. We can conclude that it is necessary to use a battery of methods that provide different and complementary information to properly interpret the results. Phenolic compounds undergo metabolic transformations in the organism which modify their activities. In vivo assays do consider these changes. From the studies performed up to date we can conclude that acute ingestion of wine directly acts on plasma antioxidant capacity due to phenolic compounds and indirectly influences by means of changes on plasmatic concentration of endogenous antioxidants.
Keywords: Phenolic compound, wine, measurement method of antioxidant activity, plasma antioxidant capacity, human, uric acid.
Recibido: 17-01-2006
Aceptado: 27-04-2006
Introducción
Las Especies Reactivas de Oxígeno (ROS) son especies químicas radicales y no radicales que debido a su inestabilidad se comportan como agentes oxidantes. Las ROS pueden tener en nuestro organismo un origen endógeno relacionado con el metabolismo del oxígeno y con distintas reacciones de defensa de nuestro sistema inmunológico. También pueden provenir de fuentes externas: el tabaco, la contaminación del aire, la radiación ultravioleta y la de alta energía, el ozono o ciertos medicamentos. El organismo dispone de mecanismos de defensa antioxidante frente a las especies reactivas de oxígeno, que comprenden sistemas enzimáticos y no enzimáticos (1). Ciertas enzimas como superóxido dismutasa, catalasa, glutatión peroxidasa o glutatión reductasa, neutralizan las especies reactivas. Los sistemas defensivos no enzimáticos abarcan una serie de compuestos antioxidantes como albúmina, ceruloplasmina, transferrina, glutatión, bilirrubina, ácido úrico, ubiquinona o melatonina. En ciertas situaciones extremas, estas defensas no son suficientes y las especies reactivas producen daño oxidativo, tanto en biomoléculas como en componentes celulares (2-3).
El daño oxidativo se relaciona con el origen y desarrollo de ciertas enfermedades multifactoriales de carácter crónico, como la oxidación de las LDL y la enfermedad cardiovascular (4), el daño oxidativo al ADN y el cáncer (5-6) y la oxidación de las proteínas de las lentes oculares y la alteración de la visión (7-8).
La ingesta de alimentos ricos en sustancias antioxidantes como vitaminas C y E, carotenoides o compuestos fenólicos, previene o disminuye el desarrollo de estas enfermedades (9-12). Se cree que la dieta aumenta la defensa antioxidante del organismo evitando el daño oxidativo.
Los compuestos fenólicos son sustancias orgánicas ampliamente distribuidas en el reino vegetal. Se sintetizan como metabolitos secundarios con funciones de defensa, y son en gran medida responsables de las propiedades del color, la astringencia y el flavor (sabor y aroma) de los vegetales. Se encuentran en las verduras y frutas, y en productos derivados como el vino o la cerveza. Todos tienen en su estructura uno o más anillos aromáticos con al menos un sustituyente hidroxi (13). Su estructura química es propicia para secuestrar radicales libres, debido a la facilidad con la que el átomo de hidrógeno desde el grupo hidroxilo aromático puede ser donado a la especie radical, y a la estabilidad de la estructura quinona resultante que soporta un electrón desapareado (14).
La actividad antioxidante de los polifenoles depende del número y la localización de los grupos hidroxilo que contiene en su estructura (15-16).
Además de su actividad antioxidante, se han atribuido otras propiedades biológicas a los compuestos fenólicos: inhiben la agregación plaquetaria (17) y ejercen como agentes vasorrelajantes (18), antiinflamatorios (19) y anticancerígenos (11, 20-21).
Uvas y vinos presentan una gran variedad de compuestos fenólicos de muy diversas estructuras químicas y pesos moleculares, cuya cantidad total y la proporción en que aparecen dependen de una serie de factores, como la variedad de la uva, el área de producción, la añada, la climatología, las técnicas agrícolas, los métodos de vinificación, el procedimiento de prensado de la uva y el tiempo de fermentación del mosto con la piel y las semillas.
Los compuestos fenólicos de la uva se localizan en las partes sólidas: piel, semilla y tejido vascular. En la pulpa destaca la presencia de ácidos fenólicos y sus derivados. Los flavonoles y antocianos se encuentran localizados en las células del hollejo de la uva, siendo éstos últimos responsables del color rojo de los vinos tintos. Las procianidinas y flavan3-oles se localizan en las semillas de las uvas. En los vinos blancos los fenoles mayoritarios son aquellos procedentes de la pulpa, mientras que en los tintos, la maceración alcohólica de los hollejos y las semillas permite la liberación y solubilización de los flavonoides.
La "Paradoja Francesa" constituyó un interesante punto de partida, al mostrar cómo en Francia existe un riesgo bajo de padecer enfermedades cardiovasculares en la población a pesar del elevado consumo de grasas saturadas de origen animal. Se descubrió que la dieta de los franceses difiere de la de otros países desarrollados por el consumo de vino tinto (22). Numerosos estudios epidemiológicos que relacionan el consumo moderado y regular de vino con una disminución del riesgo de padecer enfermedades cardiovasculares, crónicas y degenerativas se realizaron a raíz de esta observación (23-25).
El objetivo de esta revisión es el estudio de la actividad antioxidante del vino, analizando los distintos métodos que se han empleado en su evaluación. Esta actividad se correlacionará, tanto desde el punto de vista cualitativo como cuantitativo, con el perfil de compuestos polifenólicos presentes en el vino.
Actividad Antioxidante
Comparación de los métodos de medida de la actividad antioxidante del vino: ventajas e inconvenientes
Los métodos de determinación de la actividad antioxidantes se basan en comprobar cómo un agente oxidante induce daño oxidativo a un sustrato oxidable, daño que es inhibido o reducido en presencia de un antioxidante. Esta inhibición es proporcional a la actividad antioxidante del compuesto o la muestra. Por otra parte, hay ensayos que se basan en la cuantificación de los productos formados tras el proceso oxidativo.
Los distintos métodos difieren en el agente oxidante, en el sustrato empleado, en la medida del punto final, en la técnica instrumental utilizada y en las posibles interacciones de la muestra con el medio de reacción. Además, los objetivos de los diferentes métodos de medida son diversos. Entre ellos señalamos la medida de la resistencia de un alimento a la oxidación, la evaluación cuantitativa del aporte en sustancias antioxidantes o la evaluación de la actividad antioxidante del plasma una vez ingerido el alimento (26-30).
Los métodos in vitro son útiles para comparar la actividad antioxidante de diferentes muestras de alimentos. Los resultados son limitados desde un punto de vista nutricional, ya que no reproducen la situación fisiológica. Para alcanzar una mayor aproximación algunos ensayos incluyen radicales relevantes en los sistemas biológicos (O2, H2O2, ROO, OH) (31).
Por otra parte, la actividad antioxidante de un alimento in vitro difiere de su efecto antioxidante in vivo, ya que las transformaciones metabólicas que sufren los compuestos antioxidantes en el organismo modifican su actividad. Ciertos compuestos fenólicos poliméricos que presentan una baja actividad in vitro pueden, sin embargo, contribuir a la capacidad antioxidante del plasma después de su transformación metabólica en compuestos más simples. Así, dos muestras de té verde y negro, que daban resultados muy diferentes en experiencias in vitro, produjeron, tras su consumo, un incremento similar en la capacidad antioxidante del plasma (32). Por ello es importante tener en consideración aspectos como el grado de absorción de los compuestos, los productos del metabolismo que generan y la actividad de los mismos.
Las medidas in vivo pueden reflejar las posibles interacciones entre los distintos componentes de la dieta. Sin embargo, existen numerosos aspectos aún desconocidos en las medidas in vivo, como el modo de acción de los radicales dentro de los compartimentos celulares y si los compuestos antioxidantes se transportan al interior de los mismos (33).
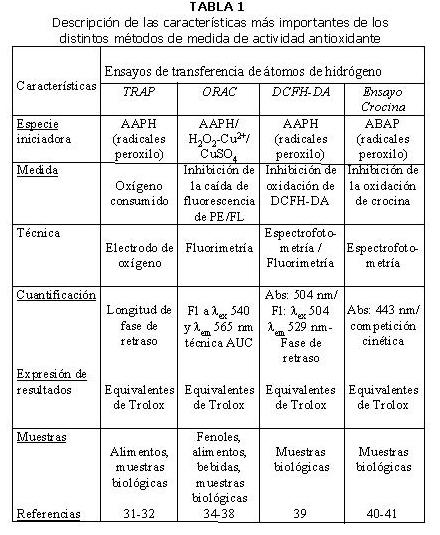
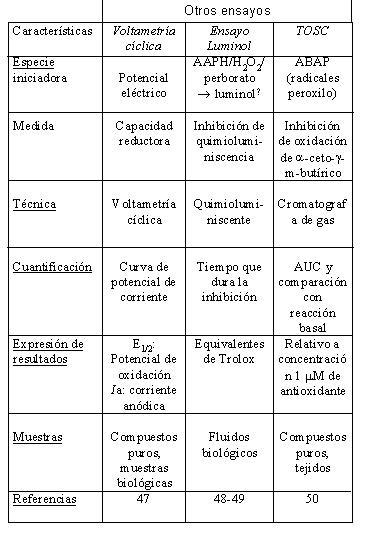
En la Tabla 1 se resumen las características más relevantes de los métodos de medida de actividad antioxidante del vino que han sido usados con mayor frecuencia (28,31-32,34-50).
Especies reactivas
La mayoría de los métodos de medida de la actividad antioxidante no emplean especies radicales de significado biológico. Son radicales ajenos al organismo el DPPH● o el ABTS●+. En el caso del ensayo FRAP el Fe2+ producido en la reacción redox del ensayo FRAP puede reaccionar con H2O2 para producir OH, que se considera el radical libre más dañino encontrado in vivo. Por otra parte, hay antioxidantes que pueden inhibir la oxidación lipídica a través de la quelación de metales de transición que intervienen en la producción de radicales libres (51). El empleo de radicales peroxilo o hidroxilo en ensayos como ORAC, TRAP, TOSC, DCFH-DA les añade un mayor significado biológico, ya que estas ROS son las más importantes a nivel fisiológico (33).
Sustrato diana
Los primeros métodos diseñados para medir la actividad antioxidante se centraron en la protección frente a la oxidación de lípidos (52), con el inconveniente de que sólo detectan un estado avanzado del daño oxidativo. El ensayo ORAC usa como diana a una proteína (ficoeritrina) que, por su sensibilidad, permite evaluar los pasos iniciales del proceso de oxidación.
Posibilidad de interferencias
Se pueden producir interacciones entre la especie que genera los radicales y los compuestos antioxidantes de la muestra. Se pueden evitar estas interferencias si existe una elevada razón molar entre la especie radical y la muestra, como ocurre en los ensayos que emplean AAPH o ABAP. Así, estos métodos muestran mayor sensibilidad y especificidad.
También se pueden producir interacciones entre el sustrato de la reacción de oxidación y la muestra alterando los resultados. La oxidación de luminol produce radicales que emiten luz. Los compuestos antioxidantes no sólo reducen los radicales producidos por AAPH, sino también los radicales luminol.
Los métodos espectrofotométricos basados en la absorbancia a una longitud de onda pueden presentar interferencias debidas a compuestos coloreados presentes en los alimentos. Este es un factor importante a considerar cuando se analiza la actividad antioxidante del vino tinto (53). Los métodos fluorimétricos no presentan este problema.
Sensibilidad del método
El método quimioluminiscente (Ensayo basado en luminol) tiene un límite de detección inferior al de los ensayos espectrofotométricos (ABTS, DPPH, FRAP, Ensayo basado en crocina) (54). Las medidas de voltametría cíclica también presentan una sensibilidad relativamente baja.
Medio de reacción hidrosoluble/liposoluble
La mayor parte de los métodos de medida de la actividad antioxidante miden solamente compuestos solubles en agua debido a las naturalezas hidrofílicas de las especies reactivas y de los sustratos oxidables que emplean. Algunos ensayos pueden adaptarse para medir antioxidantes lipofílicos: ORAC (55, 56), ABTS (57) y el ensayo TRAP (58).
Tipo de determinación
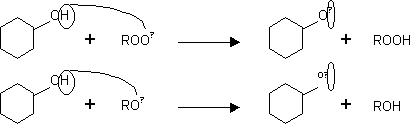
Hay métodos (TRAP, ABTS, FRAP) que cuantifican la actividad antioxidante el porcentaje de inhibición a un tiempo fijo, con el handicap de que distintos antioxidantes pueden tener un mismo porcentaje a un tiempo dado pero distinto a otro tiempo determinado. Otros métodos miden la extensión del tiempo de inhibición a un porcentaje de inhibición fijo (30). En cambio, el ensayo ORAC desarrolla la reacción de la especie reactiva con el sustrato oxidable hasta el final y usa la técnica del área bajo la curva de descenso (AUC) para la cuantificación, que integra los porcentajes de inhibición sobre el período de tiempo completo que dura la inhibición (Figura 1).
En conclusión, a la hora de abordar el estudio de la actividad antioxidante del vino es aconsejable emplear varios métodos, ya que cada uno ofrece información diferente. Hay compuestos antioxidantes que no reaccionan con determinadas especies oxidantes y sí con otras, pudiéndose obtener así valores dispares entre los distintos métodos.
Siendo el vino un alimento de sustrato hidroalcóholico, los métodos de medida de actividad antioxidante basados en especies hidrosolubles son de elección. En el caso de métodos in vitro, si el objetivo es realizar un screening de actividades antioxidantes de diferentes tipos de vinos, los métodos ABTS y DPPH son buenas elecciones, debido a su facilidad de uso y accesibilidad. El estudio de la actividad in vivo derivada de una ingesta de vino requiere el empleo de un método que mimetice las condiciones del organismo, como es el método ORAC, ya que utiliza una diana con significado biológico (proteína) y un tipo de especie oxidante presente en el organismo (radicales peroxilo).
Actividad antioxidante del vino
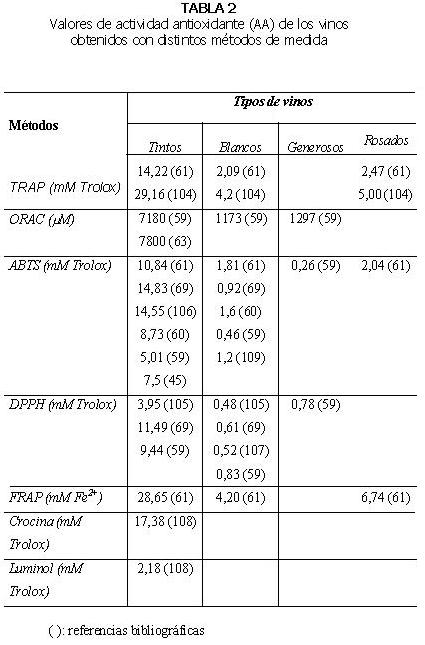
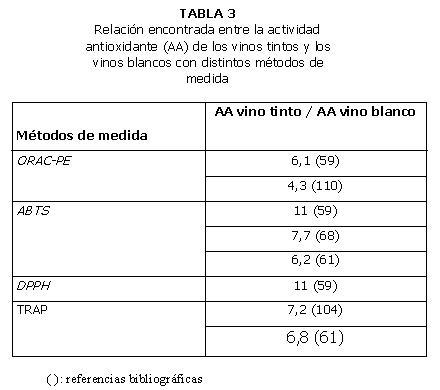
En general, los valores de actividad antioxidante de los vinos tintos obtenidos con diferentes métodos son significativamente superiores a los de los vinos blancos, rosados o generosos (59-60). La magnitud de la diferencia observada entre los vinos tintos y blancos varía en función del método empleado (Tablas 2 y 3). Si se comparan vinos blancos y generosos, de elaboración similar, no existen diferencias significativas entre los valores de actividad antioxidante medidos con los métodos ORAC-PE, ABTS y DPPH (59).
El vino tinto presenta mayor actividad antioxidante (métodos TRAP, FRAP y ABTS) que coñac, grapa, ron, cerveza y whiskey (61). Los valores TRAP y ABTS de vinos blancos fueron inferiores al del whiskey para algunas muestras y similar para otras. Con respecto al método TRAP, que utiliza R-PE y ABAP, la actividad antioxidante del vino tinto (14,22 mM) fue superior que la del vinagre (4,80 mM), té verde (7,63 mM) y té negro (4,87 mM). El vino tinto además presentó mayor valor TRAP que todas las bebidas no alcohólicas, los extractos de frutas y las verduras. En cambio, la actividad antioxidante del vino blanco (2,09 mM) fue menor que la del vinagre y el té (61).
Relación entre la actividad antioxidante del vino y su composición fenólica
Se ha determinado el contenido y la composición fenólica de los vinos mediante distintos procedimientos, con el fin de encontrar posibles relaciones entre los valores de actividad antioxidante obtenidos en las muestras y su perfil fenólico (62-64). La primera aproximación ha consistido en determinar la concentración de fenoles totales de los vinos. El método ampliamente usado para tal efecto ha sido el Índice de Polifenoles Totales (IPT) o Índice de Folin-Ciocalteau. En general, se ha encontrado una correlación lineal elevada entre los valores de actividad antioxidante y el IPT de los vinos (60, 62, 65-66) (Tabla 4).
La técnica de Extracción en Fase Sólida (SPE), que se basa en la diferencia de polaridad de los compuestos, se ha empleado para separar las principales fracciones de compuestos fenólicos de los vinos tintos (67). En concordancia con el proceso de elaboración de los vinos tintos, la fracción correspondiente a flavan-3-oles y antocianos es la más abundante, los ácidos fenólicos les siguen en orden cuantitativo y los flavonoles presentan la concentración más pequeña (59). Varios autores han encontrado correlación lineal elevada entre la concentración de flavan-3-oles y la actividad antioxidante del vino tinto medida por el método ABTS (68-69), FRAP (70), DPPH (71) y voltametría cíclica (72). Los flavonoles no presentan una relación significativa con la actividad antioxidante de los vinos (59, 73). Los ácidos fenólicos presentan una correlación lineal significativa entre su concentración y la actividad antioxidante de los vinos tintos (59, 70).
Se ha medido la actividad antioxidante de cada familia de compuestos con el fin de determinar su contribución al valor total de los vinos tintos. La fracción correspondiente a flavan-3-oles y antocianos presentó la actividad antioxidante mayor medida por los métodos ORAC-PE, ABTS, DPPH e inhibición de la oxidación de las LDL y es la que más contribuye a la actividad antioxidante de los vinos tintos (representa de 33,3 a 40,2 % del total) (59, 63, 74). La fracción de los ácidos fenólicos sigue en orden de actividad (de 6,41 a 20,8 % del total del vino). La fracción correspondiente a los flavonoles es la que menor contribución presenta. A pesar de que en estudios in vitro los flavonoles presenten elevada actividad antioxidante (75), estos compuestos no se presentan en suficientes cantidades en el vino para ser considerados determinantes de su actividad antioxidante (76).
La composición fenólica de los vinos blancos se ha analizado ampliamente mediante Cromatografía Líquida de Alta Eficacia (CLAE). Se ha intentado relacionar la concentración de los compuestos fenólicos con la actividad antioxidante de estos vinos, obteniendo coeficientes de correlación lineal elevados (r > 0,7000) en el caso de algunos compuestos (Tabla 5). Sin embargo, la actividad antioxidante de los vinos está más relacionada con el conjunto de fenoles que con algún compuesto de forma singular, a pesar de que ciertos compuestos contribuyan más que otros a la actividad antioxidante del vino (68, 70, 72, 77).
Nosotros hemos intentado construir ecuaciones que predigan la actividad antioxidante de los vinos a partir de sus constituyentes fenólicos (38). Hemos buscado una combinación lineal a partir de los valores de actividad antioxidante teóricos de los compuestos fenólicos a las concentraciones que se encuentran en los vinos. Con el análisis estadístico de regresión múltiple se obtuvo la siguiente ecuación (r = 0,9028):
De modo que para poder explicar la actividad antioxidante de un vino hay que acudir a la concentración de un amplio número de compuestos fenólicos.
Evaluación de la capacidad antioxidante del plasma tras la ingesta de vino
La capacidad antioxidante del plasma representa el balance antioxidante del organismo y valora tanto los antioxidantes endógenos como exógenos. Se ha usado como marcador indirecto de la biodisponibilidad de los antioxidantes presentes en los alimentos en estudios de intervención, tanto para evaluar el efecto aislado de un alimento a corto plazo como su influencia mediante su suplementación en la dieta a largo plazo (32).
En concreto se ha estudiado el efecto de la ingesta de espinacas, fresas (78), arándanos (79), chocolate negro (80), café (81), té negro y verde (82-83), proantocinidinas de la uva (84), chocolate rico en procianidinas (85), y bebidas alcohólicas como cerveza (86), vino blanco y vino tinto (78,83,87-88), entre otros.
Idoneidad de los métodos de medida de la capacidad antioxidante del plasma
Actualmente, la determinación de la capacidad antioxidante del plasma tras la ingesta de vino se realiza con métodos diversos (89). No existe consenso científico sobre el más idóneo, pues difieren en el objeto de medida y su posible significación biológica, así como en la interferencia que puedan presentar con los componentes del plasma. Se podría escoger cualquiera de los métodos de medida de actividad antioxidante adaptados para muestras biológicas siempre que el método esté analíticamente validado.
Plasma versus suero
Hay autores que utilizan el plasma en el estudio de la capacidad antioxidante (86), y otros emplean suero sanguíneo (79 90). Algunos trabajos no muestran diferencias significativas entre los valores de capacidad antioxidante de plasma y suero (31), en cambio, otros muestran valores más altos en el plasma que en el suero (38), o al contrario (91). En otro estudio realizado por Ghiselli y colaboradores (2000) (32), los valores de capacidad antioxidante del plasma y del suero fueron significativamente distintos en sujetos fumadores, pero no presentaban diferencias significativas en los no fumadores.
El suero se obtiene después de la eliminación del coágulo de fibrina de la sangre a temperatura ambiente. La muestra se somete así a una mayor exposición a la luz, por lo que posiblemente se pierden antioxidantes que son inestables en tales condiciones. Por otra parte, durante la agregación, las plaquetas liberan especies radicalarias que pueden disminuir la capacidad antioxidante de la muestra de suero. Esto hace aconsejable trabajar con muestras de plasma en lugar de suero para evitar pérdidas de compuestos (32). La determinación clínica de compuestos endógenos que influyen potencialmente en la capacidad antioxidante (albúmina, bilirrubina, ácido úrico) se realiza con mayor frecuencia en muestras de plasma.
Incremento medio de la capacidad antioxidante del plasma tras el consumo de vino
Los ensayos con voluntarios humanos muestran un incremento en el valor de la capacidad antioxidante tras el consumo de vino tinto, a pesar de existir diferencias interindividuales. Esta variabilidad en los resultados puede ser debida a diferencias en la absorción de los compuestos fenólicos del vino, relacionadas con la velocidad de absorción y la magnitud de la misma.
Estudios realizados con el método ORAC-PE e igual cantidad de vino tinto ingerida (300 mL), muestran valores de incremento medio máximo de la capacidad antioxidante del plasma similares y se alcanzan en tiempos parecidos: 16,4 % a los 55 minutos de la ingesta de vino (38), 16,9 % a los 60 minutos (78) o 14,4 % a los 50 minutos (87). Las ligeras variaciones encontradas entre los valores pueden atribuirse a que los grupos presentan distinta edad y sexo en cada estudio. En cambio en el método FRAP, se encuentran porcentajes de incremento más dispares: 28,6 % a los 55 minutos de la ingesta de vino (38) o 5,5 % a los 60 minutos (78).
En relación con otros alimentos, el vino tinto induce un incremento medio superior en los valores de capacidad antioxidante. Se ha obtenido un aumento máximo del 9 % (ORAC-PE) tras el consumo de 294 g de espinacas, del 14 % después del consumo de 240 g de fresas (78) y del 15 % tras la ingesta de un suplemento de 100 gramos de arándanos en polvo seco (equivale a 500-650 gramos de arándanos enteros) (79). El consumo de 500 mL de cerveza ocasionó un incremento máximo en la capacidad antioxidante del plasma muy similar al analizado para el vino tinto, aunque también hay que considerar que el volumen ingerido fue bastante superior (86).
La capacidad antioxidante del plasma medida con el método FRAP aumentó un 12,2 % tras la ingesta de 294 g de espinacas, un 4,8 % después del consumo de 240 g de fresas (78), un 3,5 % después de ingerir 100 g de chocolate negro (80) y un 4 % tras consumir 400 mL de té verde (20 g de hojas de té seco) (83).
Contribución de los compuestos antioxidantes a la capacidad antioxidante del plasma: compuestos fenólicos del vino y antioxidantes endógenos
Los compuestos antioxidantes del plasma relacionados con el consumo de vino son los compuestos fenólicos que se absorben y los metabolitos originados por la flora colónica, que se reabsorben posteriormente. El organismo absorbe un porcentaje mínimo de la concentración inicial de estos compuestos y, por otra parte, una vez que alcanzan el torrente sanguíneo, sufren una dilución considerable. Tras administrar dosis considerablemente elevadas de trans-resveratrol (25 mg/70 Kg peso), (+)-catequina (25 mg/70 Kg peso) y quercetina (10 mg/70 Kg peso), los porcentajes de absorción de estos compuestos fueron 16-17 %, 1,2-3 % y 2,9-7 % de las dosis administradas respectivamente (92). Ningún compuesto fenólico excede una concentración de 1 mM en el plasma tras el consumo de 10-100 mg del mismo (93).
Estos niveles tan bajos en el plasma humano constituyen una dificultad para su identificación y cuantificación, ya que la mayoría están por debajo de los límites de detección de las técnicas cromatográficas actuales. Sin embargo, el incremento observado en la capacidad antioxidante del plasma en los estudios indica que la proporción absorbida de estos compuestos sí es suficiente para desempeñar su papel antioxidante y presentar actividad en el organismo.
Hay autores que ofrecen las concentraciones que resultan efectivas para algunos compuestos: 0,75 mM para (-)-epigalocatequina, 1,2 mM para ácido gálico, 0,25-0,38 mM para (-)-epicatequina, (+)-catequina, (-)-galato de epicatequina y (-)-galato de epigalocatequina, con respecto a la inhibición de la oxidación de LDL al 50 % (94). La ingesta diaria de 375 mL de vino tinto durante 2 semanas produjo un aumento significativo de la capacidad antioxidante del plasma medida con el método TBARS y en la concentración plasmática de compuestos fenólicos y sus metabolitos glucuronidado y metilados (95).
Por otra parte, los compuestos antioxidantes endógenos (albúmina, bilirrubina, ácido úrico, glutatión) podrían influir en la capacidad antioxidante del plasma, si modifican su concentración tras el consumo de vino (84,96).
Los métodos ORAC-PE, FRAP, TRAP, ABTS y DPPH miden la capacidad antioxidante del compartimento hidrofílico o acuoso del plasma donde se localizan los compuestos antioxidantes solubles en agua (ácido ascórbico, ácido úrico y proteínas). La actividad antioxidante de los compuestos liposolubles que se encuentran en las lipoproteínas del plasma, tales como carotenoides y tocoferoles, no influyen en las medidas realizadas con estos métodos, y han de estimarse mediante otros ensayos.
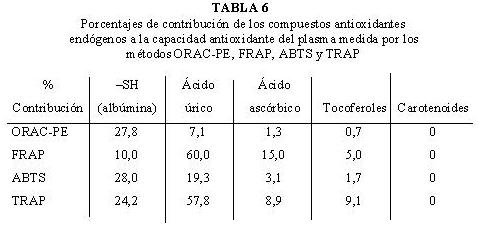
Se ha estudiado el porcentaje de contribución de los distintos compuestos endógenos a la capacidad antioxidante total del plasma determinada por los métodos de uso más frecuente en la bibliografía (97). Así, el ácido úrico (60,0 y 57,8 % de contribución para FRAP y TRAP respectivamente) y la albúmina (27,8 y 28,0 % de contribución para ORAC-PE y ABTS respectivamente), son los compuestos que más contribuyen a la capacidad antioxidante del plasma (Tabla 6).
En otro trabajo (46), se estudió la contribución de ácido úrico, bilirrubina y albúmina a la capacidad antioxidante del plasma (FRAP), obteniendo valores de contribución del 60, 5 y 10 % respectivamente. La contribución de albúmina y bilirrubina es escasa y despreciable y no ha de ser tenida en cuenta en las medidas realizadas con este ensayo. Además, a nivel basal existe una relación lineal significativa entre la capacidad antioxidante del plasma (FRAP) y la concentración de ácido úrico (r = 0,81889) (38) y entre los valores ORAC-PE del plasma y las concentraciones de albúmina (r = 0,81509).
Por otra parte, Ghiselli et al. (2000) (32) estimaron que las proteínas contribuyen en un 86 % a la capacidad antioxidante del plasma (ORAC-PE).Los grupos –SH de la proteína albúmina son responsables de parte de esta capacidad antioxidante porque reaccionan con radicales peroxilo durante los primeros pasos de la reacción de oxidación, y contribuyen a la duración de la fase de retraso.
En un estudio realizado con 51 sujetos maduros pertenecientes al grupo "Antioxidant Supplementation in Atherosclerosis Prevention", el análisis de regresión múltiple puso de manifiesto una correlación lineal significativa entre la capacidad antioxidante estudiada mediante el método TRAP y las concentraciones de urato y ácido ascórbico. El urato fue la contribución más alta del TRAP medido en el plasma (98). Se señaló la existencia de un porcentaje de contribución al valor TRAP no identificado, que según Metsä-Ketelä (1991) (48) podría deberse a la albúmina.
El consumo de 375 mL de vino tinto provocó un aumento significativo de la concentración de urato en suero (83). De la misma forma se observó un aumento significativo en los niveles de urato del plasma después del consumo de una dieta rica en grasas acompañada de 400 mL de vino tinto, y un aumento no significativo en los niveles de grupos –SH y a-tocoferol. La ingesta de 200 mL de café (60 gramos de café tostado y molido por litro de agua) produjo un incremento estadísticamente significativo de ácido úrico en el plasma. En cambio, otros compuestos como ácido ascórbico o a-tocoferol no se modificaron, y los grupos –SH tampoco mostraron un incremento significativo (81). La ingesta de una comida rica en grasas acompañada de 300 mg de un extracto de proantocianidinas del grano de la uva provocó también un aumento significativo de grupos –SH y urato (84).
En otros trabajos se describe, por el contrario, cómo los antioxidantes endógenos no se modifican tras la ingesta de alimentos. Los niveles plasmáticos de ácido úrico no sufren cambios significativos después del consumo de té negro y verde (82), 500 mL de cerveza (86) u 80 gramos de chocolate rico en procianidinas (557 mg) (85). Tampoco se observaron cambios en los niveles de bilirrubina tras el consumo de fresas, espinacas o vino tinto (78).
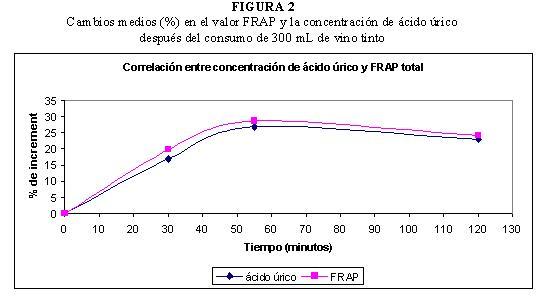
En nuestros estudios, tras el consumo de 300 mL de vino tinto, se obtuvo una correlación lineal positiva muy elevada entre los valores de capacidad antioxidante medidos con el método FRAP y las concentraciones de ácido úrico. En la Figura 2 se observa que el incremento medio del valor FRAP y el incremento de la concentración de ácido úrico siguen una evolución similar (38).
La contribución del ácido úrico al valor FRAP implica que su concentración debe ser determinada y tenida en cuenta cuando se estudian los efectos del consumo de alimentos en la capacidad antioxidante del plasma medida mediante este ensayo. Si se considera que el 60 % del valor FRAP del plasma se debe a la actividad antioxidante del ácido úrico, como apuntan algunos autores (46, 97), se podría considerar que el 40 % del valor FRAP restante se debe a los compuestos fenólicos del vino y sus metabolitos.
El efecto del vino sobre este aumento del ácido úrico puede deberse a la acción del alcohol o de los compuestos fenólicos que contiene. El efecto del consumo de alcohol en la concentración de ácido úrico sérica ha sido objeto de discusión recientemente debido a que el mecanismo implicado en tal efecto no se conoce totalmente (99). El etanol induce un aumento en la concentración plasmática de uridina y purinas. La uridina es atribuible a un incremento en la degradación de bases de pirimidina y purina (100). En otros estudios, la relación entre el etanol y la concentración de ácido úrico no es tan evidente. La administración oral de etanol en sujetos sanos no incrementó la actividad de la enzima xantina-oxidasa, responsable de la ruta catabólica de síntesis del ácido úrico (101). La administración intravenosa de etanol (0,25-0,35 g/kg/h) durante dos horas, no produjo cambios significativos en los niveles de urato en suero, ni tampoco en la excreción urinaria del ácido úrico (102). Una ingesta de 0,5 g etanol/kg incrementa la concentración de ácido úrico alrededor de 6,7 mg/L en bebedores habituales (> 60 g etanol/día), pero no en bebedores ocasionales o no bebedores. Además, los niveles de hipoxantina y xantina en plasma incrementaron sus niveles en mayor medida en el grupo de los bebedores habituales. Parece que en estos últimos ocurre una degradación acelerada de adenina provocada por el aumento en la oxidación del etanol (103).
Por otra parte, el consumo de vino tinto produjo un aumento significativo en el nivel de ácido úrico plasmático (5,6%), sin embargo, la ingesta del mismo vino previamente dealcoholizado no produjo este incremento (83). Parece ser que el metabolismo de la molécula de etanol en el hepatocito produce un incremento en la degradación de ATP hacia los precursores de ácido úrico (nucleótido de adenina) y, por consiguiente, un aumento en la formación de ácido úrico a partir de la degradación de los nucleótidos de las purinas (83).
Además del efecto del alcohol, se ha estudiado la influencia de los polifenoles en los niveles de ácido úrico. Extractos de manzana, que contienen polifenoles de esta fruta, retrasan significativamente la oxidación in vitro del urato del plasma mediada por radicales peroxilo; el mecanismo propuesto para la inhibición de dicha oxidación puede ser la reducción de la especie radical de urato por ciertos polifenoles, como quercetina o (+)-catequina, regenerando, por consiguiente, urato en el plasma. Esta reacción es termodinámicamente posible (96). Por otra parte, parece que los compuestos fenólicos son capaces de interaccionar con los mecanismos de secreción y reabsorción del ácido úrico aumentando el nivel de éste en el plasma (88).
A pesar de la influencia manifiesta de los compuestos antioxidantes endógenos, la capacidad antioxidante del plasma tras el consumo de vino no puede ser simplemente debida a éstos y, en particular, al ácido úrico. El ácido úrico no afecta los valores ORAC, y además su actividad es muy baja (ORAC-FL) (1,38 mM) dando una contribución despreciable a los valores ORAC-FL del plasma. Por tanto otras moléculas, los compuestos fenólicos, además del ácido úrico son responsables del incremento observado en la capacidad antioxidante después del consumo de vino (38). Dietas que contienen alimentos con cantidades significativas de polifenoles influyen en el incremento de la capacidad antioxidante del plasma, además del efecto de los antioxidantes endógenos. En un trabajo realizado con 8 hombres sanos y jóvenes, que ingirieron una comida rica en grasas acompañada de 300 mg de extracto de proantocianidinas del grano de la uva, se constató un aumento significativo de la capacidad antioxidante del plasma medido por TRAP. El valor TRAP teórico, que se calculó a partir de las concentraciones de los antioxidantes anteriores fue menor que el valor TRAP medido en el plasma. Por ello, otros antioxidantes contribuyeron en la capacidad antioxidante del plasma después del suplemento de proantocianidinas. Cuando los sujetos consumieron la comida rica en grasas sin extracto de uva, el valor TRAP teórico coincidió con el valor TRAP medido (84).
Se podría concluir así que el vino interviene en la capacidad antioxidante del plasma pudiendo actuar de forma directa (per se), por su contenido en compuestos fenólicos, e indirecta, ya que puede inducir un aumento en los niveles plasmáticos de otros antioxidantes endógenos.
REFERENCIAS
1. Halliwell B, Gutteridge JMC. The antioxidants of human extracellular fluids. Arch. Biochem. Biophys. 1990; 280: 1-8. [ Links ]
2. Sies H. Oxidative stress: from basic research to clinical application. Am. J. Med. 1991; 91: 31S-39S. [ Links ]
3. Halliwell B. Oxidative stress, nutrition and health. Free Radic. Res. 1996; 25: 57-74. [ Links ]
4. Berliner JA, Heinecke JW. The role of oxidized lipoproteins in atherogenesis. Free Radic. Biol. Med. 1996; 20: 707-727. [ Links ]
5. Bagchi D, Bagchi M, Stohs SJ, Das DK, Ray SD, Kuszynski CA, Joshi SS, Pruess HG. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention. Toxicology 2000; 148: 187-197. [ Links ]
6. Diplock AT, Charleux JL, Crozier-Willi G, Kok FJ, Rice-Evans C, Roberfroid M, Stahl W, Viña-Ribes J. Functional food science and defence against reactive oxidative species. Br. J. Nutr. 1998; 80 (l): S77-S112. [ Links ]
7. Dean RT, Fu S, Stocker R, Davies MJ. Biochemistry and pathology of radical-mediated protein oxidation. Biochem. J. 1997; 324: 1-18. [ Links ]
8. Taylor A. Cataract: relationship between nutrition and oxidation. J. Am. Coll. Nutr. 1993; 12: 138-146. [ Links ]
9. Gerster H. b-Carotene, vitamin E and vitamin C in different stages of experimental carcinogenesis. Eur. J. Clin. Nutr. 1995; 49: 155-168. [ Links ]
10. Park YK, Park E, Kim JS, Kang MH. Daily grape juice consumption reduces oxidative DNA damage and plasma free radical levels in healthy Koreans. Mutat. Res. 2003; 529: 77-86. [ Links ]
11. Le Core L, Fustier P, Chalabi N, Bignon YJ, Bernard-Gallon D. Effects of resveratrol on the expression of a panel of genes interacting with the BRCA1 oncosuppressor in human breast cell lines. Clin. Chim. Acta 2004; 344: 115-121. [ Links ]
12. Jampol LM, Ferris FL. Antioxidants and zinc to prevent progression of age-related macular degeneration. J. Am. Med. Assoc. 2001; 286 (19): 2466-2468. [ Links ]
13. Bravo L. Polyphenols: Chemistry, Dietary Sources, Metabolism, and Nutritional Significance. Nutr. Rev. 1998; 56 (11): 317-333. [ Links ]
14. Pannala AS, Chan TS, Obrien P, Rice-Evans C. Flavonoid B-ring chemistry and antioxidant activity: fast-reaction kinetics. Biochem. Biophys. Res. Com. 2001; 282: 1161-1168. [ Links ]
15. Rice-Evans C, Miller NJ, Paganga G. Structure-antioxidant activity relationships of flavonoids and phenolic acids. Free Rad. Biol. Med. 1996; 20: 933-956. [ Links ]
16. Cao G, Sofic E, Prior RL. Antioxidant and prooxidant behaviour of flavonoids: structure-activity relationships. Free Radic. Biol. Med. 1997; 22: 749-760. [ Links ]
17. Laughton MJ, Evans PJ, Moroney MA, Hoult JRS, Halliwell B. Inhibition of mammalian 5-lipooxigenase and cyclooxigenase by flavonoids and phenolic dietary additives: relationship to antioxidant activity and to iron reducing ability. Biochem. Pharmacol. 1991; 42: 1673-1681. [ Links ]
18. Andriambeloson E, Magnier C, Haan-Archipoff G, Lobstein A, Anton R, Beretz A, Stoclet JC, Andriantsitohaina R. Natural dietary polyphenolic compounds cause endothelium-dependent vasorelaxation in rat thoracic aorta. J. Nutr. 1998; 128: 2324-2333. [ Links ]
19. Cook NC, Samman S. Flavonoids-Chemistry, metabolism, cardioprotective effects and dietary sources. Nutr. Biochem. 1996; 7: 66-76. [ Links ]
20. Delmas D, Rebe C, Lacour S, Filomenko R, Athias A, Gambert P, Cherkaoui-Malki M, Jannin B, Dubrez-Daloz L, Latruffe N, Solary E. Resveratrol-induced apoptosis is associated with Fas redistribution in the rafts and the formation of a death inducing signaling complex in colon cancer cells. J. Biol. Chem. 2003; 278: 41482-41490. [ Links ]
21. Stewart JR, Artime MC, O´Brian CA. Resveratrol: A Candidate Nutritional Substance for Prostate Cancer Prevention. J. Nutr. 2003; 133: 2440S-2443S. [ Links ]
22. Renaud S, De Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet 1992; 339: 1523-6. [ Links ]
23. Hertog MGL, Feskens EJM, Hollman PCH, Katan MB, Kromhout D. Dietary antioxidant flavonoids and risk of coronary heart disease: the Zutphen Elderly Study. Lancet 1993; 342: 1007-1011. [ Links ]
24. Hein HO, Suadicani P, Gyntelberg F. Alcohol consumption, serum low density lipoprotein cholesterol concentration, and risk of ischaemic heart disease: six year follow up in the Copenhagen male study. Br. Med. J. 1996; 312: 736-741. [ Links ]
25. Mcelduff P, Dobson AJ. How much alcohol and how often? Population based case-control study of alcohol consumption and risk of a major coronary event. Br. Med. J. 1997; 314: 1159-1167. [ Links ]
26. Frankel N, Meyer AS. Review The problems of using one-dimensional methods to evaluate multifunctional food and biological antioxidants. J. Sci. Food Agric. 2000; 80: 1925-1941. [ Links ]
27. Wang CC, Chu CY, Chu KO, Choy KW, Khaw KS, Rogers MS, Pang CP. Trolox-Equivalent Antioxidant capacity Assay Versus Oxygen radical Absorbance Capacity Assay in Plasma. Clin. Chem. 2004; 50 (5): 952-954. [ Links ]
28. Pérez DD, Leighton F, Aspee A, Aliaga C, Lissi E. A comparison of methods employed to evaluate antioxidant capabilities. Biol. Res. 2000; 33 (2): 71-77. [ Links ]
29. Schwarz K, Bertelsen G, Nissen LR, Gardner PT, Heinonen MI, Hopia A, Huynh-BA T, Lambelet P, Mcpail D, Skibsted LH, Tijburg. Investigation of plant extracts for the protection of processed foods against lipid oxidation. Comparison of antioxidant assays based on radical scavenging, lipid oxidation and analysis of the principal antioxidant compounds. Eur. Food Res. Technol. 2001:212 (3): 319-328. [ Links ]
30. Arnao MB, Cano A, Acosta M. Methods to measure the antioxidant activity in plant material. A comparative discussion. Free Rad. Res. 1999; 31: S89-96. [ Links ]
31. Wayner DDM, Burton GW, Ingold KU, Locke S. Quantitative measurement of the total peroxyl radical-trapping antioxidant capability of human blood plasma by controlled peroxidation: The important contribution made by plasma proteins. FEBS Lett. 1985; 187 (1): 33-37. [ Links ]
32. Ghiselli A, Serafini M, Natella F, Scaccini C. Total antioxidant capacity is a tool to asses redox status: critical view and experimental data. Free Radic. Biol. Med. 2000; 29 (11): 1106-1114. [ Links ]
33. Antolovich M, Prenzler PD, Patsalides E, Mcdonald S, Robards K. Methods for testing antioxidant activity. Analyst 2002 ; 127: 183-198. [ Links ]
34. Cao G, Prior RL. Measurent of Oxygen Radical Absorbance Capacity in Biological Samples. Meth. Enzymol. 1999; 299 (5): 50-62. [ Links ]
35. Ou B, Hampsch-Woodill M, Prior RL. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. J. Agric. Food Chem. 2001; 49: 4619-4626. [ Links ]
36. Davalos A, Bartolome B, Suberviola J, Gomez-Cordoves C. (2003). Orac-fluorescein as a model for evaluating antioxidant activity of wines. Pol. J. Food Nutr. Sci. 2003; 12 (SI 1): 133-136. [ Links ]
37. Davalos A, Gomez-Cordoves C, Bartolome B. (2004). Extending Applicability of the Oxygen Radical Absorbance Capacity (ORAC-Fluorescein) Assay. J. Agric. Food Chem. 2004; 52 (1): 48-54. [ Links ]
38. Fernández-Pachón MS, Villaño D, Troncoso AM, García-Parrilla MC. Antioxidant Capacity of Plasma after Red Wine Intake in Human Volunteers. J. Agric. Food Chem. 2005; 53 (12): 5024-5029. [ Links ]
39. Valkonen M, Kuusi T. Spectrophotometric assay for total peroxyl radical-trapping antioxidant potential in human serum. J. Lipid Res. 1997; 38: 823-833. [ Links ]
40. Tubaro F, Ghiselli A, Papuzzi P, Maiorino M, Ursini F. Analysis of plasma antioxidant capacity by competition kinetics. Free Radic. Biol. Med. 1998; 24: 1228-1234. [ Links ]
41. Lussignoli S, Fraccaroli M, Andrioli G, Brocco G, Bellavite P. A microplate-based colorimetric assay of the total peroxyl radical trapping capability of human plasma. Anal. Biochem. 1999; 269: 38-44. [ Links ]
42. Brand-Williams W, Cuvelier ME, Berset C. Use of a free radical method to evaluate antioxidant activity. Food Sci. Technol. 1995; 28: 25-30. [ Links ]
43. Sánchez-Moreno C, Larrauri JA, Saura-Calixto F. A procedure to measure the antiradical efficiency of polyphenols. J. Sci. Food Agric. 1998; 76: 270-276. [ Links ]
44. Cano A, Hernández-Ruíz J, García-Cánovas F, Acosta M, Arnao MB. An end-point method for estimation of the total antioxidant activity in plant material. Phytochem. Anal. 1998; 9: 196-202. [ Links ]
45. Alonso AM, Domínguez C, Guillén DA, Barroso CG. Determination of antioxidant power of red and white wines by a new electrochemical meted and its correlation with polyphenolic content. J. Agric. Food Chem. 2002; 50: 3112-3115. [ Links ]
46. Benzie IFF, Strain JJ. The Ferric Reducing Ability of Plasma (FRAP) as a Measure of "Antioxidant Power": The FRAP Assay. Anal. Biochem. 1996; 239: 70-76. [ Links ]
47. Kohen R, Beit-Yannai E, Berry EM, Tirosh O. Overall low molecular weight antioxidant activity of biological fluids and tissues by cyclic voltammetry. Meth. Enzymol. 1999; 300: 285-296. [ Links ]
48. Metsä-Ketelä T. Luminescent assay for total peroxyl radical-trapping capability of plasma. Biolumin. Chemilumin. Proc. Int. Symp. 6th Meeting 1991; 389-392. [ Links ]
49. Alho H, Leinonen J. Total antioxidant activity measured by chemiluminescence methods. Meth. Enzymol. 1999; 299: 3-14. [ Links ]
50. Winston GW, Regoli F, Dugas AJ, Fong JH, Blanchard KA. A rapid gas chromatographic assay for determining oxyradical scavenging capacity of antioxidants and biological fluids. Free Radic. Biol. Med. 1998; 24: 480-493. [ Links ]
51. Morel I, Lescoat G, Cogrel P, Sergent O, Pasdeloup N, Brissot P, Cillard P, Cillard J. Antioxidant and iron-chelating activities of the flavonoids catechin, quercetin and diosmetin on iron-loaded rat hepatocyte cultures. Biochem. Pharmacol. 1993; 45 (1): 13-19. [ Links ]
52. Frankel EN. In search for the better methods to evaluate natural antioxidants and oxidative stability in food lipids. Trends Food Sci. Technol. 1993; 4: 220-225. [ Links ]
53. Villaño D, Fernández-Pachón MS, Troncoso AM, García-Parrilla MC. The antioxidant activity of wines determined by the ABTS method: influence of sample dilution and time. Talanta 2004; 64: 501-509. [ Links ]
54. Girotti S, Ferri E, Maccagnani L, Budini R, Bianchi G. Plasma antioxidant capacity determination: comparative evaluation of chemiluminescent and spectrophotometric assays. Talanta 2002; 56: 407-414. [ Links ]
55. Prior RL, Hoang H, Gu L, Wu X, Bacchiocca M, Howard L, Hampsch-Woodill M, Huang D, Ou B, Jacob R. Assays for Hydrophilic and Lipophilic Antioxidant Capacity (oxygen radical absorbance capacity (ORACFL)) of Plasma and Other Biological and Food Samples. J. Agric. Food Chem. 2003; 51: 3273-3279. [ Links ]
56. Aldini G, Yeum KJ, Russell RM, Krinsky NI. A method to measure the oxidizability of both the aqueous and lipid compartments of plasma. Free Radic. Biol. Med. 2001; 31 (9): 1043-1050. [ Links ]
57. Alcolea JF, Cano A, Acosta M, y MB. Hydrophilic and lipophilic antioxidant activities of grapes. Nahrung 2002; 46: 353-356. [ Links ]
58. Gorinstein S, Martin-Belloso O, Katrich E, Lojek A, CIZ M, Gligelmo-Miguel N, Haruenkit R, Park YS, Jung ST, Trakhtenberg S. Comparison of the contents of the main biochemical compounds and the antioxidant activity of some Spanish olive oils as determined by four different radical scavenging tests. J. Nutr. Biochem. 2003; 14: 154-159. [ Links ]
59. Fernández-Pachón MS, Villaño D, García-Parrilla MC, Troncoso AM. Antioxidant activity of wines and relation with their polyphenolic composition. Anal. Chim. Acta 2004; 513: 113-118. [ Links ]
60. Fogliano V, Verde V, Randazzo G, Ritieni A. Method for Measuring Antioxidant Activity and Its Application to Monitoring the Antioxidant Capacity of Wines. J. Agric. Food Chem. 1999; 47: 1035-1040. [ Links ]
61. Pellegrini N, Serafini M, Colombi B, Del Rio D, Salvatore S, Bianchi M, Brighenti F. Total Antioxidant Capacity of Plant Foods, Beverages and Oils Consumed in Italy Assessed by Three Diofferent In Vitro Assays. J. Nutr. 2003; 133: 2812-2819. [ Links ]
62. Frankel EN, Waterhouse AL, Teissedre PL. Principal Phenolic Phytochemicals in Selected California Wines and Their Antioxidant Activity in Inhibiting Oxidation of Human Low-Density Lipoproteins. J. Agric Food Chem. 1995; 43: 890-894. [ Links ]
63. Ghiselli A, Nardini M, Baldi A, Scaccini C. Antioxidant Activity of Different Phenolic Fractions Separated from an Italian Red Wine. J. Agric. Food Chem. 1998; 46 (2): 361-367. [ Links ]
64. Cao G, Prior RL. Red wine in moderation: potencial health benefits independent of alcohol. Nutr. Clin. Care 2000; 3: 76-82. [ Links ]
65. Vinson JA, Hontz BA. Phenol Antioxidant Index: Comparative Antioxidant Effectiveness of Red and White Wines. J. Agric. Food Chem. 1995; 43: 401-403. [ Links ]
66. Sánchez-Moreno C, Jiménez-Escrig A, Saura-Calixto F. LDL oxidizability indexes in measurement of antioxidant activity in selected Spanish wines. Nutr. Res. 2002; 22: 507-517. [ Links ]
67. Brenneman CA, Ebeler SE. (1999). Chromatographic separations using solid-phase extraction cartridges: Separation of wine phenolics. J. Chem. Educ. 1999; 76 (12): 1710-1711. [ Links ]
68. Simonetti P, Pietta P, Testolin G. Polyphenol Content and Total Antioxidant Potential of Selected Italian Wines. J. Agric. Food Chem. 1997; 45: 1152-1155. [ Links ]
69. De Beer D, Joubert E, Gelderblom WCA, Manley M. Antioxidant Activity of South African Red And White Cultivar Wines: Free Radical Scavenging. J. Agric. Food Chem. 2003; 51: 902-909. [ Links ]
70. Arnous A, Makris DP, Kefalas P. Effect of Principal Polyphenolic Components in Relation to Antioxidant Characteristics of Aged Red Wines. J. Agric. Food Chem. 2001; 49: 5736-5742. [ Links ]
71. Arnous A, Makris DP, Kefalas P. Correlation of Pigment and Flavanol Content with Antioxidant Properties in Selected Aged Regional Wines from Greece. J. Food Composition Anal. 2002; 15: 655-665. [ Links ]
72. Brenna OV, Pagliarini E. Multivariate Analysis of Antioxidant Power and Polyphenolic Composition in Red Wines. J. Agric. Food Chem. 2001; 49: 4841-4844. [ Links ]
73. Burns J, Gardner PT, O´Neil J, Crawford S, Morecroft I, Mcphail DB, Lister C, Matthews D, Maclean MR, Lean MEJ, Duthie GC, Crozier A. Relationship among Antioxidant Activity, Vasodilation Capacity, and Phenolic Content of Red Wines. J. Agric. Food Chem. 2000; 48: 220-230. [ Links ]
74. Kerry NL, Abbey M. Red wine and fractionated phenolic compound prepared from red wine inhibit low density lipoprotein oxidation in vitro. Atherosclerosis 1997; 135: 93-102. [ Links ]
75. Maxwell SRJ. Wine antioxidants and their impact on antioxidant function in vivo. ACS Symposium Series 1997; 661: 150-165. [ Links ]
76. Gardner PT, Mcphail DB, Crozier A, Duthie GG. Electron spin resonance (ESR) spectroscopic assesment of the contribution of quercetin and other flavonols to the antioxidant capacity of red wines. J. Sci. Food Agric. 1999; 79: 1011-1014. [ Links ]
77. Alonso AM, Guillén DA, Barroso CG, Puertas B, García A. Determination of Antioxidant Activity of Wine Byproducts and Its Correlation with Polyphenolic Content. J. Agric. Food Chem. 2002; 50: 5832-5836. [ Links ]
78. Cao G, Russell RM, Lischner N, Prior RL. Serum Antioxidant Capacity Is Increased by Consumption of Strawberries, Spinach, Red Wine or Vitamin C in Elderly Women. J. Nutr. 1998; 128: 2383-2390. [ Links ]
79. Kay CD, Holub BJ. The effect of wild blueberry (Vaccinium angustifolium) consumption on postprandial serum antioxidant status in human subjects. Br. J. Nutr. 2002; 88: 389-397. [ Links ]
80. Serafini M, Bugianesi R, Maiani G, Valtuena S, De Santis S, Crozier A. Plasma antioxidants from chocolate. Nature 2003; 424 (6952): 1013. [ Links ]
81. Natella F, Nardini M, Giannetti I, Dattilo C, Scaccini C. Coffee Drinking Influences Plasma Antioxidant Capacity in Humans. J. Agric. Food Chem. 2002; 50: 6211-6216. [ Links ]
82. Leenen R, Roodenburg AJ, Tijburg LB, Wiseman SA. A single dose of tea with or without milk increases plasma antioxidant activity in humans. Eur. J. Clin. Nutr. 2000; 54: 87-92. [ Links ]
83. Caccetta RAA, Burke V, Mori TA, Beilin LJ, Puddey IB, CROFT KD. Red wine polyphenols, in the absence of alcohol, reduce lipid peroxidative stress in smoking subjects. Free Radic. Biol. Med. 2001; 30 (6): 636-642. [ Links ]
84. Natella F, Belelli F, Gentili V, Ursini F, Scaccini C. Grape Seed Proanthocyanidins Prevent Plasma Postprandial Oxidative Stress in Humans. J. Agric. Food Chem. 2002; 50: 7720-7725. [ Links ]
85. Rein D, Lotito S, Holt RR, Keen CL, Schmitz HH, Fraga CG. Epicatechin in Human Plasma: In Vivo Determination and Effect of Chocolate Consumption on Plasma Oxidation Status. J. Nutr. 2000; 130: 2109S-2114S. [ Links ]
86. Ghiselli A, Natella F, Guidi A, Montanari L, Fantozzi P, Scaccini C. Beer increases plasma antioxidant capacity in humans. J. Nutr. Biochem. 2000; 11: 76-80. [ Links ]
87. Serafini M, Maiani G, Ferro-Luzi A. Alcohol-Free Red Wine Enhances Plasma Antioxidant Capacity in Humans. J. Nutr. 1998; 128: 1003-1007. [ Links ]
88. Natella F, Ghiselli A, Guidi A, Ursini F, Scaccini C. Red wine mitigates the postprandial increase of LDL susceptibility to oxidation. Free Radic. Biol. Med. 2001; 30 (9): 1036-1044. [ Links ]
89. Prior RL, Cao G. In vivo total antioxidant capacity: comparison of different analytical methods. Free Radic. Biol. Med. 1999; 27 (11-12): 1173-1181. [ Links ]
90. Day AP, Kemp HJ, Bolton C, Hartog M, Stansbie D. Effect of Concentrated Red Grape Juice Consumption on Serum Antioxidant Capacity and Low-Density Lipoprotein Oxidation. Ann. Nutr. Metab. 1997; 41: 353-357. [ Links ]
91. Rea CA, Maxwell SR, Maslin DJ, Thomason HL, Thorpe GH. Anticoagulant effects of antioxidant capacity [letter; comment] . Ann. Clin. Biochem. 1996; 33 (Pt 2): 174. [ Links ]
92. Goldberg DM, Yan J, Soleas GJ. Absorption of three wine-related polyphenols in three different matrices by healthy subjects. Clin. Biochem. 2003; 36: 79-87. [ Links ]
93. Scalbert A, Williamson G. Dietary Intake and Bioavailability of Polyphenols. J. Nutr. 2000; 130: 2073S-2085S. [ Links ]
94. Rice-Evans CA, Miller NJ, Paganga G. Antioxidant properties of phenolic compounds. Trends Plant Sci. 1997; 2: 152-159. [ Links ]
95. Tsang C, Higgins S, Duthie GG, Duthie SJ, Howie M, Mullen W, Lean MEJ, Crozier A. The influence of moderate red wine consumption on antioxidant status and indices of oxidative stress associated with CHD in healthy volunteers. Brit. J. Nutr. 2005; 93: 233-240. [ Links ]
96. Lotito SB, Frei B. Relevance of apple polyphenols as antioxidants in human plasma: contrasting in vitro and in vivo effects. Free Radic. Biol. Med. 2004; 36 (2): 201-204. [ Links ]
97. Yeum KJ, Russell RM, Krinsky NI, Aldini G. Biomarkers of antioxidant capacity in the hydrophilic and lipophilic compartments of human plasma. Arch. Biochem. Biophys. 2004; 430: 97-103. [ Links ]
98. Nyyssönen K, Porkkala-Sarataho E, Kaikkonen J, Salonen JT. Ascorbate and urate are the strongest determinats of plasma antioxidative capacity and serum lipid resistance to oxidation in Finnish men. Atherosclerosis 1997; 130: 223-233. [ Links ]
99. Iberopoulos EN, Miltiadous GA, Elisaf MS. Alcohol intake, serum uric acid concentrations, and risk of gout. Lancet 2004; 364: 246-247. [ Links ]
100. Yamamoto T, Moriwaki Y, Takahashi S, Yamakita J, Tsutsumi Z, Ohata H, Hiroishi K, Nakano T, Higashino K. Effect of ethanol and fructose on plasma uridine and purine bases. Metabolism 1997; 46 (5): 544-547. [ Links ]
101. Yamamoto T, Moriwaki Y, Takahashi S, Tsutsumi Z, Yamakita J, Nasako Y, Hiroishi K, Higashino K. Determination of human plasma xanthine oxidase activity by high-performance liquid chromatography. J. Chromatogr. B 1996; 681 (2): 395-400. [ Links ]
102. Faller J, Fox IH. Ethanol-induced hyperuricemia. Evidence for increased urate production by activation of adenine nucleotide turnover. N. Engl. J. Med. 1982; 307 (26): 1598-1602. [ Links ]
103. Nishimura T, Shimizu T, Mineo I, Kawachi M, Ono A, Nakajima H, Kuwajima M, Kono N, Matsuzawa Y. Influence of daily drinking habits on ethanol-induced hyperuricemia. Metabolism 1994; 43 (6): 745-748. [ Links ]
104. Campos AM, Lissi EA. Total antioxidant potential of Chilean wines. Nutrition Research 1999; 16 (3): 385-389. [ Links ]
105. Piljac J, Martinez S, Valek L, Stipcevic T, Ganic KK. A comparison of methods used to define the phenolic content and antioxidant activity of croatian wines. Food Technology and Biotechnology 2005; 43 (3): 271-276. [ Links ]
106. Pellegrini N, Simonetti P, Gardana C, Brenna O, Brighenti F, Pietta P. Polyphenol Content and Total Antioxidant Activity of Vini novelli (Young Red Wines). J. Agric. Food Chem. 2000; 48 (3): 732-735. [ Links ]
107. Psarra E, Makris DP, Kallithraka S, Kefalas P. Evaluation of the antiradical and reducing properties of selected Greek white wines: correlation with polyphenolic composition. J. Sci. Food Agric. 2002; 82: 1014-1020. [ Links ]
108. Girotti S, Bolelli L, Budini R, Arfelli G. Comparison of analytical methods in determining total antioxidant capacity in red wine. Analytical Letters 2002; 35 (4): 747-758. [ Links ]
109. Höner K, Cervellati R, Neddens C. Measurements of the in vitro antioxidant activity of German white wines using a novel method. Eur. Food Res. Technol. 2002; 214: 356-360. [ Links ]
110. Sánchez-Moreno C, Cao G, Ou B, Prior RL. Anthocyanin and Proanthocyanidin Content in Selected White and Red Wines. Oxygen Radical Absorbance Capacity Comparison with Nontraditional Wines Obtained from Highbush Blueberry. J. Agric. Food Chem. 2003; 51: 4889-4896. [ Links ]
111. Landrault N, Poucheret P, Ravel P, Gasc F, Cros G, Teissedre PL. Antioxidant Capacities and Phenolic Levels of French Wines from Different Varieties and Vintages. J. Agric. Food Chem. 2001; 49: 3341-3348. [ Links ]