Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622versión On-line ISSN 2309-5806
ALAN v.56 n.2 Caracas jun. 2006
Efecto de diversos tratamientos en la cocción del frijol Mucuna sobre el contenido de L-Dopa
Carmen Luz García Echeverría y Ricardo Bressani
Centro de Ciencia y Tecnología de Alimentos, Universidad del Valle de Guatemala, Guatemala
Resumen
El factor más limitante en el consumo del frijol Mucuna (Frijol Terciopelo) para el ser humano es su alto contenido de L-Dihidroxifenilalanina (L-Dopa) con niveles que pueden ser del 9%. Los métodos convencionales utilizados para transformar el frijol crudo en comestible no son suficientemente efectivos en reducir los niveles de L-Dopa en tiempo razonables para su preparación. Varios otros procesos se han utilizado con resultados poco prometedores. En este trabajo, el frijol Mucuna fue cocinado por microondas, con vapor y a cocciones en soluciones de pH 3, 6, 7, 9 y 11. Las cocciones alcalinas se lograron con hidróxido de sodio, hidróxido de potasio e hidróxido de calcio, mientras que las de pH ácido con ácido clorhídrico. El tiempo inicial de cocción fue constante por 6 hrs. Además las muestras secas y molidas de los tratamientos anteriores fueron cocidas en agua por 0, 3 y 6 minutos, y el proceso fue evaluado por el nivel de eliminación de L-Dopa.
Ninguno de los métodos evaluados fue capaz de eliminar el L-Dopa del frijol Mucuna. El tratamiento de cocción con Ca(OH)2 a pH 9 y luego lavado con agua caliente produjo la reducción mas alta del 80.4%. No hubo efecto de los iones alcalinos. La reducción del tamaño de la partícula por molienda parece ser efectivo como ha sido demostrado por otros autores.
Palabras Claves: frijol mucuna, L-Dopa, cocción alcalina (Na, K, Ca), eliminación L-Dopa.
Effect of different cooking treatments of Mucuna beans on its L-Dopa content.
Summary
The main limiting factor in the consumption by humans of the velvet bean (Mucuna) is its relatively high content of L-Dihydroxyphenylalanine (L-Dopa), with levels as high as 9%. Conventional cooking methods used to transform raw velvet bean into an edible product are not sufficiently effective in reducing the levels of L-Dopa in adequate processing time. In this report, Mucuna beans were cooked by microwave, utilizing vapor and in water solutions at pH 3, 6, 7, 9 and 11. Cooking alkaline solutions were achieved using sodium hydroxide, potassium hydroxide, and calcium hydroxide. The acid pH was achieved through the use of HCl. The initial cooking time was fixed at 6 hrs. The processed bean samples were dried, ground and analyzed for L-Dopa and protein. The ground samples were further washed with boiling water for 0, 3 and 6 minutes, them dried and analyzed.
None of the procedures evaluated was capable of eliminating L-Dopa from Mucuna beans. The Ca(OH)2 treatment at pH 9 which was washed with hot water produce a reduction of L-Dopa of 80.4%. There was not effect attributed to the alkaline ions. Reducing particle size appears to be most effective as it has been shown by other workers.
Key words: Mucuna beans, L-Dopa, alkaline cooking (Na, K, Ca), L-Dopa elimintation.
RECIBIDO: 01-02-2006
ACEPTADO: 13-06-2006
Introducción
El frijol terciopelo (Mucuna spp.) ha sido, desde hace años un buen cultivo de cobertura debido a su resistencia, a la gran cantidad de follaje que produce y a su capacidad de fijar el nitrógeno atmosférico (1,2). Sin embargo, el grano contiene una alta cantidad de L-Dopa, sustancia tóxica para el ser humano, hasta el punto de ser una fuente comercial de la misma para tratar la enfermedad de Parkinson.
Actualmente, el frijol se utiliza como cultivo de rotación con el maíz en algunas partes del país. Si el frijol terciopelo se pudiera consumir, se podría impulsar su uso como abono verde y como alimento (3,4).
Los métodos tradicionales de preparación sólo permiten consumir cantidades relativamente pequeñas de la semilla debido a los niveles residuales de Dopa, lo cual lo hace impracticable como cultivo para consumo humano. Sin embargo, tiene una proteína (24 – 30%) con una alta proporción de aminoácidos esenciales, en particular lisina que la hace similar a otras leguminosas de grano (5,6). Es asimismo muy similar a otras leguminosas de grano en su contenido de minerales, grasa y fibra dietética (7,8).
El frijol Mucuna posee los mismos factores antinutrientes de las demás leguminosas, como inhibidor de proteasa, inhibidor de amilasa, lectinas, ácido fítico, Polifenoles, taninos, HCN y factores de flatulencia en cantidades similares. El problema es que también contiene L-Dopa (6.97 a 9.16%), sustancia que comparte con la Vicia faba (1.5%) (9).
Es este el factor más limitante en el uso en nutrición del frijol Mucuna. Un estudio clínico confirma la eficacia de las semillas en el tratamiento de la enfermedad de Parkinson debido a su contenido de L-Dopa. La Mucuna pruriens, es reconocida como un afrodisíaco en la tradición hindú, y se ha comprobado que aumenta los niveles de testosterona, llevando a la deposición de proteínas en los músculos, incrementando su masa y fuerza. El extracto es conocido también por aumentar el estado de alerta del cerebro y mejora la coordinación que posiblemente explica su uso como sucedáneo del café (9).
Se han llevado a cabo varios estudios con el fin de eliminar Dopa lo más posible del grano.
En un estudio realizado en la India sobre el efecto de los tratamientos tradicionales de la semilla antes de su consumo, se observó que ningún tratamiento eliminaba del todo la presencia de la sustancia; sin embargo, la mayoría lograba reducir su cantidad hasta en un 60% (10).
En este estudio se utilizaron las semillas de la especie Mucuna pruriens variedad utilis, de color blanco y negro. Uno de los métodos más útiles en la eliminación de L-Dopa fue el de remojar las semillas en una solución de ácido cítrico (0.1%, pH 2.60) por 20 h y ya secas se las calentó en autoclave por 30 min (121°C, 15 lb. de presión) (10).
Otros estudios han demostrado que un tratamiento con calor seco como tostar o asar la semilla puede disminuir el L-Dopa hasta en un 49%. Lo métodos húmedos mejoran si la semilla se parte en pedazos, entre más pequeños, mayor extracción. Esto es por una mayor área superficial del frijol, con eliminación del 95% del L-Dopa, mediante un tratamiento que dura alrededor de tres días (11).
Un tratamiento muy eficaz para eliminar el L-Dopa de la semilla de Mucuna consiste en remojar por 24 horas las semillas trituradas en una solución de hidróxido de calcio (Ca(OH)2). Se logra una concentración final de menos de 0.1%. Pero el producto resultante es de un color quemado, no apto para el consumo humano, si bien puede utilizarse para alimentar pollos (3).
Otros métodos utilizados para eliminar L-Dopa no han tenido resultados aceptables. Entre estos se encuentran: cocer la semilla entera después de dejarla en remojo y germinar la semilla. En las semillas remojadas a 66°C se encontró que la velocidad a la que el L-Dopa sale de la semilla disminuye a medida que el tiempo de remojo aumenta, posiblemente por la interferencia de la gelatinización del almidón (12).
El cocinar la semilla en agua después de remojarla por 12 horas disminuye su tiempo de cocción, sobre todo si se la remoja en una solución de bicarbonato de sodio, pero no disminuye significativamente el contenido de L-Dopa. Germinar la semilla antes de consumirla no mejora la calidad de la proteína y no disminuye significativamente el contenido de L-Dopa (12).
Como las variedades del género Mucuna tienen una alta concentración de L-Dopa, y además, son la única variedad de plantas que contiene suficiente como para pensar en su extracción con fines comerciales, encontrar un método de extracción eficiente es importante. Un estudio (13) indica que la extracción con agua caliente a partir de la semilla cruda molida del frijol terciopelo es un método efectivo. Además, en este estudio se terminó de extraer con una solución ácida (HCl 0.1N) de la muestra después de los lavados previos, y el L-Dopa se separó con una resina de intercambio iónico. Este método, sin embargo, es un procedimiento de laboratorio, no siempre se pueden dar tres lavados de agua hirviendo, y seguro esto afecta las demás propiedades de la semilla. Cabe recordar que el objetivo de este estudio (13) en particular era aislar y purificar el L-Dopa, no emplear la semilla como alimento humano.
En el presente trabajo se investigaron diversos tratamientos con el fin de eliminar L-Dopa del frijol terciopelo.
Materiales y Métodos
La muestra inicial consistió en semillas de frijol Mucuna pruriens de color negro, suministradas por el Instituto de Ciencia y Tecnología Agropecuaria, Guatemala (ICTA).
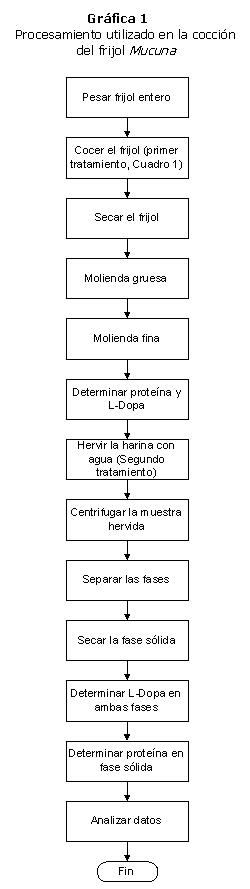
Los métodos para tratar las muestras tiene se expone en forma general en la Gráfica 1. La diferencia básica es el proceso de cocción que se aplica como primer tratamiento a las muestras.
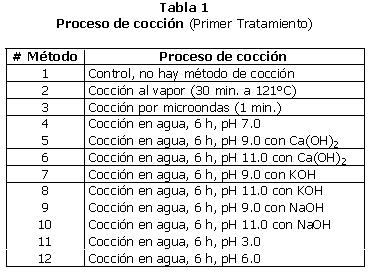
Los valores de pH fueron elegidos al azar, 2 pH ácidos y 2 pH básicos, tratando de mejorar la solubilidad del L-Dopa para facilitar su extracción. En el pH básico, se examinó la influencia de los iones de Na, K y Ca. También se estudió el efecto de tratamientos físicos como el calentamiento con vapor y por microondas. Se aplicaron 12 diferentes tratamientos incluyendo el control (Tabla 1).
Se realizó un análisis con respecto al contenido de L-Dopa en el frijol terciopelo crudo (control) por el método de Daxenbichler (13). También se analizó el contenido de proteína del frijol (14).
Una vez realizados los primeros tratamientos, las muestras se secaron, pesaron y pulverizaron, con lo que se obtuvo la harina de cada muestra (el control sólo fue molido).
El segundo tratamiento consistió en hervir las muestras de harina durante (0, 3 y 6 minutos). Después se determinó el contenido de L-Dopa presente tanto el extracto como en la harina ya seca.
Para evaluar la pérdida de sólidos durante este procesamiento, se registró el peso de la muestra antes del tratamiento y después de secada. Además, se determinó el porcentaje de sólidos de los líquidos de cocción. También se determinó el contenido de proteína de las muestras tratadas.
1. Primer Tratamiento
a. Cocción en agua (Muestra # 4 al 12): 100 semillas pesadas previamente se colocaron en un vaso de precipitación, con 300 ml de una muestra preparada como se indica en la Tabla 1. Las semillas se colocaron a hervir hasta que quedaron suaves (aproximadamente 6 horas). Cuando el líquido se consumía, se agregaba nuevo líquido a fin de conservar el volumen y las condiciones de cocción iguales (agua-des-ionizada en todos los casos, menos en el de pH ácido, donde se agregó más solución ácida). El agua se descartó (una porción de 5 ml se secó en cada caso para determinar la cantidad de sólidos perdidos). Los frijoles se secaron en un horno de convección, antes de molerlos.
b. Cocción al vapor (Muestra # 2): 300 semillas pesadas previamente se colocan en una olla sin agua dentro de un autoclave por 30 minutos (tarda aproximadamente 15 min. en llegar a la temperatura de 121°C) y se deja enfriar. Luego se secaron en un horno de convección antes de molerlos.
c. Cocción en microondas (Muestra # 3): 100 semillas pesadas previamente se colocaron sin agua en un vaso de precipitación. Se les calentó en un horno de microondas durante un minuto, tiempo establecido con anterioridad que no inducía expansión de la semilla. Las semillas se secaron luego en un horno de convección, antes de molerlas.
2. Obtención de harina
a. Molienda: los granos, ya secos, se molieron de primero en un molino de café, hasta lograr pedazos pequeños. Luego se molieron en un molino centrífugo para lograr una harina fina de aproximadamente 80 mesh.
3. Segundo tratamiento
a. Extracción con agua: tres porciones, de 4 g cada una, de harina de cada muestra que recibió el primer tratamiento, se colocaron en un vaso de precipitación con cierta cantidad de agua des-ionizada dependiendo de tiempo de ebullición (40, 60, 80 ml), debido a la evaporación. Una porción no se hirvió. Otra se hirvió durante tres minutos y la otra durante seis minutos. Después se centrifugó y se separaron las fracciones. La fracción sólida se secó.
Diseño Experimental
Para comprobar la hipótesis de investigación se empleó un diseño experimental con posprueba únicamente, selección aleatoria de las muestras, y grupo de control (15).
Se estudió el efecto de los diferentes tratamientos (variables independientes, véase las Gráficas 1 y 2 y Cuadro 1) sobre las siguientes variables dependientes:
- El contenido de L-Dopa en las diferentes harinas.
- El contenido de proteína en las diferentes harinas.
Los datos se procesaron utilizando el paquete estadístico de Microsoft Excel y el programa Analyset-it (http://www.analyse-it.com/).
El propósito de los experimentos fue encontrar un tratamiento que reduzca a cero el contenido de L-Dopa del frijol terciopelo negro, con el mínimo daño a sus propiedades nutritivas. Para esto, a un grupo se aplicaron diversos tratamientos (Tabla 1), seguidos de molienda y extracción con agua hirviendo (Gráfica 1) cada prueba se realizó con múltiples replicados, incluyendo los tiempos de ebullición durante la segunda fase del procesamiento. Se buscaron diferencias en el contenido de L-Dopa y proteína causadas por los tratamientos, con respecto al control.
Se seleccionó un nivel de significación a =0.05 (probabilidad de cometer un error tipo I, falso positivo) para las pruebas estadísticas.
Para observar si existen diferencias significativas entre los tratamiento se empleó análisis de varianza de una vía y comparaciones pareadas de medias por el método de la mínima diferencia significativa y el método de Tukey (16) como el análisis de varianza requiere una distribución normal de los datos, se realizó la prueba Shapiro-Wilk W para normalidad (Programa Analyse-it).
Para determinar si existe asociación entre el tiempo de ebullición (2° Tratamiento) y el contenido de L-Dopa en la fase sólida, así como entre el contenido de L-Dopa en la fase sólida y el contenido de sólidos en la fase líquida, se empleó una prueba de correlación de Pearson para variables continuas normalmente distribuidas. Además, se efectuó un análisis de regresión lineal para ajustar los datos a ecuaciones y calcular coeficientes de correlación (Programa Analyse-it).
Para determinar si los coeficientes de correlación de Pearson eran significativos al nivel de a= 0.05, se emplearon valores críticos publicados en Internet (http://www.gifted.vconn.edu/siegle/research/correlation/corrchrt.htm). Para los coeficientes de correlación para regresión lineal se utilizó una tabla de valores críticos publicada por Volk (17).
Discusión y Resultados
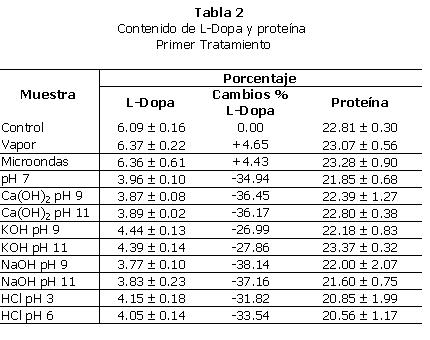
1. Primer tratamiento: después de realizados los primeros tratamientos listados en la Tabla 1, se procedió a obtener el contenido de L-Dopa y proteína de las muestras, como indica la Gráfica 1. Esto se realizó por triplicado, y los resultados promedio presentados en la Tabla 2.
a. L-Dopa: el análisis de varianza de los datos demostró que existían diferencias significativas entre las muestras tratadas, en cuanto a su contenido de L-Dopa. Entonces se realizó un análisis comparativo (mínima diferencia significativa).
Según este análisis, las muestras NaOH pH 9, NaOH pH 11, Ca(OH)2 pH 9, Ca(OH)2 pH 11, pH 7 y HCl pH 6 no tenían diferencias significativas entre sí. Además, fueron los tratamientos que más redujeron el contenido de L-Dopa en la muestra (de un 6% a un 3.8%, reducción del 38% masa sobre masa). De esto se observa que el método de cocer la muestra sólo en agua (pH 7) era tan eficaz como cocerla con hidróxido de sodio (NaOH) e hidróxido de calcio (Ca(OH)2) a cualquier pH y con HCl a pH 6.
El tratamiento con hidróxido de potasio (KOH) a cualquier pH y el tratamiento con HCl a pH 3 no tiene diferencias significativas entre sí en cuanto al contenido de L-Dopa, pero sólo lograron reducir su contenido de 6% a 4.3%, 29% masa sobre masa por lo que resultaron menos eficaces que los anteriores.
Es interesante indicar que el ion K no fue tan efectivo en reducir L-Dopa como los iones de sodio y calcio.
Los tratamientos físicos (microondas y vapor) no tuvieron efectos significativos en la reducción del L-Dopa posiblemente debido a la falta de solvente conservando un porcentaje de alrededor del 6%. El tratamiento con microondas por un minuto fue previamente seleccionado en base a que el grano se mantenía entero ya que con un mayor tiempo el grano se expandía y se quema. Debido a que la muestra control (la cual sólo fue molida) no se le eliminó el agua como a las otras muestras, su contenido de L-Dopa parece ligeramente menor que el de las muestras de microondas y vapor.
b. Proteína: con respecto al contenido de proteína, todos los métodos la conservaron prácticamente en su porcentaje original. No se observan diferencias significativas entre el contenido de proteína del frijol crudo (control) y la mayor parte de las muestras, excepto por tres: NaOH pH 11, HCl pH 3 y HCl pH 6.
Los tratamientos a pH ácido favorecieron la pérdida de proteína, así como el tratamiento con hidróxido de sodio a pH 11. Sin embargo, la diferencia entre los tratamientos no es muy grande (control 22%, HCl pH 3 21% masa sobre masa) pero si es significativa.
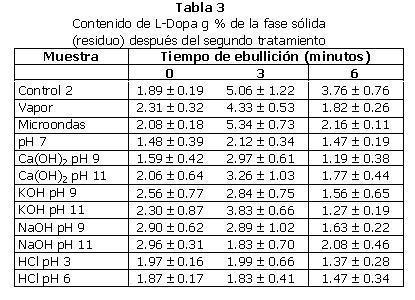
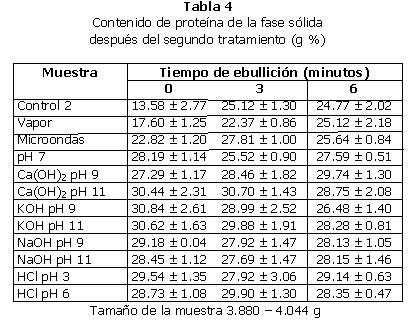
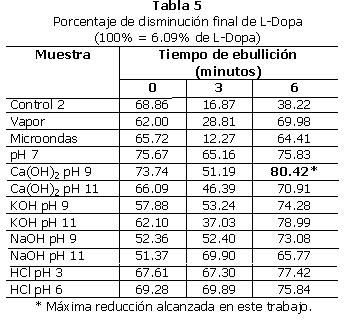
2. Segundo tratamiento: los resultados promedio para el segundo tratamiento pueden verse en las Tablas 3 (L-Dopa) y 4 (proteína). En la Tabla 5 se encuentran los porcentajes de disminución de L-Dopa en relación a la muestra control.
El análisis de varianza de dos vías (comparar el efecto del primer tratamiento con el tiempo de ebullición) indicó diferencias significativas de ambos tratamientos sobre los contenidos de L-Dopa y proteína. También señaló una interacción significativa entre el primer y segundo tratamientos sobre dichos contenidos. Para llegar a una comprensión más clara de los resultados, se tratará cada método (Tabla 1) por separado. Luego se analizarán los casos según el tiempo de ebullición.
El segundo tratamiento ocasionó pérdida de masa en todas las muestras. Esto es porque al disolver las muestras en agua y luego separar la fase líquida de la sólida, esta última pierde compuestos solubles. En algunas de las muestras el contenido de proteína resultó mayor que en la muestra Control porque, al separar la fase líquida de la sólida en el segundo tratamiento, algunas sustancias solubles se quedaron en la fase líquida, mientras que la proteína permaneció en el sólido, con lo que su concentración se incrementó.
Además se hicieron pruebas con respecto a hervir las harinas por nueve y doce minutos, pero las pérdidas de masa fueron mayores al 40%, por lo que no se consideraron prácticas desde el punto de vista económico, y no se analizaron.
Se realizaron triplicados de cada prueba del segundo tratamiento. Las determinaciones de L-Dopa y proteína se hicieron en duplicado, obteniéndose un total de seis resultados (tanto de L-Dopa como de proteína) para cada tiempo de ebullición.
En casi todos los tratamientos se observó una mayor concentración (significativa) de L-Dopa en las harinas hervidas por tres minutos que en las hervidas por cero y seis minutos. Este comportamiento muestra que la solubilidad del L-Dopa disminuye al hervir la harina por poco tiempo (tres minutos) y aumenta al hervirla por más tiempo (seis minutos). Posiblemente el tiempo reducido de 3 minutos no permite una hidratación completa de la muestra y por consiguiente para la extracción de Dopa como consecuencia. Las porciones sólo lavadas en agua presentan en general una cantidad similar de L-Dopa a la de la de las muestras hervidas por seis minutos, exceptuando las muestras NaoH pH 9 y pH 11, HCl pH 3 y pH 6, que se explican más adelante. Esto es de interés ya que es un tratamiento en frío, y el frijol Mucuna fue molido, lo que facilita la solubilidad de Dopa.
A continuación se discute el efecto del segundo tratamiento sobre el contenido de L-Dopa y proteína del frijol terciopelo, comparándolo con la muestra Control molida del primer tratamiento.
a. Control 2 (la muestra Control sometida al segundo tratamiento). De acuerdo con el análisis de varianza de una vía, lavar la muestra control con agua fue significativamente más eficaz para disminuir el contenido de L-Dopa que hervirla por tres o seis minutos, pero provocó una mayor pérdida de proteína (de hecho, la mayor pérdida de proteína de todas las muestras es el Control lavado con agua a temperatura ambiente, siendo esta una pérdida significativa). Esto es porque parte de la proteína permanece soluble cuando la muestra se lava con agua a temperatura ambiente y se pierde al separar la fracción líquida. No hubo diferencias significativas en el contenido de L-Dopa entre las muestras Control 2 hervidas durante tres y seis minutos.
Al comparar la muestra Control con la muestra Control 2, se observa que hervir la muestra durante tres minutos no provocó una disminución significativa en el contenido de L-Dopa, aunque éste sí disminuyó significativamente en los otros dos casos.
b. Vapor: la muestra tratada en autoclave (vapor) redujo significativamente su contenido de L-Dopa con respecto a la muestra Control en todos los tiempos de ebullición. En la muestra hervida durante tres minutos, se observó una reducción significativamente menor de L-Dopa con respecto a los tratamientos a cero y seis minutos. También hubo una pérdida significativa de proteína al lavar la muestra con agua, pero no al hervirla.
c. Microondas: la muestra tratada por microondas exhibe un comportamiento similar al de la muestra tratada al vapor, en lo que se refiere a la pérdida de L-Dopa, excepto una reducción del contenido de L-Dopa no significativa al hervir la muestra por tres minutos.
En esta muestra se aprecian aumentos significativos en la concentración de proteína, por causa de la pérdida de masa total, aunque no en el tratamiento del tiempo 0.
d. pH 7: en los tres tiempos de ebullición la reducción de L-Dopa con respecto al Control fue significativa. Sin embargo, el comportamiento fue similar al de la muestra al vapor, también con una reducción en el L-Dopa menor al hervir la harina por tres minutos, comparándola con los otros dos tratamientos.
El contenido de proteína no cambió significativamente al hervir la muestra por tres minutos, pero sí hubo cambio en los otros dos casos, en los que se observó aumentos.
e. Ca(OH)2 pH 9: exhibe un comportamiento similar al de la muestra pH 7, en lo que se refiere a pérdida de L-Dopa, con una disminución significativa del contenido de esta sustancia de acuerdo con la muestra control, y también en la muestra hervida por tres minutos la disminución fue menor.
Con respecto a la proteína, en todos los casos se aprecian aumentos de su contenido, por causa de la pérdida de otros compuestos al separar la fase sólida.
Es en esta muestra en la que se obtuvo la mayor disminución en la concentración de L-Dopa (ver Tabla 5).
f. Ca(OH)2 pH 11: con respecto al control, todos los cambios de L-Dopa y proteína fueron significativos. Se obtuvo una mayor eliminación de L-Dopa al hervir esta muestra por seis minutos, mientras que la menor pérdida fue la de tres minutos.
También se observa un aumento aparente en la concentración de proteína, por causa de la pérdida de otros componentes en el agua de cocción.
Entre las dos muestras tratadas con hidróxido de calcio (Ca(OH)2 pH 9 y Ca(OH)2 pH 11) no se aprecian diferencias significativas con respecto al contenido de L-Dopa en ninguno de los tiempos de ebullición del segundo tratamiento. Tampoco se aprecian diferencias significativas con respecto al contenido de proteína.
g. KOH pH 9: el comportamiento de esta muestra es similar al de las anteriores, la disminución de L-Dopa fue significativa en todos los casos. Se observa una mayor concentración de L-Dopa en la muestra hervida por tres minutos, la cual tiene una diferencia significativa con respecto a la muestra hervida por seis minutos.
Con respecto a la proteína, todas las muestras presentaron un aumento en la concentración de la misma, el cual fue significativo con respecto a la muestra Control.
h. KOH pH 11: en esta muestra, todas las pérdidas de L-Dopa fueron significativas con respecto al control. Sin embargo, la muestra hervida por tres minutos presentó una concentración significativa mayor de L-Dopa que las otras dos.
En esta muestra también se observó una concentración final de proteína significativamente mayor a la de la muestra control.
Los dos tratamientos de hidróxido de potasio (KOH pH 9 y KOH pH 11) no presentan diferencias significativas entre sí después del segundo tratamiento, tanto en L-Dopa como en contenido de proteína.
i. NaOH pH 9: esta muestra también presentó una reducción significativa en su contenido de L-Dopa, pero a diferencia de las muestras anteriores, en las que se observó una mayor retención de L-Dopa al hervirlas por tres minutos, en este caso, la muestra de cero minutos y la de tres minutos de ebullición no tiene diferencias significativas entre si. Es la muestra hervida por seis minutos la única significativamente diferente, con una concentración final menor de L-Dopa.
j. NaOH pH 11: en esta muestra también hubo una reducción significativa de L-Dopa en todos los casos con respecto a la muestra Control. Sin embargo, a diferencia de todas las muestras anteriores, el lavar la muestra con agua a temperatura ambiente redujo la cantidad de L-Dopa en menor medida que al hervirla. No hay diferencias significativas entre las muestras hervidas por tres y seis minutos, pero la muestra no hervida si presenta diferencias significativas con respecto a las hervidas.
También se aprecia un aumento en el contenido de proteína en todos los casos.
Entre las dos muestras tratadas con hidróxido de sodio (NaOH pH 9 y NaOH pH 11) no hay diferencias significativas con respecto a su contenido de L-Dopa de proteína.
k. HCl pH 3: este método produjo reducciones significativas en el contenido de L-Dopa con respecto a la muestra Control. Sin embargo, no hubo diferencias significativas entre los diferentes tiempos de ebullición del segundo tratamiento con respecto al L-Dopa y la proteína.
También se observó un aumento significativo en la concentración final de proteína con respecto a la muestra Control.
l. HCl pH 6: en esta muestra se aprecia también una disminución significativa de L-Dopa con respecto a la muestra Control. Su comportamiento es muy similar al comportamiento de la muestra HCl pH 3, tanto en cuanto al contenido de L-Dopa como al contenido de proteína.
En esta muestra también se aprecia un aumento significativo de proteína con respecto a la muestra Control.
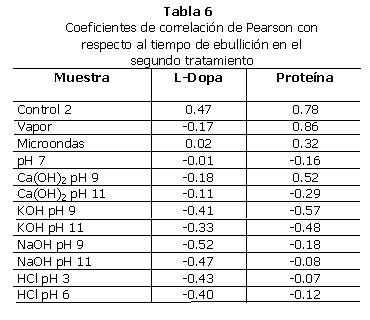
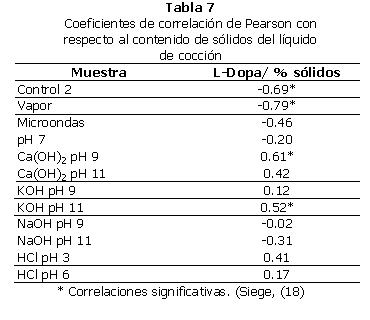
m. Correlaciones: no se encontró correlación significativa entre el tiempo de ebullición y el contenido de L-Dopa y de proteína en la fase sólida. Las Tablas 6 y 7 contienen los coeficientes de correlación de Pearson para estas pruebas.
A excepción de cuatro casos, no se encontró una correlación significativa entre el contenido de sólidos del líquido de cocción y el contenido de L-Dopa de sus respectivas fases sólidas.
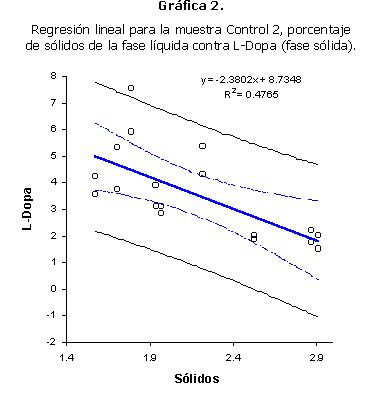
En la muestra Control 2 se encontró una correlación significativa entre el porcentaje de sólidos del líquido de cocción y el contenido de L-Dopa de la fase sólida (Tabla 7). El análisis de regresión también dio un coeficiente de correlación significativo (Gráfica 2). En este caso, la correlación es negativa. Esto significa que entre más sólidos se encuentran en la fase líquida, hay menos L-Dopa en la fase sólida. Este es un resultado lógico, ya que esto indica que entre los sólidos que se perdieron en el líquido de cocción se encuentra el L-Dopa.
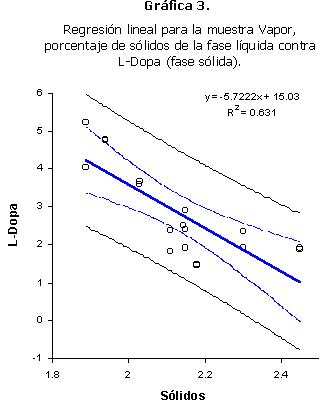
En la muestra vapor se encontró una correlación significativa entre el porcentaje de sólidos del líquido de cocción y el contenido de L-Dopa de la fase sólida (Tabla 7). El análisis de regresión también dio un coeficiente de correlación significativo (Gráfica 3). La correlación también es negativa, por lo que la explicación es la misma que para el uso de la muestra Control 2.
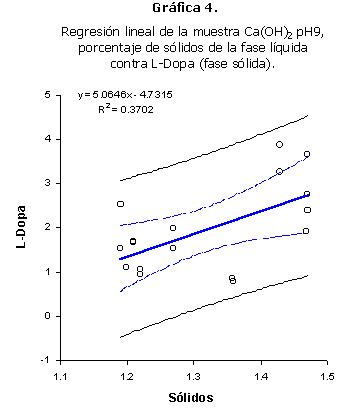
Al realizar una correlación de Pearson entre el contenido de L-Dopa de la fase sólida y el porcentaje de sólidos de la fase líquida de la muestra Ca(OH)2 pH 9, se observó una correlación significativa (Tabla 7). El análisis de regresión también dio un coeficiente de correlación significativo (Gráfica 4). En este caso, la correlación es positiva. Esto indica que mientras más sólidos se encuentran en la fase líquida, más L-Dopa se encuentra en la fase sólida. En este caso, la mayor cantidad de sólidos disueltos hace más lenta la salida del L-Dopa.
Al realizar una correlación de Pearson entre el contenido de L-Dopa de la fase sólida y el porcentaje de sólidos de la fase líquida de la muestra KOH pH 11, se observó una correlación significativa (Tabla 7). El análisis de regresión también dio un coeficiente de correlación significativo (Gráfica 5). En este caso la correlación es también positiva.
De los resultados presentados se puede concluir que ninguno de los tratamientos empleados en la cocción del frijol Mucuna es capaz de eliminar el L-Dopa aunque si se observaron reducciones importantes en varios tratamientos. La cocción en húmedo con eliminación del caldo de cocción induce pérdidas en L-Dopa que son de 27.0 a 38.1% de reducción. Los iones de Ca y Na fueron un poco más efectivos que los de K. El lavado con agua en caliente por 6 minutos fue más efectivo que el mismo tratamiento por menos tiempo y en frío. La mayor reducción de L-Dopa fue del 80.4%, con una cocción con hidróxido de calcio a pH 9, seguido de un lavado con ebullición por 6 minutos.
Referencias
1. Eilittä, M., R. Bressani, L. Carew, R. Carsky, M. Flores, R. Gilbert, L. Huyck, L. St-Laurent, N. Szabo. 2002. Mucuna as Food and Feed Crop: an Overview. Ch 1. En: Food and Feed from Mucuna: Current Uses and the Way Forward. Proceedings of an International Workshop. Flores, M., M. Eilittä, R. Myhrman, L. Carew, R. Carsky (Ed.). Centro Internacional de Información sobre Cultivos de Cobertura (CIDICCO), Litografía López, Honduras. [ Links ]
2. Eilittä, M., L., Sollenberg. 2002. The many Uses of Mucuna: Velvetbean in the Southern United States in the Early 20th Century. Ch 4. En Food and Feed from Mucuna: Current Uses and the Way Forward. Proceedings of an International Workshop. Flores, M., M. Eilittä, R. Myhrman, L. Carew, R. Carsky (Ed.). Centro Internacional de Información sobre Cultivos de Cobertura (CIDICCO), Litografía López, Honduras. [ Links ]
3. Diallo, O., S. Kante, R. Myhrman, M. Soumah, N. Cissé, T. Berhe. 2002. Increasing Farmer Adoption of Mucuna pruriens ad Human Food and Animal Feed in the Republic of Guinea. Ch 3. En: Food and Fee from Mucuna: Current Uses and the Way Forward. Proceedings of an International Workshop. Flores, M., M. Eilittä, R. Myhrman, L. Carew, R. Carsky (Ed.). Centro Internacional de Información sobre Cultivos de Cobertura (CIDICCO), Litografía López, Honduras. [ Links ]
4. Gilbert, R. 2002. Mucuna pruriens in Malawi: A promising Legume with a Troubled History. Ch 2. En: Food and Feed from Mucuna: Current Uses and the Way Forward. Proceedings of an International Workshop. Flores, M., M. Eilittä, R. Myhrman, L. Carew, R. Carsky (Ed.). Centro Internacional de Información sobre Cultivos de Cobertura (CIDICCO), Litografía López, Honduras. [ Links ]
5. Bressani, R. 2002. Factors Influencing Nutritive Value in Food Grain Legumes: Mucuna Compared to Other Grain Legumes. Ch. 8. En: Food and Feed from Mucuna: Current Uses and the Way Forward. Proceedings of an International Workshop. Flores, M., M. Eilittä, R. Myhrman, L. Carew, R. Carsky (Ed.). Centro Internacional de Información sobre Cultivos de Cobertura (CIDICCO), Litografía López, Honduras. [ Links ]
6. Siddjuraju, P., K. Becker, H. Makkar, 2000. Studies on the Nutritional Composition and Antinutritional Factors of Three Different Germplasm Seed Materials of an Under-Utilized Tropical Legume, Mucuna pruriens Var. utilis, Journal of Agricultural and Food Chemistry. 48:6048-6060. [ Links ]
7. Siddhuraju, P., K. Vijayakumari, K. Janardhanan, 1996. Chemical Composition and Protein Quality of the Little-Known Legume, Velvet bean (Mucuna pruriens (L.) DC.), Journal of Agricultural and Food Chemistry. 44:2636-2641. [ Links ]
8. Ukachukwu, S., I. Ezeagu, G. Tarawali, J. Ikeorgu. 2002. Utilization of Mucuna ad Food and Feed in West Africa. Ch 9. En: Food and Feed from Mucuna: Current Uses and the Way Forward. Proceedings of an International Workshop. Flores, M., M. Eilittä, R. Myhrman, L. Carew, R. Carsky (Ed.). Centro Internacional de Información sobre Cultivos de Cobertura (CIDICCO), Litografía López, Honduras. [ Links ]
9. Szabo, N., I. Tebbett. 2002. The chemistry and Toxicity of Mucuna Species. Ch 6. En: Food and Feed from Mucuna: Current Uses and the Way Forward. Proceedings of an International Workshop. Flores, M., M. Eilittä, R. Myhrman, L. Carew, R. Carsky (Ed.). Centro Internacional de Información sobre Cultivos de Cobertura (CIDICCO), Litografía López, Honduras. [ Links ]
10. Siddhuraju, P., K. Becker, 2001. Effect of Various Domestic Processing Methods on Antinutrients and In Vitro Protein and Starch Digestibility of Two Indigenous Varieties of Indian Tribal Pulse, Mucuna pruriens Var. utilis, Journal of Agricultural and Food Chemistry. 49:3058-3067. [ Links ]
11. Myhrman, R. 2002. Detection and Removal of L-Dopa in the Legume Mucuna: Ch 7. En: Food and Feed from Mucuna: Current Uses and the Way Forward. Proceedings of an International Workshop. Flores, M., M. Eilittä, R. Myhrman, L. Carew, R. Carsky (Ed.). Centro Internacional de Información sobre Cultivos de Cobertura (CIDICCO), Litografía López, Honduras. [ Links ]
12. Bressani, R., M. Lau, M. Vargas. 2003. Protein and Cooking Quality and Residual Content of Dehydroxyphenilalanine and Trypsin Inhibitors of Processes Mucuna Beans (Mucuna spp), Tropical and Subtropical Agrosystems. 1. 197-212. [ Links ]
13. Daxenbichler, M., C. VanEtten, F. Earle, W. Tallent. 1972. L-Dopa Recovery from Mucuna Seed, Journal of Agricultural and Food Chemistry, 20:1046, 1047, 1048. [ Links ]
14. AOAC Official Methods of Analysis of the Association of Official Analytical Chemists. 1984. 14a. Ed. Association of Official Analytical Chemists, Inc. US. [ Links ]
15. Hernández, R., Fernández, C., Baptista, P. 2003. Metodología de la Investigación 3ª Edición. Mc Graw-Hill, México. [ Links ]
16. Montgomery, D.C. 1997. Design and analysis of experiments. Fourth Edition, John Wiley & Sons. New York. [ Links ]
17. Volk, W. 1969. Applied Statistics for Engineers. 2nd Edition. Mc Graw-Hill. New York. P. 268. [ Links ]
18. Siege, D., 2003. Critical Values of the Pearson Product-Moment Correlation Coefficient. Recuperado de Internet el 02/01/2004. http://www.gifted.uconn.edu/siegle/research/Correlation/corrchrt.htm [ Links ]