Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622
ALAN vol.66 no.1 Caracas ene. 2016
Fuentes naturales de fitoesteroles y factores de producción que lo modifican
Paola Silva, Ana C. Pinheiro, Lorena Rodríguez, Victoria Figueroa, Cecilia Baginsky.
Departamento de Producción Agrícola, Facultad de Ciencias Agronómicas, Universidad de Chile, Santiago, Chile. Departamento de Nutrición, Facultad de Medicina, Universidad de Chile, Santiago, Chile. Departamento de Nutrición y Alimentos, División de Políticas y Saludables, Ministerio de Salud.
RESUMEN: Actualmente los fitoesteroles son adicionados a los alimentos industrializados, lo que aumenta su costo y por lo tanto limita su consumo. Este manuscrito tiene como objetivo identificar alimentos que son una fuente natural de fitoesteroles, así como también analizar cómo el ambiente y el manejo productivo modifican su contenido, relacionando estos aspectos con la salud. Los fitoesteroles son compuestos presentes en las plantas con propiedades hipocolesterolémicas, que pueden contribuir a prevenir las enfermedades cardiovasculares. La ingesta diaria estimada de fitoesteroles varía entre 160 y 500 mg/día, sin embargo su acción beneficiosa se logra con consumos de 1500 mg a 2400 mg diarios. Las semillas de oleaginosas y de cereales son las mayores fuentes naturales de fitoesteroles. El amaranto es considerado un pseudocereal y entre los cereales tiene la mayor concentración de fitoesteroles con 178 mg/100 g, valor 5 veces superior al de la harina de trigo. El ambiente modifica el contenido de fitoesteroles de los alimentos, la sequía y temperaturas altas duplican su contenido en las semillas; la fertilización nitrogenada y la fecha de siembra pueden provocar cambios, pero se requieren más estudios al respecto. La selección de genotipos con mayor contenido de fitoesteroles y el estudio de la interacción genotipo ambiente, permitirá la identificación de aquellos genotipos con adaptación local para este carácter. El manejo productivo podrá aumentar la oferta de alimentos naturales ricos en fitoesteroles, contribuyendo a una mayor oferta de alimentos protectores de la salud.
Palabras clave: Fitoesteroles, salud, amaranto, interacción GxA, ambiente.
SUMMARY. Natural sources of phytosterols and production factors that modify them. Currently phytosterols are added to processed foods, which increase their cost and therefore limits its use. This manuscript aims to identify foods that are a natural source of phytosterols, as well as analyze how the environment and production management modify its content, linking these aspects with health. Phytosterols are compounds found in plants with hypocholesterolemic properties, which may help prevent cardiovascular diseases. The estimated daily intake of phytosterols varies between 160 and 500 mg/day, but its beneficial effect is achieved with 1,500 to 2,400 mg daily consumption. Oil and cereal seeds are the largest natural sources of phytosterols. Amaranth is considered a pseudocereal and among the cereals has the highest concentration of phytosterols with 178 mg/100 g, value 5 times higher than wheat flour. Environment modifies phytosterol content in food, drought and high temperatures can double their content in seeds; nitrogen fertilization and planting date can cause changes, but more studies are needed. The selection of genotypes with higher phytosterol content and studying the genotype x environment interaction, allow the identification of those genotypes with local adaptation for this character. The production management will increase the supply of natural foods rich in phytosterols, contributing to a greater supply of health protective foods.
Key words: Phytosterols, health, amaranth, interaction GxE, environmental.
INTRODUCCION
El problema de salud pública más importante actualmente en el mundo y en América Latina, incluyendo Chile, son las enfermedades no transmisibles vinculadas a la dieta, como las cardiovasculares. Enfrentar este problema requiere un cambio en los entornos alimentarios de tal modo que se aumente la oferta de alimentos saludables y se promueva su consumo. Existen compuestos bioactivos de reconocido valor nutricional y preventivo como los fitoesteroles, que pueden contribuir a reducir la absorción de colesterol y por lo tanto disminuyen un importante factor de riesgo cardiovascular. Actualmente, la tendencia ha sido aislar estos compuestos bioactivos y adicionarlos a los alimentos industrializados, lo que aumenta su costo y por lo tanto limita su consumo.
Una de las estrategias para impulsar el mayor consumo de compuestos bioactivos protectores de la salud como es el caso de los fitoesteroles podría ser a través del aumento de sus concentraciones en alimentos que naturalmente los contienen utilizando para tal el manejo agronómico. Para ello se debe conocer las especies de mayor aporte, como también identificar los factores de producción que lo potencian como el ambiente y el manejo productivo. Este manuscrito tiene como objetivo identificar alimentos que son fuente natural de fitoesteroles, analizar cómo el ambiente y el manejo productivo modifican su contenido, relacionando estos aspectos con la salud.
Función y estructura de los fitoesteroles
Los fitoesteroles y sus productos de reducción química los fitoestanoles, son esteroles de origen vegetal que tienen amplia distribución en la naturaleza. Corresponden a metabolitos secundarios de las plantas, que son sintetizados y utilizados por las células, y aunque no son esenciales tienen un papel fundamental en la sobrevivencia de las plantas. Son compuestos claves en la formación de microdominios (agregados de lípidos que compartimentan procesos celulares) en la membrana plasmática (1). Además, desempeñan un papel esencial en la regulación de la fluidez y una cadena carbonada con 9 a 10 carbonos (8). Su estructura química es parecida a la del colesterol; sin embargo, difieren estructuralmente. El colesterol posee 27 átomos de carbono (C27) y los fitoesteroles 28 o 29, debido a la presencia de sustituyentes de tipo metilo (C1) o etilo (C2) en la cadena lateral de la molécula (Figura 1).
Según Brufau et al, 2008 (2), se han identificado 250 estructuras diferentes de fitoesteroles, siendo los más comunes el β-sitoesterol, el campesterol y el stigmasterol (9,10) (Figura 1). Los fitoesteroles se producen a través de la biosíntesis de los isopropenoides, que ocurre exclusivamente en el citoplasma y que consta de más de 25 reacciones catalizadas por diferentes enzimas (11). Se generan a partir de moléculas de acetil-CoA y por la actividad enzimática de la enzima acetil- CoAcarboxilasa (ACC), convirtiendo la Acetil-CoA en 3-hidroxi-3-metilglutaril CoA, el cual a su vez se reduce a melovato. El melovato mediante procesos sucesivos de fosforilaciones y una descarboxilación es transformado en isoprenoide, el que finalmente da origen a los fitoesteroles (12).
Alimentación y salud: fitoesteroles
Actualmente hay una gran preocupación por las enfermedades crónicas no transmisibles como permeabilidad de la membrana (2). Son precursores hormonales, involucrados en el proceso de embriogénesis de la planta, tienen un papel fundamental en el crecimiento y en los procesos de desarrollo a través de la división celular, como también en la morfogénesis (3). Participan en la defensa de la planta frente a diferentes estreses bióticos (4-5) o abióticos (6), actuando como señales moleculares dentro de la planta o entre la planta y su entorno (condiciones ambientales o presencia de microorganismos).
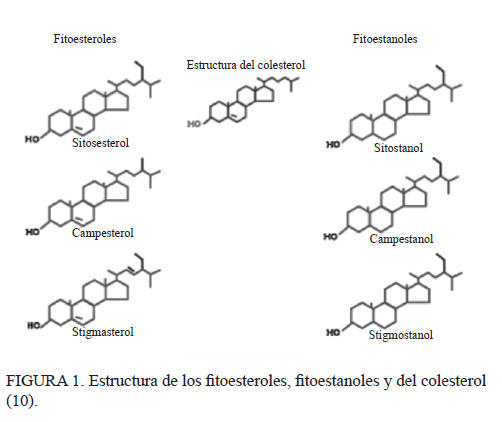
Los fitoesteroles pertenecen al grupo de los compuestos isoprenoides (7), tienen un núcleo de 17 carbonos dispuestos en 4 anillos con un grupo 3-β hidroxilo, a menudo con un doble enlace en la posición 5,6 y
las cardiovasculares, las dislipidemias, la diabetes, la hipertensión y el cáncer. Ello debido a su alta prevalencia, constituyéndose en la principal causa de mortalidad, morbilidad y discapacidad precoz en muchos países miembros de la Organización para la Cooperación y el Desarrollo Económico (OCDE) (13).
Las enfermedades crónicas no transmisibles están asociadas a entornos y estilos de vida poco saludables, mala alimentación, sedentarismo y tabaquismo, entre otros. La Encuesta Nacional de Salud (ENS 2009-2010) muestra que en Chile más del 60% de la población sufre mal nutrición por exceso (sobrepeso u obesidad), más de un 30% padece hipertensión arterial, casi un 40% dislipidemias y cerca de un 10% tiene diabetes (14). Además, la misma encuesta indica que el 89% de la población es sedentaria, el consumo de sal (9,8 g/día) duplica las recomendaciones (5,0 g/día) y solamente el 15% consume las 5 porciones diarias de frutas y verduras recomendadas por el Ministerio de Salud (15).
En las últimas décadas se ha dado un creciente cambio en la oferta y la demanda de alimentos y en los patrones de alimentación. Ha aumentado el consumo de alimentos ultraprocesados (16,17) que se relacionan a una mayor carga de enfermedades crónicas no transmisibles, y ha disminuido el consumo de preparaciones culinarias tradicionales (18). En Chile, las Guías Alimentarias para la Población (19) recogen gran parte de las recomendaciones internacionales respecto del consumo de alimentos saludables. Sin embargo, tanto en la población como en la industria chilena crece también el interés por alimentos más saludables, en especial aquellos que contienen nutrientes bioactivos que puedan contribuir a prevenir enfermedades cardiovasculares y cánceres (20), tales como ácidos grasos poliinsaturados omega 3, fibra y fitoesteroles.
Los fitoesteroles no son sintetizadas por los seres humanos, se absorben mal y se excretan más rápido desde el hígado que el colesterol, lo que explica su bajo contenido en el tejido humano. Se estima que la ingesta diaria de fitoesteroles se encuentra en un rango entre 160 mg/día y 500 mg/día (21), lo que equivale a menos de la mitad de las recomendaciones para obtener efectos beneficiosos (22).
Entre los principales beneficios asociados al consumo de fitoesteroles está la regulación que ejercen sobre el colesterol total, a través de su solubilización y de la competencia por espacio en las micelas (23). Una alimentación rica en fitoesteroles puede llegar a producir una disminución de hasta un 15% del colesterol plasmático y de un 20% del colesterol LDL. Para ejercer su acción los fitoesteroles deben ser consumidos en cantidades entre 1500 mg – 2400 mg diarios (24).
Fitoesteroles en alimentos
Estos compuestos están en forma natural en plantas, encontrándose las mayores concentraciones en semillas, tallos, hojas y frutos (10). A nivel industrial los fitoesteroles han sido utilizados para enriquecer ciertos alimentos como el pan, los cereales, las pastas, productos lácteos (leche, yogurt), jugos de fruta y margarinas (25). Sin embargo su producción y consumo son muy limitados dado su alto costo. Entre las especies vegetales existe una gran variabilidad en el contenido de fitoesteroles (5). En frutas y verduras su contenido es bajo, encontrándose valores de 2 mg/100g en sandías hasta 24 mg/100g en naranjas, mientras que en las verduras los valores fluctúan entre 3 mg/100g en berenjenas hasta 54 mg/100g en arvejas (10).
Las semillas de oleaginosas y de cereales son las mayores fuentes naturales de fitoesteroles. En este sentido, semillas de oleaginosas como canola tienen 399 mg/100g (12), soya 353 mg/100g (26), girasol 225 mg/100g (27) y maní 127 mg/100g (28). En semillas de cereales, señalan valores para centeno, trigo, cebada y avena de 110 mg, 76 mg, 83 mg y 52 mg/100g, respectivamente (29). Otro trabajo en centeno, cebada y maíz han demostrado que los valores más altos se encuentran en centeno con 76 mg/100g, y los más bajos en maíz con 44 mg/100g (Tabla 1) (30). En arroz se han encontrado valores cercanos a 80 mg/100g (31), y en sorgo se señalan valores de 48 mg/100g (32).
Los pseudocereales son especies ricas en carbohidratos y en la dieta de seres humanos reemplazan a los cereales, sin embargo no pertenecen a la familia Graminaceae (donde se encuentran los cereales). En este grupo destacan especies como la quinoa (Chenopodium quinoa), el amaranto (Amaranthus spp.) y el alforfón (Fagopyrum esculentum). En la quinoa el contenido de fitoesteroles es de 83 mg/100g y 107 mg/100g en alforfón, valores más altos que los encontrados en cereales (30). En el caso de amaranto, se señalan valores de 178 mg/100g,
destacándose como el pseudocereal con el mayor contenido de fitoesteroles (30) incluso superior al de los cereales. En el caso del trigo, el mayor consumo se hace como harina refinada, la cual corresponde sólo a la sección del endosperma de la semilla, que contiene 36 mg de fitoesteroles/100g, valor muy inferior al encontrado en la harina de trigo integral (Tabla 1).

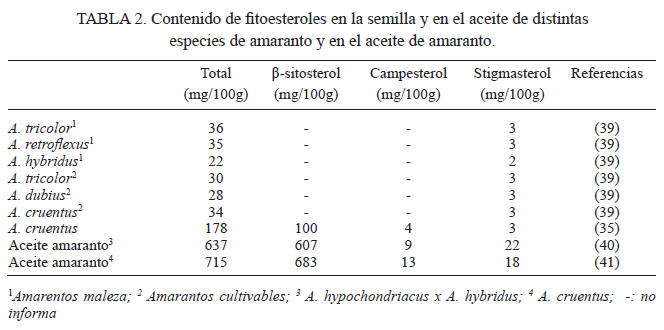
Se estima que hay 61 especies de amaranto (Amaranthus spp.) en el mundo, con una gran diversidad genética (33). El contenido de lípidos en la semilla de amaranto varía entre 5,7 y 10,9%, con un promedio de 8,8%, variabilidad que también se refleja en su contenido de fitoesteroles (34). Los primeros estudios fueron hechos en cinco especies de amaranto (A. tricolor, A. retroflexus, A. hybridus, A. dubius, A. cruentus), encontrándose los valores más altos de contenido de fitoesteroles dentro de la especie considerada como malezas (A. tricolor) con 36 mg/100g y dentro de las especies cultivables, en A. cruentus con 34 mg/100g (Tabla 2) (35). Estudios recientes en semillas de A. cruentus señalan valores de 178 mg/100g, muy superiores a lo informado (35), atribuyendo esta gran diferencia a los distintos métodos de extracción para su cuantificación (36). Los principales fitoesteroles encontrados en el aceite y semillas de amaranto son, en orden de importancia, el β-sitoesterol, el campesterol y el stigmasterol; sus cantidades varían entre especies y variedades (37,38), observándose que más del 50% del total de fitoesteroles corresponde a β-sitoesterol (36, 37, 38).
El contenido de fitoesteroles tiene una gran variabilidad genética dentro de una misma especie (39). Este carácter tiene una alta heredabilidad (0,84-0,91) y podría ser utilizada en programas de fitomejoramiento (12). En semillas de oleaginosas como el girasol (Helianthus annuus L.) se han llevado estudios para determinar la variabilidad intraespecífica (dentro de la especie) en su contenido de fitoesteroles, observándose que en 464 ecotipos provenientes de 47 genotipos, el contenido fluctuó entre 143 hasta 471 mg/100g de semilla. También varió el tipo de fitoesterol presente; así, el sitoesterol fluctuó entre 45,1 - 65,0%, el stigmasterol entre 5,2 - 14,2% y el campesterol entre 3,8 - 16,7% del contenido total de fitoesteroles (35). Resultados similares fueron encontrados en 9 líneas de girasol (40), mientras que en 27 variedades modernas de canola (Brassica napus L.) se cuantificaron fluctuaciones entre 357 y 480 mg/100g de semilla. Se encontró también variabilidad genética en la cantidad de sitoesterol, campesterol, brassicasterol y avenasterol, con valores entre 180 - 246 mg/100g, 116 - 174 mg/100g, 27 - 50 mg/100g y 7 - 13 mg/100g, respectivamente (12).
Otros estudios en leguminosas proteaginosas (especies que producen en sus semillas altos contenidos de proteínas y grasas) como el maní, han demostrado también la existencia de esta variabilidad; en tres variedades comerciales de maní los valores fluctuaron entre 117 y 138 mg/100g (28). En otra especie proteaginosa como la soya, la evaluación de 11 líneas determinó valores que fluctuaron entre 235 y 405 mg/100g (40).
En cereales como el trigo, el contenido de fitoesteroles de 23 variedades comerciales varió entre 49 y 80 mg/100g de semillas (39). Por su parte en siete variedades de avena, se han señalado rangos de variación entre 37 - 46 mg/100g (41); mientras que en seis variedades de arroz se han señalado valores entre 76 - 95 mg/100g (31).
Efecto del ambiente en el contenido de fitoesteroles
El ambiente es capaz de provocar los mayores cambios en el contenido de fitoesteroles (42, 43), llegando a representar hasta el 90% de la variación total observada para este carácter (44). Factores como el tipo de suelo y características climáticas pueden variar el contenido de fitoesteroles (45, 46, 47), al igual que prácticas agronómicas, estreses abióticos y bióticos (46, 48).
Diversos autores sugieren que los fitoesteroles están implicados en la respuesta de las plantas a estreses por baja y alta temperatura, sequía, alta concentración de sal y ataques de patógenos (49). Este hecho estaría relacionado principalmente a su papel como precursor en la biosíntesis de brasinoesteroides (hormonas vegetales que influyen en diferentes procesos fisiológicos de las plantas como la elongación, el desarrollo vascular y la división celular) (3, 50), y su capacidad de resistir la oxidación dentro de la membrana celular (29). En este sentido, los estudios han indicado que los fitoesteroles y ácidos grasos insaturados pueden estar implicados en los mecanismos de adaptación de las plantas a temperaturas bajas extremas entre -4,5 a -2,5 °C (31).
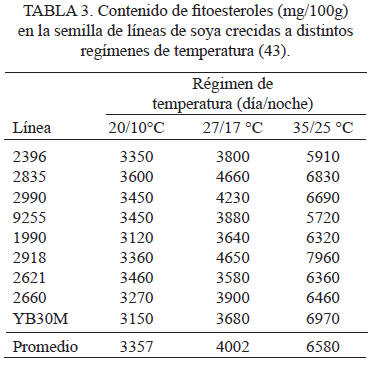
En estudios llevados a cabo bajo condiciones controladas de aumento de la temperatura en un cultivo de soya, se observó que las semillas duplicaron la concentración de fitoesteroles a altas temperaturas (Tabla 3), determinándose un aumento de campesterol a expensas de estigmasterol y β-sitosterol (40). En condiciones de campo, se determinó que el contenido de fitoesteroles en semillas de trigo cultivado en climas más cálidos y secos, presentaron mayor contenido de fitoesteroles en comparación de aquellos que fueron sembrados en un clima más frío y lluvioso (51). Una respuesta similar fue encontrada en variedades de arroz, obteniendo los mayores valores de fitoesteroles cuando fueron cultivadas en una estación seca y con altas temperaturas, en comparación a aquellos cultivados en condiciones más frías y húmedas (52). Resultados semejantes fueron observados en genotipos de sorgo (53) y trigo (42). Sin embargo, otros estudios han determinado un menor contenido de fitoesteroles en años con alta temperatura y baja precipitación durante el llenado de grano (31).
En términos generales existen muy pocos estudios sobre el efecto de prácticas agronómicas como riego, fertilización, densidad y fecha de siembra, sobre el contenido de fitoesteroles y también de otros nutrientes y no nutrientes. Ensayos llevados a cabo en canola, determinaron una disminución en el contenido de fitoesteroles en semillas cuando se aplicó nitrógeno al cultivo, con variaciones entre 370 mg/100g, cuando las plantas no fueron fertilizadas con nitrógeno, a 352 mg/100g con aplicaciones de 130 kg N/ha. Esto podría deberse a que la fertilización nitrogenada provoca un aumento en el rendimiento en semilla de canola y en la cantidad total de aceite, sin embargo, la concentración de aceite disminuye y por lo tanto es esperable que la concentración de fitoesteroles por gramo de semilla también disminuya (54).
En cereales de invierno, las fechas de siembra tardías someten el cultivo a mayores temperaturas de crecimiento, especialmente durante el llenado de grano, por lo que sería probable observar aumentos del contenido de fitoesteroles con este manejo. Sin embargo, estudios realizados en 20 genotipos de trigo, señalan no haber encontrado una variación relevante en el contenido de fitoesteroles en dos fechas diferentes de siembra (con temperatura media durante el llenado de grano de 18 y 22 °C, respectivamente) (39).
Interacción genotipo x ambiente en el contenido de fitoesteroles
Como se ha mencionado anteriormente, el genotipo o variedad puede cambiar su contenido de fitoesteroles con el ambiente. Sin embargo, también el genotipo que tiene el mayor contenido de fitoesteroles en un ambiente determinado puede no lograrlo en otro ambiente y este cambio de orden de los genotipos en los distintos ambientes se conoce como interacción genotipo ambiente (GxA) (55).
Una evaluación del efecto del genotipo y el ambiente sobre el contenido de fitoesteroles en cuatro variedades de trigo candeal, cultivados en tres años consecutivos bajo manejo tradicional y orgánico (6 ambientes) indica que la interacción GxA fue significativa y explicó una proporción de la variación total similar a la del genotipo (44). De esta manera, en una localidad con menor precipitación y día más corto, la variedad Daepoong presentó el mayor valor con 3,2 mg/100g, mientras que en la localidad con mayor precipitación y día más largo, esta misma variedad fue una de las que tuvo el menor contenido con 0,2 mg/100g. Una situación similar ha sido señalada en otras variedades de trigo (42), sorgo (53) y centeno (31).
Dada la importancia de la interacción GxA, esta debe ser considerada para las recomendaciones de introducción de genotipos por zonas de cultivo. De esta manera, se podría potenciar el contenido de fitoesteroles, identificando genotipos con adaptación local o estable en la producción de estos compuestos.
Fitoesteroles y salud: regulación de mensajes en los alimentos
En Chile, la Resolución Exenta N°764/09 regula los mensajes saludables que pueden ser asociados a nutrientes u otros factores alimentarios presentes en los alimentos. Esta resolución contempla un listado de 18 declaraciones de propiedades saludables autorizadas, las que deben cumplir con requisitos de contenido, matriz alimentaria y marco del mensaje autorizado (15).
Respecto de fitoesteroles, fitoestanoles y enfermedad cardiovascular, el mensaje autorizado en la Resolución 764 es: Entre muchos factores que afectan las enfermedades cardiovasculares, las dietas que contengan ésteres de fitoesteroles y/o ésteres de fitoestanoles y que sean bajas en grasas saturadas y colesterol y sin ácidos grasos trans, pueden contribuir a reducir los niveles de colesterol y el riesgo de estas enfermedades. Para su uso se exige que la matriz alimentaria, objeto de la adición, sea baja en grasa saturada (se eximen de esta condición los aceites, aderezos de ensaladas y margarinas que sean exclusivamente de origen vegetal), baja en colesterol y libre de ácidos grasos trans, y si el contenido de grasa total supera los 13 g por cada 50 g de producto deberá decir en el panel principal ver contenido de grasas en la información nutricional. Se exige además que el alimento tenga un mínimo de 0,65 g de ésteres de fitoesteroles y/o un mínimo de 1,7 g de ésteres de fitoestanoles y establece una recomendación de consumo de al menos 1,3 g/día de ésteres de fitoesteroles y/o 3,4 g/día de ésteres de fitoestanoles.
En Estados Unidos (EEUU), la Food and Drug Administration (FDA) revisó en el año 2011 el mensaje saludable relacionado a los fitoesteroles y su relación con las enfermedades cardiovaculares. La propuesta fue de una ingesta diaria de al menos 2000 mg de fitoesteroles como parte de una dieta baja en grasas saturadas y colesterol para la obtención de los efectos benéficos a la salud, y estableció que los alimentos deben contener al menos 500 mg de fitoesteroles por porción de consumo en este país para tener el mensaje saludable (56).
La agencia European Food Safety Authority (EFSA), de la Unión Europea, indica una recomendación de ingesta de entre 1500 mg a 3000 mg diarios, la que se concentra principalmente en productos industrializados como yogurt, margarinas o aceites (57). En Brasil, la Agencia Nacional de Vigilância Sanitaria (ANVISA) aprobó un mensaje saludable para alimentos ricos en fitoesteroles en los cuales su contenido debe ser de al menos 800 mg por porción. El marco del mensaje indica que los fitoesteroles ayudan en la reducción de la absorción del colesterol. Su consumo debe estar asociado a una alimentación equilibrada y hábitos de vida saludables (58).
CONCLUSIONES
Los fitoesteroles son factores alimentarios que reducen la absorción de colesterol en el intestino por competencia, ya que poseen una estructura química similar al colesterol. Una dieta rica en fitoesteroles puede reducir el colesterol total y el colesterol LDL (dañino para la salud). La ingesta diaria estimada de fitoesteroles varía entre 160 y 500 mg/día, sin embargo su acción beneficiosa se logra con consumos de 1500 mg a 2400 mg diarios. Esto ha implicado que se promueva su consumo y que se regule el uso de un mensaje saludable que comunica su presencia en los alimentos y su efecto positivo sobre los niveles de colesterol y como factor protector de enfermedades cardiovasculares.
Los fitoesteroles se encuentran también en forma natural en los alimentos. Las semillas de oleaginosas y de cereales son las mayores fuentes naturales de fitoesteroles y estas concentraciones pueden ser aumentadas a través del manejo agronómico. El pseudocereal amaranto puede alcanzar 178 mg de fitoesteroles por 100 g, valor cinco veces superior a la harina refinada de trigo. Es muy probable que el contenido de fitoesteroles pueda aumentarse al sembrar los cultivos en zonas más cálidas y secas.
Estrategias agronómicas como riego deficitario, fertilización y fecha de siembra pueden afectar las concentraciones de este bioactivo, pero se requiere de más estudios para su correcta implementación. La selección intraespecífica de genotipos con mayor contenido de fitoesteroles y el estudio de la interacción GxA, permitirá la identificación de genotipos con adaptación local para este carácter y el manejo de estos factores productivos podrá aumentar la oferta y el contenido de fitoesteroles en alimentos naturales.
Aplicando estas estrategias se puede mejorar la oferta de alimentos naturales ricos en fitoesteroles lo que puede contribuir a mejorar la dieta y a reducir la prevalencia de las enfermedades crónicas no transmisibles, integrando el conocimiento en nutrición, salud, agricultura y ambiente.
AGRADECIMIENTOS
Este trabajo fue financiado por CORFO Innova Línea 1. Código 2013-25477.
REFERENCIAS
1. Roche Y, Gerbeau P, Buhot B, Thomas D, Bonneau L, Gresti J, Mongrand S, Perrier J. Depletion of phytosterols from the plant plasma membrane provides evidence for disruption of lipid rafts. FASEB J 2008, 22: 980-991. [ Links ]
2. Brufau G, Canela M, Rafecas, M. Phytosterols: physiologic and metabolic aspects related to cholesterol-lowering properties. Nutr Res 2008, 28: 217–225. [ Links ]
3. Schaller H. The role of sterols in plant growth and development. Prog Lipid Res 2003, 42: 163–175. [ Links ]
4. Kessler A, Baldwin I. Plant responses to insect herbivory: the emerging molecular analysis. Annu Rev Plant Biol 2002, 53:299–328. [ Links ]
5. Lattanzio V, Lattanzio V, Cardinali A. Role of phenolics in the resistance mechanisms of plants against fungal pathogens and insects. Phytochemistry: Advances in Research 2006, 23-67. [ Links ]
6. Ramakrishna A, Ravishankar G. Influence of abiotic stress signals on secondary metabolites in plants. Plant Signal Behav 2011, 6: 1720-1731. [ Links ]
7. Ramadan M. Tocol and phytosterol composition of edible oils in the egyptian market. J Food Process Pres 2012, 36: 531-538. [ Links ]
8. Fernandes P, Cabral J. Phytosterols: applications and recovery methods. Bioresource Technol 2007, 98: 2335-2350. [ Links ]
9. Gajewski M, Przybyl J, Kosawskaand O, Szymczak P. Some factors influencing free sterols content in broccoli (Brassica oleracea L. var. Botrytis ItalicalicaPlenck). J Food Biochem 2009, 33: 881-894. [ Links ]
10. Han J, Yang Y, Yuang M. Contents of phytosterols in vegetables and fruits commonly consumed in china. Biomed Environ Sci 2008, 21: 449- 453. [ Links ]
11. Benveniste, P. Sterol metabolism. Meyerowitz EM, Somerville C (eds) The Arabidopsis book. American Society of Plant Biologists 2002; 1–31.
12. Amar S, Becker H, Moellers C. Genetic variation in phytosterol content of winter rapeseed (Brassica napus L.) and development of NIRS calibration equations. Plant Breed 2009, 128: 78-83. [ Links ]
13. OECD. Estadísticas de la OCDE sobre la salud 2014 Chile en comparación. En http://www.oecd.org/ els/health-systems/Briefing-Note-CHILE-2014-in- Spanish.pdf [Citado el 9 de Diciembre de 2015].
14. MINSAL. Ministerio de Salud. Encuesta Nacional de Salud ENS 2009-2010. En http://web.minsal.cl/portal/ url/item/bcb03d7bc28b64dfe040010165012d23.pdf [Citado el 17 de Junio de 2015].
15. MINSAL. Ministerio de Salud. Ministerio de Salud. Normas técnicas sobre directrices nutricionales que indican, para la declaración propiedades saludables de los alimentos. Resolución Exenta N° 764/09. En http:// web.minsal.cl/reglamento_san_alimentos [Citado el 17 de Junio de 2015].
16. Crovetto M, Uauy R. Changes in processed food expenditure in the population of Metropolitan Santiago in the last twenty years. Rev Méd Chile 2012, 140:305-312.
17. Crovetto M, Uauy R, Martins A, Moubarac J, Monteiro C. Household availability of ready-to-consume food and drink products in Chile: impact on nutritional quality of the diet. Rev Méd Chile 2014, 142:850-858.
18. Louzada M, Martins A, Canella D, Baraldi L, Levy R, Claro R, Moubarac J. Cannon G, Monteiro C. Ultraprocessed foods and the nutritional dietary profile in Brazil. Rev Sáude Pública 2015, 49:1-11.
19. MINSAL. Ministerio de Salud. Guías de Alimentación Sana. En http://web.minsal.cl/alimentos_nutricion [Citado el 29 de Julio de 2015].
20. Araya H, Lutz R. Alimentos funcionales y saludables. Rev Chil Nutr 2003, 30: 8-4.
21. Pollak OJ, Kritchevsky D. Sitosterol. In: Clarkson, T.B., Kritchvsky D, Pollak OJ (Eds.). Monographs on Atherosclerosis. Karger, Basel, Switzerland. 1981; 219p.
22. Valenzuela A, Ronco A. Fitoesteroles y fitoestanoles: aliados naturales para la protección de la salud cardiovascular. Rev Chil Nutr 2004, 31: 161-169.
23. Cusack L, Fernandez M, Volek J. The food matrix and sterol characteristics affect the plasma cholesterol lowering of phytosterol/phytostanol. Adv Nutr 2013, 4: 633–643.
24. Laitinen K, Gylling H. Dose-dependent LDLcholesterol lowering effect by plant stanol ester consumption: clinical evidence. Lipids Heal Dis 2012; 11:140.
25. Clifton P, Noakes M D S, Al, E. Cholesterol-lowering effects of plant sterol esters differ in milk, yoghurt, bread and cereal. Eur J Clin Nutr 2004, 58: 503–509.
26. Costa J, Amaral J, Mafra I, Oliveira B. Refining of Roundup Readysoya bean oil: Effect on the fatty acid, phytosterol and tocopherol profiles. Eur J Lipid Sci Tech 2011, 113: 528-535.
27. Fernandez A, Velasco L, Fernandez J. Phytosterols in the seeds of wild sunflowers species. HELIA 2011, 34: 31-38.
28. Shin E, Pegg R, Phillips D, Eitenmiller R. Commercial peanut (Arachis hypogaea L.) cultivars in the United States: phytosterol composition. J Agric Food Chem 2010, 58: 9137-9146.
29. Piironen V, Lindsay D, Miettinen T, Toivo J, Lampi, A. Review. Plant sterols: Biosynthesis, biological function and their importance to human nutrition. J Sci Food Agric 2000, 80: 939–966.
30. Ryan, E., K. Galvin, T. OConnor, A. Maguire and N. OBrien. Phytosterol, squalene, tocopherol content and fatty acid profile of selected seeds, grains and legumes. Plant Foods Hum Nutr 2007, 62: 85-91.
31. Zangerberg M, Boskov H, JØrgensen J, Hellgren L. Cultivar and year to year variation of phytosterol content in rye (Secale cereal L.). J Agric Food Chem 2004, 52: 2593-2597.
32. Singh V, Moreau R, Hicks K. Yield and phytosterol composition of oil extracted from grain sorghum and its wet-milled fractions. Cereal Chem 2003, 80:126- 129.
33. Achigan E, Sogbohossou O, Maundu P. Current knowledge on Amaranthus spp.: research avenues for improved nutritional value and yield in leafy amaranths in sub-Saharan Africa. Euphytica 2014, 197: 303-317.
34. Valcárcel-Yamani B, Caetano da Silva S. Applications of quinoa (Chenopodium quinoa Willd.) and amaranth (Amaranthus spp.) and their influence in the nutritional value of cereal based foods. Food Public Health 2012, 2: 265-275.
35. Fernando T, Bean G. A comparison of the fatty acids and sterols of seeds of weedy and vegetable species of Amaranthus spp. J Am Oil Chem Soc 1985, 62: 89-91.
36. Ogrodowska D, Zadernowski R, Czaplicki S, Derewiaka D, Wronowska B. Amaranth seeds and products – The source of bioactive compounds. Polish J Food Nutr Sci 2014, 64: 1-6.
37. Marcone M, Kakuda Y, Yada R. Amaranth as a rich dietary source of sitosterol and other phytosterols. Plant Food Hum Nutr 2004, 58: 207–211.
38. Andrade de Castro L, Manólio R, Saldiva P, Ferrari R, Miguel A, Almeida C, Gomes J. Amaranth oil increased fecal excretion of bile acid but had no effect in reducing plasma cholesterol in hamsters. Lipids 2013, 48:609–618.
39. Alignan M, Roche J, Bouniols A, Cerny M, Mouloungui Z, Merah O. Effects of genotype and sowing date on phytostanol-phytosterol content and agronomic traits in wheat under organic agriculture. Food Chem 2009, 117: 219-225.
40. Vlahakis C, Hazebroek, J. Phytosterol accumulation in canola, sunflower, and soybean oils: effects of genetics, planting location, and temperature. J Am Oil Chem Soc 2000, 77: 49-53.
41. Määttä K, Lampi A, Petterson J, Fogelfors B, Piironen V, Kamal A. Phytosterol content in seven oat cultivars grown at three locations in Sweden. J Sci Food Agric 1999, 79: 1021-1027.
42. Chen, Y. Effect of genotype and environment on nutritional and health beneficial compounds in wheat grain. Beijing, China. China Agricultural University. 2004. 65p.
43. Nguyen H, Neelakadan A, Quach T, Valliyodan B, Kumar R, Zhang Z, Nguyen, H. Molecular characterization of Glycine max squalene synthase genes in seed phytosterol biosynthesis. Plant Physiol Biochem 2013, 73: 23-32.
44. Beleggia R, Platani C, Nigro F, De Vita P, Cattivelli L, Papa R. Effect of genotype, environment and genotype-by-environment interaction on metabolite profiling in durum wheat (Triticum durum Desf.) grain. J Cereal Sci 2013, 57: 183-192.
45. Haddada F, Manaï H, Oueslati I, Daoud D, Sánchez J, Osorio E, Zarrouk M. Fatty Acid, Triacylglycerol, and Phytosterol composition in six Tunisian olive varieties. J Agric Food Chem 2007, 55: 10941-10946.
46. Plumb J, Rhodes M, Lampi A, Buchgraber M, Kroon P. Phytosterols in plant foods: Exploring contents, data distribution and aggregated values using an online bioactives database. J Food Compos Anal 2011, 24: 1024–1031.
47. Sawadikiat P, Hongsprabhas P. Phytosterols and ϒ-oryzanol in rice bran oils and distillates from physical refining process. Int J Food Sci Technol 2014, 49: 2030-2036.
48. Ruggiero A, Vitalini S, Burlini N, Bernasconi S, Iriti M. Phytosterols in grapes and wine, and effects of agrochemicals on their levels. Food Chem 2013, 141: 3473–3479.
49. Asami T, Yoshida, S. Brassinosteroid biosynthesis inhibitors. Trends Plant Sci 1999, 4: 348–353. [ Links ]
50. Krishna P. Brassinosteroid-mediated stress responses. J Plant Growth Regul 2003, 22: 289–297. [ Links ]
51. Chen Y, Dunford N, Edwards J, Carver B, Goad C. Genotype and environment affect phytosterol content and composition of wheat. Cereal Chem 2009, 86: 96- 99. [ Links ]
52. Britz S, Prasad P, Moreau R, Allen L, Kremer D, Boote K. Influence of growth temperature on the amounts of tocopherols, tocotrienols, and γ-oryzanol in brown rice. J Agric Food Chem 2007, 55: 7559-7565. [ Links ]
53. Chung, I., Yong S, Lee J, Kim S. Effect of genotype and cultivation location on β-sitosterol and α-, β-, γ-, andδ-tocopherols in sorghum. Food Res Int 2013, 51: 971–976. [ Links ]
54. Gül M, Egesel C, Tayyar S, Kahriman, F. Changes in phytosterols in rapeseed (Brassica napus L.) and their interaction with nitrogen fertilization. Int J Agric Biol 2007, 9: 250-253. [ Links ]
55. Via S, Lande R. Genotype-environment interaction and the evolution of phenotypic plasticity. Evolution 1985, 39: 505-522. [ Links ]
56. FDA. Health claims: plant sterol/stanol esters and risk of coronary heart disease (CHD). En http://www.ecfr.gov/cgi-bin/textidx?c=ecfr;sid=502078d8634923ed c695b394a357d189;rgn=div8;view=text;node=21% 3A2.0.1.1.2.5.1.14;idno=21;cc=ecfr [Citado el 16 de Junio de 2015].
57. EFSA. Blood cholesterol reduction health claims on phytosterols can now be judged against EFSA new scientific advice. En http://www.efsa.europa.eu/en/press/news/nda090731.htm [Citado el 16 de Junio de 2015].
58. ANVISA. Alimentos com Alegações de Propriedades Funcionais e ou de Saúde, Novos Alimentos/ Ingredientes, Substâncias Bioativas e Probióticos. En http://www.anvisa.gov.br/alimentos/comissoes/tecno_lista_alega.htm [citado el 16 de junio 2015]. Recibido: 28-09-2015 Aceptado: 11-12-2015













