Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos Venezolanos de Puericultura y Pediatría
Print version ISSN 0004-0649
Arch Venez Puer Ped vol.71 no.1 Caracas Mar. 2008
Citocinas séricas en niños infectados con Giardia Lamblia.
Jorymar Leal M.(*), Pablo Ortega (*), Tania Romero A. (**)
(*) Inmunología. Docente-Investigadora adscrita al Laboratorio de Investigación en Malnutrición Infantil y Retardo Mental. Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. Venezuela.Gastroenterología Infantil y Nutrición Pediátrica en Latinoamérica. Docente-Investigador adscrito al Laboratorio de Investigación en Malnutrición Infantil y Retardo Mental. Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. Venezuela.
(**) Inmunología. Fundadora–Coordinadora del Postgrado de Inmunología. Facultad de Medicina, Universidad del Zulia. Venezuela.
Autor corresponsal: Dra. Jorymar Leal. Laboratorio de Investigación en Malnutrición Infantil. Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. Apartado 526. Maracaibo, 4001. Venezuela. Teléfono-Fax: 0261 7597250 – 0261 7597249. E-mail: jyleal@hotmail.com
RESUMEN
Introdución: La giardiasis intestinal es un problema de salud pública en los países en desarrollo. Aunque los mecanismos de inmunidad innata y adquirida son necesarios para el control de la infección, son escasos los estudios sobre la participación de las citocinas Th1 y Th2 en el control de la infección en humanos.
Objetivo: Determinar en niños infectados con Giardia lamblia (G. lamblia) las concentraciones séricas de las citocinas Th1 (IL-2 e IFNgamma) y Th2 (IL-4 e IL-10).
Métodos: Se seleccionaron 101 niños (3-6 años; F=52, M=49) nutricionalmente eutróficos; 62 niños no parasitados y 39 niños con trofozoitos y/o quistes de G. lamblia según estudio coproparasitológico. Las concentraciones séricas de IFN-gamma, IL-4 e IL-10 (pg/mL) fueron determinadas por el método ELISA y la IL-2 (U/mL) por el método EAISA. Para comparar las medias de los grupos se utilizó la prueba t de Student. Se consideró el 95% de confiabilidad estadística (p< 0,05).
Resultados: Nuestros resultados no evidenciaron diferencias estadísticamente significativas entre los valores séricos de las citocinas analizadas entre los niños no infectados y los infectados con G. lamblia.
Conclusión: Las proteínas antigénicas específicas de G. lamblia son pobres inmunógenos, por lo cual no son capaces de estimular las células linfoides para la producción de citocinas en suero, para ello son necesarios otros estudios in vivo e in vitro que permitan la caracterización del patrón de citocina Th1 y/o Th2, como uno de los elementos necesarsios para el control de la infección.
Palabras Clave: Citocinas – niños – Giardia lamblia.
SUMMARY
Introduction: Intestinal giardiasis is a public health problem in developing countries. Although the innate and adaptative immunity mechanisms are necessary for proper control of the infection, few studies have been published in humans on the role of cytokine Th1-Th2 in infection control. The aim of the present study was to analyze the serum concentration of Th1 cytokine (IL-2 and IFN-gamma) and Th2 (IL-4 and IL-10) in euthrophic children infected or not with Giardia lamblia (G. lamblia).
Methods:Were analyzed 101 children (3-6y; F=52, M=49) nutritionally eutrophic. Sixty two children free of G. lamblia and 39 infected. The serum concentration of IFN-gamma, IL-4 and IL-10 (pg/mL) were determined by ELISA method and IL-2 (U/mL) by EAISA method. The Students t test was applied to compare the groups. We considered 95% statistical significance (p<0.05).
Results: Cytokine values in children infected with G. lamblia were not statistically different from values in not infected children, probably due to the labile capacity of antigenic proteins to stimulate the immune response. Other in vivo and in vitro studies are necessary to detect the role of cytokine Th1-Th2 in infection control.
Key words: Cytokines – children – Giardia lamblia.
INTRODUCCIÓN:
Las giardiasis constituyen un problema de salud pública en el mundo, especialmente en los países en desarrollo como Venezuela (1,2), reportando en el Estado Zulia una prevalencia que oscila entre 18% y 45% (3-7), donde se encuentra asociado con bajo nivel educativo de la población, bajo índice de lactancia materna e insalubridad ambiental (3-7).
En humanos, esta infección es causada por Giardia lamblia (G. lamblia), un protozoario intestinal flagelado, que habita en el duodeno y en la porción proximal del yeyuno; existe en dos formas en la naturaleza: el trofozoito que es la forma de multiplicación del parásito en el interior del hospedero y el quiste o forma infectante que puede sobrevivir en el medio exterior (8, 9). Actualmente, se reconoce como patógeno puesto que se ha asociado a cuadros diarreicos y síndrome de malabsorción intestinal (10).
La susceptibilidad o resistencia a la infección por G. lamblia depende de diversos factores que incluyen la respuesta inmune del hospedero, el estado nutricional, la presencia de infecciones concomitantes, la heterogeneidad en la infectividad y patogenicidad de las cepas de G. lamblia y la flora intestinal normal (11). Los mecanismos de la respuesta inmunitaria con relación a la infección aún no son totalmente conocidos, sin embargo, han sido documentados en humanos y múridos la participación de los mecanismos de la inmunidad innata y adquirida, tanto humoral como celular, para el control de la infección por Giardia sp. (11,12).
Se ha señalado que el principal mecanismo de defensa del hospedero contra el parásito son los anticuerpos específicos contra los antígenos de superficie y citosólicos de G. lamblia, encargados de aglutinar los trofozoítos, reducir su motilidad y unión a las células epiteliales, y además de promover la destrucción del 98% de los parásitos in vitro (12, 13). Igualmente, la inmunidad mediada por células juega también un papel importante en las mucosas (12). Existen investigaciones realizadas in vivo e in vitro en modelos de ratones que han demostrado la participación de los linfocitos T cooperadores (T helper, Th) CD4+ en el control de la infección (12). Sin embargo, no se conoce la participación diferente de los subtipos de linfocitos TCD4+ colaboradores Th1 y Th2, y en consecuencia, de sus productos denominados citocinas, en la eliminación del parásito y/o producción de determinadas subclases de anticuerpos. Estudios en múridos han demostrado que las células TCD4+ Th1 secretan Interleucina 2 (IL-2), Interferón gamma (IFN-y), Factor de necrosis tumoral beta (TNF-b), IL-15 y Factor estimulante de colonias de granulocitos y macrófagos (GM–CSF), las cuales predominan en la inmunidad celular; entre tanto que, las células TCD4+ Th2 secretan IL-4, IL-5, IL-6, IL-9, IL-10, IL-13, Factor transformante del crecimiento b (TGF-b) y GM-CSF, las cuales participan en la inmunidad humoral (14).
Por ello, el objetivo de la presente investigación fue determinar en niños infectados con G. lamblia las concentraciones séricas de las citocinas Th1 (IL-2 e IFN-y) y Th2 (IL- 4 e IL-10).
MÉTODOS:
Sujetos: Se evalúo una población conformada por 256 niños (3-7 años) quienes asistían a un Centro de Educación situado en el Noroeste de Maracaibo-Venezuela, en una zona constituida por familias ubicadas en los estratos IV y V de pobreza crítica y extrema, estimada por el Método de Graffar, adaptado para Venezuela por Méndez Castellano y Méndez (15). Se seleccionó por muestreo aleatorio simple, una muestra de 113 niños, quienes fueron evaluados por antropometría, análisis clínico, coproparasitológico y determinación sérica de la proteína C reactiva. Se seleccionó una muestra que cumplió con los criterios de inclusión: edad entre 3 y 7 años, ambos sexos, eutróficos, con examen coproparasitológico positivo para G. lamblia y negativo para este protozoario y otras formas parasitarias, y sin patología aguda, crónica, o proceso inflamatorio activo. El presente estudio descriptivo y transversal cumplió con lo dispuesto en la Declaración de Helsinki por lo que fue aprobado por el Consejo Técnico del Instituto de Investigaciones Biológicas de la Facultad de Medicina de la Universidad del Zulia. Los padres o representantes legales de los niños dieron su consentimiento verbal y escrito para la inclusión del niño en el proyecto de investigación.
Evaluación nutricional - Antropométrica: Para la evaluación nutricional antropométrica, se establecieron las varia-bles Peso, Talla y Edad, y la combinación de éstas. Se aplicó el puntaje Z para el análisis de los indicadores Peso//Edad (P//E), Talla//Edad (T//E) y Peso//Talla (P//T), utilizando el programa estadístico Epi-Info, versión 6.04 (Centers for Diseases Control and Prevention, Atlanta, Georgia, U.S.A. OMS, 1994), tomando como base el patrón de referencia internacional del Centro Nacional de Estadística en Salud de USA (NCHS/OMS), válido para estudios en Latinoamérica. Valores de Puntaje Z entre +2 y ≥-2 Desviaciones Estándar (DE) fueron considerados indicativos de nutrición adecuada (eutróficos) y valores <-2 DE indicativos de desnutrición (16).
Toma de la muestra: Los niños eutróficos incluidos en el estudio fueron evaluados mediante interrogatorio y examen físico, además se les tomó una muestra de sangre (5 mL), por punción venosa antecubital, en ayunas, entre las 8:00-9:00 am, la cual fue vertida en un tubo sin anticoagulante, el cual fue trasladado en un medio refrigerado al Laboratorio de Investigación en Malnutrición Infantil, donde fue sometido a centrifugación a 3000 rpm durante 10 minutos, con el objeto de obtener el suero, el cual se repartió en dos alícuotas en tubos Eppendorf.
Análisis de la Proteína C Reactiva: Se tomó una alícuota para el análisis semicuantitativo de la Proteína C Reactiva (Wiener Lab), con el objeto de incluir en el estudio los niños eutróficos libres de infección al examen físico y con Proteína C reactiva negativa. El resto de las alícuotas fueron conservadas a -70 ºC hasta su estudio.
Evaluación Coproparasitologica: Previa información del representante legal del niño respecto a la toma de la muestra de heces, se recolectó una muestra seriada, la cual fue entregada al personal especializado y con comprobada experiencia en el área de análisis de muestras biológicas, para su procesamiento macroscópico y microscópico en el Laboratorio clínico ubicado en el Hospital de Especialidades Pediátricas de Maracaibo-Estado Zulia.
Determinación de las concentraciones séricas de las citocinas Th1 (IFN-y e IL-2) y Th2 (IL-4 e IL-10): Para la determinación de citocinas, las alícuotas de suero conservadas a -70 ºC, fueron transportadas y analizadas en el Laboratorio Regional de Referencia Virológica del Instituto de Investigaciones Clínicas de la Facultad de Medicina de la Universidad del Zulia. Para la determinación de IFN-y, IL-4 e IL-10 se aplicó el método de Inmunoanálisis Enzimático de doble anticuerpo (ELISA) y para la determinación de la IL-2, con el método de doble anticuerpo con sensibilidad amplificada (EAISA), una variante del método ELISA (BioSource Europe SA). Las concentraciones séricas de las citocinas se calcularon en el rango lineal de la curva de los estándares.
Análisis Estadístico: Los valores obtenidos de IFN-y, IL- 4 e IL-10 (pg/mL), y de IL-2 (U/mL), fueron expresados como Media ± Desviación Estándar (X±DE). Para comparar las medias de los grupos se utilizó la prueba t de Student para muestras independientes. Se consideró el 95% de confiabilidad estadística con una p< 0,05. El procesamiento de los datos se realizó con el programa de Sistema de Análisis Estadístico (SAS) (SAS Institute, Cary, NC).
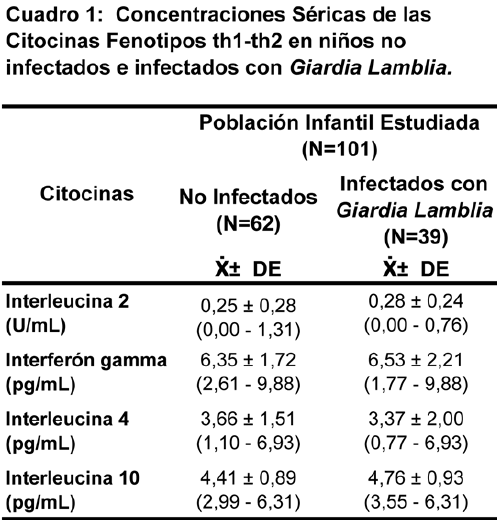
RESULTADOS: Se evaluó una muestra de 101 niños eutróficos (F=52; M=49), 62 niños no mostraron parásitos en las heces y solo 39 niños (34,48%) se encontraron infectados exclusivamente por G. lamblia al momento del examen coproparasitológico. No se observaron diferencias significativas con respecto a la edad y el sexo, sin embargo, la giardiasis fue más prevalente en el grupo de niños entre 5-6 años (51,30%) y en el sexo masculino (53,80%). El 53,84% de los niños infectados con G. lamblia. manifestaron síntomas gastrointestinales (diarrea, dolor abdominal y trastornos de la evacuación), entre tanto que, el 46,16% eran portadores asintomáticos. El Cuadro 1 I muestra los valores séricos de las citocinas Th1 (IFN-y e IL-2) y Th2 (IL-4 e IL-10) analizadas en los niños eutróficos no infectados y en los infectados con G. lamblia. Nótese que no se observaron diferencias estadísticamente significativas entre las concentraciones séricas de las citocinas analizadas en los grupos estudiados. Asimismo, el grupo de niños infectados con G. lamblia, sintomáticos y asintomáticos, no mostraron diferencias significativas entre sí y al compararlos con los niños no infectados (Datos no mostrados en el Cuadro).
DISCUSION:
En la presente investigación las concentraciones séricas de las citocinas del fenotipo Th1 (IFN-y e IL-2) y Th2 (IL-4 e IL-10) en los niños eutróficos no infectados no mostraron diferencias estadísticamente significativas con el grupo de niños infectados con G. lamblia. Nuestros resultados parecen ser contradictorios con otros estudios in vivo e in vitro realizados en humanos. Al respecto, Jung y col., observaron en cultivo de células epiteliales del colon de individuos infectados con G lamblia, que la expresión de los genes de las citocinas no fueron alteradas en los casos de infecciones por este protozoario intestinal no invasivo (17). Por otro lado, Baqai y col., no observaron variaciones en los valores séricos de IL-10, IL-2 y TNF-alfa en individuos infectados con G. lamblia (18), resultados similares a los detectados en el presente estudio. Sin embargo, Baqai y col., observaron en los individuos infectados con G. lamblia, un incremento significativo de IL-4 en suero, citocina que pudiese actuar como regulador del proceso inflamatorio asociado con la giardiasis (18). Además, Bayraktar y col., observaron en niños infectados con G lamblia, un incremento significativo de los valores séricos de TNF-alpha y el receptor soluble de la IL-2 (IL2Rs), valores que disminuían al suministrarles el tratamiento adecuado, por lo que según este estudio el predominio del fenotipo Th1 esta involucrado en la patogénesis de la giardiasis (19).
Otras investigaciones realizadas en animales por Singer y Nash (20) han señalado en ratones infectados por G. lamblia, que las concentraciones en suero de IFN-ã e IL-4 son similares al grupo no infectado. Por su parte, Zhou y col., han mostrado en las placas de Peyer y en los nódulos linfoides mesentéricos de ratones infectados por G. muris un incremento en la producción de IFN-ã, IL-4 e IL-5 (21).
Aunque poco se conoce acerca de los antígenos específicos de G. lamblia, existen diversas investigaciones que señalan que Giardia elimina el 70% de sus antígenos de superficie cada 24 horas. Asimismo, estas proteínas antigénicas son pobres inmunógenos, por lo cual no son capaces de estimular las células linfoides para la producción de citocinas en suero, no así en la lámina propia intestinal (22-24). Estas consideraciones nos conducen a manifestar que son necesarios otros estudios in vivo e in vitro que permitan la caracterización del comportamiento de las citocinas en suero y en sobrenadantes de cultivo de células mononucleares de sangre periférica (CMSP), intraepiteliales y de la lámina propia intestinal estimuladas o no con mitógenos, para comprender mejor la inmunobiología de la interacción entre el hospedero y Glamblia, así como el patrón de citocina Th1 y/o Th2, como uno de los elementos necesarios para el control de la infección.
Adicionalmente, dado que G lamblia es un protozoario que ataca la mucosa del yeyuno, se adhiere a los oligosacáridos presentes en las microvellosidades intestinales, además de que los trofozoitos pueden invadir la mucosa intestinal y localizarse en la lamina propia, especialmente en individuos inmunosuprimidos y malnutridos, provocando la destrucción de la barrera epitelial (23). Se hace necesaria la aplicación de métodos diagnósticos más precisos en áreas endémicas basados en biopsia del líquido duodenal por endoscopia para su análisis histológico y la detección por medio de anticuerpos inmunofluorescentes de G. lamblia, lo cual garantiza un 100% de sensibilidad (25). Por ello, en individuos con examen de heces negativo es relevante el uso de nuevos métodos de inmunodiagnóstico que permitan la detección temprana del protozoario en portadores asintomáticos, para evitar los consecuencias sobre su estado de salud y nutricional al recibir el tratamiento adecuado. Sin embargo, es necesario considerar como primera línea los programas de prevención en los hogares, las comunidades y las escuelas, y así mismo evaluar su repercusión, establecer mejoras y asegurar su continuidad para evitar la perpetuación de esta zoonosis y los problemas de salud por ella ocasionados en nuestras comunidades
Agradecimiento: Este trabajo fue financiado por el Consejo de Desarrollo Científico y Humanístico (CONDES) de la Universidad del Zulia. Nuestro reconocimiento al personal del Laboratorio Regional de Referencia Virológica del Instituto de Investigaciones Clínicas de la Facultad de Medicina de La Universidad del Zulia, en especial al Lic. Ricardo Atencio, por su valiosa colaboración; al personal del Laboratorio Clínico del Hospital de Especialidades Pediátricas de Maracaibo y al personal docente, padres y representantes de los niños del Centro Pre-escolar Rómulo Gallegos I.
REFEREnCIAS:
1. Urrestarazu M, Liprandi F, Pérez E, Gónzalez R, Pérez I. Características etiológicas, clínicas y sociodemográficas de la diarrea aguda en Venezuela. Rev Panam Salud Pública. 1999; 6: 149-154. [ Links ]
2. Devera R, Niebla G, Nastasi J, Velásquez V, González R. Giardiasis en escolares de Ciudad Bolívar, Estado Bolívar, Venezuela. Rev Biomed 1998; 9: 145-150. [ Links ]
3. Chacín de Bonilla L. El problema de las parasitosis intestinales en Venezuela. Invest Clin. 1990; 31: 1. [ Links ]
4. Chacín-Bonilla L, Dikdan Y, Guanipa N, Villalobos R. Prevalencia de Entamoeba histolytica y otros parásitos intestinales en un barrio del Municipio Mara, Estado Zulia, Venezuela. Invest Clin 1990; 31: 3-15. [ Links ]
5. Rivero Z, Chourio G, Díaz I, Cheng R, Rucsón G. Enteroparásitos en escolares de una institución pública del municipio Maracaibo, Venezuela. Invest Clin 2000; 41: 37- 57. [ Links ]
6. Rivera M, De La Parte M, Hurtado P, Magaldi L, Collazo M. Giardiasis intestinal. Invest Clin 2002; 43: 119-128. [ Links ]
7. Cheng R, Castellano J, Díaz O, Villalobos R. Prevalencia de Giardiasis en Hogares de Cuidado Diario en el municipio San Francisco, estado Zulia, Venezuela. Invest Clin 2002; 43: 231-237. [ Links ]
8. Thompson R, Reynoldson J, Mendis A. Giardia and Giardiasis. Adv Parasitol 1993; 32: 71-160. [ Links ]
9. Ortega Y, Adam R. Giardia: Overview and Update. Clin Infec Dis 1997; 25(3): 545-550. [ Links ]
10. Solomons N. Pathways to the impairment of human nutritional status by gastrointestinal pathogens. Parasitology 1993; 107: 19S-35S. [ Links ]
11. Singer S, Nash T. The role of normal flora in Giardia lamblia infections in mice. J Infect Dis 2000; 181: 1510-1512. [ Links ]
12. Faubert G. Immune response to Giardia duodenalis. Clin Microbiol Rev 2000; 13: 35-54. [ Links ]
13. Langford T, Housley M, Boes M, Chen J, Kagnoff M, Gillin F, et. al. Central importance of immunoglobulin A in host defense against Giardia spp. Infect Immun 2002; 70: 11-18. [ Links ]
14. Oppenheim J, Ruscetti F. Citocinas. En: Parslow T, Stites D, Terr A, Imboden J, edotores. Inmunología básica y clínica. 10ª Edición. México. El Manual Moderno; 2002, P 167-187. [ Links ]
15. Méndez H, de Méndez M. Estratificación social y biología humana. Arch Ven Puer Ped 1986; 49: 93-104. [ Links ]
16. Waterlow J. Evaluación del Estado Nutricional en la Comunidad. En: Malnutrición Proteico-Energética. Publicación Científica N° 555. Washington, D.C. E.U.A. Organización Panamericana de la Salud – Organización Mundial de la Salud. 1996; 260-280. [ Links ]
17. Jung HC, Eckmann L, Yang SK, Panja A, Fierer J, Morzycka- Wroblewska E, et al. A distinct array of proinflammatory cytokines is expressed in human colon epithelial cells in response to bacterial invasion. J Clin Invest. 1995; 95(1):55-65. [ Links ]
18. Baqai R, Kazmi SU, Qureshi H. Role of cytokines in giardiasis. J Pak Med Assoc. 2000; 50(4):113-115. [ Links ]
19. Bayraktar MR, Mehmet N, Durmaz R. Serum cytokine changes in Turkish children infected with Giardia lamblia with and without allergy: Effect of metronidazole treatment. Acta Trop. 2005; 95(2):116-122. [ Links ]
20. Singer, SM., Nash TE. T-cell-dependent control of acute Giardia lamblia infections in mice. Infect Immun 2000; 68:170-175. [ Links ]
21. Zhou P, Li E, Zhu N, Robertson J, Nash T, Singer S. Role of Interleukin-6 in the Control of Acute and Chronic Giardia lamblia Infections in mice. Infect Immun 2003;71(3):1566- 1568. [ Links ]
22. Ebert E. Giardia induces proliferation and interferon ã production by intestinal lymphocytes. Gut 1999; 44: 342-346. [ Links ]
23. Kasper L, Buzoni D. Minireview Ups and downs of mucosal cellular immunity against protozoan parasites. Infect Immun 2001; 69: 1-8. [ Links ]
24. Kraft S. The intestinal immune response in Giardiasis. Gastroenterol 1979; 76: 877-879. [ Links ]
25. Wahnschaffe U, Ignatius R, Loddenkemper C, Liesenfeld O, Muehlen M, Jelinek T, et al. Diagnostic value of endoscopy for the diagnosis of giardiasis and other intestinal diseases in patients with persistent diarrhea from tropical or subtropical areas. Scand J Gastroenterol. 2007; 42(3):391-396. [ Links ]