Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped v.72 n.2 Caracas jun. 2009
Anemia y depleción de las reservas de hierro en niños con Síndrome de Down
Jorymar Y. Leal Montiel(*), Pablo Ortega(**), Daisy Amaya (***), Carlos J. Chávez(****)
(*) Laboratorio de Investigación en Malnutrición Infantil. Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. Doctora en Ciencias Médicas. MgSc. en Inmunología.
(**) Laboratorio de Investigación en Malnutrición Infantil. Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. Doctora en Ciencias Médicas. MgSc. en Gastroenterología Infantil y Nutrición Pediátrica en Latinoamérica.
(***) Laboratorio de Investigación en Malnutrición Infantil. Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. MgSc. en Biología Celular y Molecular.
(****) Laboratorio de Investigación en Malnutrición Infantil. Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. MgSc. en Genética Médica.
Autor Corresponsal: Dra. Jorymar Leal. Laboratorio de Investigación en Malnutrición Infantil. Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. Apartado 526. Maracaibo, 4001. Venezuela. Teléfono: +58 261 7597250, Móvil: 0414 6676098 -Fax: +58 261-7597249. e-mail: jyleal@hotmail.com / jylealluz@yahoo.com
resumen
En el Síndrome de Down (SD) son escasos los estudios que determinan la prevalencia de anemia y deplecion de las reservas de hierro (drfe).
Objetivo: Evaluar la prevalencia de anemia y drfe en ninos con SD de Maracaibo-Venezuela.
Metodos: Se realizó un estudio descriptivo en 169 ninos entre 4-14 anos: ochenta y siete sin SD y 80 con SD, sin procesos infecciosos e inflamatorios activos. Se consideró anemia valores de hemoglobina <110 g/L en <5 años, <115 g/L entre 5 -11 años y <120 g/L entre 12-14 años. Microcitosis vcm<80 fL, Hipocromia hcm<27 pg. Se consideró drfe=ferritina<15µg/L; riesgo de drfe (rdrfe) ferritina=15-20µg/L y reservas normales (rfe normal) ferritina>20µg/L. Los datos fueron analizados con el pregrama de estadisticas sAs, y se consideró como significacion estadistica una p<0,05.
Resultados: la prevalencia total de anemia fue 20,71%, significativamente mas baja en ninos con sd (5,92%) (p<0,01). La prevalencia de microcitosis (5,0%) e hipocromia (18,75%) tambien fue menor en estos ninos (p<0,0001), no observandose casos de macrocitosis, pero si de hipercromia (7,50%). La prevalencia de drfe en ninos con sd (9,14%) fue superior a la observada en ninos sin sd; sin embargo, la prevalencia de rdrfe (36,59%), fue mas baja en ninos con sd. No se observaron diferencias estadisticamente significativas en cuanto a edad, peso y estatura.
Conclusión: La depleción y riesgo de depleción de las reservas de hierro son deficiencias nutricionales prevalentes en niños con Síndrome de Down, que requieren de una atención especial del estado nutricional y de salud en esta población.
Palabras Clave: Anemia, depleción de hierro, síndrome de Down, niños
summary
There are few studies in relation to the prevalence of anemia and depletion of iron stores (dIs) in individuals with Down Syndrome (ds).
Objective: To evaluate the prevalence of anemia and dIs in children with Down Syndrome from Maracaibo-Venezuela.
Methods: A descriptive study was carried out on 169 chidren (aged 4 to 14 years); 87 without ds and 80 with ds; without infectious or inflammatory processes. Anemia was considered when Hemoglobin <110 g/L in <5y old, hb<115 g/L in 5 to 11y old and hb<120 g/L in 12 to 14 y old; microcytosis (mean corpuscular volume mcv<80 fL) and hypochromia (Mean Corpuscular Haemoglobin mch<27 pg). dIs=ferritin<15µg/L; dIs risk ferritin=15-20µg/L and normal iron stores normal (nIs) ferritin>20µg/L. Statistical analysis was performed with sAs programs, statistical significance was considered when p<0.05.
Results: The overall prevalence of anemia was 20.71%. This prevalence was much lower in children with ds (5.92%; p<0.01) Prevalence of microcytosis (5.0%) and hypochromia (18.75%) were also significantly lower in children with ds (p<0.0001). No macrocytosis was observed but hipercromia was detected in 7.50%. Although, the prevalence of dIs (9.14%) was higher in children with ds, the prevalence of dIs risk was lower (36.59%). Age, weight and height did not show statistical differences between groups.
Conclusion: dIs and dIs risk are prevalent nutritional deficiencies in children with Down Syndrome, which require special attention in order to improve nutritional and health status in this population.
Key Words: Anemia, depleted iron stores, Down syndrome, children.
introduCCiÓn
La anemia es la deficiencia nutricional más frecuente en el mundo. Representa un problema de salud pública de gran magnitud, tanto en países desarrollados, como en vías de desarrollo (1,2). Aunque su incidencia real no se conoce, la Organización Mundial de la Salud estima que en el mundo existen aproximadamente 2.000 millones de personas anémicas (1). La anemia ha sido definida por la oms como una condición en la cual el contenido de hemoglobina en la sangre está por debajo de valores considerados normales, los cuales varían con la edad, el sexo, el embarazo y la altitud (3). Las causas de la anemia son variables; entre éstas se incluyen: la pobre ingesta dietaria de macro y micronutrientes, la excesiva pérdida de sangre, la destrucción de los eritrocitos y el incremento de los requerimientos durante ciertos estadios de la vida. Los nutrientes más frecuentemente involucrados en su etiología son: el hierro, el ácido fólico y la vitamina B12 (3,4). Recientemente, se han señalado otros nutrientes como el ácido ascórbico, la piridoxina y la vitamina A, cuya deficiencia coadyuva la condición de anemia (3,4).
Las deficiencias nutricionales son la causa más importante de anemia en la población mundial, considerándose el corficit de hierro como el trastorno nutricional de mayor prevalencia y la causa más frecuente de anemia en el mundo, especialmente en los países en vías de desarrollo como los de América latina (4-6). La oms estima que 500 a 600 millones de personas anémicas tienen deficiencia de hierro (2,3). En Venezuela, la anemia es un problema común que afecta a lactantes, preescolares, escolares, adolescentes, mujeres en edad fértil y embarazadas (6,7).
Aunque la anemia es el indicador comúnmente utilizado para monitorear la deficiencia de hierro (8), valorar el estado de este micronutriente solamente sobre la base de la anemia, puede conducir a diagnósticos erróneos, puesto que la saturación de transferrina y la ferritina sérica, permiten evaluar el estado del hierro y detectar las primeras etapas de depleción de las reservas de hierro (drfe), aún cuando las concentraciones de hemoglobina continúan por encima del valor límite determinado para anemia (8,9).
La deficiencia de hierro no debe ser considerada como un estado simple de deficiencia, ya que afecta no sólo a la eritropoyesis, causando anemia, sino también a otros órganos y funciones, produciendo trastornos no hematológicos que se asocian con aumento en la tasa de morbilidad en la infancia, pobre rendimiento en la escala de desarrollo y trastornos del aprendizaje con inadecuados logros educacionales (10). Es importante señalar que, el hierro es uno de los principales sustratos que soportan y permiten el desarrollo y la actividad metabólica de múltiples procesos a nivel cerebral, entre los cuales se encuentra el proceso de mielinización, la regulación y la conducción de neurotransmisores como la serotonina, la dopamina y el gABA, cuya deficiencia compromete en los infantes las respuestas afectivas y el funcionamiento cognoscitivo, y la coordinación de patrones de movimiento y memoria. Además, cuando ocurre un déficit de hierro cerebral en etapas tempranas, los daños ocurridos persisten en la etapa adulta, más allá de la recuperación de la anemia durante los primeros meses de vida (11-16).
El Síndrome de Down (sd), también llamado trisomía 21, es la causa más frecuente de retraso mental identificable de origen genético. Se trata de una anomalía cromosómica que tiene una incidencia que oscila alrededor de 1 por cada 1000 nacimientos vivos (17). Las personas con Síndrome de Down tienen una probabilidad superior a la de la población general de padecer algunas patologías debido al exceso de proteínas sintetizadas por el cromosoma de más (18). La presencia silente de trastornos digestivos como la enfermedad celiaca (ec) se encuentra presente en el 4 al 7% de las personas con sd (19). En estos sujetos genéticamente predispuestos, la enfermedad celiaca caracterizada por inflamación en la región proximal del intestino delgado ocasionada por proteínas como el gluten y las gliadinas, impide la absorción de micronutrientes como el hierro. De allí que, la mitad de los pacientes con ec presentan anemia por déficit de hierro (20). Sin embargo, a pesar de que se conocen las consecuencias de la deficiencia de hierro a nivel cerebral y la predisposición genética de malabsorción intestinal de este nutriente en individuos con sd, son escasos los estudios de prevalencia de anemia y estado de las reservas de hierro en esta población. El objetivo del presente estudio fue evaluar la prevalencia de anemia y drfe en niños con sd de Maracaibo Venezuela.
métodos
Se realizó un estudio descriptivo y transversal, en 169 niños, constituido por individuos citogenéticamente normales (cn) según evaluación citogenética e individuos con sd, con edades entre 4 y 14 años, seleccionados al azar en sus respectivas Unidades de Educación Primaria y Secundaria localizadas en Maracaibo – Venezuela durante el segundo semestre del año 2006 y primero del 2007. El presente estudio, recibió la aprobación del Consejo Técnico del Instituto de Investigaciones Biológicas de la Facultad de Medicina de la Universidad del Zulia y la Comisión Científica del Consejo de Desarrollo Científico y Humanístico de la Universidad del Zulia (condes-luz) bajo el Nº CC-0802-06. Así mismo, fue aprobado por la Coordinación Regional de las Escuelas Bolivarianas de la Dirección Regional de Educación y de la Junta Directiva de las respectivas Unidades Educativas. Se obtuvo el consentimiento informado por escrito de los padres y/o representantes legales. Ambos grupos se encontraron ubicados en los estratos socio-económicos Iv y v según la escala de Graffar modificada para Venezuela por Méndez Castellano y Méndez (21).
El criterio principal de inclusión estuvo constituido por el análisis del cariotipo de los participantes del estudio, realizado por un especialista técnico en citogenética.
La evaluación clínica fue realizada por personal médico capacitado, considerándose como criterios de exclusión: individuos con al menos un episodio de temperatura axilar >37ºC durante los últimos 15 días, tres o más evacuaciones líquidas en menos de 24 horas, procesos infecciosos activos y resultado de proteína C reactiva positiva.
Se obtuvo una muestra de sangre por punción venosa periférica teniendo en cuenta que hubiesen transcurrido por lo menos ocho horas de ayuno. La sangre fue recolectada en 3 tubos; el primer tubo sin anticoagulante, fue sometido a centrifugación (3000 rpm x 10 min) para la obtención de suero, que posteriormente fue separado en tubos eppendorf para la determinación de ferritina sérica y proteína C reactiva. Un segundo tubo con edtA fue utilizado para realizar la cuantificación de hemoglobina e indicadores hematimétricos y un tercer tubo con heparina fue utilizado para procesar el cariotipo de los participantes del estudio.
Las concentraciones de hemoglobina fueron determinadas con un contador hematológico automatizado Sysmex K- 800. Para definir anemia se utilizaron como puntos de corte los valores de hemoglobina inferiores a 110 g/L en menores de 5 años, 115 g/L entre 5 -11 años y 120 g/L entre 12-14 años según los criterios de la oms. Valores de volumen corpuscular medio (vcm) menores a 80 fL fueron considerados como microcitosis y vcm mayor a 94 fL como macrocitosis. Con respecto a la hemoglobina corpuscular media (hcm) valores menores a 27 pg definieron hipocromia y hcm >32 pg definieron hipercromia (22,23).
La ferritina sérica fue cuantificada mediante el método de quimioluminicencia. Se definió como depleción de las reservas de hierro (drfe) valores de ferritina <15 µg/L; riesgo de depleción de las reservas de hierro (rdrfe) ferritina entre 15 y 20 µg/L y reservas de hierro normales (rfe normal) ferritina >20 µg/L, según lo recomendado por la Organización Mundial de la Salud (22).
La proteina C reactiva fue analizada mediante la prueba semicuantitativa de aglutinación en placa (Wiener Laboratorios s.A.I.c. Rosario.Argentina). fueron excluidos los individuos con proteina C reactiva positiva (24).
El procesamiento de los datos se realizó con el programa de Sistema de Análisis Estadístico (sAs) Versión 8.1 (sAs Institute, Cary, NC, USA 2000). Los valores obtenidos fueron expresados como media ± desviacion estandar (X±DE). Se aplicó la prueba de normalidad de Kolmogorov-Smirnov (KS), se realizó un análisis exploratorio y univariado. Para estimar las diferencias entre los valores promedio de las variables analizadas de los individuos citogeneticamente normales y con sd, se utilizo la prueba t de student. Se consideró el 95% como índice de confiabilidad estadistica con una p<0,05.
resultados
Se analizaron 89 individuos (46 XX ó XY) citogenéticamente normales (10,3 ± 3,9 años) y 80 individuos (47 XX o XY+ 21) con Síndrome de Down (9,1 ± 4,2 años). No se observaron evidencias clínicas ni de laboratorio de cuadros infecciosos o inflamatorios activos. Los niños con sd no presentaron otras malformaciones congénitas. Debido a consideraciones técnicas solo fueron analizadas 164 muestras para la determinación de los valores de ferritina sérica (niños CN=87; niños con sd=77).
En el cuadro 1 se muestra la prevalencia de anemia, microcitosis, hipocromía y depleción de las reservas corporales de hierro en niños citogenéticamente normales y con Síndrome de Down. La prevalencia de anemia en la población total estudiada fue 20,71%, siendo esta significativamente más baja en niños con sd (5,92%) con respecto a los niños cn (14,79%) (p<0,01). La prevalencia de microcitosis (5,0%) e hipocromía (18,75%) fue significativamente más baja en niños con sd que en los cn (microcitosis= 42,69%; hipocromía = 65,17%) (p<0,0001). En niños con sd, no se observaron casos de macrocitosis, pero si de hipercromía (n= 6). Además, en los niños con sd la prevalencia de drfe (9,14%) fue superior que en los niños CN; sin embargo, la prevalencia de rdrfe (36,59%), fue más baja en niños con sd, aun cuando estas diferencias no mostraron significancia estadística.
El cuadro 2 muestra los valores promedio de las variables antropométricas, hematimétricas y la ferritina sérica de los grupos estudiados. En los niños con sd se encontró un incremento significativo de los valores promedio de hemoglobina, hematocrito, vcm, hcm y ferritina sérica; además, mostraron una disminución significativa de los valores promedio de la serie roja. Por otro lado, no se observaron diferencias estadísticamente significativas en cuanto a la edad, el peso y la estatura.
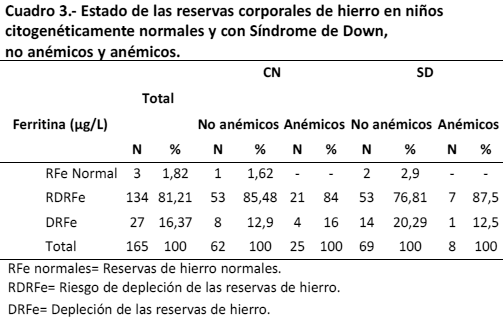
Por último, en el cuadro 3 se presenta el estado de las reservas corporales de hierro en niños citogenéticamente normales y con Síndrome de Down, no anémicos y anémicos. El total de niños anémicos con sd mostraron afectación de las reservas de hierro (rdrfe y drfe), comportamiento similar al observado en los niños anémicos cn. Asimismo, la prevalencia de afectación de las reservas de hierro en niños no anémicos con sd (97,10%) y cn (98,38%) resultó ser alta; sin embargo, estas diferencias no resultaron estadísticamente significativas.
disCusiÓn
A pesar de las divergencias de criterios que impiden precisar la verdadera magnitud del problema en el mundo, se ha reconocido que en países de menor desarrollo, uno de cada dos niños menores de cinco años y una de cada dos mujeres embarazadas presentan anemia por deficiencia de hierro (25,26). Por cada caso de anemia por deficiencia de hierro existen dos casos de deficiencia de hierro sin anemia (27). En América Latina y el Caribe, se reportan tasas de anemia de 45% en lactantes, 30% en preescolares y escolares, 20% en mujeres en edad fértil y 35% en embarazadas y podría estimarse que casi el doble de esta población presenta deficiencia subclínica de hierro (4,28). En Venezuela es el problema nutricional más frecuente que afecta en orden de importancia a lactantes, preescolares, escolares y adolescentes, a la mujer en edad fértil y a la embarazada (29-32).
A pesar que el Síndrome de Down (sd) es la primera causa congénita de retraso mental, no se conocen hasta el momento estudios que determinen la prevalencia de anemia y depleción de las reservas de hierro en estos individuos, situación que pudiese comprometer aún más el desarrollo mental de esta población. Los resultados del presente estudio muestran que en los niños con sd estas prevalencias de anemia, rdrfe, microcitosis e hipocromía, resultaron significativamente más bajas con respecto a la prevalencia observada en niños citogenéticamente normales. Es importante señalar, que no se observaron casos de macrocitosis, aún cuando esta característica es prevalente en esta población (33), pero si se observó hipercromía. Además, se observó un incremento significativo de los valores promedio de hemoglobina, hematocrito, vcm, hcm, y ferritina sérica, lo cual pudiese explicar las bajas prevalencias de anemia, microcitosis e hipocromía observadas en estos niños con Síndrome de Down. Estos resultados, pudieran ser debidos a que los niños con sd estudiados asistían a Unidades Educativas y Centros de Cuidado diario donde recibían un plan de alimentación balanceada acorde a los requerimientos nutricionales establecidos para la edad. Sin embargo, la prevalencia de drfe fue superior en niños con sd que en niños citogenéticamente normales, aunque esta diferencia no mostró ser significativa. El resultado del presente estudio pudiera ser debido al escaso aporte de hierro a través de los alimentos proporcionados dentro del programa de alimentación que reciben los niños con Síndrome de Down, así mismo a la ausencia de suplementación con este micronutriente. Resultados similares fueron observados por Annerén y col (34) quienes encontraron valores bajos de este oligoelemento en eritrocitos y neutrófilos de niños con sd.
En el presente estudio, a pesar de que la prevalencia de anemia observada en niños con sd fue más baja que en sujetos normales, es importante señalar que la prevalencia de drfe resultó más alta en los niños con sd. Por lo que, conociendo que la deficiencia de hierro es un estado en el cual el contenido de este micronutriente en el cuerpo está por debajo de lo normal, y que se presenta a través de un espectro que va desde la disminución y agotamiento de las reservas de hierro hasta la reducción de las células rojas y de la concentración de hemoglobina (9), es posible considerar este grupo como una población de riesgo para el desarrollo de anemia por deficiencia de hierro. La anemia es la manifestación más avanzada de la deficiencia de hierro, caracterizada por una reducción de la concentración de hemoglobina y hematocrito, presencia de hipocromía y microcitosis en sangre periférica y disminución de la ferritina sérica (35, 36). Sin embargo, la microcitosis no es exclusiva de la deficiencia de hierro, también se puede apreciar en otras condiciones en las que existe un defecto de la hemoglobinización de los precursores eritroides (talasemia, infección o inflamación crónica, intoxicación plúmbica, anemias sideroblásticas) (36).
Aunque no se observaron diferencias estadísticamente significativas en cuanto a la edad, el peso y la estatura entre los niños con sd y los niños CN, es conocido que el desarrollo físico de los individuos con sd es más lento que en niños citogenéticamente normales. El retardo en el desarrollo puede ser debido a causas congénitas como déficit de hormona de crecimiento, cardiopatías congénitas, hipotiroidismo, leucemia (37-40); asimismo, puede estar relacionado con malos hábitos nutricionales como el escaso aporte calórico, desequilibrio dietético e ingesta por debajo de las necesidades de minerales o vitaminas (41,42); así como por la presencia silente de trastornos digestivos como la enfermedad celiaca. Aunque en el presente estudio no fue evaluada la presencia de esta patología, es relevante considerar su detección en futuras investigaciones.
En conclusión, en la presente investigación la depleción de las reservas de hierro y el riesgo de depleción de las reservas de hierro son deficiencias nutricionales prevalentes en niños con Síndrome de Down, lo cual requiere de una atención especial del estado nutricional y de salud en este grupo, que permita corregir, aliviar o evitar la anemia y la depleción de las reservas de hierro a través de un conjunto de actividades preventivas, diagnósticas y terapéuticas (43). Para ello es necesario, un adecuado aporte alimentario, la fortificación de alimentos y la suplementación farmacológica de hierro para cubrir los requerimientos diarios. Además, particularmente en el inicio de la etapa de alimentación complementaria, es necesaria la educación nutricional como parte de la consulta pediátrica donde se resalte la relevancia del aporte de hierro por la dieta. Todo ello con el propósito de mejorar la calidad y la esperanza de vida de los individuos con Síndrome de Down.
reFerenCias
1. Oficina Sanitaria Panamericana. La anemia como centro de atención, hacia un enfoque integrado para un control eficaz de la anemia. Sesión conjunta de la Asamblea General de las Naciones Unidas y del Fondo de las Naciones Unidas a favor de la Infancia (unIcef) 2004. Traducción al español de la oPs. Washington DC 2005. [ Links ]
2. Stoltzfus RJ. Iron deficiency anaemia: reexamining the nature and magnitude of the public health problem. J Nutr 2001; 131:697s-701s. [Disponible en: http://www.nutrition.org/cgi/reprint/131/2/697s,pdf]. Consultado en diciembre 2008. [ Links ]
3. Nestel P, Davidsson L. Anemia, Deficiencia de hierro y Anemia ferropriva. Grupo Consultor Internacional de Anemia Nutricional (InAcg), Oficina de Salud, Enfermedades Infecciosas y Nutrición, Oficina de Salud Global, Agencia para el Desarrollo Internacional de los Estados Unidos (usAId. Washington DC 2004, pp. 1-6. [ Links ]
4. Mora JO, Mora OL. Anemia ferropriva. En: J.o. mora, o.l. mora (editores). Deficiencia de micronutrientes en América Latina y el Caribe. Primera edición. oPs, oms, usAId, Roche, omnI. washington, d.c. 1999, pp.1-25. [ Links ]
5. World Health Organization. Consultation on iron deficiency: indicators and strategies for iron deficiency control programmes. Geneva 1999. [ Links ]
6. Landaeta-Jiménez M, García M, Bosch V. Principales deficiencias de micronutrientes en Venezuela. Rev Esp Nutr Comunit 2003; 9: 117-127. [ Links ]
7. Ministerio de Salud y Desarrollo Social- Instituto Nacional de Nutrición. Deficiencia de hierro en Venezuela: Acciones para su prevención y control. Rev Obstetr Ginecol Venez 2003; 63: 1-74. [ Links ]
8. World Health Organization. Department of Nutrition for Health and Development /United Nations University/unIcef, Iron deficiency anemia, assessment, prevention and control: a guide for programme managers. Geneva 2001. [ Links ]
9. Lönnerdal BO, Deney KG. Epidemiología de la deficiencia de hierro en lactantes y niños. An Nestle 1996; 51: 82-89. [ Links ]
10. Krieger E, Hurtado A, Hartl C, Keith G, Scott K. Early childhood anemia and mild or moderate retardation. Am J Clin Nutr 1999; 69: 115 -119. [ Links ]
11. Olivares M, Walter T. Consecuencias de la deficiencia de hierro. Rev Chil Nutr 2003; 30:226-233. [ Links ]
12. Stanco G. Funcionamiento intelectual y rendimiento escolar en niños con anemia y deficiencia de hierro. Colomb Med 2007; 38 (Supl 1): 24-33. [ Links ]
13. Hurtado EK, Claussen AH, Scott KG. Early childhood anemia and mild or moderate mental retardation. Am J Clin Nutr 1999; 69:115–119. [ Links ]
14. Lozoff B. Explanatory mechanisms for poorer development in iron deficient anemic infants. En: Nutrition, health and child development. Pan American Health Organization, World Bank, and Tropical Metabolism Research Unit. Scientific Publication No. 566. Washington DC 1998, pp. 162–178. [ Links ]
15. Pollit E. Early iron deficiency and later mental retardation. Am J Clin Nutr 1999; 69: 4–5. [ Links ]
16. Lozoff B, Jiménez E, Hagen J, Mollen E, Wolf A. Poorer behavioral and developmental outcome more than 10 years after treatment for iron deficiency in infancy. Pediatrics 2000; 105: e51. http://www.pediatrics.org/cgi/content/full/105/4/e51. Consultado en diciembre 2008. [ Links ]
17. Artigas López M. Síndrome de Down (trisomía 21). En: Genética. Protocolos de la Asociación Española de Pediatría 2001. 37-43. Consultado en enero 2009. [ Links ]
18. Basile HS. Retraso mental y genética. Síndrome de Down. Rev Arg Clin Neuropsiquiatr 2008; 15(1): 9-23. [ Links ]
19. Sala Castellví P, Llorens ME, Ducet Vilardell P, Vila Cerén C, Elizari Saco M, Demestre Guasch X, et al. Anemia y enfermedad celíaca en una paciente con Síndrome de Down. Rev Med Int Sind Down 2008; 12(1): 8-11. [ Links ]
20. Deprati M. Enfermedad celíaca. Evid Act Pract Ambulat 2005;8:51-55. [ Links ]
21. Méndez Castellano H, Méndez MC. Sociedad y estratificación social. Método Graffar-Méndez Castellano. Ediciones fundacredesa. Caracas 1994,206 p. [ Links ]
22. World Health Organization (who). Iron deficiency anaemia. Assessment prevention and control. A guide for programme managers. Report of who/unIcef/unu. Document who/nhd/01.3 [on line]. Geneva 2001; disponible en:url: http://www.who.int/nut/documents/ida_assessment_prevention_control.pdf Consultado en diciembre 2008. [ Links ]
23. Balcells A. Exámenes de sangre. Hematología clínica. Hemogramas y exámenes hematológicos. En: La clínica y el laboratorio. w.t. reich (editor principal). Ediciones Científicas y Técnicas, s.A. 16va edición. México 1995, pp. 143-204. [ Links ]
24. Amesty-Valbuena A, Pereira N, Castillo JL, García D, Núñez JR, Cayama N, et al. Medidores de inflamación (proteína C reactiva) en el niño con desnutrición proteico-energética y en el niño eutrófico. Invest Clin 2004; 45:53-62. [ Links ]
25. United Nations Administrative Committee on Coordination/Sub-Committee on Nutrition (Acc/Scn) in Collaboration with the Department of International Health and Development, Tulane School of Public Health and Tropical Medicine, New Orleans LA 70112. International Food Policy Research Institute. Fourth Report on the World Nutrition Situation. Acc/scn; IfPrI. Geneva 2000, pp. 23–27. [ Links ]
26. Beard J, Stoltzfus R. Iron-deficiency anemia: reexamining the nature and magnitude of the public health problem. J Nutr 2001; 131 (Suppl.): 563-703. [ Links ]
27. Chen WA, Lesperance L, Bernstein H. Screening for iron deficiency. Pediatr Rev 2002; 23: 171–178. [ Links ]
28. Ramakrisnan U. Prevalence of micronutrient malnutrition worldwide. Nutr Rev 2002;60 (Suppl): 46-52. [ Links ]
29. fundacredesa-unIcef. Estudio Impacto del enriquecimiento de las harinas con hierro y vitamina A en la población venezolana. Ministerio de la Secretaría. Caracas 1998, 121p. [ Links ]
30. fundacredesa. Estado nutricional y composición corporal en niños lactantes, preescolares y escolares de siete años. En: Indicadores de situación de vida y movilidad social, años 1995- 2001. Estudio nacional. Tomo II. Caracas 2001, pp.499-557. [ Links ]
31. Landaeta-Jiménez M. Alimentación y nutrición en la Venezuela de 2000. An Venez Nutr. 2000; 13:143-150. [ Links ]
32. Solano L, Meertens L, Peña E, Arguello F. Deficiencia de micronutrientes. Situación actual. An Venez Nutr 1998; 11: 48- 54. [ Links ]
33. Corretger JM, Serés A, Casaldáliga J, Trías K. (editores). El pediatra y el Síndrome de Down. En: Síndrome de Down: aspectos médicos actuales. Primera edición. Editorial Elsevier. Madrid 2005, pp. 21-41. [ Links ]
34. Annerén G, Johansson E, Lindh U. Trace element profiles in individual blood cells from patients with down's syndrome. Acta Paediatr Scand 1985; 74(2):259-263. [ Links ]
35. Thomas C, Thomas L. Biochemical markers and hematologic indices in the diagnosis of funtional iron deficiency. Clin Chem 2002; 48: 1006-1076. [ Links ]
36. Dallman PR. Laboratory diagnosis of iron deficiency in infants and children. Ann Nestle 1995; 53:8-14. [ Links ]
37. Saenz RB. Primary care of infants and young children with down syndrome. Am Fam Phys 1999; 59 (2): 381-390. [ Links ]
38. Committee on Genetics. American Academy of Pediatrics. Health supervision for children with Down Syndrome. Pediatrics 2001; 107(2):442-449. [ Links ]
39. National Down Syndrome Congress. Healthwatch for the person with Down Syndrome II. [Publication on line]. Disponible en: [http://www.members.carol.net/~ndsc/hw_table.html.]. Consultado en enero 2009. [ Links ]
40. Leonard S, Bower C, Petterson B, Leonard H. Medical aspects of school-aged children with Down Syndrome. Dev Med Child Neurol 1999; 41 (10): 683-688. [ Links ]
41. Luke A, Sutton M, Schoeller DA, Roizen NJ. Nutrient intake and obesity in prepubescent children with Down Syndrome. J Am Diet Assoc 1996; 96 (12): 1262-1267. [ Links ]
42. Chad K, Jobling A, Frail H. Metabolic rate: a factor in developing obesity in children with Down Syndrome?. Am J Ment Retard 1990; 95 (2): 228-235. [ Links ]
43. Duran P. Anemia por deficiencia de hierro: estrategias disponibles y controversias por resolver. Arch Argent Pediatr 2007; 105(6): 488-490. [ Links ]