Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped vol.77 no.3 Caracas set. 2014
Crecimiento, nutrición temprana en el niño y riesgo de obesidad
Coromoto Macías-Tomei (1), Marianella Herrera Hernández (2), Mariana Mariño Elizondo (3), Daniela Useche (4)
(1) Pediatra. Especialista en Crecimiento, Desarrollo y Nutrición. Profesor Asociado (jubilada). Departamento de Procesos Biológicos y Bioquímicos. Universidad Simón Bolívar. Grupo de Transición Alimentaria y Nutricional, Fundación Bengoa. Caracas, Venezuela.
(2) Pediatra. Médico Especialista del Departamento de Pediatría. Centro Médico Dr. Rafael Guerra Méndez. Valencia, Estado Carabobo, Venezuela.
(3) Pediatra Nutrólogo. Centro de Atención Nutricional Infantil (CANIA). Caracas, Venezuela.
(4) Pediatra Especialista en Nutrición Clínica y Salud Pública. Ejercicio Privado en Barquisimeto, estado Lara, Venezuela.
Autor Corresponsal: Coromoto Macías-Tomei Teléfonos: +584142774180 Correo electrónico: coritomei@gmail.com
RESUMEN
La obesidad infantil se ha incrementado en las últimas décadas y actualmente es la Enfermedad Crónica Relacionada con la Nutrición (ECRN) más frecuente en el mundo. Las estrategias de prevención son de importancia vital para evitar la persistencia de la obesidad durante el crecimiento y maduración y en la edad adulta, en especial para la prevención de las comorbilidades asociadas a mediano y largo plazo. Las evidencias demuestran los efectos de la programación prenatal sobre una obesidad posterior y la aparición de ECRN. La alimentación con leche humana se ha asociado con bajo riesgo de sobrepeso y obesidad así como con cifras bajas de presión arterial, de LDL-colesterol en la etapa adulta y una menor tendencia a desarrollar diabetes tipo 2. Al iniciar la alimentación complementaria se pueden adoptar distintos patrones que suponen riesgo para sobrepeso, obesidad y otras ECRN. En niños menores de 10 años, se revisa la influencia de los macronutrientes, en especial el aporte de proteínas y de algunos micronutrientes en relación a la obesidad durante el crecimiento y en etapas posteriores. Se recomienda el inicio de la alimentación complementaria a los 6 meses de edad. La nutrición adecuada entre la concepción y los dos años de edad es una "ventana de tiempo crítica" y a la vez una ventana de oportunidad donde obstetras y pediatras tienen un protagonismo indiscutible en el logro del pleno desarrollo del potencial humano de cada niño.
Palabras clave: Nutrición temprana, Obesidad, Enfermedades crónicas relacionadas con la nutrición, Lactancia Humana, Alimentación complementaria, Niños
Growth, early child nutrition and risk of obesity
SUMMARY
Childhood obesity has increased in frequency during recent decades and is currently the most frequent chronic disease related with nutrition (CDRN) worldwide. Prevention strategies are vital to avoid the persistence of obesity during growth, maturation and adulthood, especially for the prevention of associated comorbidities in the medium and long term. Evidence shows the effects of prenatal programming on subsequent obesity and the occurrence of CDRN. Feeding with human milk has been associated with low risk of overweight and obesity as well as with low figures of blood pressure, LDL-cholesterol in adulthood and a lower tendency to develop type 2 diabetes. Different patterns that pose risk of overweight, obesity and other CDRN may be adopted when complementary feeding is initiated. Influence of macronutrients, especially proteins, and some micronutrients are revised in children under 10 years of age, in relation to obesity during growth and later on. It is recommended that complementary feeding should start at 6 months of age. Adequate nutrition between conception and two years of age is a "crucial time window" as well as a window of opportunity in which obstetricians and pediatricians have a very important role in obtaining the full development of the human potential in every child.
Key words: Nutrition, Obesity, Chronic Diseases Related to Nutrition, Human breastfeeding, Complementary feeding, Children.
INTRODUCCIÓN
La obesidad infantil se ha incrementado en las últimas décadas y actualmente es la Enfermedad Crónica Relacionada con la Nutrición (ECRN) más frecuente en el mundo; se le considera una epidemia global, debido a su alta prevalencia y mayor severidad en niños y adolescentes de países desarrollados y en vías de desarrollo (1-5).
Los esquemas de tratamiento de la obesidad en niños y adolescentes no han sido exitosos a largo plazo, por ello las estrategias de prevención son de importancia vital para evitar la persistencia de la obesidad durante el crecimiento y maduración y en la edad adulta, en especial para la prevención de las comorbilidades asociadas a mediano y largo plazo (1-3, 6,7).
Las evidencias demuestran los efectos de la programación prenatal sobre una obesidad posterior y la aparición de ECRN (4,8-11). La ganancia de peso en la embarazada que influye en el feto, así como el peso bajo y alto al nacer, seguido de ganancia precoz y excesiva de peso durante los dos primeros años de vida, se asocian con un incremento significativo del riesgo de obesidad posterior (12,13).
Aun cuando un niño o adolescente con sobrepeso u obesidad no siempre será un adulto obeso, esta condición se asocia con alto riesgo de persistencia en la edad adulta: la obesidad a los dos años de edad aumenta el riesgo 1,3 veces, mientras que si se mantiene hasta los 15-17 años, el riesgo es 17 veces mayor, en comparación a sus pares eutróficos (2,14). Los hijos de padres delgados tienen un 9% de riesgo de obesidad, mientras que si ambos padres tienen sobrepeso, éste aumenta a 60- 80% y se duplica en niños menores de 10 años (5).
La nutrición adecuada durante los primeros años de vida es fundamental para el pleno desarrollo del potencial humano de cada niño; de modo tal, que el período entre la concepción y los dos años de edad es una "ventana de tiempo crítica" para la promoción del crecimiento, el desarrollo y una salud óptimos (15,16), considerada también ventana de oportunidad (17).
PAPEL PROTECTOR DE LA LECHE HUMANA EN LA PREVENCIÓN DEL SOBREPESO Y OBESIDAD
La alimentación con leche humana se ha asociado con bajo riesgo de sobrepeso y obesidad así como con cifras bajas de presión arterial, de LDL-colesterol en la etapa adulta y una menor tendencia a desarrollar Diabetes Mellitus tipo 2 (DM2) (18).
En cuanto al neurodesarrollo, al comparar niños amamantados con aquellos que reciben fórmula artificial se han observado diferencias, aunque con resultados no concluyentes, debido a la influencia de la educación parental, coeficiente intelectual, ambiente en el hogar y estrato social (19).El programa de intervención de Promoción de Lactancia Materna (estudio PROBIT) brinda evidencia que ajusta los resultados en las puntuaciones de coeficiente intelectual los cuales son significativamente mayores en niños amamantados. Además, estas altas puntuaciones del coeficiente de inteligencia se notan en niños que reciben leche humana exclusiva por 3 meses o más. En los pretérmino, población de más alto riesgo, se han observado efectos positivos significativos de la alimentación con leche humana en el neurodesarrollo a largo plazo (20).
La experiencia nutricional alterada durante el periodo de lactancia puede tener un impacto sobre la salud adulta del niño. La nutrición excesiva y la ingesta incrementada de carbohidratos durante el periodo de amamantamiento predisponen a la obesidad en la adultez y se relaciona con enfermedades metabólicas (21,22). La alimentación con leche humana reduce la obesidad en un 20% en la edad escolar, en comparación con la fórmulas infantiles o leche entera de vaca, incluso después de ajustar otras variables biológicas y socio demográficas (23,24).
Los niños amamantados muestran un patrón de succión diferente caracterizado por un aumento de la frecuencia y vigor de la succión, así como un mejor control del volumen de las tomas y de los intervalos que aquellos que ingieren fórmulas, quienes consumen un volumen 20-30% mayor, después de las 6 semanas de vida (25,26). Los patrones de alimentación son buenos predictores del Índice de Masa Corporal (IMC) a los 3 años de edad (27).
INFLUENCIAS DE LA LECHE HUMANA EN LA COMPOSICIÓN CORPORAL DE NIÑOS MENORES DE 10 AÑOS
La determinación de la composición de la ganancia de peso corporal durante el primer año de vida es fundamental para la evaluación de los requerimientos nutricionales en este período de rápido crecimiento en niños nacidos a término y sobretodo en los pretérmino. Los aspectos dinámicos de dicha ganancia ponderal juegan un rol primordial en la programación nutricional de la morbilidad en la edad adulta (28). Sin embargo, la asociación entre la edad de introducción de la alimentación complementaria y la aparición de la obesidad en etapas posteriores no ha sido exhaustivamente estudiada, ya que la mayoría de los ensayos publicados están basados solo en el comportamiento del IMC, sin considerar la adiposidad medida por indicadores de composición corporal. Por lo tanto, se requieren más estudios aleatorizados con un seguimiento a largo plazo con la finalidad de evaluar si las intervenciones nutricionales en los dos primeros años de vida conllevan beneficios a largo plazo en la prevención de la obesidad (3,29). Otros estudios muestran que la evolución del IMC recibe una fuerte influencia de los antecedentes genéticos de cada niño, mientras que el efecto de los factores ambientales es mucho menos importante. Los factores genéticos son predominantes para la evolución espontánea del IMC, pero sólo los eventos ambientales son capaces de modificar la curva del IMC (30).
A corto plazo, la malnutrición materna afecta al feto, porque compromete su crecimiento y causa cambios de la composición corporal (menor masa magra) y en el desarrollo cerebral; además genera una reprogramación del metabolismo lipídico y de carbohidratos, hormonas, funciones genéticas y de receptores. A largo plazo, estos cambios conducen a una reducción del desarrollo cognitivo, del desempeño escolar, reducción de la capacidad para el trabajo e incremento en el riesgo de ECRN en la edad adulta (13,31).
Una mayor ganancia de peso gestacional se asocia a un mayor IMC en los hijos a los 3 años, entre los factores involucrados están: una mayor prevalencia de sobrepeso materno gestacional, peso alto al nacer y rápida ganancia de peso durante el primer año de vida (32).
La ingesta alimentaria materna de ácidos grasos ώ-3 y ώ- 6 en la gestación y durante el período de lactancia determinan las cantidades y los tipos de estos ácidos grasos transferidos a través de la placenta, secretados en la leche humana y acumulados en los tejidos de los niños en fase de desarrollo. Un suministro bajo de ácidos grasos ώ-3 y un suministro elevado de ácidos grasos ώ-6 durante el desarrollo inicial se asocia a características posteriores del síndrome metabólico: dislipidemia, resistencia a la insulina e hiperfagia (33,34).
Los niños alimentados con leche humana muestran un crecimiento diferente que los que reciben fórmulas infantiles. En condiciones deficientes, con tasas elevadas de infección y diarrea, la leche humana protege frente a déficit del crecimiento. En condiciones adecuadas, los niños alimentados con leche humana presentan una menor ganancia media de peso durante el primer año de vida que los niños alimentados con fórmulas infantiles. Las evidencias confirman que la leche humana se asocia con una probabilidad menor de sobrepeso (21%) y de obesidad (25%) antes de los 10 años de edad (35).
Introducir la alimentación complementaria antes del cuarto mes de vida es un factor de riesgo asociado a obesidad a los 3 años de edad; la lactancia materna representa un factor protector en comparación con aquellos que no la han recibido o se les suspendió antes del cuarto mes (36).
RESPUESTA METABÓLICA, ENDOCRINA Y DE CRECIMIENTO A LA INGESTA DE PROTEÍNA DE LA LECHE HASTA LOS DOS AÑOS DE EDAD
El enfoque de programación nutricional es novedoso en la medicina preventiva y en la epidemiología. Esto implica que ciertos nutrientes en cantidades bien definidas durante periodos sensibles pueden determinar respuestas endocrino-metabólicas, que originan alteraciones permanentes, cuya expresión clínica se manifiesta varias décadas después (13).
Se reconocen tres principales periodos sensibles (7):
a. Fase de crecimiento intrauterino correspondiente a las primeras semanas de vida extrauterina en nacidos pretérmino.
b. Las primeras 4 a 6 semanas de vida que representan el periodo de lactancia, ya sea con leche humana o con fórmulas infantiles.
c. Alimentación complementaria, en la cual los sólidos son introducidos progresivamente y que se extiende hasta el final del segundo año de vida.
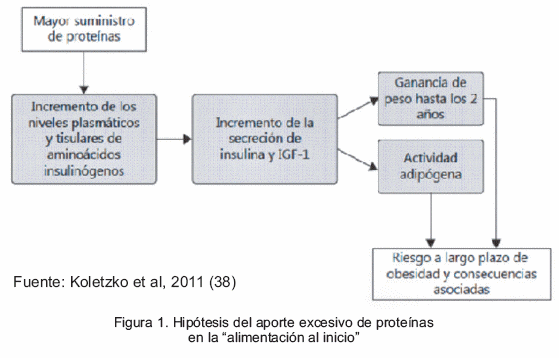
La hipótesis de la ganancia rápida de peso posnatal o del crecimiento acelerado (37) incluye el planteamiento del aporte excesivo temprano de energía y proteínas, según el cual un exceso de proteínas en la alimentación que supere las necesidades metabólicas dará lugar a un aumento de las concentraciones plasmáticas y tisulares de aminoácidos liberadores de insulina y a un incremento de la secreción de insulina y de IGF-1 que, a su vez, aumentarán la ganancia temprana de peso, la actividad adipógena y el riesgo de obesidad a largo plazo (38) (Figura 1).
Al comparar la leche humana con fórmulas infantiles de mayor o menor contenido de proteínas, pero de igual densidad energética, en el Proyecto Europeo de Obesidad Infantil, que incluyó niños sanos alimentados con lactancia materna exclusiva por al menos 3 meses, se observó que los alimentados con fórmulas con mayor aporte de proteínas presentaron un IMC significativamente mayor con respecto a los que recibieron fórmulas con menor aporte proteico y leche humana (38).
Al realizar un seguimiento a los 6 años se evidencia una notable diferencia en el IMC entre los grupos alimentados con fórmulas infantiles, a favor de quienes recibieron menor contenido proteico (38). Los efectos protectores de la leche humana en comparación con las fórmulas infantiles en los niños son: mejor habilidad para regular la sensación de hambre y saciedad (39) por la posible modulación de algunas hormonas o componentes similares a hormonas, como la leptina y la ghrelina (40) contenidas en la leche humana; la calidad de la grasa con más de un 99% de triglicéridos con un alto contenido de ácidos grasos poliinsaturados de cadena larga (LC-PUFA) y colesterol así como un importante porcentaje de carbohidratos no digeribles (30%) de la leche humana que permanecen a lo largo del tracto gastrointestinal como un sustrato beneficioso para las cepas intestinales (Lactobacillus y Bifidusbacillus) (41). Todos estos elementos contribuyen a un crecimiento lento en niños amamantados en comparación con los que reciben fórmulas infantiles. Este patrón de alimentación limita la carga a las células beta del páncreas (42) que conlleva a un incremento en el depósito de LC-PUFA en las membranas tisulares, el desarrollo de un control más eficiente de la síntesis endógena de colesterol y modificaciones favorables del medio intestinal (43).
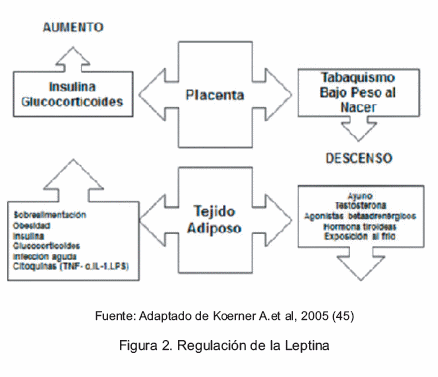
Se sugiere que la programación de concentraciones relativas de leptina vinculada a la alimentación en los primeros meses de vida puede relacionarse con obesidad en etapas posteriores de la vida, ya que esta hormona es un mediador del aparato nutricional sensitivo ambiental que dirige la programación metabólica y tiene un papel fundamental en el sistema endocrino para alcanzar la homeostasis de la energía. Tanto en niños a término como pretérmino se ha observado una asociación inversa entre la leptina del cordón umbilical y el IMC (44).
Los niveles de leptina en sangre se correlacionan con las reservas totales de grasa corporal. Durante el ayuno o de la pérdida de peso, la leptina disminuye, mientras que aumenta durante la sobrealimentación o la ganancia de peso (45) (Figura 2).
COMPOSICIÓN DE LA MICROBIOTA Y OBESIDAD
La microbiota intestinal es un complejo ecosistema formado por 500 a 1000 especies diferentes de bacterias, la mayoría anaerobios estrictos con una marcada influencia en el metabolismo, en la utilización de energía y en enfermedades metabólicas del huésped (46). La microbiota es un factor ambiental que contribuye con la aparición de obesidad. El fenotipo obeso se relaciona con mayor fermentación microbiana, extracción de energía y regulación del metabolismo periférico (47,48).
Recientes avances científicos apuntan hacia un bajo grado de inflamación sistémica y determinadas características de la microbiota local intestinal como factores que predisponen a la sobrealimentación. El género Bifidobacterium afecta la cantidad y calidad de la microbiota durante el primer año de vida, y se ha observado una mayor concentración en niños eutróficos a los 7 años de edad en comparación con los que desarrollan sobrepeso (49,50).
Las Bifidobacteria, especialmente B. breve, B. infantis, and B. longum, tipifican la composición de la microbiota intestinal de niños alimentados con leche humana, y la presencia de oligosacáridos favorecen su tránsito en el intestino. Se ha demostrado que la lactancia materna está asociada en un 13-22% con reducción de sobrepeso y obesidad en la niñez, y que la duración del amamantamiento está inversamente asociada con el riesgo de sobrepeso. Se sugiere que las Bifidobacteria constituyen un enlace interno entre la alimentación con leche humana y el desarrollo del peso.
En condiciones alteradas, la microbiota intestinal permite la hidrólisis de los polisacáridos no digeribles en monosacáridos fácilmente absorbibles y la activación de la lipasa lipoproteica por acción directa en el epitelio intestinal. En consecuencia, la glucosa se absorbe rápidamente y los ácidos grasos son almacenados en exceso. Ambos procesos refuerzan la ganancia de peso. El incremento del número de bacteroides en la microbiota intestinal predispone al almacenamiento de energía y obesidad. Las alteraciones de la microbiota en humanos durante el periodo crítico de maduración están relacionadas al desarrollo de condiciones inflamatorias como alergia y se sugiere una relación entre el asma y obesidad (49).
CRECIMIENTO COMPENSATORIO EN MENORES DE DOS AÑOS NACIDOS A TÉRMINO, PRE-TÉRMINO Y RIESGO DE ENFERMEDAD CARDIO-METABÓLICA
La evaluación del crecimiento y desarrollo es fundamental a fin de detectar una ganancia excesiva de peso, ya que ésta genera un impacto negativo en la salud infantil. Para lograr un crecimiento lineal armónico es indispensable promover la lactancia materna exclusiva durante los primeros 6 meses de vida, seguida de una alimentación complementaria que incorpore progresivamente alimentos nutritivos de baja densidad calórica (22,38,50-54).
Un crecimiento rápido debido a una sobrealimentación en etapas tempranas de la vida ocasiona un crecimiento compensatorio, conocido en inglés como catch-up growth, el cual favorece la obesidad en niños pretérmino y a término con peso bajo al nacer (55,56). Una dieta alta en energía luego del alta hospitalaria puede promover un crecimiento compensatorio a expensas de una alta adiposidad especialmente de masa grasa visceral, mientras que un consumo proteico adecuado a sus requerimientos favorece la ganancia de masa magra (19,57). Además este crecimiento compensatorio exagerado pone en riesgo la salud cardiometabólica futura de los niños (58,59). Se ha observado que niños pretérmino, a los 4 y 6 años de edad presentan una distribución distorsionada de la grasa corporal a expensas de una mayor adiposidad central y menor grasa periférica, en comparación con sus pares nacidos a término, lo cual sugiere que los primeros tienen mayor riesgo cardiometabólico en etapas posteriores de la vida (60).
Cuando sea imposible continuar la lactancia materna, al iniciar la alimentación complementaria, se recomienda el uso de fórmulas de continuación con bajo contenido proteico, en lugar del uso de la leche entera de vaca, por su alto contenido de proteínas (4,54).
Para prevenir la obesidad es importante identificar los períodos críticos para su desarrollo. Se ha observado que la adiposidad aumenta en el primer año de vida, luego disminuye y vuelve incrementarse a los 6 años de edad; este comportamiento se conoce como rebote adiposo. Por lo general, un rebote adiposo temprano (antes de los 5,5 años) predispone a alta adiposidad, una edad ósea adelantada y crecimiento acelerado; cuando ocurre luego de los 7 años se observa una baja adiposidad. El rebote temprano está asociado a ECRN (61,62).
ALIMENTACIÓN COMPLEMENTARIA Y RIESGO DE SOBREPESO Y OBESIDAD EN EL NIÑO MENOR DE 10 AÑOS
La alimentación complementaria representa el período de transición de la lactancia materna a los patrones alimentarios familiares, principalmente debido a la introducción de alimentos distintos a la leche humana que aportan al menos el 50% del consumo calórico total (7).
Al iniciar la alimentación complementaria se pueden adoptar distintos patrones que suponen riesgo para sobrepeso, obesidad y otras ECRN, debido a un alto consumo de energía, proteínas, grasa saturadas, sal, azúcar libre y bajo consumo de frutas y vegetales (63). Se recomienda el inicio de la alimentación complementaria a los 6 meses de edad (51,64,65).
La introducción de alimentos sólidos antes de los 4 meses de edad en niños que nunca recibieron lactancia materna o la recibieron menos de 4 meses en comparación con los que la recibieron después de esta edad, aumentó en 6 veces el riesgo de obesidad a los 3 años de edad, independientemente de la velocidad de crecimiento (36).
De manera natural los seres humanos tienen preferencias por sabores con alto contenido de azúcar y sal, sin embargo, las experiencias sensoriales de las etapas tempranas de la vida pueden modificar estas preferencias. Madres que consumen alimentos saludables transmiten estos sabores al líquido amniótico y a la leche humana y los niños que reciben lactancia materna tienen mayor aceptación de estos sabores que los alimentados con fórmula artificial (66).
Independientemente del modo de alimentación temprano, los niños menores de dos años pueden aprender a través de una exposición repetida y variada de alimentos. Para que ocurra este aprendizaje estos alimentos deben formar parte de la dieta familiar y la exposición debe ser sostenida en el tiempo. Enseñar a los niños a comer alimentos con contenidos bajos de sal y azúcar, como frutas y vegetales, durante la alimentación complementaria puede ayudar a evitar consumos excesivos de alimentos no saludables que condicionen riesgo de enfermedades en el futuro (66).
Energía: por lo general, en niños menores de 2 años, el consumo de energía está determinado por las prácticas de alimentación, en especial por el uso del biberón, el cual interfiere en el desarrollo de la autorregulación sólida de la ingesta en comparación con la alimentación con leche humana (39,63,67) y es un factor independiente asociado a la ganancia de peso de los niños.Las madres de niños alimentados con biberón,incluso que contengan leche humana,tienen más dificultades para comprender las claves de hambre-saciedad de sus hijos, lo que conduce a la sobrealimentación (68). En Venezuela esta situación es más grave, debido a que las madres agregan cereales y azúcar a la preparación del biberón (69).
Para evitar la ganancia excesiva de peso las recomendaciones de energía se deben realizar de acuerdo al informe de FAO 2004, las cuales son 10-25% inferiores a las recomendaciones de esta organización realizadas en 1985 (70).
Macronutrientes
Proteínas: La ingesta de proteínas, tanto en calidad como en cantidad, durante los primeros años de vida, tiene efectos importantes sobre la salud a largo plazo. Si el niño recibe leche humana en forma exclusiva, el aporte proteico es del 5- 7% del aporte total de energía, pero si recibe fórmula infantil está en 8-9%, lo que aumenta la ingesta proteica en promedio 0,5g/kg/d. Si recibe leche entera de vaca, el aporte proteico asciende a 20% (16,63,71).
Al iniciar la alimentación complementaria, el aporte proteico aumenta hasta 14-15%. En caso de que este aporte sobrepase el 16% de la distribución calórica total, los niveles de IGF-1 se elevan en un 20% y los de insulina sérica en un 100%, siempre y cuando la fuente sea leche entera de vaca, lo cual aumenta la probabilidad de desarrollar sobrepeso. Esto no se ha observado con carnes ni proteínas de origen vegetal (7,71-74).
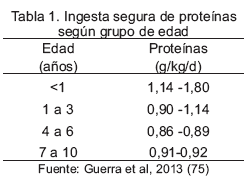
En la reciente revisión de las recomendaciones de energía y nutrientes para la población venezolana los valores de referencia de proteínas fueron inferiores a los del año 2000. Las proteínas en relación al aporte de energía total no deben ser inferiores a 10% ni mayores a 14% (75).
Carbohidratos: Comprenden un variado grupo de nutrientes que van desde los azúcares simples, los carbohidratos de absorción lenta a la fibra no digerible, su velocidad de absorción es clave en la regulación de la respuesta insulínica (76).
El consumo de carbohidratos refinados en cuanto a cantidad y precocidad en su introducción condiciona riesgo de obesidad y comorbilidad asociada. Se ha demostrado una estrecha relación entre el consumo de bebidas endulzadas con azúcar y el exceso en la ganancia de peso en niños (77); sin embargo, recientemente se ha cuestionado esta relación (78). La principal fuente de azúcar añadida en la dieta proviene de bebidas endulzadas: jugos de frutas, aguas saborizadas, bebidas carbonatadas, para deportistas y energizantes (77).
Además de contribuir con la densidad energética de la dieta, los carbohidratos simples o refinados producen alteraciones metabólicas en función de su índice glicémico, lo que puede condicionar riesgo para el desarrollo de diabetes mellitus tipo 2, independientemente de obesidad (77). La fructosa proveniente del azúcar y del jarabe de maíz (principal endulzante de bebidas industrializadas) promueve la dislipidemia y el depósito visceral de grasa posiblemente por el aumento de la lipogénesis hepática de novo (77).
Existen evidencias de que tan precozmente como a las 4 meses de edad hay un alto consumo de dulces y bebidas azucaradas (63,79,80). Un estudio en niños venezolanos entre 1 y 3 años de edad reportó que el azúcar es el segundo alimento más consumido (69), los jugos azucarados envasados son la cuarta fuente más importante de carbohidratos y las bebidas gaseosas ocupan el octavo lugar del consumo total de carbohidratos (81).
Fibra dietética: debido a su papel determinante en la microbiota intestinal, el tipo y la cantidad de fibra de la dieta están siendo ampliamente estudiados en la actualidad. Se ha observado un aumento en la relación Firmicutes/ Bacteriodetes en obesos, en comparación con individuos delgados, y su valor se reduce con la pérdida de peso durante dietas bajas en calorías (82); por lo tanto, esta relación podría considerarse un biomarcador de obesidad (76).
Grasas: los lípidos son fundamentales en el aporte calórico total y su calidad en las primeras etapas de la vida es clave para el adecuado suministro de energía y nutrientes (83).
La Sociedad Venezolana de Puericultura y Pediatría coincide con la recomendación de la Academia Americana de Pediatría (AAP) respecto a que no deben hacerse restricciones de grasa en los primeros 2 años de vida, debido a que el 50% del aporte calórico de la leche humana proviene de las grasas y los alimentos recomendados para esta edad no incrementan el porcentaje de calorías derivados de este macronutriente (84-86).
En niños mayores de 2 años se recomienda un aporte total de grasas de 20% a 30% (87-89). Esto se enfoca en implementar una dieta baja en grasas saturadas y colesterol < 300mg/d, con una relación Omega 6 / Omega 3 de 5/1 y menos de 1% de ácidos grasos trans (85). Con respecto a los ácidos grasos esenciales se recomienda un aporte de 3-4,5% de ácido linoleico y de 0,4-0,6% de ácido alfa linoleico (83,85,89). No se ha investigado el papel de los ácidos grasos esenciales con respecto al desarrollo de tejido adiposo y riesgo de obesidad (83).
La relación entre el consumo de grasa y ganancia de peso o aumento en el Índice de Masa Corporal en menores de 7 años no ha sido demostrada (84,90). En una muestra de niños y adolescentes venezolanos se observó una relación entre el excesivo aporte dietario de grasas y la disminución de niveles séricos de leptina, lo que podría explicar el origen de la malnutrición por exceso, porque la reducción en la secreción de leptina por parte del adipocito aumenta la ingesta de alimentos (91).
Vitaminas y Minerales
Vitamina D: La vitamina D inhibe la acumulación de grasa, aumenta la síntesis de proteína, preserva las células pancreáticas, disminuye la resistencia a la insulina y reduce el apetito, por tanto favorece el control de la obesidad y la diabetes tipo 2 (92). Se ha reportado una asociación entre valores bajos de vitamina D y obesidad, pero sus mecanismos no están del todo claros; se ha postulado que el secuestro de la vitamina D en el tejido adiposo -donde se expresan los receptores de esta vitamina- podría ser la causa de esta alteración (93).
En niños y adolescentes obesos el grado de adiposidad medido por IMC mostró una asociación inversa y significativa con los niveles de 25(OH)D3 (94). En niños y adolescentes obesos y eutróficos la adiposidad visceral resultó un predictor independiente de los niveles bajos de vitamina D (95). En estudios de suplementación también se ha puesto de manifiesto esta relación antagónica que implica que a mayor nivel de masa grasa se requerirán mayores dosis de vitamina D para alcanzar la repleción (96).
En la reciente revisión de las recomendaciones de energía y nutrientes para la población venezolana se aumentó el aporte diario de vitamina D para los niños menores de 2 años hasta 400 UI/día (97).
Vitamina A: Diversos estudios sugieren que la deficiencia de vitamina A puede incrementar el riesgo de obesidad; el ácido retinoico regula la producción de diversas adipocinas incluyendo la leptina y resistina, las cuales controlan el consumo de alimentos, el gasto energético y la composición corporal (98). Se ha reportado una correlación negativa entre niveles de carotenoides, vitamina E y el IMC en niños y adolescentes; mientras que se encontró una asociación positiva entre las concentraciones de retinol con el grado de adiposidad en niños (99,100).
Calcio: este mineral actúa modulando el metabolismo energético y reduciendo el riesgo de obesidad. Tanto el calcio elemental como el proveniente de los lácteos ejercen efectos comparables. Sin embargo, el calcio lácteo tiene mayor efecto en la disminución del depósito de grasas (101,102).
Hierro: El estado nutricional del hierro en pacientes con sobrepeso u obesidad ha sido evaluado en distintos contextos sin resultados consistentes. En niños y adolescentes con peso normal, sobrepeso y obesidad se demostró una mayor prevalencia de anemia por déficit de hierro en los obesos en relación a los normopeso y una correlación negativa entre los valores de hierro y el IMC (103).Se ha observado que los niños con sobrepeso tiene dos veces más riesgo de presentar déficit de hierro que la población general, por lo que se plantea la necesidad de investigar esta condición en los niños con IMC elevado (104). Las posibles causas del déficit de hierro en pacientes con sobrepeso y obesidad podrían ser: un aumento en los requerimientos por el incremento en el crecimiento y superficie corporal, un aporte dietético insuficiente por el consumo de alimentos de bajo valor nutritivo, dietas restrictivas a repetición, factores genéticos, inactividad física y un incremento en los niveles de hepcidina parcialmente mediada por la leptina (105).
Zinc: se ha observado déficit de zinc en niños obesos, pero su efecto metabólico no ha sido bien estudiado. El zinc forma parte del metabolismo de las hormonas involucradas en la fisiopatología de la obesidad, tal como la insulina y leptina, además de participar en el metabolismo de los macronutrientes (98,106,107).
Sodio: Hay evidencias científicas del efecto adverso del excesivo consumo de sal sobre la salud. El mayor aporte de sodio de la dieta proviene de alimentos industrializados. Se ha demostrado efecto directo del sodio sobre la presión sanguínea e indirecto sobre la obesidad (108), a través del aumento del consumo de líquidos que incluyen bebidas azucaradas. La reducción de 1 g/d de sal está relacionada con la disminución de 100 g de líquidos totales y 27 g de bebidas azucaradas (109), aunque se ha observado que el aumento de peso debido a la sal puede ser independiente de la ingesta de bebidas azucaradas (110).
CONCLUSIONES
El crecimiento y el desarrollo son características clave para los niños y constituyen marcadores sensibles de salud y nutrición. Para el pediatra es indispensable su evaluación y seguimiento como parte de la consulta de niños sanos.
La nutrición adecuada de la madre durante la gestación y de los niños durante los primeros años de vida es fundamental para lograr una buena salud en etapas posteriores y en la edad adulta. Por el contrario, la nutrición inadecuada durante los periodos críticos puede conducir a malnutrición por déficit y exceso y a enfermedades crónicas en la edad adulta.
La reducción de proteínas en las fórmulas infantiles induce respuestas metabólicas y endocrinas parecidas a las obtenidas con la alimentación con leche humana, la cual es insustituible.
La alimentación con leche humana reduce la obesidad en un 20% en etapas posteriores del crecimiento. Los niños amamantados tienen mejor habilidad para regular la sensación de hambre y saciedad.
El inicio de la alimentación complementaria debe ser a los 6 meses de edad.
El elevado aporte proteico y el alto consumo de bebidas azucaradas industrializadas están asociados a mayor riesgo de obesidad.
Un suministro bajo de ácidos grasos ώ-3 y elevado de ácidos grasos ώ-6 durante el desarrollo inicial se asocia a características posteriores del síndrome metabólico, como dislipidemia, resistencia a la insulina e hiperfagia.
El incremento del número de bacteroides en la microbiota intestinal predispone al almacenamiento de energía y obesidad.
Se ha reportado una asociación entre obesidad y valores bajos de vitaminas A, D, calcio, hierro y zinc, pero sus mecanismos no están del todo claros.
La nutrición adecuada en los primeros 1000 días de vida es fundamental para el pleno desarrollo del potencial humano; el periodo entre la concepción y los dos años de edad es una "ventana de tiempo crítica" para la promoción del crecimiento, el desarrollo y una salud óptimos.
RECOMENDACIONES
La reducción de nacimientos pre-término y disminución de los factores de riesgo para ECRN debe ser competencia de obstetras y pediatras, a fin de promover la salud a largo plazo.
Se recomienda una intervención médica precoz y adecuada, en especial en los períodos de rápido crecimiento, a fin de prevenir la obesidad en niños, ya que está asociada con alto riesgo de persistencia en la edad adulta.
Se recomienda la lactancia materna exclusiva durante los primeros 6 meses de vida y en forma ideal hasta los 2 años, ya que está comprobado que la ingesta excesiva de proteínas en esta etapa está asociada con obesidad en años posteriores.
La alimentación complementaria debe iniciarse a los 6 meses de edad.
Cuando sea imposible continuar la lactancia materna y se haya iniciado la alimentación complementaria, se deben administrar fórmulas infantiles de continuación con bajo contenido proteico de alta calidad, en lugar de la leche entera de vaca, ya que ésta proporciona un aporte muy elevado de proteínas y grasa saturada.
Es necesario ajustar las recomendaciones venezolanas actuales de vitamina D para niños y adolescentes obesos.
Se recomienda una ingesta de fibra dietética acorde a la edad del niño, ya que ésta desempeña un papel determinante en la microbiota intestinal.
Durante el primer año de vida no debe agregarse sal a las preparaciones; se debe restringir el consumo de alimentos industrializados por su alto contenido de sodio. No se debe permitir el añadido de sal en la mesa.
REFERENCIAS
1. World Health Organization. Diet, nutrition and the prevention of chronic diseases. WHO Technical Report Series N° 916. Geneva 2003; 149 p. [ Links ]
2. Macías-Tomei C, Maulino N. Obesidad y síndrome metabólico. En: L. Machado, I. Espinoza, R. Santiago (eds.). Nutrición Pediátrica. Sociedad Venezolana de Puericultura y Pediatría. Editorial Médica Panamericana. Caracas 2009, pp.241-272.
3. Beyerlein A, von Kries R. Breastfeeding and body composition in children: will there ever be conclusive empirical evidence for a protective effect against overweight?. Am J Clin Nutr 2011; 94 (Suppl.):1772S–1775S. [ Links ]
4. Koletzko B, Brands B, Poston L, Godfrey K, Demmelmair H. Early nutrition programming of long-term health. Proc Nutr Soc 2012;71: 371–378.doi:10.1017/S0029665112000596. [ Links ]
5. Andrade de Oliveira AM. Epidemiological and Clinical Aspects in a Developing Country. In: S.A. Yuca (editor). Childhood Obesity. InTech. Rijeka, Croatia 2012, pp. 3-14.
6. Institute of Medicine (IOM). Committee on Obesity Prevention Policies for Young Children. In: L.L. Birch, L. Parker, A. Burns (Editors). Early Childhood Obesity Prevention Policies. The National Academies Press. Washington, DC 2011; 140 p.
7. Agostoni C, Baselli L, Mazzoni MB. Early nutrition patterns and diseases of adulthood: A plausible link?. Europ J Int Med 2013; 24: 5-10. [ Links ]
8. Vasylyeva T. Genetics of obesity. In: R.J. Ferry (editor). Nutrition and Health: Management of pediatric obesity and diabetes. Humana Press. New York 2011, pp. 3-17.
9. Patel MS, Srinivasan M. Programación metabólica en la vida posnatal inmediata. Ann Nestlé 2011; 69 (2): 18-28. [ Links ]
10. Reifsnider E, Mendias E. Early infant feeding influences and weight of children. In: S.A. Yuca (editor). Childhood Obesity. InTech. Rijeka, Croatia 2012, pp .15-52.
11. López-Blanco M, Landaeta-Jiménez M, Macías-Tomei C. Contribución del Crecimiento prenatal y posnatal temprano en las enfermedades crónicas relacionadas con la nutrición. An Venez Nutr 2013a; 26 (1):26-39. [ Links ]
12. Koletzko B, von Kries R, Closa R, Escribano J, Scaglioni S, Giovannini M, et al. Can infant feeding choices modulate later obesity risk? Am J Clin Nutr 2009a; 89 (Suppl.):1502S–1508S. [ Links ]
13. Fall C. Evidence for the intra-uterine programming of adiposity in later life. Ann Hum Biol 2011; 38 (4): 410-428. [ Links ]
14. Heinberg L, Thompson K. The obesity epidemic in children and adolescents. In: L. Heinberg, K. Thompson (editors). Obesity in Youth: causes, consequences, and cures. American Psychological Association. Washington, DC 2009, pp. 3-14.
15. Mutch D, Wahli W, Williamson G. Nutrigenomics and nutrigenetics: the emerging faces of nutrition. FASEB J 2005; 12: 1602-1616. [ Links ]
16. Michaelsen KF, Larnkjær A, Mølgaard C. Amount and quality of dietary proteins during the first two years of life in relation to NCD risk in adulthood. Nutr Metab Cardiovasc Dis 2012; 22: 781-786. [ Links ]
17. Barker DJ. The origins of the developmental origins theory. J Intern Med 2007; 261:412-417. [ Links ]
18. Agostoni C, Braegger C, Decsi T, Kolacek S, Koletzko B, Michaelsen KF, et al. Breast-feeding: A commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr 2009; 49:112-125. [ Links ]
19. Lapillonne A, Griffin IJ. Feeding Preterm Infants Today for Later Metabolic and Cardiovascular Outcomes. In: R. Uauy (editor). Global Neonatal Consensus Symposium: Feeding the Preterm Infant. J Pediatr 2013; 162 (3) (Suppl. 1): S7-S16.
20. Kramer MS, Fombonne E, Igumnov S, Vanilovich I, Matush L, Mironova E, et al. Promotion OF Breastfeeding Intervention Trial (PROBIT) Study Group. Effects of prolonged and exclusive breastfeeding on child behavior and maternal adjustment: evidence from a large, randomized trial. Pediatrics 2008;121(3): e435-e440. Disponible en: http://www.pediatrics.org/cgi/content/full/121/3/e435. Fecha de consulta: 20 de junio 2014. [ Links ]
21. Mulchand P. Programación metabólica en la vida posnatal inmediata. Ann Nutr Metab 2011;58 (Suppl. 1):18–28. [ Links ]
22. Twells L, Newhook LA, Ludlow V. Can breastfeeding reduce the risk of childhood obesity?. In: S.A. Yuca (editor). Childhood Obesity. InTech. Rijeka, Croatia 2012, pp .53-78.
23. Arenz S, Ruckerl R, Koletzko B, von Kries R. Breast-feeding and childhood obesity- a systematic review. Int J Obes Relat Metab Disord 2004;28:1247-1256. [ Links ]
24. Gale C, Logan KM, Santhakumaran S, Parkinson JRC, Hyde MJ, Modi N. Effect of breastfeeding compared with formula feeding on infant body composition: a systematic review and meta-analysis. Am J Clin Nutr 2012; 95:656–669. [ Links ]
25. Li R, Fein SB, Grummer-Strawn LM. Association of breastfeeding intensity and bottle-emptying behaviors at early infancy with infants' risk for excess weight at late infancy. Pediatrics 2008; 122: S77-S84. doi: 10.1542/peds.2008-1315j. [ Links ]
26. American Academy of Pediatrics. Breastfeeding and the Use of Human Milk. Section on Breastfeeding. Pediatrics 2012;129 (3): e827-e841. doi:10.1542/peds.2011-3552.
27. Koletzko B, Broekaert I, Demmelmair H, Franke J, Hannibal I, Oberle D, et al. Protein intake in the first year of life: a risk factor for later obesity? The E.U.Childhood Obesity Project. Adv Exp Med Biol 2005; 569: 69–79.
28. Rigo J. Body composition during the first year of life. Nestlé Nutr Workshop Series Pediatr Program 2006; 58: 65-78. [ Links ]
29. Stettler N. Infant feeding practices and subsequent development of adipose tissue. In: H. van Goudoever, S. Guandalini, R.E. Kleinman (eds). Early Nutrition: Impact on Short- and Long- Term Health. Nestlé Nutr Inst Workshop Series Pediatr Program 2011; 68, pp. 215–225.
30. Tounian P. Programación hacia la obesidad infantil. Ann Nestlé 2011; 69 (2): 30-41. [ Links ]
31. Vorster HH, Kruger A. Poverty, malnutrition, underdevelopment and cardiovascular disease: a South African perspective. Cardiovasc J Afr 2007; 18(5):321-324. [ Links ]
32. Weng S, Redsell S, Swift J, Yang M, Glazebroo C. Systematic review and meta-analyses of risk factors for childhood overweight identifiable during infancy. Arch Dis Child 2012; 97(12):1019-1026. [ Links ]
33. Novak EM, Keller BO, Innis SM. Calidad de los lípidos alimentarios y consecuencias a largo plazo. Nutrition Institute Workshop Series 2010; 68: 29-31. [ Links ]
34. Pedersen L, Lauritzen L, Brasholt M, Thora Buhl T, Bisgaard H. Polyunsaturated fatty acid content of mothers milk is associated with childhood body composition. Pediatr Res 2012; 72 (6): 631-636. [ Links ]
35. Koletzko B, von Kries R, Closa R. Lower protein in infant formula is associated with lower weight up to age 2 y: a randomized clinical trial. Am J Clin Nutr 2009b; 89:1836S–1845S. [ Links ]
36. Huh SY, Rifas-Shiman SL, Taveras EM, Oken E, Gillman MW. Timing of solid food introduction and risk of obesity in preschool-aged children. Pediatrics 2011; 127(3):e544-551. Disponible en: http://www.pediatrics.org/cgi/content/full/127/3/e544 Fecha de consulta: 24 de mayo 2014. [ Links ]
37. Singhal A, Lucas A. Early origins of cardiovascular disease: is there a unifying hypothesis?. Lancet 2004; 363: 1642–1645. [ Links ]
38. Koletzko B, Beyer J, Brands B, Demmelmair H, Grote V, Haile G, et al. Grupo de Estudio del Proyecto Europeo de Obesidad Infantil. Influencias tempranas de la nutrición sobre el crecimiento postnatal. Nestlé Nutrition Institute Workshop Series 2011a; 71: 4-8. [ Links ]
39. Li R, Fein SB, Grummer-Strawn LM. Do infants fed from bottles lack self-regulation of milk intake compared with directly breastfed infants?. Pediatrics 2010; 125: pe 1386-1393, Disponible en: http://pediatrics.aappublications.org/content/125/6/e1386.full.html Fecha de consulta: 27 de mayo de 2014.
40. Agostoni C. Ghrelin, leptin and the neurometabolic axis of breastfed and formula-fed infants. Acta Paediatr 2005a; 94:523-525. [ Links ]
41. Boehm G, Stahl B. Oligosaccharides from milk. J Nutr 2007; 137:S847-S849. [ Links ]
42. Madsen AL, Schack-Nielsen L, Larnkjaer A, Molgaard C, Michaelsen KF. Determinants of blood glucose and insulin in healthy 9-month-old term Danish infants; the SKOT cohort. Diabet Med 2010; 27:1350-1357. [ Links ]
43. Koletzko B, Agostoni C, Bergmann R, Ritzenthaler K, Shamir R. Physiological aspects of human milk lipids and implications for infant feeding: a workshop report. Acta Paediatr 2011b;100:1405-1415. [ Links ]
44. Savino F, Liguori S. Update on breast milk hormones: Leptin, ghrelin and adiponectin. Clin Nutr 2008; 27: 42–47. [ Links ]
45. Koerner A, Kratzsch J, Kiess W. Adipocytokines: leptin-the classical, resistin-the controversial, adiponectin-the promising, and more to come. Best Pract Res Clin Endocrinol Metab 2005; 19: 525–546. [ Links ]
46. Power SE, O'Toole PW, Stanton C, Ross RP, Fitzgerald GF. Intestinal microbiota, diet and health. Br J Nutr 2014; 111 (3):387-402. [ Links ]
47. Bäckhed F. Programación del metabolismo del huésped por la microbiota intestinal.Ann Nutr Metab 2011;58 (Suppl.2):44– 52. [ Links ]
48. Reinhardt C, Reigstad CS, Bäckhed F. Intestinal microbiota during infancy and its implications for obesity. J Pediatr Gastroenterol Nutr 2009; 48(3):249-256. [ Links ]
49. Bäckhed F, Ding H, Wang T. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci USA 2004;101:15718 –15723. [ Links ]
50. Organización Mundial de la Salud. Estrategia mundial para la alimentación del lactante y el niño pequeño. Ginebra 2002. Disponible en: http://www.who.int/nutrition/publications/gs_infant_feeding_text_spa.pdf. Fecha de consulta: 28 de noviembre de 2009.
51. World Health Organization. Evidence on the long–term effect of the breast feeding. Systematic reviews and meta-analyses. Breastfeeding and the risk of overweight and obesity in later life. In: World Health Organization. Geneva 2007, pp.25-33.
52. Pando R, Gat-Yablonski G, Phillip M. Nutrition and Catch-up Growth. J Pediatr Gastroenterol Nutr 2010; 51 (Suppl. 3): S129-S130. [ Links ]
53. Kerkhof GF, Willemsen RH, Leunissen RWJ, Breukhoven PE, Hokken-Koelega ACS. Health profile of young adults born preterm: Negative effects of rapid weight gain in early life. J Clin Endocrinol Metab 2012; 97: 4498–4506. [ Links ]
54. Koletzko B, Bhutta ZA, Cai W, Cruchet S, El Guindi M, Fuchs GJ, et al. Compositional requirements of follow-up formula for use in infancy: Recommendations of an International Expert Group Coordinated by the Early Nutrition Academy. Ann Nutr Metab 2013; 62: 44–54. [ Links ] doi: 10.1159/000345906.
55. Ong KK, Ahmed ML, Emmett P, Preece MA, Dunger DB, and the Avon Longitudinal Study of Pregnancy and Childhood Study Team. Association between postnatal catch-up growth and obesity in childhood: prospective cohort study. BMJ 2000; 320: 967-971. [ Links ]
56. López de Blanco M. Conceptos básicos del crecimiento y maduración. En: M. López. I. Izaguirre, C. Macías (editores). Crecimiento y Maduración Física: Bases para el diagnóstico y seguimiento clínico. Editorial Médica Panamericana. Caracas 2013b, pp. 3-8.
57. Cooke RJ, Griffin IJ. Altered body composition in preterm infants at hospital discharge. Acta Paediatr 2009; 98: 1269– 1273. [ Links ]
58. Thomas EL, Al Saud NB, Durighel G, Frost G, Bell JD. The effect of preterm birth on adiposity and metabolic pathways and the implications for later life. Clin Lipidol 2012; 7(3):275-288. [ Links ]
59. Nainggolan L, Barclay L. Is Preterm Birth a Risk Factor for Later Diabetes? JAMA. 2014; 311:575-576. [ Links ]
60. Gianni ML, Mora S, Roggero P, Amato O, Piemontese P, Orsi A, et al. Regional fat distribution in children born preterm evaluated at school age. J Pediatr Gastroenterol Nutr 2008; 46:232–235. [ Links ]
61. Rolland-Cachera MF, Deheeger M, Maillot M, Bellisle F. Early adiposity rebound: causes and consequences for obesity in children and adults. Int J Obes 2006; 30 (Suppl. 4):S11-S17. [ Links ]
62. Williams SM, Goulding A. Patterns of growth associated with the timing of adiposity rebound. Obesity 2009; 17 (2):335- 341. doi: 10.1038/oby.2008.547. [ Links ]
63. Saavedra JM, Deming D, Dattilo A, Reidy K. Lecciones del estudio sobre la alimentación de lactantes y niños pequeños en Norteamérica: lo que comen los niños e implicaciones en cuanto a prevención de la obesidad. Ann Nestlé 2013; 71: 27- 36. [ Links ]
64. Moorcroft K E, Marshall JL, McCormick FM. Association between timing of introducing solid foods and obesity in infancy and childhood: A systematic review. Mat Child Nutr 2011; 7 (1):3-26. [ Links ]
65. Herrera M, Machado L, Villalobos D. Nutrición en recién nacidos a término y en niños de 1 a 6 meses. Arch Venez Puer Pediatr 2013; 76 (3): 119-127. [ Links ]
66. Mennella JA. Ontogeny of taste preferences: basic biology and implications for health. Am J Clin Nutr 2014; 99 (Suppl.):704S–711S. [ Links ]
67. Poskitt EME, Breda J. Complementary feeding and non communicable diseases: Current knowledge and future research needs. Nutr Metab Cardiovasc Dis 2012; 22: 819-822. [ Links ]
68. Li R, Magadia J, Fein SB, Grummer-Strawn LM. Risk of bottle- feeding for rapid weight gain during the first year of life. Arch Pediatr Adolesc Med 2012; 166: 431–436. [ Links ]
69. Torres-Cárdenas M, Pérez BM, Landaeta-Jiménez M, Vásquez-Ramírez M. Consumo de alimentos y estado nutricional según estrato socioeconómico en una población infantil de Caracas. Arch Venez Puer Pediatr 2011; 74 (2): 2-9. [ Links ]
70. Food and Agricultural Organization (FAO). Human Energy Requirements Report of a Joint Expert Consultation. Food and Agriculture Organization. Rome 2004.
71. Michaelsen KF, Greer FR. Protein needs early in life and long-term health. Am J Clin Nutr 2014; 99 (Suppl.): 718S– 722S. [ Links ]
72. Agostoni C, Scaglioni S, Ghisleni D, Verduci E, Giovannini M, Riva E. How much protein is safe? Int J Obes 2005b; 29: S8–S13. [ Links ]
73. Axelsson I. Effects of high protein intakes. Nestlé Nutr Workshop Series Pediatr Program 2006; 58: 121–131. [ Links ]
74. López-Luzardo M. Las dietas hiperproteicas y sus consecuencias metabólicas. An Venez Nutr 2009; 22 (2): 95-104. [ Links ]
75. Guerra M, Hernández MN, López M, Alfaro MJ. Valores de referencia de proteínas para la población venezolana. Arch Latinoam Nutr 2013; 63 (4): 278–292. [ Links ]
76. De Filippo C, Cavalieri A, Di Paola M, Ramazzotti M, Poullet JB, Massart S, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Nat Acad Sci 2010; 107 (33): 14691-14696. Disponible en: http://www.pnas.org/cgi/doi/10.1073/pnas.1005963107. Fecha de consulta: 27 de mayo de 2014. [ Links ]
77. Hu FB, Malik VS. Sugar-sweetened beverages and risk of obesity and type 2 diabetes: Epidemiologic evidence. Physiol Behav 2010; 100(1):47-54. [ Links ]
78. Massougbodji J, Le Bodo Y, Fratu R, De Wals P. Reviews examining sugar-sweetened beverages and body weight: correlates of their quality and conclusions. Am J Clin Nutr 2014; 99(5):1096-1104. [ Links ]
79. Olivares S. Actitudes y prácticas sobre alimentación y actividad física en niños obesos y sus madres en Santiago, Chile. Rev Chilena Nutr 2006;33:170-179. [ Links ]
80. Fox MK, Condon E, Briefel RR, Reidy KC, Deming DM. Food consumption patterns of young preschoolers: Are they starting off on the right path? J Am Diet Assoc 2010; 110(12):S52-S59. [ Links ]
81. Del Real S, Fajardo Z, Solano L, Páez MC, Sánchez A. Patrón de consumo de alimentos en niños de una comunidad urbana de Valencia, Venezuela. Arch Latinoam Nutr 2005; 55(3): 279- 286. [ Links ]
82. Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Microbial ecology: human gut microbes associated With obesity. Nature 2006; 444:1022–1023. [ Links ]
83. World Health Organization. Fats and fatty acids in human nutrition. In: World Health Organization. Geneva 2008, pp.25- 33.
84. Macé K, Shahkhalili Y, Aprikian O, Stan S. Dietary fat and fat types as early determinants of childhood obesity: a reappraisal. Int J Obes 2006; 30 (Suppl.4): S50– S57.doi:10.1038/sj.ijo.0803519. [ Links ]
85. Machado-Ponte L, Mejias A. Dislipidemia en el niño, niña y adolescente. En: L. Machado, I. Espinoza, R. Santiago (eds.). Nutrición Pediátrica. Sociedad Venezolana de Puericultura y Pediatría. Editorial Médica Panamericana. Caracas 2009, pp.273-300.
86. Noguera D, Márquez JC, Campos Cavada I, Santiago R. Alimentación complementaria en niños sanos de 6 a 24 meses. Arch Venez Puer Pediatr 2013; 76 (3): 128-135. [ Links ]
87. Machado de Ponte L, Macías de Tomei C, Mejias A, Méndez C, Merino G. Manejo integral de las dislipidemias en niños y adolescentes. Arch Venez Puer Pediatr 2010; 73 (2): 73-78. [ Links ]
88. Daniels S, Greer FR and the Committee on Nutrition Lipid Screening and Cardiovascular Health in Childhood. Pediatrics 2008; 122;198-208.
89. III Consenso Nacional para el manejo del paciente con dislipidemia. Manejo integral de las dislipidemias en niños, niñas y adolescentes. Avances Cardiol 2014; 34 (Supl. 1):S90-S98.
90. Agostoni C, Decsi T, Fewtrell M, Goulet O, Kolacek S, Koletzko B, et al. Complementary Feeding: A Commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr 2008; 46:99–110.
91. Viso González ME, Solano L, Sánchez A, Portillo Z, Llovera D. Serum leptin in eutrophic and overweight Venezuelan children and adolescents. Arch Latinoam Nutr 2005;55 (1):47-54.
92. Galvão Cândido F, Bressan J. Vitamin D: link between osteoporosis, obesity, and diabetes?. Int J Mol Sci 2014; 15(4):6569-91. doi: 10.3390/ijms15046569.
93. Wortsman J, Matsuoka L, Chen TC, Lu Z, Holick MF. Decreased bioavailability of vitamin D in obesity. Am J Clin Nutr 2000; 72:690–693.
94. Pacifico L, Anania C, Osborn JF, Ferraro F, Bonci E, Olivero E, et al. Low 25(OH) D3 levels are associated with total adiposity, metabolic syndrome, and hypertension in Caucasian children and adolescents. Europ J Endocrinol 2011; 165: 603–611.
95. Rajakumar K, de Las Heras J, Chen TC, Lee S, Holick MF, Arslanian SA. Vitamin D status, adiposity, and lipids in black American and Caucasian children. J Clin Endocrinol Metab 2011; 96:1560–1567. doi:10.1210/jc.2010-2388.
96. Dong Y, Stallmann-Jorgensen IS, Pollock NK, Harris RA, Keeton D, Huang Y, et al. A 16-week randomized clinical trial of 2000 international units daily Vitamin D3 supplementation in black youth: 25-Hydroxyvitamin D, adiposity, and arterial stiffness. J Clin Endocrinol Metab 2010; 95: 4584–4591.
97. Macías-Tomei C, Palacios C, Mariño M, Carías D, Noguera D, Chávez JF. Revisión de los valores de referencia de calcio, vitamina D, fósforo, magnesio y flúor en Venezuela. Arch Latinoam Nutr 2013; 63 (4): 362–378.
98. García OP, Long KZ, Rosado JL. Impact of micronutrient deficiencies on obesity. Nutr Rev 2009; 67(10): 559-572.
99. De Souza Valente da Silva L, Valeria da Veiga G, Ramalho RA. Association of serum concentrations of retinol and carotenoids with overweight in children and adolescents.Nutrition 2007;23(5):392-397.
100. Marks GC, Al-Mamun A, Long KZ. Low serum concentrations of carotenoids and vitamin E are associated with high adiposity in Mexican-American children. J Nutr 2014; 144(4):489-495.
101. Zemel MB, Shi H, Greer B, Dirienzo D, Zemel PC. Regulation of adiposity by dietary calcium. FASEB J 2000; 14: 1132–1138.
102. Novotny R, Daida YG, Acharya S, Grove JS, Vogt TM. Dairy intake is associated with lower body fat and soda intake with greater weight in adolescent girls. J Nutr 2004; 134: 1905– 1909.
103. Pinhas-Hamiel O, Newfield RS, Koren I, Agmon A, Lilos P, Phillip M. Greater prevalence of iron deficiency in overweight and obese children and adolescents. Int J Obes Relat Metab Disord 2003; 27: 416-418.
104. Nead KG, Halterman JS, Kaczorowski JM, Auinger P, Weitzman M. Overweight children and adolescents: a risk group for iron deficiency. Pediatrics 2004; 114:104-108.
105. Del Giudice EM, Santoro N, Amato A, Brienza C, Calabró P, Wiegerinck ET, et al. Hepcidin in obese children as a potential mediator of the association between obesity and iron deficiency. J Clin Endocrinol Metab 2009; 94 (12): 5102-5107.
106. Pizarro F, Olivares M, Kain J. Hierro y zinc en la dieta de la población de Santiago. Rev Chilena Nutr 2005; 32 (1): 19-27. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext & pid=S071775182005000100002 & lng=es & nrm=iso. Fecha de consulta: 22 de junio 2014.
107. Weisstaub G, Hertrampf E, López de Romaña D, Salazar G, Bugueño C, Castillo-Duran C. Plasma zinc concentration, body composition and physical activity in obese preschool children. Biol Trace Elem Res 2007; 118:167–174.
108. Grimes CA, Riddell LJ, Campbell KJ, Nowson CA. Dietary salt intake, sugar-sweetened beverage consumption, and obesity risk. Pediatrics 2012; 131(1):14–21.
109. He FJ, Marrero NM, Mc Gregor GA. Salt intake is related to soft drink consumption in children and Adolescents: A Link to Obesity? Hypertension 2008; 51(3): 629-634.
110. Libuda L, Kersting M, Alexy U. Consumption of dietary salt measured by urinary sodium excretion and its association with body weight status in healthy children and adolescents. Public Health Nutr 2012;15(3):433–441.