Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Archivos Venezolanos de Puericultura y Pediatría
versão impressa ISSN 0004-0649
Arch Venez Puer Ped vol.78 no.1 Caracas mar. 2015
Aspectos nutricionales de la disfunción tiroidea en niños y adolescentes con síndrome de Down
Carlos J. Chávez (1), Pablo Ortega (2), Luís E. Miranda (3), Jorymar Y. Leal M (4), Carolina Escalona (5), Criserly Delgado (6).
1. Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. Maracaibo, Venezuela.
2. Instituto de Investigaciones Genéticas. Facultad de Medicina. Universidad del Zulia. Maracaibo, Venezuela.
3. Postgrado de inmunología experimental. Facultad de Ciencias. Universidad del Zulia. Maracaibo, Venezuela.
RESUMEN
La trisomía 21 o síndrome de Down (SD) es la causa más frecuente de retardo mental de origen cromosómico, asociada con disfunción tiroidea (DT) y obesidad como problema de salud pública. El hipotiroidismo es la forma más común de DT asociada con SD, con prevalencia cercana a 50%. Objetivo: Determinar la prevalencia de disfunción de tiroidea y aspectos relacionados con el estado nutricional de niños y adolescentes con SD. Métodos: Se realizó un estudio prospectivo y transversal, en 17 niños con SD (11,5 ± 3,0 años), seleccionados aleatoriamente. El estudio empleo evaluación antropométrica, entrevista dietética con recordatorio de 72 horas y determinación de hormonas tiroideas. El análisis estadístico requirió SPSS 17, con 95% IC, p <0,05. Resultados: Individuos con SD presentaron sobrepeso en 47,1% (n=8). Se observó hipotiroidismo subclínico en 71,4% (n=10), mientras que 28,6% (n=4) mostraron hipotiroidismo clínico. El consumo de yodo (53,4 ± 12,0 vs 130,5 ± 18,1; p<0,05), fenilalanina (0,1 ± 0,0 vs 2,3 ± 0,5; p<0,05) y tirosina (0,1 ± 0,0 vs 2,3 ± 0,5; p<0,05) fue bajo comparado con la media de requerimientos para estos nutrientes tiroideos en niños y adolescentes con SD. El consumo de yodo y concentraciones de T4 (r=0,512; p<0,03) mostraron correlación positiva; asimismo, el consumo de fenilalanina y tirosina (r=0,803; p<0,001). Conclusiones: Los trastornos de organificación de hormonas tiroideas en SD no justifican la DT. Se sugiere suplementación nutricional en etapas precoces de la vida, facilitando un estado eutiroideo que propicie el desarrollo físico y cognitivo en individuos con SD. Palabras clave: Síndrome de Down, disfunción tiroidea, nutrición, niños, adolescentes.
Palabras clave: Síndrome de Down, disfunción tiroidea, nutrición, niños, adolescentes.
Nutritional aspects of thyroid dysfunction in children and adolescents with down syndrome
SUMMARY
Trisomy 21 or Down Syndrome (DS) is the most common cause of mental retardation with chromosomal origin, associated with thyroid dysfunction (TD) and obesity as a public health problem. Hypothyroidism is the most common form of TD associated with DS, with nearly 50% prevalence. Objective: To determine the prevalence of thyroid dysfunction and aspects related to the nutritional status of children and adolescents with DS. Methods: A prospective and cross-sectional study in 17 children with DS (11.5 ± 3.0 years) were randomly selected. The study anthropometric, dietary interview with 72 hours and determination of thyroid hormones was realized. The required statistical analysis SPSS 17 with 95% CI, p <0.05. Results: Individuals with DS were overweight in 47.1% (n = 8). Subclinical hypothyroidism was observed in 71.4% (n = 10), while 28.6% (n = 4) showed clinical hypothyroidism. The consumption of iodine (53.4 ± 12.0 vs 130.5 ± 18.1; p <0.05), phenylalanine (0.1 ± 0, 0 vs 2.3 ± 0.5; p <0.05) and tyrosine (0.1 ± 0.0 vs 2.3 ± 0.5; p <0.05) was low compared to the average requirement for these thyroid nutrients in children and adolescents with DS. Consumption of iodine and T4 concentrations (r = 0.512; p <0.03) showed positive correlation; Also, consumption of phenylalanine and tyrosine (r = 0.803; p <0.001). Conclusions: Organification disorders of thyroid hormones in DS does not justify the TD. Nutritional supplementation of thyroid nutrients providing a euthyroid condition that improves physical and cognitive development in individuals with DS is suggested.
Keywords: Down syndrome, thyroid dysfunction, nutrition, children, adolescents.
Recibido: 5/2/2015 Aceptado: 15/3/2015
INTRODUCCIÓN
El síndrome de Down (SD) o trisomía 21 es la alteración cromosómica más común relacionada con retardo mental en la población mundial. La incidencia de SD varía entre 1/449 y 2/700 nacidos vivos (1,2). La disfunción tiroidea (DT) es más frecuente entre niños y adultos que presenta SD con respecto a la población general, destacando el hipotiroidismo como la forma más común de DT asociada con SD, con prevalencia cercana a 50% y fundamentalmente de origen autoinmunitario (3-5). El hipertiroidismo aunque prevalente en SD, sólo casos esporádicos se han reportado en la literatura médica (6,7).
Es bien conocida la asociación existente entre SD y DT, aunque la frecuencia comunicada de hipotiroidismo en SD varía con el diseño del estudio y edad de los individuos, los análisis longitudinales y transversales han demostrado una frecuencia significativamente mayor de hipotiroidismo en niños y adultos con SD (5,8). En la edad adulta, la incidencia acumulada es aproximadamente de 30%; sin embargo, estudios previos de función tiroidea en adultos con SD señalan que 8 a 10% pueden presentar hipotiroidismo no diagnosticado o subclínico y sin intervención médica, debido a que los síntomas de hipotiroidismo en la niñez (retraso en el desarrollo, aumento de índice de masa corporal, disminución del crecimiento lineal, estreñimiento e hipotonía muscular) son típicos del SD (5,9).
Desde el punto de vista genético y bioquímico el SD presenta enzimas con repercusiones metabólicas codificadas en el cromosoma 21 extra, activamente transcritas y sobre-expresadas, determinando el conocido Efecto de dosis génica (10). Al respecto, se ha señalado que existe una relación directa entre el efecto de dosis génica y desarrollo de DT en SD debido a interferencia genética en la producción de hormona tiroidea y estrés oxidativo que dificulta la organificación tiroidea (11).
Actualmente, la forma más común y comercializada de reemplazo de la hormona tiroidea es la tetrayodotironina cristalina sintética (tiroxina, T-4), cuyos efectos secundarios incluyen: fatiga, aumento del apetito, pérdida de peso, intolerancia al calor, diaforesis, ansiedad, irritabilidad, insomnio, temblores, debilidad muscular, insuficiencia cardíaca, angina de pecho, disnea, diarrea, disminución de la densidad mineral ósea, entre otros (7). Generalmente, la terapia de reemplazo hormonal con tiroxina debe tomarse de por vida, contribuyendo con la atrofia glandular tiroidea en individuos con SD por interferencia en la producción de TSH (11).
Si bien la terapia de reemplazo hormonal con tiroxina sintética puede ser beneficiosa en el neurodesarrollo de pacientes con SD (12), no está claro que los medicamentos que contienen tiroxina sean siempre la mejor opción disponible, considerando que la DT puede ser parte de una deficiencia de nutrientes o enzimas claves necesarias para una adecuada función tiroidea (11).
El presente estudio tiene por objeto determinar la prevalencia de disfunción tiroidea y aspectos relacionados con el estado nutricional de pacientes con SD, como avance en el desarrollo de la nutrición glandular preventiva de las alteraciones nutricionales de enfermedades genéticas prevalentes en la población venezolana.
MÉTODOS
Se realizó un estudio prospectivo y transversal, en una muestra probabilística de 17 pacientes con SD con edades entre 6 y 17 años de ambos géneros (7 varones y 10 hembras), seleccionados al azar de la Unidad de Educación Especial Instituto Zulia en el primer semestre del año 2013. El estudio recibió la aprobación del Consejo Técnico del Instituto de Investigaciones Biológicas de la Facultad de Medicina y la Comisión Científica del Consejo de Desarrollo Científico y Humanístico de la Universidad del Zulia (CONDES-LUZ) bajo el Nº CC-0372-10. Además, se obtuvo consentimiento informado por escrito de padres y/o representantes legales. El grupo fue procedente de estratos socio-económicos IV y V según escala de Graffar-Méndez Castellano (13).
El criterio principal de inclusión estuvo constituido por individuos con SD (47 XX o XY + 21) según el análisis del cariotipo de los participantes en el estudio, el cual fue realizado por especialista técnico en citogenética. La evaluación clínica fue realizada por personal médico capacitado, considerando como criterios de exclusión: Individuos con al menos un episodio de temperatura axilar >37ºC durante los últimos 15 días, tres o más evacuaciones líquidas en menos de 24 horas y/o procesos infecciosos activos.
La evaluación nutricional antropométrica fue elaborada por una Licenciada en Nutrición y Dietética, considerando variables como edad, genero, peso y talla, utilizando para su análisis las tablas de FUNDACREDESA (14). Entretanto, las variables antropométricas peso y talla en individuos con síndrome de Down fueron analizadas utilizando las tablas norteamericanas elaboradas por Cronk y colaboradores (15). Asimismo, La evaluación dietética se realizó considerando nutrientes tiroideos (nutrientes utilizados en el proceso de organificación de las hormonas tiroideas, tirosina, fenilalanina y yodo) mediante recordatorio de 24, 48, 72 horas y frecuencia de consumo de alimentos, utilizando la técnica de la entrevista (16,17). Se obtuvo una muestra de sangre por punción venosa periférica teniendo en cuenta que hubiesen transcurrido por lo menos ocho horas de ayuno. La determinación de hormonas tiroideas fue realizada por radioinmunoensayo de fase sólida, para cuantificar TSH (0,3-4,5 uUI/mL) y T4 libre (0,8-1,8 ng/dL), respectivamente (18).
El análisis estadístico de los datos, se realizó con el uso del software estadístico (SPSS 17.0 para Windows.). La organización de los datos se efectuó mediante el uso de tablas de contingencia, pruebas de Mann-Whitney y correlación de Pearson, tomando el 95% como índice de confiabilidad estadística y considerando significancia estadística una P < 0.05 (los datos cuantitativos se mostraron como valores promedio ± desviación estándar).
RESULTADOS
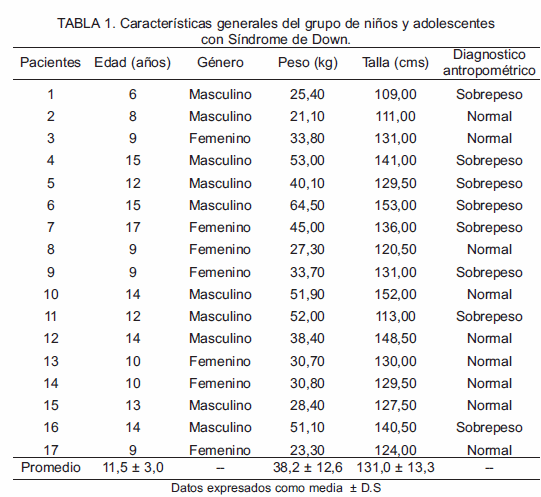
En el presente estudio se evaluó la prevalencia de disfunción tiroidea y aspectos relacionados con el estado nutricional de 17 individuos con síndrome de Down (cariotipo: 47 XY o XX + 21), con edades comprendidas entre 6 y 17 años (Edad promedio: 11,5 ± 3,0 años).
La Tabla 1 muestra las características generales del grupo de niños y adolescentes con Síndrome de Down. En niños y adolescente con SD se observó condición antropométrica nutricional de sobrepeso en 47,1% (n=8), con respecto a 52,9% (n=9) en situación de normopeso. Asimismo, se estimó talla baja en promedio (131,0 ± 13,3) asociada con la trisomía 21.
La Tabla 2 muestra la determinación de hormonas tiroideas en niños y adolescentes con Síndrome de Down. Se encontró que 71,4% (n=10) de los individuos con SD y TSH elevada presentaron hipotiroidismo subclínico, mientras que 28,6% (n=4) mostraron hipotiroidismo clínico en tratamiento médico farmacológico.
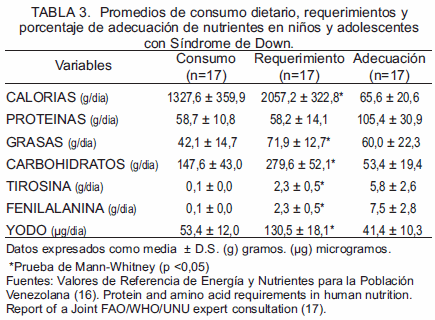
La Tabla 3 muestra los promedios de consumo dietario, requerimiento y porcentaje de adecuación de nutrientes en niños y adolescentes con Síndrome de Down. Los niños y adolescentes SD mostraron un bajo consumo dietario comparado con la media de requerimientos de calorías (1327,6 ± 359,9 vs 2057,2 ± 322,8; p<0,05), grasas (42,1 ± 14,7 vs 71,9 ± 12,7; p<0,05), carbohidratos (147,6 ± 43,0 vs 279,6 ± 52,1; p<0,05), yodo (53,4 ± 12,0 vs 130,5 ± 18,1; p<0,05), fenilalanina (0,1 ± 0,0 vs 2,3 ± 0,5; p<0,05) y tirosina (0,1 ± 0,0 vs 2,3 ± 0,5; p<0,05), corregidos con promedios de porcentaje de adecuación.
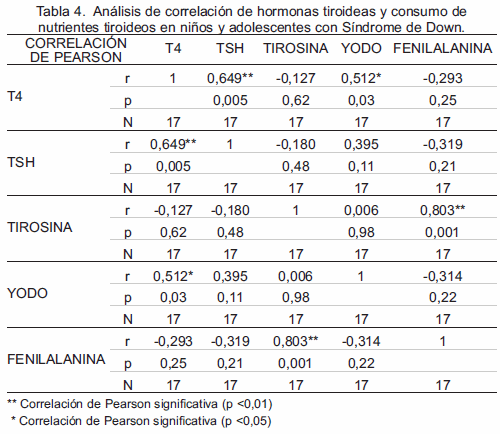
La Tabla 4 muestra el análisis de correlación de hormonas y consumo de nutrientes tiroideos en individuos con Síndrome de Down. Se evidenció una correlación positiva significativa entre la elevación de T4 y TSH (r=0,649; p<0,005). Igualmente, el consumo de yodo y concentraciones de T4 (r=0,512; p<0,03) mostraron correlación positiva significativa; del mismo modo, que el consumo dietario de fenilalanina y tirosina (r=0,803; p<0,001).
DISCUSIÓN
En la presente investigación las características antropométricas de niños y adolescentes con SD mostraron resultados que coinciden con estudios que señalan la presencia de talla baja debida a falla del crecimiento en trisomía del cromosoma 21 (19). Por consiguiente, la utilización de estándares de crecimiento realizados para la población general, no son adecuados para la evaluación antropométrica de individuos con SD, promoviendo un diagnóstico erróneo del estado nutricional. En consecuencia, se han desarrollado estándares de crecimiento específicos para estos niños, basados en la población norteamericana de individuos con SD (15).
No obstante, no existe un consenso con relación a una curva para evaluar el estado nutricional de niños y adolescentes con SD, por lo cual se han propuesto algunos estándares de crecimiento, aplicados en países donde fueron desarrollados (19); por ende, es necesario planificar un proyecto de investigación antropométrico que permita perfilar estándares que se adapten a la curva de crecimiento de niños y adolescentes venezolanos con SD.
En otro contexto, niños y adolescentes con SD estudiados manifestaron hipotiroidismo subclínico, determinado bioquímicamente como concentración elevada de hormona estimulante de tiroides (TSH) en presencia de tiroxina (T4) normal, una circunstancia particularmente común en individuos con SD con prevalencia entre 25% a 60% (5). La causa de HS en los primeros años de vida en el SD no queda clara; sin embargo, las hipótesis planteadas incluyen un defecto periférico local en la generación o acción de T3, insensibilidad tiroidea a la TSH, y secreción inadecuada o menos activa de TSH a nivel central (5). Karlsson y colaboradores (20), señalan que la autoinmunidad no es causa esencial de este trastorno; sin embargo, entre 13-34% de los auto-anticuerpos tiroideos se encuentran presentes en pacientes con SD, siendo la enfermedad tiroidea autoinmune poco común en niños preescolares con SD, pero habitual después de la edad de 8 años. No obstante, se sugiere implícitamente que el efecto de dosis génica en individuos con SD esta en relación directa con la alteración congénita en la regulación hormonal de la glándula tiroidea (10,11).
En lo que respecta al consumo de nutrientes medido por él porcentaje de adecuación, se obtuvo que individuos con SD presentan una alimentación inadecuada, con un consumo deficiente de calorías y carbohidratos recomendados en la dieta. Aunque se observó un adecuado consumo de proteínas, la entrevista evidencio que individuos con SD obtienen sus proteínas predominantemente a expensas de productos procesados o enlatados, que no son fuente adecuada de fenilalanina ni tirosina; en consecuencia, el aporte deficiente de aminoácidos esenciales para la nutrición tiroidea puede generar trastornos en la organificación tiroidea, transporte hormonal, y alteración de los mecanismos de retroalimentación que permiten el mantenimiento del estado eutiroideo (21). Actualmente, no se han reportado estudios previos relacionados con el consumo de nutrientes tiroideos y SD.
Otro elemento importante en la nutrición de la glándula tiroides es el yodo, cuya adecuada concentración es necesaria para la formación de las hormonas tiroideas, demostrándose en este estudio que el consumo de individuos con SD de este mineral fue bajo; según la entrevista nutricional, un deficiente aporte de alimentos que contienen este mineral es confirmado por Madres que desconocen el enriquecimiento de yodo en la sal utilizada para la preparación de alimentos en el hogar. Al respecto, Sarici y colaboradores (22), destacan la presencia de TSH elevada en el periodo neonatal en SD asociado con deficiencia de yodo en 40% de los casos determinados por concentraciones de yodo urinario; en consistencia, con estudios que señalan la presencia de carencias nutricionales maternas de yodo que aumentan la probabilidad de disfunción tiroidea en su descendencia (23).
Asimismo, un análisis de correlación realizado en este estudio demuestra el aumento de las concentraciones de yodo en la dieta, asociado con la producción de T4; es decir, mientras se garantice mayor aporte de yodo proveniente de una dieta rica en este mineral, mayor será la disponibilidad de hormona tiroidea funcional. La evaluación nutricional del grupo de niños y adolescentes con SD estudiados mostró que no poseen un adecuado aporte diario de yodo, principalmente por desconocimiento de sus cuidadores de la importancia de este mineral, fuentes de aporte nutricional, falla en la verificación de yodación de sal y baja disponibilidad económica para obtener una nutrición balanceada que incluya grupos de alimentos que aporten la dosis diaria recomendada en la dieta para yodo según el rango de edad: 150 μg en adultos, 90 μg para niños de 1 a 8 años y 120 μg para niños de 9-13 años (11).
Al mismo tiempo, el aporte dietético de los aminoácidos tirosina y fenilalanina guardan relación directa, debido a que ambos aumentan sus concentraciones de manera muy similar, recordando que estos aminoácidos son provenientes de la dieta diaria. Se ha reportado (24), que individuos con SD presentan trastornos de organificación de hormonas tiroideas por su condición trisomica (efecto de dosis génica); no obstante, una baja disponibilidad de nutrientes tiroideos (tirosina, fenilalanina, yodo, entre otros), demuestra la necesidad de monitorear y fomentar el aporte adecuado de los mismos, con el objeto de garantizar el incremento de las concentraciones de hormonas tiroideas.
La resolución valida de criterios médicos puede concluir que existen múltiples factores nutricionales que considerar y la medicación con tiroxina resulta un recurso práctico de tratamiento; sin embargo, la realidad es que las consecuencias a largo plazo de la supresión artificial de la función tiroidea mediante la terapia de tiroxina plantean mayores complicaciones potenciales en el futuro.
Finalmente, reconocemos la necesidad de determinar la presencia de auto-anticuerpos tiroideos y ecografía de tiroides en nuestra población, ya que la ausencia de bocio y anticuerpos se asocia a una mayor tasa de resolución espontánea del hipotiroidismo subclínico (24). Sin embargo, estimamos que una adecuada suplementación con nutrientes tiroideos diseñada para niños con SD en etapas precoces de su vida puede ser benéfica y propiciar el aumento de la actividad glandular de la tiroides que facilite el desarrollo físico y cognitivo de personas con SD.
REFERENCIAS.
1. Presson AP, Partyka G, Jensen KM, Devine OJ, Rasmussen SA, McCabe LL, et al. Current estimate of Down Syndrome population prevalence in the United States. J Pediatr 2013; 163(4):1163-1168. [ Links ]
2. Loane M, Morris JK, Addor MC, Arriola L, Budd J, Doray B, et al. Twenty-year trends in the prevalence of Down syndrome and other trisomies in Europe: impact of maternal age and prenatal screening. Eur J Hum Genet 2013; 21(1):27-33. [ Links ]
3. Fergeson MA, Mulvihill JJ, Schaefer GB, Dehaai KA, Piatt J, Combs K, et al. Low adherence to national guidelines for thyroid screening in Down syndrome. Genet Med 2009; 11(7):548-551. [ Links ]
4. Cebeci AN, Güven A, Yıldız M. Profile of hypothyroidism in Downs syndrome. J Clin Res Pediatr Endocrinol 2013; 5(2):116-120. [ Links ]
5. King K, O'Gorman C, Gallagher S. Thyroid dysfunction in children with Down syndrome: a literature review. Ir J Med Sci 2014; 183(1):1-6. [ Links ]
6. Goday-Arno A, Cerda-Esteva M, Flores-Le-Roux JA, Chillaron-Jordan JJ, Corretger JM, Cano-Pérez JF. Hyperthyroidism in a population with Down syndrome (DS). Clin Endocrinol (Oxf) 2009; 71(1):110-114. [ Links ]
7. Ali FE, al-Busairi WA, al-Mulla FA. Treatment of hyperthyroidism in Down syndrome: case report and review of the literature. Res Dev Disabil 1999; 20(4):297- 303. [ Links ]
8. Prasher V, Gomez G. Natural history of thyroid function in adults with Down syndrome--10-year follow-up study. J Intellect Disabil Res. 2007; 51(Pt 4):312-317. [ Links ]
9. Hawli Y, Nasrallah M, El-Hajj Fuleihan G. Endocrine and musculoskeletal abnormalities in patients with Down syndrome. Nat Rev Endocrinol 2009; 5(6):327- 334. [ Links ]
10. Dutta S, Nandagopal K, Gangopadhyay PK, Mukhopadhyay K. Molecular aspects of Down syndrome. Indian Pediatr 2005; 42(4):339-344. [ Links ]
11. Thiel R, Fowkes SW. Down syndrome and thyroid dysfunction: should nutritional support be the first-line treatment?. Med Hypotheses 2007; 69(4):809-815. [ Links ]
12. Van Trotsenburg AS, Vulsma T, van Rozenburg-Marres SL, van Baar AL, Ridder JC, Heymans HS, et al. The effect of thyroxine treatment started in the neonatal period on development and growth of two-year-old Down syndrome children: a randomized clinical trial. J Clin Endocrinol Metab 2005; 90(6):3304–3311. [ Links ]
13. Méndez Castellano H, Méndez de MC. Estratificación social. Método Graffar modificado para Venezuela. Arch Venez Puer Ped. 1986; 49: 93-104. [ Links ]
14. López M, Landaeta M. Manual de Crecimiento y Desarrollo. Ed. Sociedad Venezolana de Puericultura y Pediatría, FUNDACREDESA, SERONO. Caracas 1991. [ Links ]
15. Cronk C, Crocker AC, Pueschel SM, Shea AM, Zackai E, Pickens G, et al. Growth charts for children with Down syndrome: 1 month to 18 years of age. Pediatrics 1988; 81(1):102-110. [ Links ]
16. Instituto Nacional de Nutrición. Valores de Referencia de Energía y Nutrientes para la Población Venezolana. Revisión 2000. Serie de Cuadernos Azules. Publicación Nº 53. Caracas 2001, 76p. [ Links ]
17. World Health Organization, Food and Agriculture Organization of the United Nations, United Nations University. Protein and amino acid requirements in human nutrition. Report of a joint FAO/WHO/UNU expert consultation (WHO Technical Report Series 935). 2007, 265p. [ Links ]
18. Bergoglio LM, Mestman JH. Guía del consenso para el diagnóstico y seguimiento de la enfermedad tiroidea. Acta Bioquim Clin Latinoam 2006; 40 (3): 399-418. [ Links ]
19. Pinheiro A, Urteaga C, Canete G. Evaluación del estado nutricional en niños con síndrome de Down según diferentes referencias antropométricas. Rev Chil Pediatr 2003; 74(6):585-589. [ Links ]
20. Karlsson B, Gustafsson J, Hedov G, Ivarsson S, Anneren G. Thyroid dysfunction in Downs syndrome: relation to age and thyroid autoimmunity. Arch Dis Child 1998; 79(3):242-245. [ Links ]
21. Kumar S, Nadkarni J, Dwivedi R. Thyroid hormone status in malnourished children. Indian Pediatr 2009; 46(3):263-264. [ Links ]
22. Sarici D, Akin MA, Kurtoglu S, Gunes T, Ozturk MA, Akcakus M. Thyroid functions of neonates with Down syndrome. Ital J Pediatr 2012; 38:44. [ Links ]
23. Kurtoglu S, Akcakus M, Kocaoglu C, Gunes T, Budak N, Atabek ME, et al. Iodine status remains critical in mother and infant in Central Anatolia (Kayseri) of Turkey. Eur J Nutr 2004; 43(5):297-303. [ Links ]
24. Claret C., Corretger J.M., Goday A. Hipotiroidismo y síndrome de Down. Rev Med Int Sindr Down 2013; 17:18-24. [ Links ]