Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión impresa ISSN 0016-3503versión On-line ISSN 2477-975X
Gen v.64 n.1 Caracas mar. 2010
Lesiones gástricas premalignas en familiares en primer grado de pacientes con cáncer gástrico evaluados en la consulta de gastroenterología de dos hospitales universitarios de Caracas
Dres: Veitía G*, Ruiz N*, Graterol A *, Brizuela L*, Otero J *, Angarita L*, Rodríguez M*, Sandoval C*, Khassale M*, Gledhill T*, Pernalete B **, Rodríguez L**, La Cruz M**, Villarreal Lara**.
Instituciones: Hospital Vargas de Caracas *
Hospital Militar "Dr. Carlos Arvelo" **.
Para cualquier información o separata contactar al Dr. Guillermo Veitía Correo-e: gveitia@cantv.net
RESUMEN
Introducción: Las alteraciones morfológicas de la mucosa gástrica que predisponen al desarrollo de cáncer gástrico son atrofia, metaplasia y displasia. Diversos factores etiológicos han sido estudiados, destacándose el parentescoen primer grado con una probabilidad de presentar cáncer gástrico 2veces más que la población general. Objetivo: Diagnosticar lesiones gástricas premalignas en familiares de pacientes con cáncer gástrico, evaluados en las consultas de Gastroenterología del Hospital Vargas de Caracas y Hospital Militar Dr. Carlos Arvelo. Pacientes y Métodos: Se realizó un estudio descriptivo, prospectivo, longitudinal, desde Octubre 2008 a Mayo 2009. Se incluyeron 75 individuos con edades comprendidas entre 18 y 80 años, familiares en primer grado de pacientes con cáncer gástrico, a los cuales se les practicó endoscopia digestiva superior con toma de biopsia. Resultados: En 51 pacientes femeninos (68%) y 24 (32%) masculinos, se encontraron los siguientes hallazgos endoscópicos: endoscopia normal 52%, gastropatía crónica 33%, úlcera gástrica 5,33%, pólipos gástricos 3,33% y úlcera duodenal 1,33%. El estudio histológico determinó que la atrofia estuvo presente en 25 pacientes (33,3%), metaplasia intestinal en 17 pacientes (22,67%), displasia en 4 pacientes (5,33%), la mitad de ellas de alto grado y 1 (1,33%) indefinido para displasia. Conclusión y recomendación: En el grupo estudiado se encontró un 42,6% de lesiones gástricas premalignas, de las cuales el 5,33% correspondió a displasia, ninguno de estos con lesiones endoscópicas de malignidad; lo que nos hace recomendar de rutina en todos los servicios de gastroenterología del país un programa de pesquisa en familiares en primer grado de pacientes de cáncer gástrico.
SUMMARY
Introduction: Morphological alterations of the gastric mucosa that predispose to the development of gastric cancer are atrophy, metaplasia and dysplasia. Various etiologic factors have been studied, especially in first degree relatives,with a probability of gastric cancer double than that of the general population. Objective: To diagnose premalignant gastric lesions in relatives of patients with gastric cancer evaluated in the Gastroenterology consultation of Hospital Vargas de Caracas and Hospital Militar Dr. Carlos Arvelo. Patients and Methods: A descriptive, prospective, longitudinal study was made, from October 2008 to May 2009. We included 75 individuals aged 18 to 80 years in first degree relatives of patients with gastric cancer, who underwent upper gastrointestinal endoscopy with biopsy guided. Results: We found 51 (68%) female and 24 (32%) male, with these endoscopic findings: normal in 52% of the patients, with chronic gastropathy 37, 33%, gastric ulcer in 5,3%, gastric polyps in 3,33% and duodenal ulcer in 1,33%. The histological study found that atrophy was present in 25 (33.3%) patients, intestinal metaplasia in 17 (22, 67%) and dysplasia in 4(5, 33%) and 1(1,33%) indefinite to dysplasia. Conclusion and recommendation: In this group of patients it was found a 42.6% of premalignant gastric lesions, of which 5.33% corresponded to dysplasia. Neither one had endoscopic malignant lesions. We recommend as a routine in all Gastroenterology Divisions in the country a program of screening in first degree families of patients of gastric cancer.
Fecha de Recepción: Sep. 2009 Fecha de Revisión: Nov. 2009 Fecha de Aprobación: Ene. 2010.
INTRODUCCIÓN
Existen conocimientos formales acerca de condiciones y lesiones gástricas pre-neoplásicas. Una condición preneoplásica corresponde a un estado clínico asociado a un significativo aumento del riesgo de desarrollo de un cáncer, mientras que una lesión preneoplásica corresponde a una anormalidad histopatológica en la que es más probable que se desarrolle esta patología. Muchas condiciones pre-neoplásicas se asocian a lesiones pre-neoplásicas evidenciables; sin embargo, esto no es una asociación constante. La anemia perniciosa, el remanente gástrico post-gastrectomía, la enfermedad de Menetrier y más recientemente la infección gástrica por Helicobacter pylori han sido mencionadas como condiciones pre-neoplásicas para la mucosa gástrica(1). Se han publicado estudios donde se ha demostrado la asociación de cáncer gástrico con el grupo sanguíneo A y tener familiares en primer grado con cáncer gástrico y otros tipos de cáncer(2).
Las lesiones preneoplásicas han sido descritas como un hallazgo histopatológico en un momento dado, al considerar el hecho de que la carcinogénesis es un proceso progresivo en el que intervienen múltiples factores y cuya interacción parece influir en el desarrollo del cáncer gástrico. En los pacientes con infección por Helicobacter pylori (considerado como carcinogénico tipo I por la Organización Mundial de la Salud), el modelo de carcinogénesis gástrica, en múltiples etapas, considera una primera fase caracterizada por una respuesta inflamatoria crónica activa producto de la infección. El proceso inflamatorio y la respuesta inmune específica se asocian a un aumento de la proliferación celular y también de la tasa de apoptosis, asociado también a los factores de virulencia propios de la bacteria y su genotipo. Posteriormente, aparecen trastornos del crecimiento y de la diferenciación celular que darían origen a atrofia, a metaplasia intestinal y a displasia epitelial o neoplasia intraepitelial gástrica (NIEG)(1, 3).
Desde el punto de vista histopatológico, se han realizado múltiples clasificaciones para las lesiones gástricas dentro de las que se destacan en primer lugar la clasificación de Sidney, que propone la gradación y estadiaje de la gastritis; esta incluye, a su vez, dos tipos de clasificaciones, una histológica y otra endoscópica. La clasificación histológica se basa en tres parámetros: a) la etiología; b) la cronología y topografía (afectación predominante de cuerpo, de antro o pangastritis), y c) la morfología (que incluye cinco variables cuantificables, como inflamación, actividad, atrofia, metaplasia intestinal y densidad de Helicobacter pylori). En segundo lugar, la clasificación de Viena, orienta a definir el grado de displasia. Así mismo, la clasificación de Padova recuerda los 5 grados: ausencia de atipia, atipia leve, atipia límite, probable cáncer y cáncer gástrico; ésta última es, hasta la fecha, la más aceptada y seguida(4, 5, 16).
Recientemente en el 2007, el grupo internacional de gastroenterólogos y patólogos (Operative Link on Gastritis Assessment [OLGA]) formuló un sistema histológico de estadificación de las enfermedades inflamatorias gástricas. El sistema OLGA emplea el protocolo de muestras de biopsias y la escala visual analógica (EVA) recomendados por la versión actualizada de Houston del sistema de Sydney. En el sistema de estadificación OLGA, la atrofia gástrica es considerada una lesión histológica representativa de progresión de la enfermedad(6). Sidney define la atrofia como pérdida del epitelio glandular. La atrofia lleva a adelgazamiento de la mucosa y es común denominador a todos los procesos patológicos que causan daño mucoso intenso, en la clasificación OLGA, la atrofia asociada a metaplasia está representada por el cambio metaplásico que afecta diversas porciones de la unidad glandular original, con excepción de los cambios metaplásicos restringidos al segmento foveolar de la mucosa, y por lo tanto no reemplaza el espesor completo de la mucosa gástrica nativa(7).
En los últimos años, los estudios han centrado su atención en identificar los factores carcinogénicos con la finalidad de detectar precozmente lesiones premalignas y así detener la progresión de la enfermedad a cáncer gástrico, ya que éste ocupa el segundo lugar en frecuencia de los tumores malignos, por lo que continúa siendo un importante problema sanitario a nivel mundial(8).
En un estudio publicado por El-Omar et. al., en el año 2000 encontraron que los familiares de pacientes con cáncer gástrico comparado con un grupo control, tienen una mayor prevalencia de hipoclorhidria (27% vs. 3%), pero similar prevalencia de infección por Helicobacter pylori (63% vs. 64%). Entre los familiares de los pacientes de cáncer, la prevalencia de atrofia e hipoclorhidria se incrementó sólo en aquellos con evidencia de infección por Helicobacter pylori(2, 9).
Junto a la condición carcinogénica, existen condiciones asociadas al huésped (genético y ambiental) que explicarían la baja frecuencia con que los individuos infectados con Helicobacter pylori desarrollan un carcinoma o un linfoma. Además, aún en los individuos que desarrollan un tumor maligno el proceso tomaría 3 a 5 décadas en desencadenar la neoplasia, por lo que es factible plantear que una multitud de factores modulan este fenómeno(10, 11).
En 1996 en Venezuela, se realizó un estudio sobre la prevalencia de lesiones preneoplásicas gástricas y encontraron que el 94% tenían algún tipo de gastritis crónica y fueron positivos para Helicobacter pylori mediante coloración de Giemsa, el 49% tenía gastritis atrófica, el 34% había metaplasia intestinal, y el 6,5% tenían displasia(11). Gemmato en el 2005, encontró una relación estadísticamente significativa entre la presencia de lesiones preneoplásicas gástricas y la infección por Helicobacter pylori(12).
La importancia de los datos reportados nos lleva a incrementar el esfuerzo como equipo de salud en diagnosticar lo más precoz posible la enfermedad en los pacientes que tienen riesgo elevado, con miras a proponer la terapéutica adecuada para cada estadio y mejorar así la tasa de supervivencia en las lesiones tempranas. El objetivo del presente estudio fue determinar la presencia de lesiones gástricas premalignas en los familiares de primer grado de pacientes con diagnóstico de cáncer gástrico.
PACIENTES Y MÉTODOS
Estudio descriptivo, prospectivo, de corte longitudinal, realizado durante el período octubre 2008 - mayo 2009. Se incluyeron 75 pacientes, familiares en primer grado (progenitores, hermanos e hijos) de pacientes conocidos de las consultas de Gastroenterología del Hospital Vargas de Caracas y Hospital Militar Dr. Carlos Arvelo, con diagnóstico de cáncer gástrico, los cuales fueron contactados por vía telefónica o personal y expresaron su conformidad de participar en el estudio. Se excluyeron embarazadas, personas mayores de 80 años o con antecedentes personales de cáncer gástrico, pacientes con coagulopatías, insuficiencia respiratoria o insuficiencia cardíaca descompensada.
Procedimiento: los pacientes fueron llevados a endoscopia digestiva superior previo ayuno de 8 horas, con el videogastroscopio Fujinon® serie 2000 y Olympus®. Se tomaron biopsias de la mucosa gástrica según las recomendaciones de la reunión de consenso celebrada en Sidney en el año 2005 (2 de antro, 2 en curvatura menor de cuerpo y 2 de ángulo gástrico) para su estudio histopatológico. Las muestras histológicas fueron fijadas en formaldehido al 10%, deshidratadas en alcoholes crecientes (75, 80, 90, 100%), embebidas en parafina, cortadas con un micrótomo Porter-Blumm y finalmente, teñidas con hematoxilina y eosina, y con ácido peryódico Schiff (PAS) con y sin digestión. Se emplearon los criterios morfológicos de los Sistemas de Clasificación de Sydney, Padova y de Viena en la evaluación de las distintas muestras histológicas:
Presencia o no de infección por Helicobacter pylori:
Densidad de la colonización de la mucosa gástrica por Helicobacter pylori, expresado de manera semicuantitativa: + (leve), ++ (moderado), +++ (severo).
Presencia o no de infiltrado inflamatorio linfoplasmocitario en la lámina propia.
Presencia o no de polimorfonucleares neutrófilos y eosinófilos en el estroma y o permeando el epitelio glandular.
Atrofia glandular: considerando el número y tamaño de las glándulas gástricas, y su distribución focal o multifocal.
Metaplasia intestinal: incompleta o completa, focal o multifocal.
Presencia o no de atipias citomorfológicas y arquitecturales en las glándulas gástricas (displasia- neoplasia de bajo vs. alto grado).
Presencia de infiltración tumoral a la lámina propia.
ANÁLISIS ESTADÍSTICO
El procesamiento de la información fue realizado mediante la utilización del paquete de computación Excel para ambiente Windows (2003). La información se presenta en gráficas de barras simples o múltiples en donde se muestran frecuencias absolutas, porcentaje, promedios y las correspondientes pruebas y niveles de significación de ser necesarias. El criterio de significación utilizado en todos los análisis es menor a 5% de error, es decir, una probabilidad menor del 5% (p<0,05).
RESULTADOS
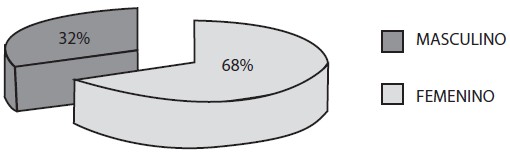
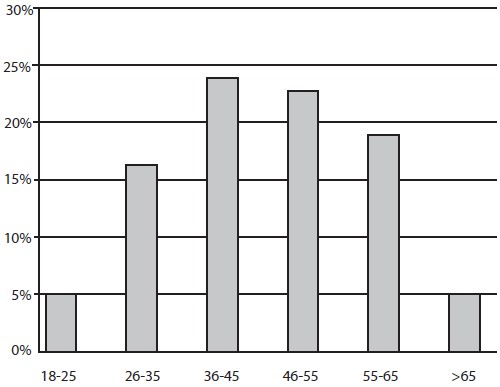
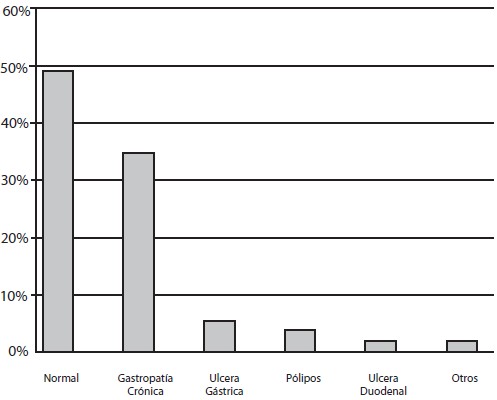
Un total de 75 pacientes fueron sometidos a endoscopia digestiva superior, 68% (n=51) del sexo femenino y 32% (n=24) del sexo masculino (Gráfico 1), con edades comprendidas entre 18 y 80 años, siendo el grupo 36-45 años el de mayor predominio con un 25,33% (19) (Gráfico 2). Con respecto a los hallazgos endoscópicos, el estudio fue normal en un 52% (39), gastropatía crónica 37,7% (n=28), distribuyéndose esta a su vez en gastropatía atrófica en 21,42% (n=6), gastropatía eritematosa 32,1% (n=9) y gastropatía erosiva 46,4% (n=13); úlcera gástrica 5,33% (n=4), úlcera duodenal 1,33% (n=1), pólipos gástricos 2,66% (n=2) y otras 1,33(n=1) (Gráfico 3).
Gráfico 1. Distribución según sexo. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
Gráfico 2. Distribución según grupo etario. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
Gráfico 3. Distribución según hallazgos endoscópicos. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
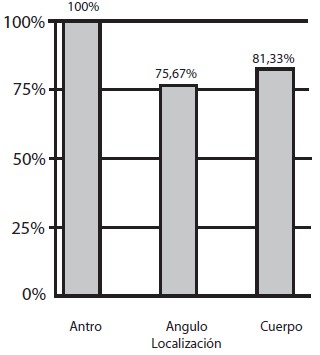
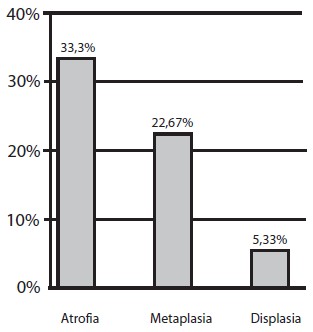
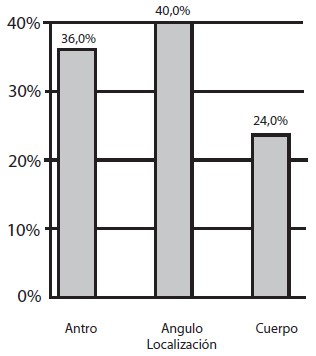
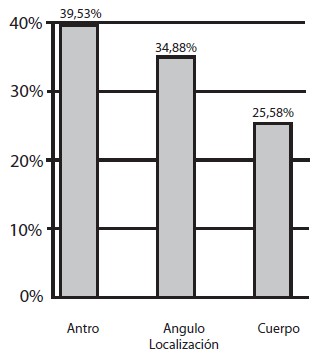
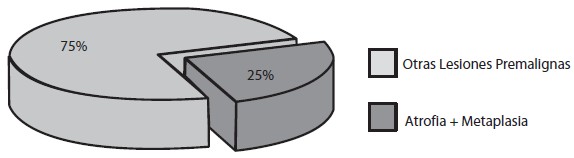
En el estudio histopatológico se encontró gastritis crónica en todos los pacientes, distribuyéndose en el 100% de las muestras de antro, en 75,67% de ángulo y en 81,3% de cuerpo (Gráfico 4); fue reportada como severa en 21%, moderada en 43,33% y leve en 19,20%. La atrofia estuvo representadaen un 30,30%, metaplasia intestinal en 22,67% y displasia en 5,33% (Gráfico 5). La metaplasia intestinal según su localización se observó en 9 muestras de antro (36%); 10 de ángulo (40%) y 6 de cuerpo (24%) (Gráfico 6). Con respecto a la atrofia glandular se evidenció en el 39,53% en antro, 38,88% en ángulo y 25,58% en cuerpo (Gráfico 7). En 4 pacientes (5,33%) se encontró displasia, 2 de alto grado, 2 de bajo grado en antro y 1 indefinido para displasia ninguno de ellos con lesiones endoscópicas de malignidad (Tabla 1). Se observó que de la totalidad de los pacientes con lesiones premalignas, en un 25% estaba presente la atrofia asociada a la metaplasia intestinal incompleta (Gráfico 8). La infección Helicobacter pylori se encontró en el 80% de los pacientes (Gráfico 9).
Gráfico 4. Distribución de gastritis según localización. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
Gráfico 5. Distribución según hallazgos histológicos. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
Gráfico 6. Distribución de metaplasia intestinal según localización. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
Gráfico 7. Distribución de atrofia según su localización. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
Tabla 1. Hallazgos Endoscópicos, Grado de Displasia y Presencia de Helicobacter Pylori. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
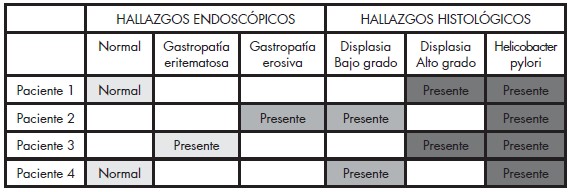
Gráfico 8. Presencia de Atrofia y Metaplasia Intestinal Incompleta. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
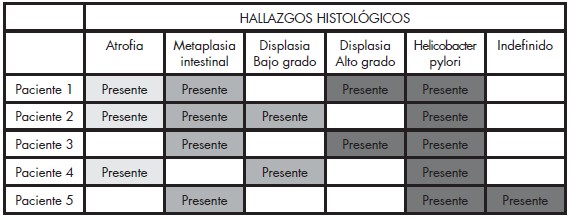
De los 2 pacientes con displasia de alto grado, 1 presentó metaplasia intestinal incompleta y atrofia asociada; el segundo sólo metaplasia intestinal incompleta. En los pacientes con displasia de bajo grado fue reportada atrofia en uno de ellos y metaplasia intestinal incompleta asociada a atrofia en el restante (Tabla 2).
Tabla 2. Displasia Asociada a otras Alteraciones Histológicas y Presencia de Helicobacter Pylori. Lesiones Gástricas Premalignas en Familiares en Primer Grado de Pacientes con Cáncer Gástrico Evaluados en la Consulta de Gastroenterología de dos Hospitales Universitarios.
DISCUSIÓN
En el presente estudio se encontró que de los 75 individuos familiares en primer grado de pacientes con cáncer gástrico, el 42,6% tenían lesiones gástricas premalignas sin hallazgos endoscópicos sugestivos de malignidad. La atrofia gástrica fue la lesión predominante en un 30,33%, lo cual es relevante ya que esta se considera un signo cardinal en el proceso gradual de la carcinogénesis. La metaplasia intestinal estuvo presente en un 22,67%, cifra que coincide con la mayoría de los estudios reportados a nivel mundial. Es de hacer que la totalidad de éstas correspondió al tipo histológicamente incompleto, hallazgo asociado a un mayor riesgo de progresión a malignidad. En el 5,33% de las muestras se encontró displasia, la mitad de ellas de alto grado y un 1,33% indefinido para displasia, dato de especial relevancia dado que en ninguno de estos pacientes se observó lesión endoscópica sugestiva de malignidad.
Existen estudios acerca de la detección de lesiones gástricas premalignas, como factores de riesgo para desarrollar cáncer gástrico, pocos de ellosen familiares en primer grado de pacientes con cáncer gástrico. Metz y Albert(3) en el 2000 y El-Omar en el 2003(2), reportan la prevalencia de atrofia e hipoclorhidria en los familiares de cáncer asociados a la infección por Helicobacter pylori. Nuestro estudio encontró un alto porcentaje de infección por este agente en los familiares en primer grado.
En Venezuela se han publicado estudios como el de Muñoz(9) y Gammato(10) acerca de la prevalencia de lesiones gástricas preneoplásicas, datos similares a los reportados en esta investigación. Es de hacer notar que el mismo fue desarrollado en una zona endémica del país, sin tomar en cuenta el antecedente familiar en primer grado.
Genta y cols. en el 2003(8), investigaron la relación de las cepas de Helicobacter pylori y los tipos de gastritis en familiares de primer grado de pacientes de cáncer gástrico. Aunque este no fue objetivo de nuestro estudio, se evidenció alto porcentaje de infección por Helicobacter pylori, sin identificación de cepas. Es de destacar la presencia de Helicobacter pylori en todos los pacientes con displasia.
CONCLUSIÓN
En el grupo estudiado se determinó un 42,6 % de lesiones gástricas premalignas. De éstas, el 5,33% correspondieron a displasia, siendo la mitad de ellas de alto grado, ninguno de éstos con lesiones endoscópicas de malignidad, por lo que recomendamos de rutina en todos los servicios de gastroenterología del país, un programa de pesquisa en familiares en primer grado de pacientes con cáncer gástrico.
REFERENCIAS BIBLIOGRÁFICAS
1. Fox James, Wang Timothy C. Inflamation Atrophy and Gastric Cancer. Journal of Clinical Investigation 2006; 117(1): 60-69.
2. El-Omar E. M., Oien K, Murray L. S, El-Nujumi A, Wirz A & et. Increased Prevalence of Precancerous Changes in Relatives of Gastric Cancer Patients: Critical role of H. pylori. Gastroenterology. 2000; 118: 22-30. [ Links ]
3. Metz D, Alberts S. Gastrointestinal Cancer Prevention in the United states: The Road Ahead. Cancer Epidemiology, Biomarkers & Prevention 2003; (12) 81-83. [ Links ]
4. Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol. 1996 Oct; 20(10):1161-8. [ Links ]
5. Sanz JM, Blanco A, Arriendo JM, Almedilla. Patología gástrica. Lesiones precursoras de Cáncer Gástrico. VII Congreso Virtual Hispanoamericano en Anatomía Patológica y I Congreso de Preparaciones Virtuales por Internet. 2005 on line: http://www.conganat.org/7congreso/PDF/521.pfd [ Links ]
6. Rugge M, Meggio A, Graham DY. Gastritis Staging in Clinical Practice: The OLGA Staging System. Gut May 2007; 56(5):631-636. [ Links ]
7. Ramírez P, Gonzáles U, Garay A, Segovia S. Evaluación Histopatológica de gastritis atrófica: Comparación de los Sistemas de Sidney y OLGA. Rev. Med Inst Seguro S 2008; 42 (2): 135-139. [ Links ]
8. Roukos Dh. Relevant Prognostic Factors in Gastric Cancer. ANN Surg 2000; 232:719-20. [ Links ]
9. Medina Lois Ernesto. Epidemiología del Cáncer Gástrico. Publicación Universidad de Chile. 2001. [ Links ]
10. Li Li, Genta R, Mae F, Gutiérrez O, Kim J, Graham D. Helicobacter pylori Strain and the Pattern of Gastritis among Fisrt-degree Relatives of Patients with Gastric Carcinoma. Helicobacter. 2003; 7 ( 6): 349-65. [ Links ]
11. Muñoz N, Kato I, Peraza S, López G, Carrillo E y cols. Prevalence of Precancerous Lesions of the Stomach in Venezuela. Cancer Epidemiol Biomarkers Prev. 1996 Jan;5(1):41-6. [ Links ]
12. Gemmato A, Casanova G, García M, Novoa D, Parlapiano D, Martínez D. Relación entre Infección por Helicobacter Pylori y Lesiones Preneoplásicas Gástricas. GEN 2005; 59 (2):93-98. [ Links ]
13. Fuccio L, Zagari L, Minardi M, Bazzoli F. Sistematic review: Helicobacter pylori Erradication for the Prevention of Gastric Cancer. Aliment Pharmacol Ther 2007; 25: 133-141.
14. Ebert A, Malfertheine P. Review article: Pathogenesis of Sporadic and Familial Gastric Cancer?implications for Clinical Management and Cancer Prevention. Aliment Pharmacol Ther 2002; 16: 1059-1066.
15. Armbrecht U, Stockbrugger RW, Rode J, et al. Development of Gastric Dysplasia in Pernicious Anemia: a Clinical and Endoscopic Follow up Study of 80 patients. Gut 1990; 31: 1105-1109. [ Links ]
16. Nagayo T . Histogenesis and Precursors of Human Gastric Cancer. Research and Practice. Springer-Verlag, Tokio, 1986. [ Links ]