Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Gen
Print version ISSN 0016-3503
Gen vol.68 no.1 Caracas Mar. 2014
Sensibilidad y especificidad de los marcadores serológicos para diagnóstico y seguimiento de la condición celíaca
Fabiola Fabiano,1 Daniel Lista,2 Joselit Torres,3 Ana Urquiola4
1 Bioanalista, Especialista en Inmunología, Directora del Laboratorio Torre Caracas e Instituto Docente de Inmuno Diagnóstico, Caracas, Venezuela.
2 Bioanalista del Laboratorio Torre Caracas e Instituto Docente de Inmuno Diagnóstico, Caracas, Venezuela.
3 Médico Pediatra, Inmunólogo y Alergólogo, Instituto Docente de Inmuno Diagnóstico, Jefe del Servicio de Pediatría del Hospital Vargas de Caracas, Venezuela.
4 Bioanalista, Especialista en Inmunología, Laboratorio Clínico Urquiola, Maracay, Venezuela.
Autor correspondiente: Dra. Fabiola Fabiano. Bioanalista. Directora del Laboratorio Torre Caracas e Instituto Docente de Inmuno Diagnóstico, Caracas, Venezuela. Correo-e: lab.torreccs@gmail.com
Resumen
Introducción: El diagnóstico precoz y seguimiento de la condición celíaca ha sido objeto de importantes cambios, y según la guía ESPGHAN (2012) la serología es ahora una herramienta fundamental. Los principales son los anticuerpos anti-gliadina IgG/IgA, anti-transglutaminasa IgG/IgA, anti-endomisiales (EMA), y los recientemente descritos anti-péptidos deaminados de gliadina (anti-DGPs). El propósito del estudio fue determinar la sensibilidad y especificidad de estos marcadores en 308 individuos con y sin patología. Materiales y métodos: A cada individuo se le realizaron determinaciones de: TTGG y TTGA Qual (AESKU Diagnostics ®, Germany), TgTG, TgTA, AAGG y AAGA por ENEASYSTEM III® (Byogenetix, Italia), Neoep. IgG/A (AESKU Diagnostics®, Germany), EMA IgG e IGA y GAF3X IgG e IgA (Euroimmun, Germany ®). Resultados: Los valores de sensibilidad (S) y especificidad (E) fueron: Para anti-IgA Celicheck: S: 44.44%, E: 97.59%; anti-TTG Qual: S: 14.28%, E: 97.61%; anti-neoepítopes IgG/IgA: S: 54.44%, E: 91.59%; AAG IgG: S: 89.11%, E: 63.19%; AAG IgA: S: 79.11%, E: 68.16%; anti-DGPs IgA: S: 86.67%, E: 96.21% (p<0,05). Conclusiones: Los ATgT IgG e IgA solo son superados por los anti-DGPs. Se debe ampliar las investigaciones para estandarizar este nuevo método de valoración.
Palabras clave: Enfermedad celiaca, anticuerpos antigliadina, antiendomisio, antitransglutaminasa
Sensitivity and specificity of serological markers for diagnosis and monitoring of celiac condition
Summary
Introduction: The diagnosis and management of celiac disease has undergone significant changes, according to the ESPGHAN guide (2012) serology is now an essential tool. The main ones are the anti-gliadin IgG/IgA anti-transglutaminase IgG/IgA, anti-endomysial and the recently described anti-deaminated gliadin peptides (anti-DGPs). The purpose of the study was to determine the sensitivity and specificity of these markers in 308 individuals with and without pathology. Materials and Methods: Each individual is simultaneously made the following determinations: TTGG and TTGA Qual (AESKU Diagnostics®, Germany), TgTG, TgTA, AAGG and AAGA ENEASYSTEM III® (Byogenetix, Italia), Neoep. IgG/A (AESKU Diagnostics®, Germany), EMA IgG, IGA and GAF3X IgG-IgA (Euroimmun, Germany®). Results: The sensitivity (S) and specificity (Sp) were: anti-IgA To Celicheck: S: 44.44%, E: 97.59% anti-TTG Qual: S: 14.28%, E: 97.61% anti-neoepitopes IgG/IgA: S: 54.44%, E: 91.59%; AAG IgG: S: 89.11%, E: 63.19%; AAG IgA: S: 79.11%, E: 68.16% IgA anti-DGPs: S: 86.67% E: 96.21% (p<0.05). Conclusions: IgG and IgA ATGT are surpassed only by anti-DGPs However, it is important to extend the research to standardize this new method of assessment.
Key words: Celiac Disease, antigliadin antibodies, antiendomysium, antitransglutaminase
Fecha de recepción: 2 de octubre de 2013. Fecha de revisión: 16 de octubre de 2013. Fecha de aprobación: 27 de enero de 2014.
Introducción
El desarrollo de pruebas serológicas para la enfermedad celíaca (EC) ha generado una revolución en el manejo diagnóstico de los cuadros malabsortivos. Así, la aparición y estudio de los anticuerpos anti-endomisiales (EMA, por sus siglas en inglés)1 condujo a una revisión de los estrictos criterios diagnósticos de la EC en 1977, basados en los esquemas de retirada y reintroducción del gluten, que requerían la realización de mínimo tres biopsias intestinales.2 Posteriormente se pasó a criterios menos agresivos en 1990(3), siendo la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN por sus siglas en ingles) la que sugirió que el diagnóstico de la EC podía realizarse mediante biopsia intestinal acompañada de marcadores serológicos positivos, que retornaban a la normalidad con la dieta libre de gluten.
Los siguientes estudios en este campo permitieron el aislamiento e identificación del principal antígeno de los EMA, la transglutaminasa tisular (TgT),4 lo que permitió el desarrollo de técnicas automatizables, una generalización de su uso, la posibilidad de completar los estudios epidemiológicos que se habían iniciado con los EMA y cambiar la concepción sobre la epidemiología de la EC.
Los anticuerpos anti-gliadina (AAG) por su parte representaron la primera herramienta serológica útil en el diagnóstico, sin embargo, se ha comprobado que no son específicos, pudiendo estar presentes en Enfermedad de Crohn,5 intolerancia al gluten no celíaca, enfermedades no gastrointestinales e incluso en individuos sanos con una dieta rica en gluten.6,7,8,9 En la década de los 70, la descripción de anticuerpos EMA mostraron una eficiencia mayor, con valores de sensibilidad y especificidad superiores al 95%.10,11,12 En 1997, el descubrimiento de los anticuerpos anti-TgT permitió aplicar métodos automatizados para estudiar un gran número de muestras.4 La aparición de falsos positivos llevó al uso de antígenos recombinantes humanos, lo que permitió mejorar en gran medida la especificidad y sensibilidad, las cuales se han reportado entre 95-99% y 89-96% respectivamente.13
En las últimas investigaciones se ha reportado un nuevo marcador en EC, los anticuerpos contra los péptidos deaminados de la gliadina (GDPs por sus siglas en inglés) o anticuerpos contra los péptidos de fusión análogos a la gliadina (GAF3X).14 El fundamento de la técnica se basa en la hipótesis que los AAG en EC se producirían frente al complejo gliadina-transglutaminasa y por tanto, los anticuerpos producidos contra péptidos deaminados resultarían más específicos de la enfermedad. Podrían preceder en su síntesis a los marcadores reticulínicos y parecen tener buen comportamiento en pacientes con EC menores de 3 años y como prueba de monitorización de adherencia a la dieta libre de gluten. Así, se han propuesto como complemento a la determinación de TgT a fin de mejorar la especificidad y sensibilidad.15
La función de los marcadores serológicos es identificar pacientes con gran probabilidad de padecer EC por cuadro clínico sugerente o pertenecer a poblaciones de riesgo, en los cuales se hace necesaria la realización de una biopsia intestinal para la confirmación de la enfermedad. Para esta función de cribado, diagnóstico y seguimiento a la dieta libre de gluten, es fundamental que estos posean una elevada sensibilidad, que permita detectar la mayoría de los casos, así como una alta especificidad, que coincida con la información obtenida de las biopsias intestinales. Tomando en cuenta estas consideraciones, el propósito de la presente investigación fue determinar y comparar la sensibilidad y especificidad de diversos marcadores utilizados en el diagnóstico de EC en el país, a fin de poder utilizar aquellos que aporten mayor información sobre esta patología.
Materiales y métodos
Se realizó un estudio transversal en 308 individuos de diversas edades y provenientes de varias ciudades de Venezuela con y sin diagnóstico clínico, histopatológico o de laboratorio de EC. Como requisito para participar en la investigación, se requirió y solicitó la autorización escrita de cada individuo adulto y del(los) representante(s) legal(es) de cada uno de los menores de edad y la firma del consentimiento informado, en donde se detallaron los objetivos, beneficios y riesgos de su participación en el estudio. Todos los representantes de los niños evaluados y los adultos recibieron los resultados de los exámenes que les fueron practicados y se explicó el diagnóstico en cada caso.
Se obtuvo 10 mL de suero de cada individuo, mediante la obtención de un volumen aproximado de 24 mL de sangre total, en tubos libres de anticoagulantes con silicón de la casa comercial Becton Dickinson®. Estos fueron sometidos a centrifugación a 15000 r.p.m durante 15 minutos en una centrífuga electrónica marca Thermo®.
Las muestras fueron almacenadas en congelación a -20 °C hasta el momento de su uso.
En cada caso se realizaron las siguientes determinaciones siguiendo las instrucciones del fabricante en relación al procesamiento de muestras, protocolos de calibración y control: Anticuerpos anti-transglutaminasa de tejido IgG por el método de Elisa (TTGG Qual) (AESKU Diagnostics®, Germany), anticuerpos anti-transglutaminasa de tejido IgA por el método de Elisa (TTGA Qual) (AESKU Diagnostics®, Germany), anticuerpos anti-transglutaminasa de tejido IgG (TgTG) por el método automatizado ENEASYSTEM III® (Byogenetix, Italia), anticuerpos anti-transglutaminasa
de tejido IgA (TgTA) por el método automatizado ENEASYSTEM III® (Byogenetix, Italia), anticuerpos anti-endomisiales IgG (EMA IgG) por el método de inmunofluorescencia indirecta (Euroimmun, Germany®), anticuerpos anti-endomisiales IgA (EMA IgA) por el método de inmunofluorescencia indirecta (Euroimmun, Germany®), anticuerpos anti-gliadina IgG (AAGG) por el método automatizado ENEASYSTEM III® (Byogenetix, Italia), anticuerpos anti-gliadina IgA (AAGA) por el método automatizado ENEASYSTEM III® (Byogenetix, Italia), anticuerpos anti-neoepítopes de la gliadina IgG/IgA (Neoep. IgG/A) por el método de ELISA (AESKU Diagnostics®, Germany), anticuerpos contra péptidos de fusión análogos a la gliadina IgG (GAF3X IgG) por el método de ELISA (Euroimmun, Germany®) y anticuerpos contra péptidos de fusión análogos a la gliadina IgA (GAF3X IgA) por el método de ELISA (Euroimmun, Germany®). El análisis estadístico de los datos obtenidos se realizó utilizando los programas computarizados Instad, SPSS y EPI INFO. Se realizó un estudio comparativo en todos los individuos evaluados. Para realizar las comparaciones entre las variables se utilizó la prueba de chi-cuadrado. A fin de establecer las comparaciones entre la presencia de síntomas clínicos y concentraciones de los marcadores serológicos, se utilizó la prueba exacta de Fisher. Para el estudio de muestras no independientes se utilizó el método de McNemar. El método estadístico no paramétrico de Kruskal-Wallis fue aplicado para verificar si existían diferencias estadísticamente significativas en los casos en los cuales la distribución de los datos no presentó una distribución normal.
Los resultados fueron expresados en porcentajes y valores de significancia estadística (p<0,05).
Resultados
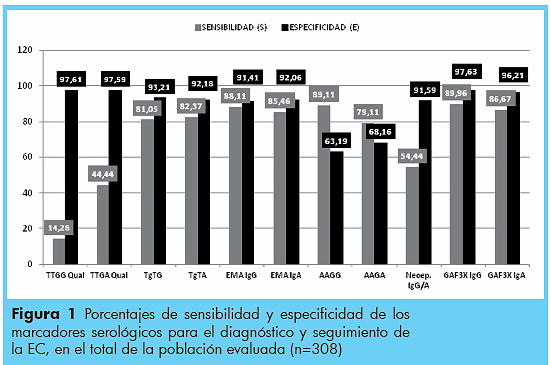
Los porcentajes de sensibilidad y especificidad de cada uno de los marcadores evaluados son mostrados en detalle en la Figura 1.
La significancia estadística en cada uno de los casos, es detallada en el Cuadro 1.
Discusión
En la década de los 60 se demostró que pacientes con EC generaban una respuesta de anticuerpos que disminuían tras instaurar una dieta libre de gluten, mas tarde, estos fueron descritos como AAG.9 Diversos estudios han reportado que estos se elevan en las fases de actividad de la enfermedad de forma consecuente con la ingesta de gluten, pero con diferencias cinéticas dependiendo del isotipo.16 Los AAG IgA disminuyen rápidamente hasta negativizarse tras la adherencia a una dieta libre de gluten, mientras que los AAG IgG presentan una cinética más lenta, mantienen sus niveles elevados durante más tiempo, y pueden no llegar a negativizarse en ciertos casos.17 La edad es otro factor importante, ya que la elevación es mayor en pacientes menores de 2 años, disminuyendo el valor diagnóstico en niños mayores y adultos.18,19 Tanto los AAG IgG como los AAG IgA han reportado en los diversos estudios una sensibilidad y especificidad entre 70 y 80%.13 En nuestro estudio, los valores de sensibilidad (S) y especificidad (E) fueron 89,11% con 63,19% para AAG IgG, y 79,11% con 68,16% para AAG IgA. Debido a la baja especificidad de ellos, ya que se encuentran presentes en patologías distintas a la EC e incluso en individuos sanos, algunos autores han sugerido que con la disponibilidad actual de marcadores serológicos alternativos que se han desarrollado en las últimas décadas, no parece justificar su uso para el diagnóstico de EC.20 Ya en la década de los 80 y posterior al descubrimiento de los AAG, se pusieron en evidencia en los pacientes con EC no tratada, otras respuestas humorales cuya detección requiere la utilización de un sustrato tisular. De ellos, el más específico y sensible es el EMA, sin embargo su cinética de negativización no se correlaciona con la de la recuperación de la integridad de la mucosa intestinal, y no es sensible a transgresiones leves de la dieta. En nuestro estudio se obtuvo un porcentaje de S y E de 88,11% con 91,41% para el isotipo IgG, y 85,46% con 92,06% para IgA, sugiriéndose entonces que estos deben ser utilizados en el diagnóstico pero no en el seguimiento de la adherencia a la dieta libre de gluten. Otro de los principales problemas que pudiera limitar su uso en el diagnóstico en diversos laboratorios públicos y privados es técnico, puesto que la IFI requiere equipos costosos, entrenamiento y experiencia del observador para su interpretación.
Los TgT IgA pueden ser más adecuados que los EMA para monitorizar la dieta, aunque se han perfilado como alternativa los TgT combinados en sus isotipos IgA e IgG.21,22 Los valores de S y E obtenidos para estos marcadores en la población estudiada fue de 14,28% con 97,61% para TTGG Qual, 44,44% con 97,59% para TTGA Qual, 81,05% con 93,21% para TgTG y 82,37% con 92,18% para TgTA, considerando que los datos obtenidos para TgTG y TgTA son comparables a los obtenidos en otros estudios, en otras poblaciones. La TgT es el principal antígeno con el cual reaccionan los EMA; sin embargo, es posible que existan otros antígenos menores en el endomisio con capacidad para unirse a EMA, esta posiblemente sea la razón por la cual los resultados de EMA y TgT no siempre son completamente concordantes. Puede decirse que los EMA IgA son más específicos y los TgT más sensibles, especialmente con el uso de antigeno recombinante humano. Sin embargo, ambos marcadores han demostrado una pérdida de sensibilidad en los casos de alteraciones parciales de la mucosa intestinal, reportándose EMA negativos en hasta 69% de los casos con alteraciones parciales (Marsh IIIa) de adultos.29 Así mismo, es posible encontrar positividades de estos marcadores sin alteraciones de la mucosa o con alteraciones leves.21,22
En los últimos años se han descrito nuevos marcadores que prometen mejorar la S y E en el diagnóstico y seguimiento de la EC, y que han sido definidos como anticuerpos contra los péptidos deaminados de la gliadina (GDPs por sus siglas en inglés) o anticuerpos contra los péptidos de fusión análogos a la gliadina (GAF3X)(14). Los reportes han sugerido que estos son más sensibles que los EMA y tan específicos como los anti-TgT. En nuestra investigación resultaron ser, en conjunto, los más sensibles (90%) y específicos (97%).
En conjunto, los resultados obtenidos en nuestra investigación sugieren que los marcadores serológicos evaluados representan pruebas altamente específicas en el diagnóstico y seguimiento de la EC, sin embargo, estos deben necesariamente interpretarse en conjunto con el resto de los procedimientos biomédicos y con la biopsia intestinal, a fin de lograr un diagnóstico certero.
Clasificación
Area: gastroenterología
Tipo: clínico
Tema: condición celíaca
Patrocinio: este trabajo no ha sido patrocinado por ningun ente gubernamental o comercial.
Referencias bibliográficas
1. Chorzelski TP, Beutner EH, Sulej J, et al. IgA antiendomysium antibody. A new immunological marker of dermatitis herpetiformis and coeliac disease. Br J Dermatol. 1984;111(4):395-402. [ Links ]
2. McNeish AS, Harms HK, Rey J, et al. The diagnosis of coeliac disease. A commentary on the current practices of members of the European Society for Paediatric Gastroenterology and Nutrition (ESPGAN). Arch Dis Child. 1979;54(10):783-6. [ Links ]
3. Revised criteria for diagnosis of coeliac disease. Report of Working Group of European Society of Paediatric Gastroenterology and Nutrition. Arch Dis Child 1990;65(8):909-11. [ Links ]
4. Dieterich W, Ehnis T, Bauer M, et al. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nat Med. 1997;3(7):797-801. [ Links ]
5. Heiner DC, Sears JW, Kniker WT. Multiple precipitins to cow's milk in chronic respiratory disease. A syndrome including poor growth, gastrointestinal symptoms, evidence of allergy, iron deficiency anemia, and pulmonary hemosiderosis. Am J Dis Child. 1962;103:634-54. [ Links ]
6. Katz J, Kantor FS, Herskovic T. Intestinal antibodies to wheat fractions in celiac disease. Ann Intern Med. 1968;69(6):1149-53. [ Links ]
7. Skerritt JH, Johnson RB, Hetzel PA, et al. Variation of serum and intestinal gluten antibody specificities in coeliac disease. Clin Exp Immunol. 1987;68(1):189-99. [ Links ]
8. Vainio E. Immunoblotting analysis of antigliadin antibodies in patients with dermatitis herpetiformis and gluten-sensitive enteropathy. Int Arch Allergy Immunol. 1986;80(2):157-63. [ Links ]
9. Ferguson A, Carswell F. Precipitins to dietary proteins in serum and upper intestinal secretions of coeliac children. Br Med J. 1972;1(5792):75-7. [ Links ]
10. Seah PP, Fry L, Hoffbrand AV, Holborow EJ. Tissue antibodies in dermatitis herpetiformis and adult coeliac disease. Lancet. 1971;1(7704):834-6. [ Links ]
11. Amara W, Husebekk A. Improved method for serological testing in celiac disease-IgA anti-endomysium antibody test: a comparison between monkey oesophagus and human umbilical cord as substrate in indirect immunofluorescence test. Scand J Clin Lab Invest. 1998;58(7):547-54. [ Links ]
12. Akbari MR, Mohammadkhani A, Fakheri H, et al. Screening of the adult population in Iran for coeliac disease: comparison of the tissue-transglutaminase antibody and anti-endomysial antibody tests. Eur J Gastroenterol Hepatol. 2006;18(11):1181-6. [ Links ]
13. Rostom A, Dube C, Cranney A, et al. The diagnostic accuracy of serologic tests for celiac disease: a systematic review. Gastroenterology. 2005;128(4 Suppl 1):S38-46. [ Links ]
14. Volta U, Fabbri A, Parisi C, et al. Old and new serological tests for celiac disease screening. Expert Rev Gastroenterol Hepatol 2010;4(1):31-5. [ Links ]
15. Volta U, Granito A, Parisi C, et al. Deamidated gliadin peptide antibodies as a routine test for celiac disease: a prospective analysis. J Clin Gastroenterol. 2010;44(3):186-90. [ Links ]
16. Arranz E, Blanco A, Alonso M, et al. IgA1 antigliadin antibodies are the most specific in children with coeliac disease. J Clin Nutr Gastroenterol. 1986;1:291-5. [ Links ]
17. Unsworth DJ, Walker-Smith JA, Holborow EJ. Gliadin and reticulin antibodies in childhood coeliac disease. Lancet. 1983;1 (8329):874-5. [ Links ]
18. Savilahti E, Viander M, Perkkio M, et al. IgA antigliadin antibodies: a marker of mucosal damage in childhood coeliac disease. Lancet. 1983;1(8320):320-2. [ Links ]
19. Mearin ML, Koninckx CR, Biemond I, et al. Influence of genetic factors on the serum levels of antigliadin antibodies in celiac disease. J Pediatr Gastroenterol Nutr. 1984;3(3):373-7. [ Links ]
20. Green PH, Rostami K, Marsh MN. Diagnosis of coeliac disease. Best Pract Res Clin Gastroenterol. 2005;19(3):389-400. [ Links ]
21. Bazzigaluppi E, Roggero P, Parma B, et al. Antibodies to recombinant human tissue-transglutaminase in coeliac disease: diagnostic effectiveness and decline pattern after gluten-free diet. Dig Liver Dis. 2006;38(2):98-102. [ Links ]
22. Reeves GE, Squance ML, Duggan AE, et al. Diagnostic accuracy of coeliac serological tests: a prospective study. Eur J Gastroenterol Hepatol. 2006;18 (5):493-501. [ Links ]