Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Gen
versão On-line ISSN 2477-975X
Gen vol.70 no.2 Caracas jun. 2016
Influencia de la microbiota intestinal en la enfermedad hepática crónica. Su rol en el hepatocarcinoma
Gisela Romero1
1 Gastroenterólogo. Experiencia en Hepatología. Doctor en Ciencias Médicas. Profesor Titular de la Universidad del Zulia. Coordinadora del Programa de Educación Continua de la Facultad de Medicina-Luz. Adjunto del Hospital Universitario de Maracaibo. romerogisela01@gmail.com
Resumen
El incremento de la traslocación de bacterias intestinales es característico en pacientes con enfermedad hepática crónica y favorece la inflamación y la fibrosis del hígado.1-3 Se ha implicado a la microbiota intestinal en la patogénesis y progresión de enfermedades hepáticas como Enfermedad Grasa Hepática No alcohólica, Esteatohepatitis no alcohólica, Colangitis Esclerosante Primaria, Enfermedad hepática por Falla intestinal y el Hepatocarcinoma. Numerosas investigaciones al respecto, vienen señalando que la microbiota intestinal y los receptores tipo Toll (TLRs) promueven el Hepatocarcinoma (HCC).1,4 La Hepatocarcinogenesis involucra a los TLR4 y a la microbiota intestinal, pero estos, no son requeridos para la iniciación del HCC sino para su promoción, mediante el incremento de la proliferación, expresión de la epiregulina hepatomitogena y la prevención de la apoptosis.4,5 La esterilización del intestino en etapas tardías de la hepatocarcinogenesis , previenen el HCC , por lo que de allí se desprenden que tanto la microbiota como estos receptores tipo Toll, representan blancos terapéuticos para la prevención del HCC en pacientes con enfermedad hepática crónica avanzada.4-6
Palabras clave: hiperlipasemia, enfermedad celíaca, hipe-renzinemia benigna familiar.
MICROBIOTA INTESTINAL THEIR INFLUENCE ON CHRONIC LIVER DISEASE. ROLE IN HEPATOCELLULAR CARCINOMA
Summary
The increase of the translocation of intestinal bacteria is characteristic of patients with chronic liver disease and promotes inflammation and fibrosis of the liver.1-3 Has been involved in the intestinal microbiota in the pathogenesis and progression of liver diseases such as liver disease Fat Non-alcoholic, non-alcoholic steatohepatitis, Primary sclerosing cholangitis, liver disease by intestinal failure and hepatocellular carcinoma. Numerous investigations into the matter, come by noting that the intestinal microbiota and the toll-like receptors (TLRs) promote the Hepatocellular carcinoma (HCC).1-4 The Hepatocarcinogenesis involves TLR4 and the intestinal microbiota, but these, are not required for the initiation of the HCC but for their promotion, through the increase of the proliferation, expression of the epiregulina hepatomitogena and the prevention of apoptosis.4-6
Key words: liver cirrhosis, microbiota, hepatocellular carcinoma, Toll-like receptors.
Introducción
La microbiota es un término que se refiere a la población de microorganismos que habitan en un lugar específico, en este caso, nos referimos a la microbiota intestinal, la cual se ha adaptado a la superficie mucosa del intestino y a su luz. Involucra a bacterias, virus, protozoarios.1 En el estómago y el duodeno habitan pocos microorganismos, típicamente menos de 1000 por gramo de contenido, principalmente lactobacilos y estreptococos. El ácido clorhídrico, la bilis y la secreción pancreática, inhiben la proliferación bacteriana, además, la actividad motora en la fase de propulsión, evita una estable colonización de las bacterias sobre la mucosa. En yeyuno e Íleon existe un mayor número de bacterias. Unas 10 mil por gramo de contenido en yeyuno y 10 millones por gramo de contenido en íleo terminal. En el intestino delgado, si bien el transito es acelerado, existen numerosas estructuras linfoides con centros germinales para inducir la inmunidad adaptativa. En el colon existen billones de bacterias por gramo de contenido, allí el tránsito es más lento y las bacterias, principalmente anaerobias, tienen mayor oportunidad de proliferar.1-3
La microbiota intestinal posee funciones metabólicas, de defensa y tróficas. Metabólicas: Los carbohidratos son fermentados en el colon a ácidos grasos de cadena corta: acetato, propionato y butirato, también producen metabolitos como lactato, piruvato, etanol, succinato y se generan gases H2, CO2, CH4 y H2S. Los ácidos grasos de cadena corta acidifican el pH luminal, lo cual suprime el crecimiento de patógenos y favorece la absorción de calcio, hierro y magnesio en el ciego. Ellos también influencian la motilidad intestinal y aumentan los requerimientos de energía para el huésped.3,4 El acetato es metabolizado en el musculo, riñón, corazón y cerebro. El butirato es fundamentalmente metabolizado por el epitelio del colon donde sirve con sustrato energético y como un regulador del crecimiento y diferenciación celular. El colon proximal se caracteriza por las altas concentraciones de sustratos, por la reacción de Saccharolisis, por tener un pH acido5,6 y por una rápida proliferación bacteriana, mientras que el colon distal presenta bajas concentraciones de sustrato, allí se cumple una importante reacción de proteólisis, el pH es neutro y existe lenta proliferación bacteriana. Esto explica el por qué si se produce una excesiva fermentación de proteínas, el colon distal será blanco para el desarrollo de cáncer o de Colitis Ulcerosa. Así surgen los argumentos sobre la necesidad de ingerir carbohidratos no absorbibles para fomentar la actividad saccharolitica en el colon distal.1,6
Función de defensa o protectora de la microbiota
La microbiota intestinal ejerce un efecto de barrera que interfiere con la invasión de patógenos. Las bacterias residentes, se oponen a la colonización por microbios exógenos y por bacterias oportunistas. El equilibrio entre estas bacterias permite el buen funcionamiento, sin embargo este equilibrio se pierde con frecuencia por el uso de antibióticos, lo cual estimula el crecimiento del Clostridium Difficile toxígenico.1-2,6-7
Función Trófica
Las bacterias residentes son capaces de controlar la proliferación y diferenciación de las células epiteliales, mediado por genes.
Así mismo modulan respuestas neuro-endocrinas, al enviar información al cerebro. Los microbios pudieran intervenir en la actividad locomotora y favorecer el estado de excitación o ansiedad del individuo. Los estudios en ratones han demostrado que un intestino libre de gérmenes, genera una mayor actividad locomotora y disminuye la ansiedad. Por otra parte, la microbiota intestinal juega un papel esencial en el desarrollo del sistema inmune, vida estimulo de las células T, de lo cual resulta una adecuada densidad de células linfoides en la mucosa intestinal y buena secreción de inmunoglobulinas hacia el plasma.1-2,6-8
Microbiota y enfermedad hepatica crónica
La relación entre el microbioma intestinal y enfermedades del hígado, se reconoce desde hace unos 100 años, cuando se demostró que el coma hepático se debía en parte, a la absorción de productos nitrogenados en el intestino.3,9 Posteriormente se logró evidenciar numerosas bacterias coliformes en el intestino de pacientes cirróticos; más adelante, se introdujeron antibióticos al manejo de la encefalopatía hepática, con resultados muy favorables. Subsecuentemente, las bacterias del intestino fueron implicadas en otra complicación de la enfermedad hepática crónica e Hipertensión Portal: la Peritonitis Bacteriana Espontanea.
En el transcurso del tiempo, se ha demostrado que los Probióticos y Prebióticos tienen utilidad en la enfermedad hepática crónica ya que modulan la microbiota, reducen las endotoxinas, disminuyen la secreción de citoquinas proinflamatorias y mejoran la función de los neutrófilos.9-13 Todas estas evidencias han permitido establecer un estrecho vínculo entre microbiota intestinal y Enfermedades Hepáticas. La microbiota intestinal se relaciona con la patogénesis y progresión de enfermedades hepáticas como Enfermedad Hepática Alcohólica, Enfermedad Grasa Hepática No alcohólica, Esteatohepatitis no alcohólica, Colangitis Esclerosante Primaria, Enfermedad hepática por Falla intestinal y el Hepatocarcinoma.3,9,13
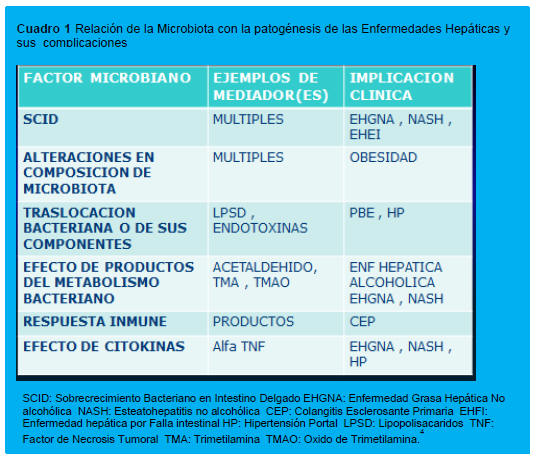
En el Cuadro 1 aparece la relación de la Microbiota con la patogénesis de las Enfermedades Hepáticas y sus complicaciones. Los pacientes con cirrosis hepática presenta sobrecrecimiento de bacterias intestinales y una función alterada de la barrera intestinal, debido a la hipoxia local y al edema de la mucosa por la Hipertensión Portal y por otros factores como el alcohol. El incremento de la permeabilidad intestinal, expone al hígado a la traslocacion de bacterias (TBI) desde el intestino hacia el sistema venoso entérico, vía vena porta y nódulos linfáticos mesentéricos.11,14-16
La enfermedad hepática por alcohol involucra la participación activa de la microbiota intestinal, ya que el alcohol aumenta la proliferación de bacterias gram negativas, quienes generan endotoxinas, a su vez, las bacterias gram negativas metabolizan el alcohol en acetaldehído, metabolito que incrementa la permeabilidad intestinal y por ello, favorecen la traslocacion de bacterias y sus productos (endotoxinas y patrones moleculares asociados al patógeno PAMPs). Entre las endotoxinas que se traslocan a la circulación sanguínea, se encuentran los LPSD, ácido lipoteicoico (LTA), DNA bacteriano, péptidoglicanos (PGN) y fragmentos como el muramildipéptido (MDP).10,14
Peritonitis Bacteriana Espontanea y el rol de la Microbiota Intestinal
El mecanismo patogénico clave que inicia la peritonitis bacteriana espontánea (PBE) es la translocación bacteriana (TBI), proceso por el cual las bacterias entéricas cruzan la barrera mucosa intestinal, alcanzan los ganglios linfáticos mesentéricos desde donde siguen la ruta sanguínea y, posteriormente, el líquido ascítico. En el paciente con cirrosis se ha demostrado la existencia de sobrecrecimiento bacteriano (SCB) atribuido en parte, a la disminución de la motilidad intestinal y a la reducción del tránsito, condiciones que favorecen la TBI.
La alta tasa de TBI en la cirrosis se debe al daño en los 3 pilares que constituyen la barrera mucosa del intestino: equilibrio de la flora bacteriana intraluminal, integridad de la barrera epitelial intestinal y sistema inmune.12,15,17 La diseminación sanguínea y el crecimiento de las bacterias en el líquido ascítico que se produce en la PBE es consecuencia del daño en el sistema inmune, característico en la cirrosis.
El déficit en la inmunidad innata y adaptativa incluye alteraciones en el TLR4 y en la expresión del HLA, disminución de la quimiotaxis, de la opsonizacion y de la función de fagocitosis, así como una función alterada del sistema reticuloendotelial. La hiperproducción en el líquido ascítico de citocinas proinflamatorias y otras sustancias con propiedades vasoactivas contribuye a la vasodilatación arterial y a la insuficiencia renal que, con frecuencia, complica el curso de la PBE. Aun en ausencia de PBE, la translocación de bacterias y productos bacterianos desde la luz intestinal contribuye a la activación sistémica de las células inmunitarias en la cirrosis.16,17,20
Las infecciones del líquido ascítico, son mayormente monomicrobianas, siendo los gérmenes más frecuentes Escherichia Coli y Klebsiella Pneumoniae en un 50-70%, mientras que el género Streptococcus oscila entre un 15-75% de los casos.17
Agentes terapeuticos que modulan la Microbiota en el paciente con cirrosis antibioticos
Básicamente dirigidos contra bacterias gram negativas. Indicaciones:17-18,21-33,41-42
* Peritonitis Bacteriana Espontanea (PBE): Cefalosporinas de 3era generación, Quinolonas.
* Profilaxis secundaria de PBE: Quinolonas tipo Norfloxacina. * Encefalopatía Hepática: Rifaximina.
* Descontaminación intestinal selectiva: Rifaximina, Neomicina, Paromomicina.
* Hemorragia Variceal Aguda: Quinolonas, B-Lactamicos.
* Prevención de la Endotoxemia en pacientes con cirrosis y circulación hiperdinamica.
Probioticos y Prebioticos
Beneficios: los Probióticos y Prebióticos tienen utilidad en la enfermedad hepática crónica ya que modulan la microbiota, reducen las endotoxinas , disminuyen la secreción de citoquinas proinflamatorias , mejoran la función de los neutrófilos , incrementan la síntesis de ácidos grasos, inhiben la adherencia bacteriana , incrementan las células Natural Killer y Linfocíticas y además, aumentan la secreción de IgA.36-37
Indicaciones:3,13-16,37-39
* Enfermedad Hepática Grasa No Alcohólica: B. longum, Lactobacilo Acidofilo y Bifidobacterium Breve (disminuyen la grasa hepática).
* Esteatohepatitis No Alcohólica: B. longum, Lactobacilo Acidofilo, Bifidobacterium Breve (propiedad de disminuir la esteatosis a través de la modulación de las Células T Killer).
* Enfermedad Hepática Alcohólica: Lactobacillus rhamnosus GG con la propiedad de disminuir la grasa hepática, la escala necroinflamatoria y la expresión de mieloperoxidasa. Disminuye la permeabilidad intestinal y probablemente la TBI. Otros: Bifidobacterium Bifidum y L. plantarum.
* Complicaciones de la Enfermedad Hepática: Lactobacillus plantarum.
* Encefalopatía Hepática: uso de prebióticos como disacáridos no absorbible (lactulosa, superior a probioticos y simbióticos).
Microbiota / Hepatocarcinoma (HCC)
En el hígado, las bacterias y sus productos inician procesos inflamatorios por mecanismos diversos, uno de ellos es mediante la activación de los receptores tipo Toll, quienes juegan un papel en la patogénesis de la fibrosis y cirrosis.
Antes, es importante identificar las características de los receptores tipo Toll (TLR) cuyo nombre deriva de la Drosofila por su semejanza. Estos receptores son proteínas transmembranas expresados por células del sistema inmune innato, cuya función es detectar los microrganismos invasores y activar señales, vía sistema inmune y la respuesta inflamatoria, para destruir los patógenos.
En los mamíferos se han demostrado unos 11 TLRs. Los TLR detectan productos moleculares de la bacteria mediante sus Receptores de Reconocimiento (PRRs) y activados, desencadenan dos señales muy importantes, la primera, es la vía del factor de transcripción NF-kB (Factor Nuclear kB) y la proteincinasa activada por mitógenos (MAPKs) p38. La segunda señal, es la activación de otros dos factores de transcripción, el NF-kB y el Factor 3 que Regula el Interferón (IRF3).45-47 Es así como el sistema inmune innato se inicia para la destrucción del microorganismo invasor.
En la Hepatocarcinogenesis la microbiota participa en forma muy específica. La inflamación crónica del hígado es un factor de riesgo bien conocido de carcinogénesis, el 80 % de los casos de Hepatocarcinoma se presentan en pacientes con cirrosis o fibrosis, enfermedades caracterizadas por ciclos persistentes de injuria, inflamación y proliferación compensatoria de hepatocitos.
La evidencia científica apoya la idea de que la inflamación persistente del hígado conduce a HCC, por lo que los investigadores centran hoy día sus estudios en las señales intra y extracelulares que inducen el HCC.4,45-47
Los resultados de las investigaciones demuestran que los lipopolisacaridos (LPSD) y patrones moleculares asociados al patógeno (PAMPs), producidos por las bacterias intestinales, activan los TLR4, desencadenando señales que estimulan la cascada del Factor Nuclear KB, de lo cual resulta una mayor secreción de epiregulina (miembro de la familia del factor de crecimiento epidérmico), aumento de las citoquinas proinflamatorias (Interleucina-1) y aumento de moléculas inflamatorias (Factor de Necrosis Tumoral alfa, TNF),que inician la promoción del desarrollo de HCC, a través de múltiples reacciones sobre los hepatocitos, células de Kupffer y células estelares.2-5,45-46
Otros estudios evidencian que la enfermedad hepática aguda y crónica, impactan negativamente sobre la homeostasis intestinal, favoreciendo la disbiosis y alterando la permeabilidad de la barrera intestinal , lo cual conduce a la TBI e induce a una mayor incidencia del HCC, vía NF-kB.
Es por esta razón que varios autores han sugerido que la esterilización intestinal mediante el uso de antibióticos, pudiera prevenir el HCC en pacientes con enfermedad hepática crónica. Igualmente se ha planteado el uso de probióticos para disminuir el SCG y la TBG.2-4,46
Antibioticos y otros compuestos para la prevencion del HCC
RIFAXIMINA: antibiótico no absorbible utilizado en Encefalopatía hepática, pudiera ser útil en la prevención del HCC.24-30 NORFLOXACINA: antibiótico del grupo de las quinolonas utilizado para el manejo de la PBE, se investiga otros usos en cirrosis y HCC.41-43
Los antibióticos ofrecen la desventaja de la aparición de infecciones por bacterias resistentes a antibióticos, malabsorción y diarreas. PROBIOTICOS y PREBIOTICOS: beneficios ya descritos en párrafos anteriores. ERITORAN TETRASODIO (E5564): es un análogo de lípidos A que se liga a un correceptor de los TLR4 evitando su activación. En fase experimental Fase III.44 TAK-242 o resatorvid: es una pequeña molécula inhibidora del dominio intracelular de los TLR4.45 CRX-526: es un ligando antagonista de los TLR4 e inhibe la secreción del alfa TNF.46 BORTEZOMIB: bloquea la vía NF-kB. Estudios clínicos en Fase II muestran resultados poco relevantes y presencia de eventos adversos.47 GEN 182: se obtuvo de tejido no tumoral adyacente al HCC, incluye genes implicados en la inflamación (Il-6 y genes relacionados con el NF-Kb) y proliferación celular.48 Los inhibidores de los TLR4 pueden producen importante inmunosupresión por lo que su uso se limita solo a pacientes con alto riesgo de HCC.
Clasificación
ÁREA: hepatología.
TIPO: artículo de revisión.
TEMA: hepatocarcinoma.
PATROCINIO: este trabajo no ha sido patrocinado por ningún ente gubernamental ni comercial.
Referencias Bibliográficas
1. WGO Handbook on Gut Microbes. May 2014. [ Links ]
2. Marrion Damaud Jamila Faivre, Nicolas Moniaux. Targeting gut flora to hepatocellular carcinoma. J of Hepatol 2013;58:385-387. [ Links ]
3. Nolan JP. The role of intestinal endotoxin in liver injury: a long and evolving history. Hepatology 2010;52: 1829-1835.
4. Eamonn M.M. Quigley, Catherine Stanton , Eileen F. Murphy. The gut microbiota and the liver. Pathophysiological and clinical implications. J. of Hepatol 2013; 58: 1020-1027.
5. Dapito DH et al. Promotion of hepatocellular carcinoma by intestinal microbiota and TLR4.Cancer cell 2012; 31; 504-516 .
6. Guarner C, Soriano G. Bacterial traslocation and its consequences in patients with cirrhosis. Eur j Gastroenterol and Hepatol.2005;17 : 27-31.
7. Villanueva A, Savic R, Llovet JM. Linphotoxins: New targets for hepatocellular carcinoma. Cancer Cell 2009; 16: 272- 273.
8. Clemente JC et al. The Impact of the gut microbiota in human health: an integrative view. Cell 2012; 148: 1248-1270.
9. Gupta A et al. Role of the small intestinal bacterial overgrowth and delayed gastrointestinal transit time in cirrhosis patients with minimal hepatic encephalopathy. J of Hepatol.2010; 53 ;849-855.
10. Purohit V et al. Alcohol, intestinal bacterial growth, intestinal permeability to endotoxin and medical consequences: summary of a symposium. Alcohol 2008; 42: 349-361.
11. Almeida J et al. Gut flora and bacterial translocation in chronic liver disease. World J Gastroenterol. 2006; 12: 1493-1502.
12. Cohen MJ et al. Antibiotic prophylaxis for spontaneous bacterial peritonitis in cirrhotic patients with ascites, without gastro-intestinal bleeding. Cochrane Database Syst Rev 2009:2: CD004791.
13. Lata J, Jurankova J, Kopacova M, Vitev P. Probiotics in Hepatology. World J Gastroenterol 2011;17; 2890-2896.
14. Frazier TH, DiBaise JK, McClaine CJ. Gut microbiota, intestinal permeability obesity-induced inflammation and liver injury. J. Parenter Enteral Nutr 2011; 35: 14S-20S.
15. Ying Ying Yang and Han Chieh Lin. Bacterial infections in patients with Cirrhosis .Chin Med Assoc. October 2005; 68:447-451.
16. Stephen Riordan and Roger Williams. The intestinal flora and bacterial infections in cirrhosis. Journal of Hepatology 2006; 45.
17. García Tsao Guadalupe. Bactertial Infectios in Cirrhosis: treatment and prophylaxis. Journal of Hepatology 2005;42 .
18. Vlachogiannakos Jiannis et al. Long-term administration of rifaximin improves the prognosis of patients with descompesated alcoholic cirrhosis .J. of Gastroenterol and Hepatol 2013;28: 450-455.
19. Gomez F. et al. Impaired function of macrophage Fc gamma receptors and bacterial infection in alcoholic cirrhosis. The New Eng J of Med. 1994;331:1122-1128.
20. Bajaj Jasmohan et al. Bacterial infections in end-stage liver disease: current challenges and future directions.Gut 2012;61: 1219-1225.
21. Rimola A. et al. Oral, nonabsorbable antibiotics prevent infections in cirrhotics with gastrointestinal hemorrhage. Hepatology 1985;5: 463-467.
22. Soriano G. et al. Norfloxacin prevents bacterial infections in cirrhotics with gastrointestinal hemorrhage. Gastroenterology 1992;103: 1267-1272.
23. Gines P. et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis :results of a double blind placebo controlled trial. Hepatology 1990;12: 716-724.
24. Bass N, Mullen K, Sigal S, et al. Rifaximin is effective in maintaining remission in hepatic encephalopathy: results of a large, randomized, placebo-controlled trial. Program and abstracts of the 44th Annual Meeting of the European Association for the Study of the Liver; April 22-26, 2009; Copenhagen, Denmark. Abstract 93.
25. Maclayton DO, Eaton-Maxwell A. Rifaximin for treatment of hepatic encephalopathy. Ann Pharmacother. 2008;Dec 17[Epub ahead of print].
26. Sanyal A, Bass N, Teperman L, et al. Chronic administration of rifaximin for the maintenance of remission of hepatic encephalopathy: a subgroup analysis of a phase 3 trial. Program and abstracts of the 44th Annual Meeting of the European Association for the Study of the Liver; April 22-26, 2009; Copenhagen, Denmark. Abstract 222.
27. Mullen K, Sigal S, Sheikh M, et al. Safety of rifaximin in patients with hepatic encephalopathy: results of a randomized, phase 3, placebo-controlled clinical trial. Program and abstracts of the 44th Annual Meeting of the European Association for the Study of the Liver; April 22-26, 2009; Copenhagen, Denmark. Abstract 207.
28. Bucci L, Palmieri GC. Double-blind, double-dummy comparison between treatment with rifaximin and lactulose in patients with medium to severe degree hepatic encephalopathy. Curr Med Res Opin. 1993;13:109-118.
29. Festi D, Mazzella G, Orsini M, et al. Rifaximin in the treatment of chronic hepatic encephalopathy: results of a multicenter study of efficacy and safety. Curr Ther Res. 1993;54:598-609.
30. Puxeddu A, Quartini M, Massimetti A, Ferrieri A. Rifaximin in the treatment of chronic hepatic encephalopathy. Curr Med Res Opin. 1995;13:274-281.
31. Paik YH, Lee KS, Han KH, et al. Comparison of rifaximin and lactulose for the treatment of hepatic encephalopathy: a prospective randomized study. Yonsei Med J. 2005;46:399-407.
32. Mas A, Rodes J, Sunyer L, et al. Comparison of rifaximin and lactitol in the treatment of acute hepatic encephalopathy: results of a randomized, double-blind, double-dummy, controlled clinical trial. J Hepatol. 2003;38:51-58.
33. Loguercio C, Federico A, De Girolamo V, Ferrieri A, Del Vecchio Blanco C. Cyclic treatment of chronic hepatic encephalopathy with rifaximin: results of a double-blind clinical study. Minerva Gastroenterol Dietol. 2003;49:53-62.
34. Pedretti G, Calzetti C, Missale G, Fiaccadori F. Rifaximin versus neomycin on hyperammoniemia in chronic portal systemic encephalopathy of cirrhotics: a double-blind, randomized trial. Ital J Gastroenterol. 1991;23:175-178.
35. Di Piazza S, Filippazzo MG, Valenza LM, et al. Rifaximin versus neomycin in the treatment of portosystemic encephalopathy. Ital J Gastroenterol. 1991;23:403-407.
36. Prasad S, Dhiman RK, Duseja A, Chawla YK, Sharma A, Agarwal R. Lactulose improves cognitive functions and health-related quality of life in patients with cirrhosis who have minimal hepatic encephalopathy. Hepatology. 2007;45:549-559.
37. Bajaj JS, Saeian K, Christensen KM, et al. Probiotic yogurt for the treatment of minimal hepatic encephalopathy. Am J Gastroenterol. 2008;103:1707-1715.
38. Garcia-Tsao G, Sanyal AJ, Grace ND, Carey WD. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology. 2007;46:922-938.
39. Ghassemi S, Garcia-Tsao G. Prevention and treatment of infections in patients with cirrhosis. Best Pract Res Clin Gastroenterol. 2007;21:77-93.
40. Fernández J, Navasa M, Planas R, et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Gastroenterology. 2007;133:818-824.
41. Terg R, Fassio E, Guevara M, et al. Ciprofloxacin in primary prophylaxis of spontaneous bacterial peritonitis: a randomized, placebo-controlled study. J Hepatol. 2008;48:774-779.
42. Saab S, Hernandez JC, Chi AC, Tong MJ. Oral antibiotic prophylaxis reduces spontaneous bacterial peritonitis occurrence and improves short-term survival in cirrhosis: a meta-analysis. Am J Gastroenterol. 2009;104:993-1001.
43. Loomba R, Wesley R, Bain A, Csako G, Pucino F. Role of fluoroquinolones in the primary prophylaxis of spontaneous bacterial peritonitis: meta-analysis. Clin Gastroenterol Hepatol. 2009;7:487-493.
44. Barochia A et al. Eritoram tetrasidium (E5564) treatment for sepsis: review preclinical and clinical studies. Expert Opin Drugs Metab Toxicol 7: 479-494.
45. Sha T et al. Therapeutics effects of TAK 242, a novel selective Toll-like receptor 4 signal transduction inhibitor, in mouse endotoxin shock model. Eur J Pharmacol 2007; 571: 231-239.
46. Luedde T, Schwabe RF. NF-Kappa B in the liver-linking injury, fibrosis and hepatocellular cancer. Nat Rev Gastroenterol Hepatol 2011;8: 108-118.
47. Kim GP et al. An international, multicenter Phase II trial of Bortezomib in patients with hepatocellular cancer. Invest New Drugs 2012; 30: 387-394.
48. Hoshida Y. et al. Gene expression signature predicts outcome of liver cirrosis. Hepatology 2009; 50 (supplement 4): 312A.













