Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.70 n.1 Caracas mar. 2010
Alteraciones clínico-metabólicas en mujeres con diabetes gestacional previa
Drs. Aleida M Rivas*, Julio C González*, Mary C Guevara*, Solange G Dávila*
*Unidad de Diabetes y Embarazo. Universidad de Carabobo-Ciudad Hospitalaria "Dr. Enrique Tejera". Valencia, Venezuela
RESUMEN
Objetivo: Conocer la frecuencia de diabetes y otros factores de riesgo cardiovascular en mujeres con diabetes mellitus gestacional (DMG) previa.
Métodos: Se evaluaron 92 mujeres con DMG previa, a quienes no se les había diagnosticado diabetes, que asistieron a la pesquisa posparto inicial o anual durante 2008. Se determinó presión arterial, circunferencia abdominal (CA) e índice de masa corporal (IMC). Se practicó prueba de tolerancia oral a la glucosa, medición de niveles de insulina y lípidos séricos. Se estableció la presencia de síndrome metabólico (SM), aplicando los criterios ATP III e índice de resistencia a la insulina mediante el modelo Homa-R. Se usó t Student para la asociación de variables.
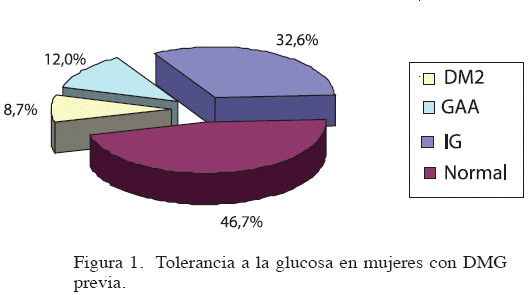
Resultados: La media de edad fue 34,7 ± 6,6 años y del período posparto, 3,5 ± 2,6 años. En 8,7 % se hizo el diagnóstico de diabetes, 32,6 % intolerancia a la glucosa y 12,0 %, glucemia alterada en ayunas. 62,1 % presentaba obesidad abdominal, 62,5 %, algún tipo de dislipidemia y 23,80 %, elevación de la presión arterial. 46,4 % reunía los criterios de SM y 29,6 % mostró un índice HOMA-R > 2,5. Las cifras de CA, IMC, triglicéridos, glucemia basal, glucemia 2 horas post-carga, e insulina 2 horas poscarga fueron más altas (P< 0,05) en mujeres con anormalidades de la tolerancia a la glucosa que en aquellas con tolerancia normal.
Conclusiones: Las mujeres con DMG previa muestran una elevada frecuencia de alteraciones clínicas y metabólicas que representan un potencial incremento del riesgo cardiovascular en un grupo poblacional relativamente joven
Palabras clave: Diabetes gestacional previa. Síndrome metabólico. Pesquisa posparto de diabetes
SUMMARY
Objective: To know the frequency of diabetes and other cardiovascular risk factors in women with previous gestational diabetes mellitus (GDM).
Methods: 92 women with previous GDM, without diagnosis of diabetes, who underwent initial or annual postpartum diabetes screening during 2008, were assessed. Blood pressure, abdominal circumference and body mass index were measured. They were tested for an oral glucose tolerance test (OGTT) and determination of plasma insulin and lipid levels. Metabolic syndrome (MS) was diagnosed according ATP III criteria and the HOMA-R model was used for the insulin resistance index calculation. Students t test was used for variables association.
Results: The average age was 34.7 ± 6.6 years and postpartum period, 3.5 ± 2.6 years. 8.7% was diagnosed with diabetes, 32.6 % with impaired glucose tolerance and 12.0 % with impaired fasting glucose. 62.1 % showed abdominal obesity, 62.5 % presented some type of dyslipidemia and 23.8 %, high blood pressure. 46.4 % met the criteria for MS, and 29.6 % showed a HOMA-R Index > 2.5. Abdominal circumference, body mass index, blood pressure, triglycerides, basal glucose, 2-h post-load glucose and 2-h post-load insulin values were higher (P< 0.05) in women with abnormal glucose tolerance than those with normal glucose tolerance.
Conclusions: Women with previous GDM show a high frequency of clinical and metabolic abnormalities that point towards a potential increase of cardiovascular risk in a relatively young population.
Key words: Previous gestational diabetes. Metabolic syndrome. Postpartum diabetes screening.
Un resumen de este trabajo fue presentado en el XVII Congreso Panamericano de Endocrinología-XI Congreso Venezolano de Endocrinología y Metabolismo efectuados en la Isla de Margarita, Venezuela del 22-25 de abril de 2009, donde obtuvo el Primer Premio Congreso Panamericano de Endocrinología (COPAEN).
La investigación fue realizada con financiamiento (Código 98-031) del Consejo de Desarrollo Científico y Humanístico (CDCH) de
la Universidad de Carabobo, Valencia, Venezuela.INTRODUCCIÓN
El embarazo se ha considerado desde hace largo tiempo como un estado diabetogénico, donde se destaca la presencia de resistencia a la insulina y de hiperinsulinemia compensadora (1). Cuando falla este último mecanismo propio de las células beta del páncreas, se presenta la diabetes mellitus gestacional (DMG), cuya prevalencia ha venido aumentando en las últimas décadas a nivel mundial, variando ampliamente su distribución dependiendo de factores étnicos y geográficos, siendo más frecuente en mujeres asiáticas, latinas y afro-americanas (2,3).
La DMG acarrea no solo consecuencias durante la gestación y el parto, sino que dicha entidad representa un inequívoco factor de riesgo para desarrollar diabetes, especialmente tipo 2, a lo largo de la vida (4,5). La más rápida conversión a diabetes se observa en los primeros cinco años después del parto, seguida de una progresión más lenta (6). De hecho, 10 % ocurre cada año hasta alcanzar 50 % en cinco años (7). Se ha estimado que en mujeres con DMG, el riesgo de desarrollar diabetes tipo 2 es seis veces mayor que en aquellas que no la han presentado y en Australia, se ha encontrado que 20 %-30 % de las mujeres con diabetes tipo 2 refieren DMG previa (8). En el conocido estudio Diabetes Prevention Program (DPP), las mujeres con historia de DMG tuvieron una tasa de incidencia cruda de diabetes 71 % más alta que la de las mujeres sin este antecedente (17,1 %/año comparado con 9,8 %/año, respectivamente) (9).
Los componentes del síndrome metabólico, tales como intolerancia a la glucosa, obesidad central, resistencia a la insulina, altos niveles de triglicéridos y bajos de HDL-colesterol están presentes en una elevada proporción de mujeres con DMG previa (10-12). Por tanto, actualmente se reconoce al embarazo como una ventana que revela los futuros riesgos metabólicos y cardiovasculares de la madre (13).
Considerando las implicaciones para la salud pública, de estos potenciales factores de riesgo cardiovascular en un grupo de mujeres relativamente jóvenes, se considera importante, aplicar estrategias de prevención y de detección precoz de los mismos. En tal sentido, actualmente, la American Diabetes Association (ADA) recomienda que a las mujeres con DMG se les realice una pesquisa para diabetes y prediabetes, entre las seis y doce semanas posparto, repetirla al año y luego, como mínimo trianualmente, seguida de pesquisa de otros factores de riesgo cardiovascular (14). Por su parte, la Asociación Latinoamericana de Diabetes (ALAD) plantea, reclasificar a las mujeres con DMG a partir de la sexta semana posparto, practicando a quienes tienen glucemias normales en ayunas, una prueba de tolerancia oral a la glucosa, de acuerdo con los criterios de la Organización Mundial de la Salud (OMS), y todas aquellas que no resulten diabéticas, deben ser reevaluadas anualmente debido a la frecuente progresión a diferentes grados de alteraciones del metabolismo hidrocarbonado (15).
Cumpliendo con estas indicaciones, en nuestro medio se practica a las mujeres con DMG previa, una pesquisa inicial y luego anual, habiendo encontrado a los 2-4 meses posparto, una tasa de progresión a diabetes de 18,08 % y de prediabetes de 28,07 % (16). No se dispone de muchos datos locales que expresen resultados con períodos de seguimiento posparto más prolongados. Con el fin de conocer, el perfil clínico-metabólico de las mujeres con DMG que asistieron a la pesquisa durante el año 2008, se realizó el presente estudio.
MÉTODOS
La investigación es descriptiva-correlacional de corte transversal.
Se evaluaron las 92 mujeres con antecedente confirmado de DMG, a quienes no se les había hecho el diagnóstico de diabetes en evaluaciones previas, que asistieron durante el año 2008 a la Unidad de Diabetes y Embarazo de la Universidad de Carabobo - Ciudad Hospitalaria "Dr. Enrique Tejera" en Valencia, Venezuela, a la pesquisa posparto inicial o anual, según le correspondiese.
Se midió peso, talla, circunferencia abdominal, presión arterial y niveles de lípidos séricos en ayunas. Se les practicó PTOG con carga de 75 gramos de glucosa y se determinaron los niveles de insulina basal, a la primera y segunda hora pos-carga. Los valores de la PTOG fueron evaluados de acuerdo a los criterios de la ADA (17). Se consideró hiperinsulinemia en ayunas niveles >12 mU/l (18,19). Se determinó el índice de resistencia insulínica mediante el modelo de evaluación de la homeostasis (HOMA-R) (20), considerándose el punto de corte cuando el resultado fuese > 2,5 (21). Se calculó el índice de masa corporal (IMC) dividiendo peso en kg/talla en m
2. Se definió sobrepeso como IMC entre 25 y 29,99, y obesidad ≥ 30. Se determinó la presencia de obesidad abdominal y de síndrome metabólico aplicando los criterios del National Cholesterol Education Programs Adult Treatment Panel III (ATP III) (22). Se definió hipertensión arterial de acuerdo a los criterios del Seven Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure (23) y dislipidemias, según el II Consenso Nacional para el Manejo del paciente con dislipidemias (24).La glucemia plasmática fue medida mediante el método enzimático usando un analizador automatizado (Kit Cienvar). Los triglicéridos y colesterol se midieron mediante el método enzimático (Kit GPO/PAP Wiener) (Kit CHOL-PAP Wiener). El HDL-c se determinó mediante el método enzimático, después de lograr la precipitación de las LDL-c, VLDL-c y quilomicrones con ácido fosfotúngstico e iones de magnesio (Kit CHOL-HDL Wiener). Las concentraciones de LDL-colesterol se determinaron por diferencia con colesterol total y el sobrenadante (HDL y VLDL), después de utilizar sulfato de polivinilo/polietilenglicol como precipitante. La insulina sérica se determinó mediante el ensayo inmunoenzimo métrico in vitro (ELISA) con anticuerpos monoclonales (Kit DRG Diagnostics).
Para el análisis estadístico se utilizó el programa estadístico Spss. Los resultados obtenidos se expresaron como promedios ± desviación estandar. Se utilizó t de Student para la asociación de variables. Se considero significativo el valor de P < 0,05.
RESULTADOS
El promedio de edad fue 34,7 ± 6,6 años y del período posparto, 3,5 ± 2,6 años. A 8 mujeres (8,7
.%) se les hizo el diagnóstico de diabetes y a 41 (44,6 %) de pre-diabetes, de las cuales 30 (32,60 %) corresponden a intolerancia a la glucosa (IG) y 11 (12,0 %), a glucemia alterada en ayunas (GAA).Los casos con ambas anormalidades fueron incluidos como IG (Figura 1).
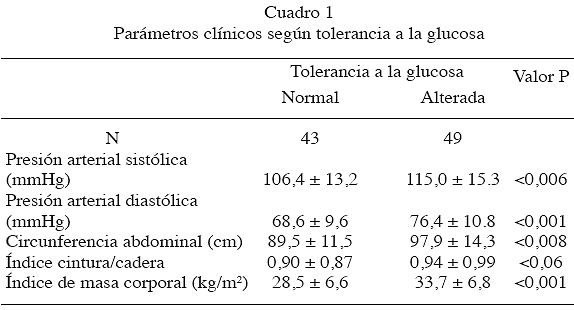
Las características clínicas y metabólicas de las mujeres con DMG previa, distribuidas en dos grupos de acuerdo a la actual tolerancia a la glucosa: normal y alterada (diabetes tipo 2 + intolerancia a la glucosa + glucemia alterada en ayunas), se expresan en los Cuadros 1 y 2, evidenciándose que este último grupo presenta niveles significativamente más altos de presión arterial sistólica (P < 0,006), presión arterial diastólica (P < 0,001), circunferencia abdominal (P = 0,008), IMC (P = 0,001), triglicéridos (P< 0,002), glucemia basal (P< 0,0001), glucemia 1 hora pos-carga (P< 0,0001), glucemia 2 horas pos-carga (P < 0,0001) e insulina 2 horas pos-carga (P< 0,02).
En el Cuadro 3 aparecen los principales factores de riesgo para desarrollar diabetes tipo 2 en las mujeres con actual tolerancia normal a la glucosa o prediabetes.
DISCUSIÓN
La DMG es un marcador para el desarrollo de diabetes tipo 2 y SM en la madre en un futuro cercano, resultando de gran importancia realizar diagnóstico oportuno de dichas entidades mediante periódicas pesquisas posparto, con medición de parámetros clínicos y de laboratorio, de acuerdo
a pautas internacionales que lamentablemente no se cumplen de manera satisfactoria, aun en países desarrollados (25).En este estudio se recogen los resultados de la pesquisa realizada durante un año en mujeres con historia de DMG de 3,5 ± 2,6 años de duración, utilizando la prueba de tolerancia oral a la glucosa,
recomendada por su mayor sensibilidad, especificidad y costo-efectividad que la determinación de glucemia en ayunas (26). La incidencia obtenida de diabetes de 8,7 % se corresponde con la de 7,8 % de un estudio similar con un período posparto de 6 ± 2,7 años (10), ambas cifras dentro de la progresión anual estimada de 5 %-10 %. La elevada frecuencia encontrada de prediabetes lleva a que más de la mitad de las mujeres estudiadas presenten algún grado de anormalidad de la tolerancia a la glucosa, lo cual es sin embargo, inferior a la cifra reportada en la India, de más de los dos tercios de las mujeres evaluadas cuatro años posparto, considerada una de las más altas tasas del mundo (27). Los valores significativamente más altos de PA, CA, IMC, triglicéridos, glucemia basal y pos-carga en el amplio grupo de mujeres con anormalidades de la tolerancia a la glucosa pudiera ser expresión de un incremento del riesgo cardiovascular comparado con quienes aún presentan una tolerancia normal a la glucosa, a sabiendas de que estas últimas ya tienen también un potencial aumento del mismo, por el solo antecedente de DMG.Los resultados obtenidos al excluir a las mujeres a quienes ya se les realizó el diagnóstico de diabetes indican que los factores de riesgo cardiovascular están presentes en una gran magnitud en aquellas que aún no la han desarrollado. La obesidad general y en mayor proporción, la abdominal fue comprobada en más de la mitad de las mujeres, lo cual debe ser motivo de alarma, pues se conoce que el desarrollo de obesidad durante las edades medias de la vida es un fuerte predictor independiente de enfermedad cardiovascular particularmente en las mujeres, así como de SM, diabetes tipo 2 y mortalidad temprana (28). La presencia de IG o GAA de manera aislada predice riesgos posteriores de diabetes tipo 2 y enfermedad cardiovascular en grados diferentes, siendo mucho mayor cuando coexisten ambas anormalidades (29). Las dislipidemias, elevadas en nuestra serie, constituyen un conocido factor de riesgo presente en mujeres con DMG previa, habiéndose
demostrado niveles significativamente más altos de colesterol, LDL-c, triglicéridos y más bajos de HDL-c que en grupos control de mujeres sin este antecedente (12,30). Aun cuando la frecuencia de hipertensión arterial en el grupo de mujeres estudiadas fue menor que la reportada en otras investigaciones (10,30), cerca de una cuarta parte, presentaba valores anormales de PA. También se encontró en una frecuencia no desestimable, ascenso de los niveles de insulina basal, así como del índice HOMA-IR, demostrando que existen cambios en la secreción y resistencia a la insulina, los cuales probablemente variarán dependiendo de la historia natural de las alteraciones posparto (12,30,31), conociéndose que el incremento de los valores de glucemia en ayunas, insulina en ayunas y HOMA-IR se ha encontrado también asociado al riesgo de diabetes en mujeres ya posmenopáusicas (32).Cerca de la mitad de las mujeres estudiadas reunían los criterios ATP III para SM, constelación o agrupación de muchas de las alteraciones ya mencionadas, cuya presencia implica aumento del riesgo para la morbi-mortalidad de origen cardiovascular. Esta proporción se encuentra dentro del rango reportado en otras publicaciones, algo menor que en algunas (11) y mayor que en otras (10,12), siendo bien conocido que la prevalencia de SM es más alta en las mujeres con DMG previa, independientemente de los criterios usados y constituyendo la obesidad, el mejor predictor del mismo (31,33,34).
En conclusión, las mujeres con DMG previa presentaron alteraciones clínicas y metabólicas: diabetes, prediabetes, obesidad, dislipidemias, hipertensión arterial, hiperinsulinemia, resistencia a la insulina y síndrome metabólico, las cuales contribuyen a aumentar el riesgo de enfermedad cardiovascular a edades tempranas. Por tanto, en las mujeres con antecedente de DMG, resulta necesario realizar la detección precoz de dichas complicaciones y en todas las mujeres en edad reproductiva, la aplicación de medidas preventivas que fundamentalmente estén
dirigidas a abordar un factor de riesgo modificable como es el aumento de peso, durante las etapas preconcepcional, prenatal y posparto.Agradecimiento
Al Consejo de Desarrollo Científico y Humanístico (CDCH) de la Universidad de Carabobo por el financiamiento aportado (Código 98031).
Al personal de la Unidad de Diabetes y Embarazo. UC-CHET, en especial a la Coordinadora General Dra. Nancy Oñate de Gómez, por el gran apoyo prestado.
REFERENCIAS
1. Ryan EA, O Sullivan MJ, Skyler JS. Insulin action during pregnancy: Studies with the euglycemic clamp technique. Diabetes. 1985;34:380-389. [ Links ]
2. Thorpe LE, Berger D, Ellis JA, Bettegowda VR, Brown G, Matte T, et al. Racial and ethnics disparities in gestational diabetes among pregnant women in
New York City, 1990-2001. Am J Public Health. 2005;95:1536-1539. [ Links ]3. Dabelea D, Snell-Bergeon J, Hartsfield C, Bischoff K, Hamman R, McDuffie R. Increasing Prevalence
of Gestational Diabetes Mellitus (GDM) over time and by birth cohort. Diab Care 2005;28:579-584. [ Links ]4. Lindsay R. Gestational diabetes: Causes and consequences. Br J Diabetes Vasc Dis. 2009;9:27-31. [ Links ]
5. Yogev Y, Visser G. Obesity, gestational diabetes and pregnancy outcome. Semin Fetal Neonatal Med. 2009;14:77-84. [ Links ]
6. Kim C, Newton K, Knoop R. Gestational diabetes and the incidence of Type 2 Diabetes. A systematic review. Diab Care. 2002;25:1862-1868. [ Links ]
7. Wollitzer A, Jovanovic L. 10 years later......Diabetes Mellitus and Pregnancy. The Endocrinologist. 2007;17:30-34. [ Links ]
8. Cheung NW, Byth K. Population health significance
of gestational diabetes. Diab Care. 2003;26:2005-2009. [ Links ]9. Ratner RE, Christophi CA, Metzger BE, Dabelea D, Bennett P, Pi-Sunyer X, et al. The Diabetes Prevention Program Research Group. Prevention of diabetes in women with a history of gestational diabetes: Effects of metformin and lifestyle interventions. J Clin Endoc Metab. 2008;93:4774-4779. [ Links ]
10. Wender E, Sporna M, Zawiejska A, Sporna A, Brazert J. Components of metabolic syndrome in women after Gestational Diabetes. Pol Arch Med Wewnetrznej. 2007;117:457-461. [ Links ]
11. Ferrada C, Molina M, Cid L, Riedel G, Ferrada C, Arévalo R. Relación entre diabetes gestacional y síndrome metabólico. Rev Med Chile. 2007;135:1539-1545. [ Links ]
12. Akinci B, Celtik A, Yenez S, Yesil S. Prediction of developing metabolic syndrome after gestational diabetes mellitus. Fertil Steril. 2009. In Press [ Links ]
13. Sattar V, Greer IA. Pregnancy complications and maternal cardiovascular risk: Opportunities for intervention and screening? BMJ. 2002;325:157-160. [ Links ]
14. Metzger B, Buchanan T, Coustan D, De Leiva
A, Dunger D, Hudden D, et al. Summary and Recommendations of the Fifth International Workshop-Conference on Gestational Diabetes Mellitus. Diab Care. 2007;30(Suppl 2):251-260. [ Links ]15. ALAD. Consenso Latinoamericano de Diabetes
y Embarazo. La Habana, Cuba 2007. Rev Asoc Latinoam Diabetes. 2008;XVI:55-69. [ Links ]16. Rivas AM, González N, González J. High frequency of diabetes in early post-partum assessment of women with gestational diabetes mellitus. Diabetes & Metabolic Syndrome: Clin Research Reviews. 2007;1:159-165. [ Links ]
17. Expert Committee on the Diagnosis and Classification of Diabetes Mellitus: Report of the Expert Committee on the Diagnosis and Classification of Diabetes
Mellitus. Diab Care. 1997;20:1183-1197. [ Links ]18. Ascaso JF, Pard S, Real JT, Lorente R, Priego A, Carmenia R. Diagnosing insulin resistance by simple quantitative methods in subjects with normal glucose metabolism. Diab Care. 2003;26:3320-3325. [ Links ]
19. Mc Auley KA, Williams SM, Mann JL, Welker RJ, Ledwis-Barned NJ, Temple LA, et al. Diagnosing insulin resistance in the general population. Diab Care. 2001;24:460-464. [ Links ]
20. Mattheuws DR, Hosker JP, Rudenski AS, Naylor BA, Teacher DF, Turner RC. Homeostasis Model
Assessment: Insulin resistance and beta cell function from fasting plasma glucose and insulin concentration in man. Diabetologia. 1985;28:412-419. [ Links ]21. Bonora E, Targher G, Alberiche M, Bonadonna RC, Saggiani F, Zenere NA, et al.
Homeostasis Model Assessment Closely Mirrors the Glucosa Clamp Technique in the Assessment of Insulin Sensitivity. Diab Care. 2000;23:57-63. [ Links ]22. Grundy S, Brewer B, Cleeman J, Smith S, Lenfant
C. Definition of Metabolic Syndrome. Report of the National Heart, Lung, and Blood Institute/ American Heart Association Conference on Scientific Issues Related to Definition. Circulation. 2004 ;109:433-438. [ Links ]23. The Seven Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment
of High Blood Pressure. The JNC 7 Report. JAMA. 2003;289:2560-2572. [ Links ]24. International Lipid Information Bureau. II Consenso Nacional para el Manejo del Paciente con Dislipidemias. Venezuela 2005. [ Links ]
25. Dietz PM, Vesko KK, Callaghan WM, Bachman DJ, Bruce FC, Berg FC, et al. Postpartum screening for diabetes after a gestational diabetes mellitus affected pregnancy. Obstet Gynecol. 2008;112:868-874. [ Links ]
26. Kim C, Herman W, Vijan S. Efficacy and cost of
postpartum screening strategies for diabetes among women with histories of gestational diabetes mellitus. Diab Care. 2007;30:1102-1106. [ Links ]27. Kale SD, Yajnik CS, Kulkami SR, Meenakumari
K, Joglekar AA, Khorsand N, et al. High risk of diabetes and metabolic syndrome in Indian women with gestational diabetes mellitus. Diabet Med. 2004;21:1257-1258. [ Links ]28. Yogev Y, Catalano PM. Women and obesity. Obstet Gynecol Clin N Am. 2009;36:317-332. [ Links ]
29. Pallardo LF, Herranz L, Martin-Vaquero P, García Ingelmo T, Grande C, et al. Impaired fasting glucose and impaired glucose tolerance in women with prior gestational diabetes are associated with a different cardiovascular profile. Diab Care. 2003;26:2318-
2322. [ Links ]30. Verma A, Boney CM, Tucker R, Vohr BR. Insulin resistance syndrome in women with prior history of gestational diabetes mellitus. J Clin Endocrinol Metab. 2002;87:3227-3235. [ Links ]
31. Albareda M, Caballero A, Badell G, Rodríguez-Espinosa J, Ordoñez-Llanos J, de Leiva A, et al. Metabolic Syndrome at follow up in women with and without gestational diabetes mellitus in index pregnancy. Metabolism. 2005;54:1115-1121. [ Links ]
32.
Song Y, Manson JE, Tinker L, Howard BV, Killer LH, Nathan L, et al. Insulin sensitivity and insulin secretion determined by Homeostasis Model Assessment and risk of diabetes in a multiethnic cohort of women. The Women`s Health Initiative Observational Study. Diab. Care 2007; 30: 1747-1752. [ Links ]33. Madarász E, Tamás G, Tabák A, Zsuzsa K. Carbohydrate metabolism and cardiovascular risk factors 4 years after pregnancy complicated by gestational diabetes. Diabetes Res Clin Prac. 2009;85:197-202. [ Links ]
34. Lauenborg J, Mathiesen E, Hansen T, Glumer C, Jorgensen T, Borch-Jhonsen K, et al. The prevalence of metabolic syndrome in a Danish population of women with previous gestational diabetes mellitus is three-fold higher than in the general population. J Clin Endocrinol Metab. 2005;90:4004-4010. [ Links ]