Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.71 n.4 Caracas dic. 2011
Restricción del crecimiento fetal: factores de riesgo
Dra. María Scucces*
*Ginecólogo Obstetra
Correspondencia: CIADANA (Centro de Investigación y Análisis Docente Asistencial del Núcleo Aragua). Laboratorio de Microscopia Electrónica, Fac. Cs de la Salud, Universidad de Carabobo, Núcleo Aragua, Maracay, Edo. Aragua. Venezuela. Correo electrónico: mscucces@yahoo.com
RESUMEN
Objetivo: Determinar los factores de riesgo asociados a la restricción del crecimiento fetal. Métodos: Estudio retrospectivo, epidemiológico, descriptivo de 262 casos de retardo del crecimiento fetal registrados de 1999 a 2008. Se analizaron los factores de riesgo: edad, paridad, control prenatal, resultado perinatal. Ambiente: Departamento de Obstetricia, Hospital Central de Maracay. Resultados: La edad promedio fue de 25,4 años. En paridad 53,3 % tenían de dos a cuatro embarazos. En 48,4 % la restricción del crecimiento fetal no se encontraron factores de riesgo. El 79 % de los neonatos nació a término con peso inferior a 2 500 g. Conclusiones: Los fetos con restricción del crecimiento fetal representan una población heterogénea cuya única característica común está dada por el bajo peso al nacer. Es necesario el diagnóstico diferencial de los fetos para el monitoreo y tratamiento adecuados.
Palabras clave: Restricción del crecimiento fetal. Factores de riesgo. Diagnóstico.
SUMMARY
Objective: Determine risk factors associated with intrauterine growth restriction. Methods: A retrospective, epidemiological and descriptive study of 262 patients with diagnosis of Intrauterine Growth Restriction from 1999 to 2008. It was analyzed risk factors: age, parity, prenatal care, perinatal outcome. Setting: Department of Obstetric, Hospital Central de Maracay. Results: The mean age was 25.4 years. In parity 53 % had from two to four pregnancies. In 48.8 % there were no cause of the intrauterine growth restriction. 79 % of neonates wereterm and weight below 2 500 g. Conclusion: Infants with IGR represent a heterogeneous group and affects neonates with low birth weight. Diagnosis the cause of IGR and the proper management of these infants is important.
Key words: Intrauterine growth restriction. Risk factors. Diagnosis.
INTRODUCCIÓN
La restricción del crecimiento fetal (RCF) puede ser identificada ya durante el embarazo, a través de los métodos diagnósticos actuales, de allí la imperiosa necesidad de un diagnóstico obstétrico in útero. Su definición se basa en una biometría fetal por debajo del 10º percentil para la época, en aquellos fetos cuya edad de gestación haya sido debidamente establecida (1). El 10º percentil del peso para un recién nacido (RN) de las poblaciones caucásicas residente en los países occidentales se aproxima a los 2 500 g en el sexo femenino y los 2 700 g en el masculino (1). Actualmente el peso ecográfico (peso fetal estimado) es calculado mediante ecuaciones matemáticas, combinando algunos parámetros biométricos (circunferencia cefálica, circunferencia abdominal y longitud del fémur). Entre los diversos programas de cálculo, el software Hadlock, es el más usado (1).
Han sido utilizados otros valores en percentil como el 3º, el 5º y las dos o tres desviaciones estándar por debajo de la distribución normal del peso fetal correspondiente a la edad de gestación, pero, aun cuando diferentes límites han sido propuestos para diferenciar la población normal de aquella con restricción del crecimiento intrauterino, la mayoría de los autores considera como RCF a fetos cuyo peso al nacer está por debajo del 10º percentil para su edad de gestación (1-4). Un problema acerca de está definición lo constituye el hecho que las curvas de pesos fetales tomadas como referencia difieren notablemente entre ellas, expresión esto de abordajes diferentes en la recolección y selección de los datos, así como de, diferencias en las características somáticas de las diversas poblaciones (1,5).
Para la Organización Mundial de la Salud (OMS) (5,6), cualquier feto cuyo peso al nacer sea inferior a 2 500 g es definido como de bajo peso al nacer (BPN) independientemente de la edad de gestación. En atención a ello, los RN se dividen en tres clases: I. Recién nacidos adecuados para la edad de gestación nacidos antes de las 37 semanas (pre-término); II. Neonatos pequeños para la edad de gestación nacidos antes de las 37 semanas (pre-término con RCF); III. Neonatos pequeños para la edad de gestación nacidos después de las 37 semanas de embarazo (a término con RCF) (2,5,6).
Otra forma de identificar una masa corporal no acorde a la edad de gestación es utilizando el índice ponderal fetal, calculado dividiendo el peso fetal estimado entre la longitud del fémur elevado al cubo. Así, un feto podría no tener RCF por la definición del percentil, pero sí podría tener un índice ponderal anormal debido a una malnutrición intrauterina. La desventaja de dicho índice está en el error potencial introducido al calcular la longitud del fémur al cubo (2,4,5).
Siendo el criterio ponderal al nacer el único a ser considerado para definir a los fetos con restricción del crecimiento intrauterino, es evidente como a dicha categoría pertenezcan fetos extremamente heterogéneos entre ellos y a quienes diferentes causas, han conducido a una característica común como lo es el BPN (1,6). Puesto que a la diversidad de las etiologías se corresponden diversos aspectos funcionales prenatales y posnatales, es posible reunir la RCF en tres grupos: I. Casos en el que de la norma (feto pequeño para la edad gestacional PEG); II. Casos en el que es expresión de anomalías intrínsecas del feto (aneuploidías, síndromes genéticos, malformaciones estructurales) que implican una reducción del potencial de crecimiento; III. Casos en el que es debido a factores ambientales/placentarios (malnutrición materna, infecciones, hipertensión, pre-eclampsia, etc.) que implican limitación de substratos al feto o un impedimento para la actuación de su potencial genético de crecimiento (1,3,6).
El crecimiento fetal es, en esencia, un concepto abstracto, puesto que durante el embarazo solo es posible medir formas antropométricas aisladas cuyo crecimiento expresa el desarrollo individual de esa figura solamente. Winick citado por Brar y col. (5) describe tres fases en el crecimiento fetal normal: I. Fase 1: ocurre durante las primeras 16ª semanas de gestación, se caracteriza por hiperplasia de los tejidos con aumento en el número de las células; II. Fase 2: comprende el período que va desde las 16ª a las 32ª semanas y se distingue por una concomitante hiperplasia e hipertrofia de los tejidos con aumento tanto del número como de las dimensiones celulares embriofetales; III. Fase 3: se extiende de las 32ª semanas al parto y su rasgo está dado por un aumento del volumen (hipertrofia) de las células, y además porque en ella ocurre la mayor parte de la deposición de la grasa fetal (1,4,5). Es por todo lo antes dicho y de acuerdo a la temporalidad de la actuación del daño al crecimiento que se distinguen tres categorías de RCF: I. Simétrico, así definido por presentar un perfil de crecimiento constantemente debajo de la norma y una reducción simétrica de los parámetros biométricos (polo cefálico, abdomen, miembros), comprende el 20 % y las causas que lo producen actúan durante la Fase 1 del crecimiento fetal; II. Mixto (Simétrico-Asimétrico), se caracteriza por un perfil de crecimiento de la figura antropométrica que, en un primer momento está debajo de la norma, pero que posteriormente se recupera para ubicarse en un rango de normalidad, hay una reducción constante de los parámetros biométricos con una relación variable entre las dimensiones de los varios segmentos del cuerpo fetal (polo cefálico, abdomen, miembros), abarca el 10 % y sus causas inciden en la fase intermedia de la gestación (16ª a 24ª semanas), (Fase 2); III. Asimétrico, alcanza el 70 %, el perfil de crecimiento se mantiene en un rango de normalidad hasta cierto punto para luego descender, manifestando una reducción asimétrica de los parámetros biométricos fetales con una relación elevada entre el polo cefálico y el abdomen, las causas que lo producen actúan en la fase tardía de la gestación (después de las 24ª semanas), (Fase 3) (1,4,5). El diagnóstico de la restricción del crecimiento intrauterino depende, en parte, de una precisa datación de la gestación. La fecha de la última regla (FUR) es un índice confiable para hacerlo si se logra evaluar la madre desde los inicios de la misma y el embarazo está bien controlado, es poco útil, en cambio, si existe una historia de ciclos menstruales irregulares o cuando la fecundación haya ocurrido poco después de la suspensión de anticonceptivos orales. Es raro descubrir clínicamente una RCF antes de las 22ª a 24ª semanas, de allí que, hasta ese momento la medida de la altura uterina debería corresponder a la edad gestacional pero, aunque simple, este es un método poco sensible y específico (2,6,7). Como el crecimiento fetal restringido es definido sobre la base del criterio ponderal, el diagnóstico puede realizarse con métodos que sean capaces de estimar el peso fetal y para ello, la ecografía bidimensional ofrece identificar parámetros biométricos fetales que permiten estimarlo con una aproximación inferior al 10 % del peso real, de lo que se deduce, que otras metodologías son de escasa utilidad para hacerlo si se las confronta con la ecografía. Una evaluación ecográfica es particularmente útil en datar la gestación antes de las 22ª semanas. Las figuras antropométricas usadas son la longitud cráneo-caudal (LCC) en el primer trimestre, el diámetro biparietal (DBP) y/o la longitud del fémur (LF) en el 2º trimestre y hasta las 24ª semanas de gestación. Las limitaciones de la ecografía como método diagnóstico residen en su escasa capacidad predictiva ya que solo evidencia la restricción del crecimiento fetal una vez que este se haya instaurado sin predecir su aparición (2,8,9). Los datos biométricos, arriba descritos, pueden completarse a las 32ª a 34ª semanas de embarazo con la búsqueda de los núcleos de osificación de las epífisis distales del fémur, que, de estar ausentes indicarían una edad de gestación inferior a las 34ª semanas (5,8). Existen otros métodos disponibles para calcular retrospectivamente la gestación mediante exámenes físicos y neurológicos del RN, pero son de poca utilidad (8).
Como el crecimiento fetal restringido es sinónimo, muy a menudo, de sufrimiento fetal crónico (SFC), la ecografía Doppler es una técnica que permite el uso del ultrasonido para el estudio de la hemodinámica fetal y es útil en el caso de sospecha RCF o SFC, ya que evalúa cualitativamente y cuantitativamente los flujos hemáticos fetales, fetoplacentarios y uterinos (8). Permite determinar en las arterias umbilicales, la aorta y las ramas de la arteria uterina, la velocidad y cantidad de flujo sanguíneo registrado en forma de onda y las resistencias que a ella se oponen (8), todo lo cual ofrece posibilidades diagnósticas tanto en la previsión de identificar fetos a riesgo de desarrollar restricción del crecimiento intrauterino, como en el diagnóstico diferencial de los mismos. El Doppler puede ser utilizado con provecho a partir de la 20ª a 25ª semanas de gestación (1,4,8).
El feto con restricción del crecimiento intrauterino puede tener numerosas complicaciones en el período neonatal que están relacionadas con la etiología del daño al crecimiento. Las alteraciones en el desarrollo neurológico a largo plazo, se relacionan con la causa del mismo y pueden ir desde sordera, ceguera o parálisis cerebral (5). Un feto PEG nacido a término, con respecto a uno de dimensiones apropiadas posee un riesgo de morbilidad y mortalidad perinatal 5 a 10 veces mayor debido a causas como: A. Asfixia, B. Lesiones neurológicas, C. Hipoglucemia Neonatal, D. Hipocalcemia, E. Policitemia, F. Aspiración de meconio, G. Persistencia de circulación fetal, H. Enterocolitis necrotizante. Si, además, se asocian la presencia de anomalías congénitas como malformaciones, anomalías cromosómicas, síndromes genéticos o infecciones prenatales, el riesgo de un resultado desfavorable aumenta considerablemente (1,5,6,10,11). Los estudios a largo plazo de individuos con RCF dan un riesgo mayor de padecer: I. Enfermedades cardiovasculares, II. Hipertensión, III. Arterioesclerosis, IV. Diabetes mellitus Tipo II (1).
En el presente trabajo nos proponemos como objetivo determinar los factores de riesgo que presentaron las embarazadas con diagnóstico de restricción del crecimiento fetal que se atendieron de 1999 a 2008 en el Servicio de Obstetricia del Hospital Central de Maracay.
MÉTODOS
Estudio retrospectivo, epidemiológico y descriptivo de los casos con diagnóstico de RCF, atendidos en el Servicio de Obstetricia del Hospital Central de Maracay desde 1999 a 2008.
La población se formó tomando en cuenta aquellos casos seleccionados en base al diagnóstico de egreso codificado en los archivos del departamento de historias médicas como: Atención materna por déficit del crecimiento fetal que acudieron al servicio de obstetricia. Para formar la muestra de este trabajo se tomaron en cuenta las historias disponibles en uno de los dos archivos del departamento de historias médicas, por encontrarse el otro inhabilitado para su uso. Se recopilaron 262 casos de RCF que incluyen 18 embarazos gemelares. Se analizaron: factores maternos (edad, paridad, control prenatal, peso, estado nutricional de la madre); factores de riesgo (causas genéticas, anomalías congénitas, infecciones, embarazo gemelar, factores placentarios, trastornos hipertensivos maternos, enfermedades sistémicas crónicas, oligohidramnios); el resultado perinatal según peso al nacer y edad de gestación.
Los datos se obtuvieron de forma personal y directa, se agruparon, ordenaron y clasificaron para realizar cuadros y se analizaron de acuerdo al porcentaje.
RESULTADOS
Entre 1999 y 2008, se atienden 294 073 pacientes en el Servicio de Obstetricia del Hospital Central de Maracay. Se registraron 3 259 casos de restricción del crecimiento fetal. Se recopilaron solo 262 casos que incluyen 18 embarazos gemelares, (lo que nos impide dar cifras acerca de la incidencia del mismo).
En cuanto a los datos epidemiológicos de las pacientes no es posible sistematizar la información por motivos diversos: I. No pueden recabarse datos acerca del control prenatal por no aparecer en la historia, atendidas en período expulsivo en muchos casos; II. De ello se deriva que el peso materno y el estado nutricional de la madre no puedan reportarse (y además la altura uterina no se registra como dato diagnóstico de RCF); III. Pocos casos tienen datos biométricos y de flujometría Doppler y en ellos no siempre se clasifica la restricción del crecimiento intrauterino pues las ecografías que se reportan no se corresponden con la edad de gestación en que se realiza el diagnóstico y por tanto el peso al nacer es el único criterio de restricción del crecimiento fetal en la totalidad de los casos.
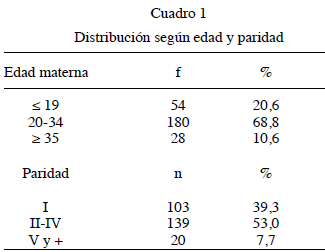
Edad materna se encontró que 68,8 % tienen edades comprendidas entre 20 y 34 años, con extremos de 13 y 44 años y una media de 25,4 años como se ve en el Cuadro 1, al igual que la paridad donde se evidencia que 53 % tenía entre II a IV embarazos.
Los factores de riesgo, se detallan en el Cuadro 2, donde encontramos que el 48,4 % no tuvo factores de riesgo en la RCF, en 19,8 % el factor registrado es el oligohidramnios, seguido en 17,5 % por los trastornos hipertensivos maternos. Hay 6 % embarazos gemelares, el 1,3 % registró anomalías congénitas que se correspondieron en su mayoría a ciemopatías del sistema nervioso central, el 0,7 % presentó infecciones, el 4 % corresponde a factores placentarios que en su totalidad fueron casos de desprendimiento prematuro de placenta normoinserta, el único caso de anomalía genética (0,3 %) no resulta bien identificado siendo catalogado solamente como cromosomopatía.
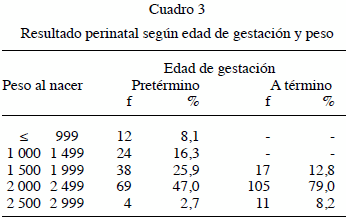
En el Cuadro 3 se clasificaron los neonatos según la edad de gestación y el peso al nacer observándose que 79 % resultó a término con peso inferior a los 2 500 g, y en 47 % eran pretérmino y con menos de 2 500 g, [además hay 8,2 % nacidos a término con peso entre 2 500 g y 2 999 g entre los que se registra 1 solo caso cuyo peso al nacer resultó de 2 900 g con alteraciones hemodinámicas del tipo aumento del índice de resistencia de las arterias uterinas.
DISCUSIÓN
La incidencia de la restricción del crecimiento intrauterino varía del 3 % al 7 % de todos los nacidos vivos (5) y la prevalencia atañe al 10 % de la población, si se considera el peso al nacer como inferior al 10º percentil para la época gestacional o al 5 % de los nacidos vivos si se considera el 5º percentil (1). Su diagnóstico puede hacerse dificultoso cuando la edad gestacional no es conocida con certeza, pero la presencia de ciertos factores de riesgo predisponentes, deben alertar al respecto (1,12). Entre los grupos a riesgo se citan aquellos cuyas edades son inferiores a los 20 años y superiores a los 35. Nuestros datos registran un 68,8 % de madres con edades comprendidas entre 20 y 34 años, lo cual no es acorde con lo reportado por Faneite y col. (6). Es frecuente hipotetizar que el embarazo en la adolescente incremente el riesgo de CFR, no obstante, las informaciones al respecto registran que no existe tal incremento, a menos que, existan factores conocidos que sean la causa de la restricción del crecimiento intrauterino y que estén asociados al embarazo, de lo contrario, una adolescente con un adecuado control prenatal no verá incrementar el riesgo de RCF por el solo estatus de su edad (13).
La primiparidad es otra de las causas de crecimiento fetal restringido y encontré que 53 % tenían entre 2 y 4 embarazos y solo 39,3 % de las pacientes eran primigesta lo que se corresponde con lo reportado por Faneite y col. (6), pero difiere de los datos de Quintero y col. (17) quien en su estudio presenta un 47 % de nulíparas (6,13,17).
Los mecanismos que pueden condicionar la RCF, son diversos. Las anomalías fetales genéticas o adquiridas in útero, afectan el crecimiento fetal a través de una reducción del potencial de crecimiento. Se estima que 40 % se deba a causas genéticas maternas y fetales (mitad cada uno). Los genes maternos son los que poseen la mayor influencia sobre el peso al nacer. La influencia paterna sobreviene a través de la contribución de un cromosoma Y (5). Los RN con trisomías 13, 18 y 21, y también, la monosomía XO presentan restricción del crecimiento fetal; los mosaicos 45, X y 46, XX lo tienen en grado menor (5). El crecimiento fetal restringido puede ser la única manifestación de anomalías cromosómicas más asintomáticas desde el punto de vista clínico como ocurre en el caso de los mosaicismos limitados a la placenta (1). Pueden, además, existir condiciones en las cuales uno de los pares de homólogos sea de derivación exclusiva de uno de los dos progenitores, estas son las disomías uniparentales (Du), entre las cuales está la Du7 materna o (síndrome de Silver-Russel); la Du6 paterna o diabetes neonatal transitorio o en el síndrome Du14 paterno y el Du16 materno (1,14). Se describe también, una asociación significativa entre RCF y malformaciones congénitas fetales o síndromes dismórficas con modelo hereditario conocido o simplemente el resultado de una mutación genética o multifactorial. En estos casos, el feto está condicionado al crecimiento restringido por un programa genético o a una constitución física alterada. El pronóstico de estos casos, sin embargo, está dado no tanto por la restricción del crecimiento en sí como por la severidad de las causas que los producen. En todos los casos descritos anteriormente la restricción del crecimiento fetal es severa, precoz (desde el 1er trimestre), simétrica, con implicación de todos los segmentos corporales fetales. En el trabajo se encontró 0,3 % de cromosomopatía no bien definida y 1,3 % de malformaciones congénitas, ello no se corresponde con lo reportado por Evans, citado por Gross (12) quien señala 5 % a 10 % de causas genéticas (1,5,6,12).
Es conocido que las infecciones causan RCF, si bien, no está definido el número de microorganismos que posean este efecto. Encontramos 0,7 % de infecciones de los cuales una era infección por HIV y la misma paciente era portadora de hepatitis B. El mecanismo subyacente de la restricción del crecimiento intrauterino está condicionado por una reducción del potencial de crecimiento (1). La mayoría de los agentes infecciosos alcanzan el feto a través de la vía hematógena, replicándose inicialmente en la placenta produciendo villositis. En cambio, los efectos fetales, están relacionados con el momento en el que ocurre el daño y por el tiempo de duración de la infección (5).
Los embarazos múltiples están asociados a una elevada y progresiva disminución del peso fetal y de la placenta después de las 24ª semanas, de allí que en el 3er trimestre de la gestación sean necesarios controles ecográficos cada 4 semanas para la evaluación del crecimiento fetal y el eventual diagnóstico de crecimiento discordante entre los fetos (diferencia de peso mayor del 25 % entre ambos fetos) (1,8). El crecimiento fetal restringido leve de ambos gemelos, puede deberse a una disminución de la dimensión celular. Al nacer, presentan un crecimiento acelerado con recuperación de sus pesos; lo que reporta a la tesis que la etiología del retardo esté dada por condiciones anormales del ambiente que se traducen en incapacidad de aportar adecuadamente sustancias nutritivas y O2, que no a un bajo potencial intrínseco de los gemelos. Estos embarazos inciden en menos del 1.% en todos los casos de restricción del crecimiento fetal (8,12). En los embarazos gemelares monocoriales la incidencia de muerte intrauterina de uno o de ambos fetos después de las 34ª semanas es igual respecto los bicoriales, pero, independientemente de la corialidad, la muerte de un gemelo in útero estimula la cascada de la coagulación por lo que se hace necesario el monitoreo de dichos parámetros maternos (1). Al margen del riesgo de trasfusión feto–fetal, en caso de placentación monocorial, la muerte del co-gemelo determina un elevado riesgo de hándicap neurológico en el feto que sobrevive (25 % o más). La hipotensión/ isquemia del gemelo sobreviviente, está a la base del daño. Algunos autores han propuesto para ello identificar el pico sistólico de la arteria cerebral media en las 24 horas sucesivas a la muerte del feto para evaluar el grado de anemización del co-gemelo sobreviviente (1).
En los embarazos gemelares bicoriales, el riesgo de restricción del crecimiento fetal selectivo (RCFs) de uno de los fetos es de 25 %. La causa de tal asimetría es incierta. Entre las hipótesis creíbles se cita que una de las placentas sufra daño anatómico o que exista una mal función selectiva. Ante un embarazo gemelar monocorial, la RCFs debe hacer sospechar el surgimiento del síndrome de transfusión feto-fetal (STFF) y esto atañe 12,5 % a 25 % de los embarazos monocoriales. En ausencia de criterios diagnósticos de STFF, la restricción del crecimiento intrauterino puede atribuirse a: I. Alteración focal de la invasión trofoblástica; II. Subdivisión desigual del territorio placentario entre los dos gemelos; III. Inserción velamentosa del cordón; IV. Anastomosis vasculares irregulares entre ambas circulaciones fetales. La metódica Doppler permite obtener en modo continuo y no invasivo información cuantitativa y cualitativa sobre la situación circulatoria materna y fetal, ofreciendo posibilidades diagnósticas tanto en la previsión como en el riesgo de desarrollar RCF y también en el diagnóstico diferencial. Recientemente se ha planteado la evaluación del flujo de la arteria umbilical del feto pequeño y se ha propuesto una clasificación de tres formas: I, II, III. En el tipo II: (ausencia o inversión del flujo diastólico persistente) existe el riesgo de deterioro fetal progresivo in útero; en el tipo III (ausencia o inversión del flujo diastólico intermitente), está documentada una mayor incidencia de muerte fetal in útero del feto pequeño o de lesiones cerebrales en el feto grande, independientemente de la muerte del co-gemelo (1,12). Nuestros datos registran 6 % de embarazos gemelares y ello duplica los reportados por Faneite y col. (6).
Anomalías primitivas placentarias como los tumores, la arteria umbilical única, patologías que cursan con un aumento de las resistencias placentarias como son la placenta circunvalada, placenta previa, las anomalías müllerianas, trombosis, infartos y hematomas placentarios, determinan una hipo nutrición fetal, impidiendo de realizar su potencial genético de crecimiento (1). En nuestro datos el 4 % se asociaron a factores placentarios.
Los trastornos hipertensivos maternos determinan insuficiencia útero placentaria, lo cual, se traduce en una reducción del aporte de substratos al feto (6). Tal insuficiencia placentaria puede manifestarse en todas las épocas de embarazo y, de no coexistir factores genéticos o ambientales, la RCF por limitación de substratos se caracteriza por ser tardía, de entidad variable, asimétrica, con prevalencia del polo cefálico sobre el abdomen y los miembros. La asimetría es la consecuencia de fenómenos compensatorios realizados por el feto para hacerle frente al aporte inadecuado de sustancias nutritivas y de O2. A estas condiciones de compromiso del flujo sanguíneo, el feto reacciona con un cambio profundo y activo de su hemodinámica. Un primer mecanismo de adaptación circulatoria está dado por un aumento del flujo sanguíneo en el ductus venoso de Aranzio y una concomitante reducción del flujo venoso que de la vena umbilical se dirige al hígado. Todo ello se traduce en un mayor flujo sanguíneo, mayormente oxigenado al ventrículo izquierdo fetal respecto al derecho. Otro mecanismo de adaptación consiste en la variación de las resistencias periféricas, produciendo vasodilatación a nivel de los vasos cerebrales y miocardio y constricción a nivel de vasos esplácnicos y sistema músculo cutáneo. Esto redistribuye el gasto cardíaco con protección de los órganos más nobles y vitales como son el corazón, el encéfalo, las suprarrenales y una reducción de la perfusión de órganos no vitales. Este fenómeno (brain sparing effect), tiene como consecuencia un crecimiento no solo retardado, sino desproporcionado (1,8,16). Sin embargo, la persistencia de una condición de privación de substratos, determina un progresivo deterioro de las condiciones de la salud fetal y la aparición de signos de sufrimiento. Otros signos tardíos, están dados por la disminución de la cantidad de líquido amniótico, la reducción de los movimientos fetales y las alteraciones de los patrones de la frecuencia cardíaca fetal (1,8,16). El Doppler riesgo de desarrollar RCF por limitación de sustratos, permitiendo una vigilancia más intensiva de estos casos, de manera tal de evitar el sobreponerse un sufrimiento fetal agudo e identificar el momento más apropiado para el parto. Se estudian las formas de las ondas de velocidades en la sístole y la diástole a través de varios índices: relación sístole/diástole (S/D); índice de resistencia (IR); índice de pulsatilidad (IP) (12).
Las anomalías de la circulación fetal que ocurren en el crecimiento fetal restringido abarcan los siguientes territorios vasculares: I. Circulación útero placentaria: en los fetos las alteraciones en el flujo de las arterias uterinas, identifica casos de RCF severos, ligados a grave disfunción placentaria (1,4,17); II. Arteria umbilical: las alteraciones del Doppler en la arteria umbilical son índice de un aumento en el riesgo de mortalidad perinatal (1,4,12); III.
Aorta descendente: el aumento de las resistencias en este vaso, determina una severa reducción del flujo sanguíneo en los órganos esplácnicos, y ello se asocia a la presencia de complicaciones neonatales como la enterocolitis necrotizante (12); IV. Arteria renal: el aumento de las resistencias está inversamente relacionado con la cantidad de líquido amniótico (8,12). El estudio de la arteria renal es un parámetro importante para evaluar la perfusión renal y monitorizar la respuesta del feto a la hipoxia (12); V. Arterias cerebrales: La carótida interna y la arteria cerebral media, ante la hipoxia experimentan vasodilatación significativa y tienen valor predictivo y pronóstico en relación a la encefalopatía poshipóxica del RN, para la cual resultan mayormente a riesgo de los fetos con notable vasodilatación cerebral (1,8,12); VI: Flujos venosos fetales: a través de estos vasos (vena umbilical, ductus venoso de Aranzio, vena cava inferior) el feto recibe O2 y otros nutrientes (1,8,12). La onda venosa de flujo Doppler del ductus, cambia al avanzar la edad del embarazo. Su alteración se relaciona con la presencia de anomalías cardíacas estructurales, funcionales y anomalías extracardíacas con repercusión hemodinámica (16,18,19); VII. Circulación cardíaca fetal, es útil para evidenciar condiciones de alteración de la hemodinámica cardiocirculatoria fetal y enriquece las informaciones acerca de su bienestar (4,8). Más recientemente el power Doppler 3-D ha sido empleado en la evaluación de la RCF revelando mayor información acerca de la fisiopatología placentaria (20).
Se registraron 17,5 % de trastornos hipertensivos maternos, ello es mayor a los resultados de Quintero y col. (17) que presenta 8 % de gestantes (17,20). Recientemente se ha planteado la presencia de una insuficiencia placentaria sin causa aparente, avalada por el hallazgo de bajos valores de gasto cardíaco maternos revelados mediante ecocardiografía a las 13ª y 24ª semanas de gestación. El cálculo de las resistencias periféricas totales mediante ecocardiografía materna a las 11ª a 14ª semanas permitiría discriminar los casos de restricción del crecimiento fetal, de los fetos PEG lo que convierte a esta técnica en una importante herramienta en la predicción diagnóstica de RCF (1).
Las enfermedades sistémicas crónicas (lupus, nefritis, vasculitis, diabetes mellitus con compromiso vascular, etc.), impiden a la madre una adecuada perfusión vascular del lecho placentario y/o un adecuado aporte de sustancias nutritivas a la placenta, y ello determina RCF (21,22). Se obtuvieron 2 % de enfermedades sistémicas crónicas.
El oligohidramnios es un signo tardío de malnutrición fetal. Su frecuencia es de aproximadamente 4 % en la población general y está relacionado con la adaptación fetal a la hipoxia, en efecto los fetos con sufrimiento fetal presentan un aumento de las resistencias de las arterias renales lo cual está inversamente relacionado con la producción de orina fetal por parte del riñón (4,12). Philipson y col., citado por Gross (12), reportan una incidencia del 40 %, nuestros datos registraron 19 % casos de oligohidramnios siendo inferior a lo reportado por los autores mencionados (4,12).
La literatura reporta que la causa del RCF es indeterminada en el 40 % de los casos (1,12). En nuestros datos 121 casos (48,8 %), registraron un RCF sin factores de riesgo. Es frecuente identificar los fetos pequeños para la edad de gestación (PEG) con aquellos afectados por RCF; pero de hecho, solo 30 % de RN/PEG resulta tenerlo. Este último grupo de neonatos, está más sujeto a resultados perinatales adversos como son la sepsis e insuficiencia respiratoria (3,4,6). Es posible discriminar entre ambos tipos a través del estudio del monitoreo con flujometría Doppler de la arteria umbilical y de la arteria cerebral media. Los fetos PEG tienen un índice S/D de la arteria umbilical normal. La inversión del flujo diastólico (REDF) o la ausencia de flujo diastólico (AEDF) en el Doppler de la arteria umbilical revelan un severo compromiso fetal.
Un parámetro está dado por la medida del diámetro biparietal (DBP), el cual es de por si insuficiente como método diagnóstico de RCF. Su medición seriada demuestra dos patrones de crecimiento fetal: I. Perfil de crecimiento lento, con mediciones siempre debajo del percentil 10; II. Perfil de aplanamiento tardío, con detención en el último trimestre. Sin embargo, puede ocurrir la redistribución del flujo sanguíneo a los órganos esenciales como el encéfalo y el crecimiento cefálico puede continuar (1,2,4). La circunferencia abdominal (CA), como medida antropométrica, refleja las dimensiones hepáticas. En efecto, una disminución de la vascularización del hígado es uno de los eventos hemodinámicos más relevantes que se traduce en un enlentecimiento de las actividades metabólicas como la glucogenosíntesis y la reducción de factores de crecimiento (IgF-I e IgF-II). La falta de depósito de las reservas de glucógeno hepático y la disminución de la síntesis de factores de crecimiento, condicionan la disminución de la biometría abdominal (1,4). Valores de (CA) por debajo del percentil 10º a las 30ª a 34ª semanas identifican la mayoría de la RCF al nacer, aun cuando ello es un dato poco específico, pues 70 % de fetos pequeños son de peso adecuado para la edad gestacional al nacer, mas sin embargo, identifica los casos severos y un valor normal de CA, lo excluye como diagnóstico (1,4). El mejor método para la evaluación ecográfica del crecimiento fetal restringido en el 3er trimestre es la relación circunferencia cefálica y circunferencia abdominal (CC/CA); ya que, permite distinguir entre el RCF simétrico y uno asimétrico. Su valor es: I. 1 > antes de las 32ª semanas; II. 1 = a las 32ª a 34ª semanas; III. 1 < después de las 34ª semanas.
La relación entre longitud del fémur y circunferencia abdominal (LF/CA) es también otro dato biométrico útil en el diagnóstico de RCF asimétrico. Su valor es constante hasta la 20ª semanas. A partir de las 21ª semanas y hasta el término, su valor es de 22, y, valores FL/AC > 23,5 son sugestivos de restricción del crecimiento intrauterino (4,8).
Se evidenció que 79 % de los recién nacidos a término pesa menos de 2 500 g, la cifra es mayor a la reportada por Faneite y col. (6). Estos neonatos si bien poseen una mortalidad menor que los nacidos pre término adecuados para la edad gestacional (AEG), poseen, en cambio, un riesgo 5 a 30 veces mayor que aquellos nacidos a término pero AEG. Hallamos 8,3.% de casos a término cuyo peso al nacer se ubicó entre 2.500 g y 2 999 g entre los cuales un solo neonato cuyo peso al nacer fue de 2 900 g reportó un aumento del índice de resistencia a nivel de las arterias uterinas, es probable que en estos casos el peso al nacer no sea el medio adecuado para catalogar el RN como RCF, y en cambio, el índice ponderal sea quizás más aceptable para clasificarlos (2,4,6,12).
En un tentativo de uniformar los fetos con RCF ha sido propuesta una clasificación funcional de los mismos como sigue: Tipo 1: Fetos (o neonatos) con un peso inferior al 10º percentil pero funcionalmente normales (pequeño para la edad gestacional); Tipo 2: Fetos (o neonatos) con un peso inferior al 10º percentil pero con anomalías estructurales (malformaciones, cromosomopatías); Tipo 3: Fetos (o neonatos) con un peso inferior al 10º percentil pero funcionalmente (hemodinámica, motricidad, etc.), anormales (limitación de substratos); Tipo 4: Fetos con un peso superior al 10º percentil pero funcionalmente (hemodinámica, motricidad etc.) anormales (concepto de limitación del potencial genético de crecimiento). Esta clasificación permitiría seleccionar el manejo clínico adecuado para cada feto (5). El seguimiento longitudinal de los mismos implica la realización de la flujometría Doppler fetal, del Test de Reactividad Fetal (TRF) para el monitoreo de la frecuencia cardíaca fetal, y el perfil biofísico de Manning cuyo componente más importante está representado por el volumen de líquido amniótico, además del ultrasonido cada 2 a 3 semanas para evaluar el crecimiento fetal interno (HC/AC, FL/AC) (2,4,12).
La decisión del momento del parto en la restricción del crecimiento intrauterino debe ser individualizada sobre la base de la edad de gestación, la severidad de la restricción fetal, el volumen de líquido amniótico, la flujometría Doppler (1,2). En cuanto al tipo de parto, en general, la cesárea es de elección antes de las 37 semanas y en ausencia de malformaciones. Después de las 37 semanas, si hay presentación cefálica, vitalidad fetal conservada y condiciones favorables del cuello uterino para su inducción, puede considerarse la vía vaginal (2,13).
En síntesis podríamos concluir diciendo que: I. Sería de auspiciar la realización de un trabajo prospectivo para la mejor caracterización epidemiológica de las pacientes con RCF y la identificación de otros factores de riesgo que, dadas las características retrospectivas de este trabajo escapan a su diagnóstico; II. Los fetos con RCF representan una población heterogénea cuya única característica común está dada por el bajo peso al nacer, de allí que sea necesario evaluar estas pacientes en una consulta de alto riesgo obstétrico para discriminar, en función de los factores etiológicos, sus características funcionales haciendo énfasis en aquellos casos que sean debidos a insuficiencia útero-placentaria; III. Las diversas casuísticas son comparables solo haciendo referencia al tipo de población y a su configuración etiológica; IV. El diagnóstico diferencial de los fetos con RCF permite un monitoreo y un tratamiento adecuado para cada feto; V. La flujometría Doppler permite el diagnóstico preclínico de fetos a riesgo de crecimiento fetal restringido por carencia de substratos y su monitoreo intensivo, lo cual abre nuevas posibilidades terapéuticas; VI. El uso combinado de las diversas técnicas biofísicas permite un adecuado control del equilibrio ácido base, del bienestar fetal y permite una optimización del momento del parto (1,2,4-6,12,13,18).
Agradecimientos
Se agradece a la Dra. Ana Claudia Casilli, Directora Docente del Hospital Central de Maracay. A todo el personal que labora en el Departamento de Historias Médicas, en modo especial a la Sra. Mireya Macías, la Sra. Fátima Pérez.
REFERENCIAS
1. Ghi T. La patología ipertensiva materna e liposviluppo Fetale. 2ª edición. Modena: Athena Srl; 2009. [ Links ]
2. Charles D, Glover D. Current Therapy in Obstetrics. Filadelfia: B.C. Decker Inc; 1988. [ Links ]
3. Trezza F, Battista L, Falco M L, Serino C, Pareto A E, Esposito M, et al. Valutazione ecografica degli effetti dellarginina nel ritardo di crescita intrauterino. Giorn It Ost Gin. 2009;31:451-454. [ Links ]
4. Faneite P. Retardo del crecimiento intrauterino. En: Zighelboim I, Guariglia D, editores. Clínica obstétrica. 2ª edición. Caracas: Editorial MMV Disinlimed CA; 2005.p.471-477. [ Links ]
5. Brar H S, Rutherford S E. Classification of intrauterine growth retardation. Semin Perinatol. 1988;12(1):2- 10. [ Links ]
6. World Health Organization. Low birth weight: A tabulation of available information. WHO/MCH/92.2. Geneva: World Health Organization and New York: UNICEF; 1992. [ Links ]
7. Faneite P, Linares M, Faneite J, Martí A, González M, Rivera C. Bajo peso al nacer. Importancia. Rev Obstet Ginecol Venez. 2006;66(3):139-143. [ Links ]
8. Di Sarli J, Di Pasquale L,Galicia P, Rey H. Estimación del peso fetal a partir de la medición de la altura uterina. Rev Obstet Ginecol Venez. 1997;57(3):163-168. [ Links ]
9. Pescetto G, De Cecco L, Pecorari D, Ragni N. Manuale di Ginecologia e Ostetricia (Volumen II) Roma: Societá Editricie Universo; 1989:1036-1041. [ Links ]
10. Goldenberg R, Cutter G, Hoffman H, Foster J, Nelson K, Hauth J. Intrauterine growth retardation: Standards for diagnosis. Am J Obstet Gynecol. 1989;161:271- 277. [ Links ]
11. Teberg A, Walther F, Pena I. Mortality, morbidity, and outcome of the small-for-gestational age infant. Semin Perinatol. 1988;12:84-94. [ Links ]
12. Quiñones JN, Stamillo DM, Coassolo KM, Macones GA, Odibo AO. A J Obstet Gynecol. 2005;193(3 part 2):1233-1237. [ Links ]
13. Gross Th L, Sokol R J. Intrauterine growth retardation. A practical approach. USA: Year Book Medical Publishers, INC; 1989. [ Links ]
14. Messer J, Klein P, Schlaeder G. Ipotrofia Fetale. En: Schlaeder G, Messer J, Haddad J, Langer B, editores. Medicina Fetale e Neonatale. Roma: CIC Edizioni Internazionali; 1995. [ Links ]
15. Eggermann T, González D, Spengler S, Arslan-Kirchner M, Binder G, Schönherr N. Broad clinical spectrum in Silver-Russell syndrome and consequences for genetic testing in growth retardation. Pediatrics. 2009;123(5):e929-931. [ Links ]
16. Paiva S, González M L, Meneses M. Embarazo gemelar monocoriónico: mola hidatidiforme parcial y feto normal. Rev Obstet Ginecol Venez. 1995;55(4):233-236. [ Links ]
17. Sosa Olavarría A. Ultrasonografía y Clínica Embrio- Fetal. Valencia: Editorial Tatum; 1993. [ Links ]
18. Quintero J, Villamediana J, Paravisini I, Brito J, Cadena L. Velocimetría Doppler de la arteria uterina como factor de predicción de preeclampsia y crecimiento fetal restringido. Rev Obstet Ginecol Venez. 2002;62:153-159. [ Links ]
19. Díaz Guerrero L, Sosa Olavarría A. Onda de velocidad de flujo Doppler en el ductus venoso del feto normal y en el portador de patologías cromosómicas y cardíacas. Rev Obstet Ginecol Venez. 2000;60(2):89-96. [ Links ]
20. Hoffman C, Galan HL. Assessing the at-risk fetus: Doppler ultrasound. Obstet Gynecol Perinatol. 2009;21(2):161-166. [ Links ]
21. Guiot C, Gagliotti P, Oberto M, Piccoli E, Rosato E, Todros T. Is three-dimensional power Doppler ultrasound useful in the assessment of placental perfusion in normal and growth-restricted pregnancies? Ultrasound Obstet Gynecol. 2008;31(2):171-176. [ Links ]
22. Wenstrom KD. [Commentary on] Intrauterine growth restriction and placental location. Obstet Gynecol Survey. 2008;63(3):143-144 [ Links ]
23. Hanif F, Drennan K, Maria G. A Perinatology. 2007;24(8):501-505. [ Links ]