Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.72 no.3 Caracas set. 2012
Distribución genotipo-específico del virus papiloma humano entre hombres y mujeres de Caracas, Venezuela
Lics. Elvia Rivas1*, Silvanna Verlezza1, Mercedes Flores2
1 Departamento de Biología y Diagnóstico Molecular, Laboratorio AVILAB C.A. Clínica El Ávila. Caracas, Venezuela. *elviarb19@gmail.com
2 Dirección Laboratorio AVILAB C.A. Clínica El Ávila. Caracas, Venezuela
RESUMEN
Objetivo: Determinar la distribución de VPH entre hombres y mujeres con técnicas de biología molecular con la finalidad de aportar información epidemiológica para la evaluación de la utilidad del uso de las vacunas contra VPH en la población. Métodos: Se procesaron muestras de hisopados endocervicales, uretrales, balano prepuciales, biopsias y cepillados cervicales, para extracción de ADN: Kit AxyPrep Body Fluid Viral DNA/RNA Miniprep (Axygen), para la amplificación: Kit
INNO-LIPA HPV Genotyping Extra. Se recolectaron datos en el sistema electrónico INFOLAB. 1 545 pacientes en total fueron separados por sexo, grupo etario y amplificación de ADN-VPH. Resultados: 77,6 % de los pacientes del sexo masculino y 67,9 % del sexo femenino resultaron positivos para la amplificación de ADN-VPH. Se encontró un pico de positividad entre los 30 a 34 años de edad (24,3 %) al igual que para el sexo masculino (20,0 %). En el sexo femenino 50,6 %,0 % a otros genotipos. En el sexo masculino 41,3 % corresponde a VPH-AR, 34,6 % VPH-BR y un 24,2 % a otros genotipos. Los genotipos AR detectados con más frecuencia fueron VPH-52/51/16 y los de BR VPH-6/11. Conclusiones: El cáncer cervical es un problema de salud pública. El tamizaje con citología no ha tenido impacto sobre la prevalencia, se sugiere el uso de pruebas más sensibles. Se debe evaluar el uso de la vacuna en conjunto con otras estrategias, realizando un análisis identificando las debilidades y fortalezas, con la finalidad de establecer programas de prevención óptimos.Palabras clave: VPH. Cáncer cervical. Vacuna.
SUMMARY
Objective: Determine the distribution of HPV in men and women with Molecular Biology techniques in order to provide epidemiological information to evaluate the usefulness of the HPV vaccine in the population. Methods: Samples of endocervical swabs, urethral, preputial, biopsies and cervical scrapes for DNA extraction: Body Fluid Kit AxyPrep Viral DNA / RNA Miniprep (Axygen) for the amplification: INNO-LIPA HPV Kit Extra Genotyping. Data were collected in the electronic system Infolab. 1 545 patients in total were separated by sex, age group and HPV DNA amplification. Results: 77.6 % of male patients and 67.9 % of females were positive for HPV DNA amplification. We found a positive peak between 30 and 34 years of age (24.3 %) as well as for males (20.0 %). Among females 50.6 % of genotypes identified corresponded to HR-HPV, 22.4 % to HPV-LR, 27.0 % for other genotypes. In males, 41.3 % were HR-HPV, HPV-LR 34.6 % and 24.2 % other genotypes. AR genotypes detected more frequently were HPV- 52/51/16 and LR were HPV-6/11. Conclusions: Cervical cancer is a public health problem. Cytology screening has had no impact on the prevalence, we suggest the use of more sensitive tests. It is necessary to evaluate the use of the vaccine in conjunction with other strategies, analyzing the strengths and weaknesses identified, in order to establish optimal prevention programs.
Key words: HPV. Cervical cancer. Vaccine.
INTRODUCCIÓN
En la actualidad, la infección genital causada por el virus de papiloma humano (VPH), se encuentra como una de las infecciones de transmisión sexual más común en Latinoamérica y el Caribe. Se ha determinado que más de la mitad de las mujeres y los hombres sexualmente activos son infectados por el VPH en algún momento de sus vidas (1).
Tanto en hombres como en mujeres, las infecciones por VPH en las que se observan lesiones benignas del tracto genital se asocian con genotipos considerados de bajo riesgo (VPH-BR), manifestándose clínicamente en forma de condilomas o verrugas genitales (2).
Más de 14 genotipos de VPH están relacionados con proliferaciones epiteliales en las superficies cutáneas y mucosas, que en caso de tornarse persistentes o repetitivas pueden desencadenar la formación de lesiones de tipo maligno. Estos genotipos son considerados de alto riesgo (VPH-AR) (1,3,4).
En mujeres, la infección por VPH-AR se encuentra actualmente bien establecida como causante de cáncer de cervical. El VPH-16 es el tipo de alto riesgo más común encontrado en casi la mitad de todos los cánceres de cuello uterino, así también el VPH-18, el cual se presenta en un 10 % a 12 % de los cánceres de cuello uterino (5,6).
En Venezuela no existen datos oficiales sobre la distribución de los genotipos del VPH en la población general y en aquella que padece de cáncer cervical. Para el año 2010, se estimó que 4 116 mujeres fueron diagnosticadas con cáncer cervical y 1 853 murieron de la enfermedad, de igual manera es conocido que el cáncer cervical es el segundo más frecuente en el país. En América del Sur, aproximadamente 13,2 % de las mujeres en la población general están infectadas con el VPH y 67,7 % de los casos de cáncer cervical invasivo están atribuidos a los genotipos 16 y 18 del VPH (5).
En hombres, es difícil estimar la incidencia de la infección por VPH, ya que no se han hecho estudios a gran escala y en Venezuela no se encuentran estimaciones al respecto (5,7). Aún así, infecciones por los denominados VPH-AR, están asociadas a lesiones escamosas preinvasivas del pene (neoplasia intraepitelial del pene) y con el cáncer de pene, así como con las lesiones escamosas preinvasivas del ano (neoplasia intraepitelial anal) y con el cáncer de ano (1).
La prevalencia de infección de VPH varía dependiendo del método de diagnóstico, de la demografía y de las características de comportamiento de la población en estudio. La infección puede ser diagnosticada clínicamente (verrugas), citológicamente (PAp test) o virológicamente (detección de ADN-VPH) (8).
La disponibilidad de pruebas moleculares de alta sensibilidad, que permiten la detección de ADNVPH y la tipificación de los genotipos presentes, proveen la posibilidad de superar las limitaciones del despistaje por citología cervical, con la finalidad de adoptar oportunas medidas terapéuticas, además suministra a las mujeres mayor protección en contra del cáncer cervical.
Es importante conocer cuáles son los genotipos virales predominantes en nuestra población, especialmente los de alto riesgo, para adoptar en consecuencia, la conducta adecuada en cada caso y, en virtud de las vacunas que tenemos a la disposición valorar cuál sería su verdadero impacto en la salud pública (9).
Este trabajo tiene como objetivo determinar la distribución de VPH y sus genotipos en hombres y mujeres, a partir de datos suministrados por determinaciones realizadas en un período de 4 años con técnicas de biología molecular, con la finalidad de aportar información epidemiológica para la evaluación de la utilidad del uso de las vacunas contra VPH en la población como medida preventiva de la infección por el virus.
MÉTODOS
Es un estudio prospectivo y descriptivo. La población estudiada fueron los pacientes, hombres y mujeres, sin rango de edad preestablecido, que acudieron al Laboratorio AVILAB C.A. para la realización de la prueba Tipificación de VPH por parte del Departamento de Biología y Diagnóstico Molecular en los años comprendidos en 2006-2010 inclusive.
Detección de ADN de VPH y genotipificación
Se procesaron muestras de hisopados: endocervicales, uretrales, balano prepuciales, biopsias de piel y cepillados cervicales, a partir de las cuales se realizó extracción de ADN utilizando el Kit comercial AxyPrep Body Fluid Viral DNA/RNA Miniprep (Axygen), los extractos se almacenaron a – 70 °C hasta su procesamiento. Para la amplificación y genotipificación se utilizó el Kit comercial INNO-LIPA HPV Genotyping CE, el cual permite la identificación simultánea del ADN de 24 genotipos de VPH de alto y bajo riesgo más importantes: 6, 11, 16, 18, 31, 33, 35, 39, 40, 42, 43, 44, 45, 51, 52, 53, 54, 56,58, 59, 66, 68, 70, y 74 (10,11). Posteriormente, a partir del año 2010 se comenzó a utilizar una nueva versión de este kit denominada INNO-LIPA HPV Genotyping Extra, el cual cumple con el mismo principio pero incluye la identificación de 4 genotipos adicionales: 26, 53, 66, 69/71 (12).
Criterios de exclusión
Pacientes cuyo resultado positivo no incluyera en el reporte el genotipo identificado. Genotipos indeterminados, los cuales se incluyeron como resultados positivos, más no se tomaron en cuenta a la hora de determinar prevalencia de genotipos.
Se recolectaron los datos registrados en el sistema de reporte de resultados electrónico INFOLAB para hacer el análisis estadístico. 1 545 pacientes en total fueron separados por sexo, grupo etario y resultado de amplificación de ADN-VPH (positivo o negativo).
La distribución de los genotipos se realizó para los genotipos de VPH-AR: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68. Así como también para VPH-BR: 6, 11, 40, 43, 44, 54, 70 y 74.
RESULTADOS
Se procesaron en total 1 545 muestras de pacientes, 1 068 (69,1 %) fueron de sexo femenino y 477 (30,9.%) de sexo masculino.
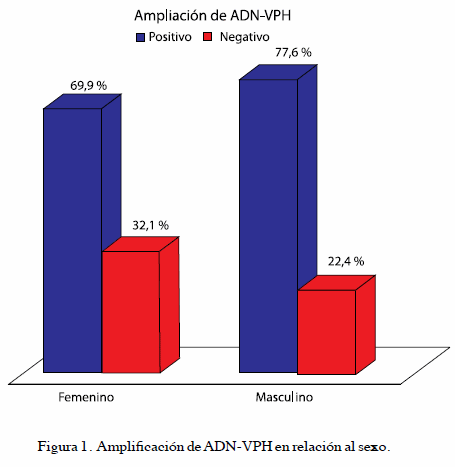
En cuanto a detección de ADN-VPH se encontró que en pacientes del sexo masculino el porcentaje de positividad fue de 77,6 % (370/477), mientras que en el caso de las pacientes de sexo femenino fue de 67.9 % (725/1 068) (Figura 1).
Del porcentaje de positividad para el sexo femenino 533/1 068 correspondió a infecciones únicas (por un solo genotipo de VPH) mientras que 192/1 068 correspondió a infecciones múltiples (por 2 o más genotipos de VPH).
En el caso del sexo masculino esta relación se mantiene similar con 252/477 de infecciones únicas y 118/477 de infecciones múltiples.
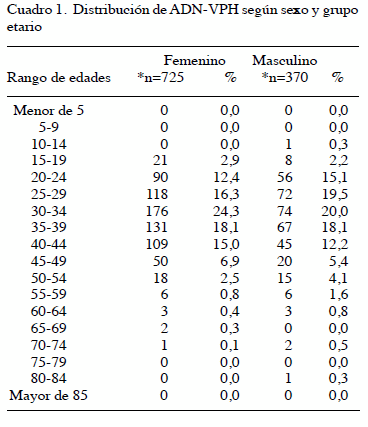
Se realizó la distribución por grupo etario según el sexo de resultados positivos (Cuadro 1). Para el sexo femenino el grupo etario con mayor positividad para ADN-VPH es el comprendido entre los 30 a 34 años de edad (24,3 %) al igual que para el sexo masculino (20,0 %).
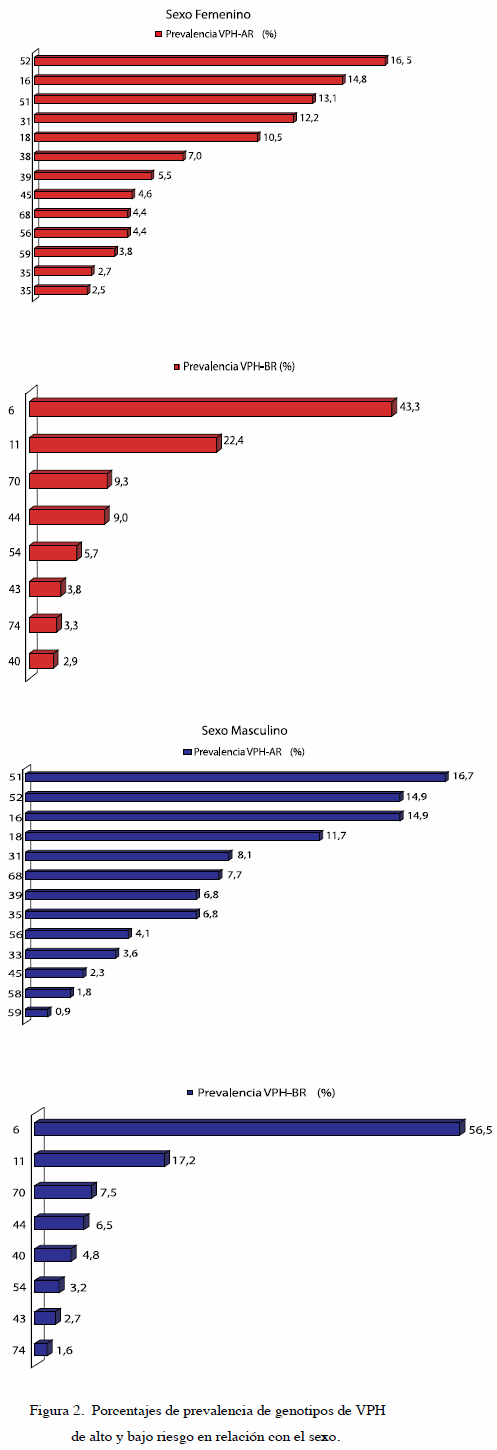
En cuanto a la distribución de los genotipos de VPH detectados, en el sexo femenino 50,6 % de los genotipos identificados correspondieron a VPHAR, 22,4 % a VPH-BR mientras que 27,0 % a otros genotipos (genotipos detectados n=937). En el sexo masculino 41,3 % corresponde a VPH-AR, 34,6 % VPH-BR y solo un 24,2 % a otros genotipos (genotipos detectados n=538).
Los genotipos de AR en el sexo femenino más comunes son el VPH-52 (78/477) VPH-16 (70/477) y VPH-51 (62/477). En el sexo masculino VPH- 51(37/222), VPH-52 (33/222) y el VPH-16 (33/222) (Figura 2).
En cuanto a genotipos de VPH-BR en ambos sexos los dos genotipos más comunes fueron VPH- 6 (mujeres: 91/210; hombres: 105/186) y VPH-11 (mujeres: 47/210; hombres: 32/186) (Figura 2).
DISCUSIÓN
Este estudio permitió estimar la magnitud y distribución de los genotipos de VPH en la población estudiada. Se observaron similitudes en cuanto a porcentaje de positividad ADN-VPH entre ambos sexos, estudios señalan que la prevalencia de VPH tiende a ser similar entre hombres y mujeres (eso es, entre un 3 % y 40 %, dependiendo de la población y el grupo de edad considerado) (13).
La distribución por edad de la infección por VPH y sus genotipos ha sido variable en regiones del mundo y aún en diferentes grupos de una misma área geográfica (14). En este estudio se determinó que en ambos sexos se presenta un predominio de positividad en las edades comprendidas entre los 30-34 años mientras que un segundo pico de positividad lo encontramos entre los 35-39 años en mujeres y 25-29 años en hombres. Está descrito que el VPH es más común en mujeres jóvenes sexualmente activas de 18 a 30 años de edad, después de los 30 años decrece la prevalencia, sin embargo, el cáncer de cérvix es más común después de los 35 años, lo que sugiere infección a temprana edad y progresión lenta del cáncer (15).
Los genotipos de VPH-AR son los de mayor prevalencia en ambos sexos superando el 40 % en ambos casos, resultado compatible con estadísticas que señalan que la incidencia de infección con tipos virales oncogénicos parece ser más alta que aquella con tipos virales no oncogénicos (15). La distribución de genotipos VPH-AR es diferente a la citada en la literatura, la cual señala, en su mayoría, que el genotipo de mayor prevalencia en Venezuela es el VPH-16 (16). Así también, a pesar de no tener data registrada acerca de nuestro país, la Organización Mundial de la Salud señala que en Suramérica el genotipo más común detectado en muestras de cérvix es VPH-16 (5). Sin embargo, para esta población el comportamiento no es igual. Si bien el VPH-16 se encuentra en los primeros lugares, resulta interesante que el mismo sea superado por genotipos como el VPH-52 y VPH-51, los cuales no han sido señalados de alta prevalencia en nuestro país. ¿A caso otros genotipos de VPH están empezando a tener mayor distribución en la población sexualmente activa?, pregunta particularmente importante tomando en cuenta el desarrollo de vacunas que protegen contra determinados genotipos de VPH.
En el caso del VPH-BR los genotipos predominantes para ambos sexos fueron VPH-6 y VPH-11. Consistente con estos datos, otros autores han referido un patrón epidemiológico de distribución similar (9,14).
Dos vacunas se encuentran actualmente aprobadas para la distribución general; una bivalente, que protege contra VPH-16 y VPH-18, y una cuadrivalente, que protege contra los genotipos VPH-6, VPH-11, VPH-16 y VPH-18. (17). La eficacia de la vacuna cuadrivalente se ha estudiado principalmente en mujeres jóvenes (de 16 a 26 años de edad) que no han estado expuestas anteriormente a los tipos de VPH específicos contra los cuales está dirigida la vacuna. Estos estudios clínicos indicaron una eficacia de la vacuna de cerca del 100 % en la prevención de precánceres de cuello uterino, de vulva y de vagina, así como de verrugas genitales, afecciones causadas por los cuatro tipos de virus contra los que protege la vacuna (18).
Tomando en cuenta los resultados de este estudio para VPH-AR, estas vacunas no cubrirían los genotipos con mayor distribución entre hombres y mujeres. Esto nos lleva a otra interrogante ¿Es acaso necesario el desarrollo de nuevas vacunas que incluyan una mayor gama de genotipos de AR?. Es necesaria la elaboración de estudios epidemiológicos a mayor escala en los cuales se cuente con información detallada de la condición del paciente y sus manifestaciones clínicas para conocer el comportamiento de estos genotipos predominantes y el impacto que puedan generar estas vacunas sobre las pacientes afectadas.
En nuestro país el uso de la vacuna todavía está en estudio por parte de las autoridades sanitarias, según este trabajo, se considera fundamental incluir dicha vacuna en el esquema de vacunación nacional, tomando en cuenta la experiencia positiva que han tenido otros países con su uso (19-21), en nuestro país se disminuirían considerablemente las infecciones por VPH tanto por los genotipos de VPH-AR y VPH-BR, logrando un máximo costo-beneficio si los programas de vacunación se enfocan de la manera adecuada.
CONCLUSIONES
El cáncer cervical es un problema de salud pública en nuestro país. La pesquisa citológica para determinar la prevalencia y detección de las lesiones preinvasoras del cáncer de cuello uterino no han sido suficiente efectivas. De allí que sugerimos el uso de pruebas complementarias más sensibles, como aquellas que detectan el ADN-VPH y sus genotipos, tanto en la mujer como en el hombre. Ello aportaría información valiosa que permitiría detectar y eliminar esas lesiones preinvasoras y por ende, disminuiría considerablemente la elevada morbimortalidad por dicho cáncer.
En nuestro estudio, a diferencia de otros, la prevalencia de genotipos de VPH-AR 51 y 52, además de los 16 y 18, presenta información valiosa que señala la importancia de incluirlos en las vacunas para proteger del VPH oncogénico a las mujeres venezolanas.
Es necesario evaluar el esquema de vacunación en conjunto con otras estrategias de prevención, realizando un análisis identificando las debilidades y fortalezas, con la finalidad de establecer programas de prevención óptimos.
Agradecimientos: a la dirección del Laboratorio Avilab C.A., por apoyar las actividades científicas del Departamento de Biología y Diagnóstico Molecular.
REFERENCIAS
1. Center for Disease Control and Prevention. Virus del papiloma humano: Información sobre el VPH para los médicos. 2007. [ Links ]
2. Castle P. The potential utility of HPV genotyping in screening and clinical management. JNCCN 2008;6:83-95. [ Links ]
3. Valdivia I, Aguayo F, Pruyas M, Snijders P, Corvalán A, Ferreccio C. Genotipos de virus papiloma humano (VPH) en pacientes con cáncer cervico-uterino en un hospital público y una clínica privada de Santiago, Chile. Rev Chil Infect. 2010;27:11-16. [ Links ]
4. García A, Berumen J, Jiménez R, Escobedo A, Cruz O. Utilidad de las técnicas de biología molecular en el virus del papiloma humano. Gamo 2006;5(4):109- 110. [ Links ]
5. WHO/ICO Information Centre on HPV and Cervical Cancer (HPV Information Centre). Human Papillomavirus and Related Cancers in Venezuela. Summary Report 2010. Disponible en: www.who.int/hpvcentre [ Links ]
6. Bosch F, De Sanjose S. Chapter 1: Human papilloma virus and cervical cancer burden and assessment of causality. J Natl Cancer Inst Monogr. 2003;3:3-13. [ Links ]
7. Del Pazo R, Lukaszuk B, Leite M, Iribas J. Deteccion de la infección por virus papiloma humano en hombres. Penescopía como método de cribado. Rev Argent Dermatol. 2008;89:146-152. [ Links ]
8. ACOG Practice Bulletin No. 61. Human Papilloma virus. Clinical Management Guidelines for Obstetrician-Gynecologists. 2005. [ Links ]
9. Somogyi L, Malpica C, Alvarado B, García M. Virus del papiloma humano (VPH) detección y tipificación en la consulta privada. Rev Obstet Ginecol Venez. 2010;70(3):160-166. [ Links ]
10. Asociación de microbiología y salud. Primera Reunión: Infección por Papiloma Humano. Bilbao. 2005. [ Links ]
11. Innogenetics® INNO LIPA Genotyping V2 User Guide Manual. [ Links ]
12. Innogenetics® INNO LIPA Genotyping EXTRA User Guide Manual. [ Links ]
13. Aguilar L, Lazcano-Ponce E, Vaccarella S, Cruz A, Hernández P, Smith J S, et al. Human papillomavirus in men: Comparison of different genital sites. Sex Transm Infect. 2006;82:31-33. [ Links ]
14. Contreras L, Correnti M, Avila M, Guerrero A, León A. Virus Papiloma Humano (VPH) en contexto ecológico venezolano. (I): diagnóstico citológico y molecular. Salud online. 2008;12(3):68-77. [ Links ]
15. López A, Lizano M. Cáncer cérvicouterino y el virus del papiloma humano. Cancerología. 2006;1:31-55. [ Links ]
16. Cavazza M, Correnti M. Actualidades sobre el Virus del Papiloma Humano. Dermatología Iberoamericana Online. 2011; Capítulo 60. [ Links ]
17. Instituto Nacional del Cáncer. Vacunas contra los virus del papiloma humano. Disponible en: http://www.cancer.gov/espanol/cancer/hojasinformativas/vacuna-VPH [ Links ]
18. Centro para el Control y la Prevención de Enfermedades (CDC). Vacuna contra el VPH Información para los médicos. Disponible en: http://www.cdc.gov/std/spanish/STDFact-HPV-Vaccine-HCP-s.htm#vaccrec [ Links ]
19. Altamonte M, Murillo R, Sánchez GI, Jerónimo J, Salmerón J, Ferreccio C, et al. Nuevos paradigmas y desafíos en la prevención y control del cáncer de cuello uterino en America Latina. Salud Pública Mex. 2010;52:544-559. [ Links ]
20. McIntyre PB, Brotherton JM, Burgess MA, Kemp AS. More data from Australia on sensitivity to HPV vaccine. BMJ. 2009;338:b26. [ Links ]
21. Lexchin J, Arya N, Singh S. Gardasil® – The new HPV vaccine: The right product, the right time: A commentary. Healthc Policy. 2010;5:26-36. [ Links ]