Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.73 no.4 Caracas dic. 2013
Micropartículas en el embarazo y la preeclampsia
Drs. Eduardo Reyna-Villasmil, Joel Santos-Bolívar, Ismael Suárez-Torres
Servicio de Obstetricia y Ginecología. Hospital Central Dr. Urquinaona. Maracaibo. Estado Zulia, Venezuela.
Correspondencia a: Hospital Central Dr. Urquinaona Final Av. El Milagro. Maracaibo, Estado Zulia. Venezuela. Teléfono: 0416-2605233. E-mail: sippenbauch@gmail.com
INTRODUCCIÓN
En los organismos multicelulares, la homeostasis se produce del sutil balance entre la proliferación y la muerte celular. Las células se diferencian, cumplen sus funciones particulares y posteriormente sufren una muerte programada y son eliminadas por fagocitosis. En cada estadio de su vida, las células están sujetas a una variedad de estímulos que llevan a la liberación de fragmentos microscópicos generados de la membrana celular, generalmente conocidos como micropartículas (MP) o microvesículas (1).
Las MP secuestran los componentes y contenidos citoplasmáticos y sobreviven a las células (Figura 1).
Debido a la plasticidad de la organización de las membranas plasmáticas en diferentes dominios, conocidos como diferentes tipos de lípidos y lipoproteínas segregadas a un estímulo dado ejercen una respuesta única en una forma inclusiva o exclusiva. Esto explica como las MP de una misma célula de origen pueden tener diferentes proteínas y composición lipídica. Tales fragmentos son interpretados en la comunicación intercelular y participan en el mantenimiento de la homeostasis bajo condiciones fisiológicas, o pueden iniciar los procesos deletéreos en caso de exceso o cuando transportan constituyentes patogénicos. Las MP pueden ser consideradas como un grupo de efectores bioactivos almacenados en forma diseminada (2).
Las MP que se pliegan en los fluidos corporales, bajo condiciones fisiológicas y patológicas. Generalmente miden 100 nm de diámetro y varían con respecto a su origen celular, tamaño, propiedades antigénicas y contenido de muchas proteínas y lípidos de las membranas y citoplasma de las células de origen (2,3). En general las más grandes son fragmentos necróticos. Las de tamaño intermedio son aquellas formadas directamente de la separación de las membranas celulares después de la activación o la apoptosis. En ocasiones son llamadas ectosomas (4) para diferenciarlos de los exosomas más pequeños (30 – 100 nm) (5), las cuales son originadas de los cuerpos multi-vesiculares intracelulares, cuando se fusionan con la membrana plasmática. Por lo que las MP son consideradas como ectosomas.
Las MP fueron las primeras en ser identificadas por la presencia de actividad similar a estas en el suero y posteriormente visualizadas directamente por microscopia electrónica (6). En la circulación, pueden originarse no solo de las plaquetas sino también de los eritrocitos, granulocitos, leucocitos y endotelio (3). Existen varios reportes de MP de células dendríticas circulantes en forma de exosomas.
MECANISMOS QUE CONTROLAN LA REMODELACIÓN DE LA MEMBRANA PLASMÁTICA
Cada una de las hojas de la bicapa de la membrana tiene una composición lipídica específica. Los aminofosfolípidos (fosfatidilserina y fosfatidiletanolamina) son componentes específicos de la hoja interna, mientras que la fosfatidilcolina y la esfingomielina están presentes en la capa externa. La distribución lipídica a través de la bicapa está bajo control de tres elementos principales: una bomba dirigida al interior, una enzima específica para la fosfatidilserina y fosfatidiletanolamina, conocida como translocasa de aminofosfolípidos una bomba dirigida hacia el exterior conocida como flopasa y una enzima que combina los lípidos y promueve la redistribución bidireccional inespecífica a través de la bicapa (7).
Un incremento sostenido y significativo del calcio citosólico que acompaña a la estimulación celular puede llevar al colapso y asimetría de la membrana al estimular la actividad de las enzimas. El cambio más prominente en la distribución lipídica es la exposición superficial de la fosfatidilserina, seguido por la liberación de MP, lo cual se logra por la degradación del cito-esqueleto por una proteólisis dependiente del calcio. Sin embargo, las MP pueden ser producidas en situaciones de menos control y una proporción de MP circulantes probablemente se originan de células necróticas más allá de la pérdida de la integridad de las membranas o de la destrucción mecánica de las células luego de la lesión.
Se puede pensar que la fosfatidilserina da origen a tales MP debido a que se pierde la asimetría en la distribución de fosfolípidos. Una vez accesible, tanto en la superficie de la célula como la de la micropartícula, la fosfatidilserina sirve al menos para dos funciones fisiológicas importantes: promueve la coagulación sanguínea y constituye una señal de depuración para las células agonizantes para el tejido retículo-endotelial. Aunque los elementos para la externalización pueden ser los mismos en ambas situaciones, los mecanismos reguladores son probablemente diferentes. La redistribución de la fosfatidilserina transmembrana ocurre en procesos apoptoicos (8). Por lo tanto, la remodelación de las membranas y la formación de MP parecen ser un proceso fundamental, probablemente compartido por todos los tipos de células, lo cual ha sido interpretado como diferentes estadios de evolución de los organismos multicelulares, por ejemplo en el proceso de fagocitosis y las funciones de coagulación.
Se pueden considerar nuevas funciones de la los receptores reportados en forma más reciente tienen funciones inesperadas en el desarrollo como importantes genes que promueven la diferenciación (9).
MECANISMO DE FORMACIÓN
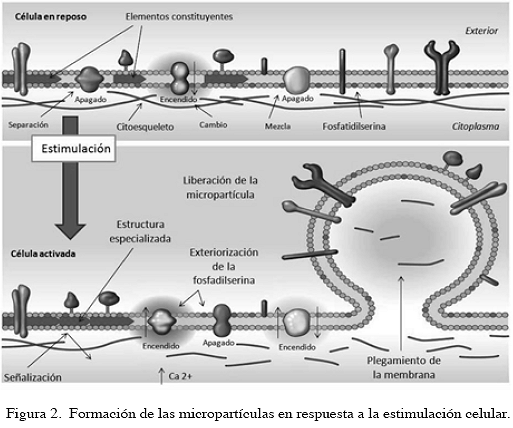
Las células cultivadas producen MP, un proceso que es estimulado por diferentes eventos, incluyendo estímulos inflamatorios o ingreso de calcio y es dependiente de la calpaina (10). Los estímulos inflamatorios incluyen citosinas como el factor de necrosis tumoral alfa (TNF-alfa) o interleucina (IL)-1beta o agentes de laboratorio como esteres de forbol, ionomicina o complemente C5a activado (11). Un evento clave temprano es la reorganización de la asimetría de los lípidos de la membrana plasmática, con exteorización de la fosfatidil serina. Los lípidos, el colesterol y las proteínas están concentrados donde se invagina la membrana por lo que las MP son ricas en colesterol y proteínas. La quelación del calcio inhibe la apoptosis y la generación de MP. La calpaina es una de las proteínas más importantes y tiene varias acciones en la generación de MP incluyendo la separación de los filamentos de cito-esqueleto, facilitación del plegamiento de MP y activación de la apoptosis a través de la procapsasa-3 (Figura 2). Diferentes mecanismos pueden contribuir al proceso de formación de MP en vías celulares específicas y el tipo puede cambiar dependiendo de cómo su producción es estimulada (12). Por ejemplo, los exosomas son producidos por mecanismos diferentes a las MP pero también responden a la activación celular (5). Tanto MP como exosomas son considerados que suministran rutas no convencionales para la secreción de proteínas (13).
EXOSOMAS
Los exosomas fueron inicialmente descritos hace más de 25 años. Son más pequeñas que las MP y formadas por la secreción de los contenidos de los cuerpos multi-vesiculares citoplasmáticos. Como las MP, son ricas en lípidos, poseen moléculas características de las células de origen y contienen algunos de sus componentes citoplasmáticos. Sin embargo, algunas proteínas de más membranas plasmáticas son excluidas y algunas, como las tetraspaninas, las cuales contribuyen a la organización de grandes complejos moleculares y sub-dominios de membranas, que se piensan que están enriquecidas. Los exosomas no contienen proteínas mitocondriales, retículo endoplásmico o aparato de Golgi. Las proteínas exosómicas incluyen aquellas encontradas en el citosol, la membrana de los compartimientos endocíticos o en la membrana plasmática. Otros marcadores incluyen anexinas, integrinas y moléculas de adhesión. La presencia de antígenos de histocompatibilidad I y II suministra a los exosomas sus capacidades antigénicas (14).
FUNCIONES BIOLÓGICAS
Las MP derivadas de las células intra-vasculares circulan en hombres y mujeres sanos (15). Las MP y los exosomas intervienen en la comunicación célula-célula, con muchos papeles potenciales en la hemostasis, trombosis, inflamación y angiogénesis. Pueden transferir moléculas bio-activas a otras células o MP, las cuales pueden contener ARN mensajero, factores de transcripción al igual que los agentes infecciosos (3). Originalmente su actividad procoagulante fue la más intensamente estudiada. En la actualidad, la capacidad de los exosomas para estimular la inmunidad a las células tumorales es el centro de la investigación.
MICROPARTÍCULAS EN LA COMUNICACIÓN INTERCELULAR.
TRANSFERENCIAS DE ANTÍGENOS E INTERCAMBIO INTERCELULAR.
Varios estudios han señalado la capacidad de las MP de inducir estimulación celular. Las MP derivadas de leucocitos activan las células endoteliales o transfieren antígenos de los leucocitos a las células epiteliales. La captación pasiva de fenotipos de leucocitos está asociada a cambios en la fosforilización de las proteínas celulares y las propiedades de adhesión célula-célula (16). Las MP derivadas de las plaquetas modulan las interacciones entre los monocitos y las células endoteliales y estimulan la proliferación, supervivencia, adhesión y quimiotaxis de las células hematopoyéticas y potencian la liberación de células progenitoras hematopoyéticas (17).
Las MP pueden conducir al ligando Fas para convertir la superficie celular en una configuración bio-activa que produce un mecanismo de señales de largo rango que dirigen la apoptosis (18). También pueden ser utilizadas para dirigir la morfogénesis en los tejidos en desarrollo. Estas MP en particular, derivadas de la membrana basal de las células han sido denominadas argosomas (19). También se ha descrito que las MP generadas de las células T apoptoicas son capaces de inducir diferenciación de las células hematopoyéticas pluripotenciales hacia la línea de los megacariocitos. Estos estudios demuestran que pueden ser vectores eficientes de información biológica de un tipo celular a otro en tejidos próximos o remotos.
MICROPARTÍCULAS Y FUNCIÓN VASCULAR
En condiciones patológicas asociadas al daño vascular como el infarto del miocardio o la preeclampsia, se ha demostrado que las MP del plasma de estos pacientes causan daños en arterias aisladas (20).
Se ha observado que las MP de las células T apoptoicas inducen disfunción endotelial tanto en los vasos de resistencia como de conductancia por alteraciones en las vías del óxido nítrico y prostaciclina. Además, las MP circulantes de los pacientes diabéticos inducen disfunción endotelial y disminución de la expresión de la sintetasa de óxido nítrico (21). Estos datos explican el papel paracrino de las MP como vectores de efectores bioactivos que promueven la disfunción vascular a través de intercambios trans-celulares durante las enfermedades inflamatorias. La disfunción del óxido nítrico endotelial no se ha reportado en todos los estudios (22), pero todos comparten las conclusiones que las MP alteran la función endotelial (23). Las diferencias pueden originarse de las diferencias cuantitativas o cualitativas.
Estos estudios contribuyen a una mayor comprensión de los efectos negativos del aumento en las concentraciones circulantes de MP observados en los desórdenes cardiovasculares o inmunes. Se ha propuesto que las MP de las células endoteliales alteran la función endotelial al alterar el balance reducción – oxidación (23).
MICROPARTÍCULAS EN LA ANGIOGÉNESIS
Las MP que se originan de las células tumorales estimulan la producción de metástasis a través de la neovascularización in vivo. La esfingomielina parece ser el componente activo responsable del potencial pro-angiogénico al estimular la migración, invasión y formación de túbulos por las células endoteliales. Algunas metaloproteinasas de la matriz presentes en las MP derivadas del endotelio y las plaquetas han demostrado ser potentes estimuladores angiogénicos in vitro (24).
El factor tisular (FT), el principal iniciador de la coagulación sanguínea, sirve como un regulador de la angiogénesis, crecimiento tumoral y producción de metástasis (25). El FT es el mediador de la regulación del factor de crecimiento vascular endotelial, y las MP expresan el FT en su superficie pueden de esa forma actuar en las células endoteliales para promover la formación de vasos. Se ha observado que esas MP circulan in vivo (26), pero su actividad pro-angiogénica aún debe ser bien establecida, especialmente en el contexto en el cual la actividad de señalización del FT parece estar asociado a su dominio citoplasmático, el cual probablemente está secuestrado dentro de la micropartícula (27).
MICROPARTÍCULAS, TROMBOSIS E INFLAMACIÓN
Las alteraciones patológicas llevan a variaciones en la naturaleza y proporción de las MP circulantes (tanto en aspectos cualitativos como cuantitativos) y quizás a un aumento en el número de MP procoagulantes, lo que resultaría en un incremento en la probabilidad de aparición de eventos trombóticos.
Se han descrito concentraciones elevadas en varios desórdenes caracterizados por complicaciones trombóticas y en forma particular en las enfermedades cardiovasculares (28).
El papel de las MP en la inflamación está bien documentado. Se ha descrito la asociación entre la presencia de IL-1beta y MP (como fuente de substratos aminofosfolipídicos) para la fosfolipasa secretora A2 en la generación de ácido lisofosfatídico, un potente mediador pro-inflamatorio y agonista plaquetario. Las MP han demostrado favorecer la activación endotelial y las interacciones monocito-endotelio, los dos pasos iniciales para la formación de la placa aterosclerótica (29). Aquellas derivadas de elementos sanguíneos pueden estimular la liberación de citosinas de las células endoteliales y aumentar la expresión de FT en la superficie. Las MP plaquetarias también aumentan la expresión de las moléculas de adhesión en las células monocíticas y endoteliales e induce la producción de IL-8, IL-1beta e IL-6 en las células endoteliales (30).
MICROPARTÍCULAS Y RESPUESTA INFLAMATORIA SISTÉMICA
Reportes previos han resumido la evidencia de una respuesta inflamatoria sistémica tanto en el embarazo normal y patológico (31) y enfatizado el papel de la red de inflamación intravascular que compromete no solo los leucocitos inflamatorios, sino también el endotelio, sistema de coagulación, respuesta de fase aguda y complemento (32). La activación endotelial es el factor común que subyace la inflamación sistémica asociada con las enfermedades vasculares como hipertensión crónica, obesidad, diabetes y sepsis. El síndrome metabólico (hipertensión, obesidad e insulinorresistencia) está fuertemente asociado con un incremento de las MP endoteliales circulantes, que tienen las características que se originan más de la apoptosis que de la activación. La inflamación sistémica está generalmente asociada con un incremento de las MP circulantes (33). El embarazo normal y la preeclampsia, los cuales también involucran inflamación sistémica, son similares en este sentido (34).
MICROPARTÍCULAS EN EL EMBARAZO NORMAL
La mayoría de las MP se derivan de las plaquetas (97 %-99 %). La fracción derivada de las plaquetas en la población total es de 1,5 % – 3 %. Un fracción menor (0,6 %-2,7 %) se originan de los eritrocitos. El número derivado de leucocitos es bajo y el 0,4.% – 1,0 % de las MP se originan de las células endoteliales (35).
El número máximo de MP se observan a las 28 semanas de gestación. Se ha descrito un incremento del valor absoluto de MP placentarias durante el embarazo, llegando a su nivel máximo a las 36 semanas, lo cual es debido al aumento del volumen placentario (35). La disminución inicial observada en la concentración durante el embarazo normal puede ser explicada por el incremento del volumen circulante que se produce al inicio del embarazo y por la presencia de pequeños números de células activadas en sangre materna comparada con edades gestacionales mayores (36).
MICROPARTÍCULAS Y PREECLAMPSIA
El concepto que la preeclampsia es una enfermedad del endotelio materno y del modelo de dos oleadas en la preeclampsia son básicos (37-39). Con respecto a esto último, los orígenes placentarios en la preeclampsia son potenciados por una condición sobre impuesta a la habitual (segunda fase) o antes de la aparición clínica con alteración de la placentación (primera fase).
La segunda fase de la preeclampsia es más que una disfunción endotelial debido a que los leucocitos inflamatorios están activados (40). Tales cambios están bien establecidos en el tercer trimestre del embarazo normal, aumentado en los estados de inflamación sistémica, la que está aún más exacerbada en la preeclampsia (40,41). Varios reportes han demostrado que todos los componentes de la red inflamatoria intra-vascular contribuyen a la respuesta tanto en el embarazo normal y, en un mayor grado, en la preeclampsia (32). De tal forma, al igual que en personas no embarazadas con inflamación sistémica, es de esperar que en la preeclampsia, exista un aumento en la liberación de MP de las células intravasculares (34,42).
CONCENTRACIONES DE MICROPARTÍ- CULAS EN LA PREECLAMPSIA
No existe un consenso en la literatura con relación a las concentraciones de MP o subpoblaciones de estas en la preeclampsia (15). Estas diferencias son debidas a la selección de pacientes, diferencias metodológicas y variaciones intra-individuales. Más aún, debido a que la preeclampsia es una enfermedad heterogénea y los síntomas pueden variar de embarazadas asintomáticas a críticas. En dos estudios previos se demostró que el número de MP plaquetarias y endoteliales estaban aumentadas en la preeclampsia (43,44). Las diferencias en la selección de las pacientes pueden complicar la comparación de los datos entre los investigadores. Otro factor que complica la interpretación de las concentraciones de MP en la preeclampsia son los cambios hemodinámicos que ocurren. En contraste con la hemodilución fisiológica que se observa en el embarazo, en la preeclampsia ocurre hemoconcentración debido a la salida de líquido al espacio extravascular. Más aún, las plaquetas son activadas y disminuyen en cantidad, se activan los leucocitos y ocurre lisis de los eritrocitos. Todos estos factores contribuyen a las alteraciones de las concentraciones de MP y sus sub-poblaciones. A pesar de las limitaciones, especialmente en la cuantificación de las sub-poblaciones o características de las MP circulantes parecen tener igual relevancia que las concentraciones totales.
Aunque el papel biológico o fisiopatológico de los cambios en las concentraciones circulantes de MP no está claro, probablemente reflejan los cambios en las células de origen. Por ejemplo, las elevadas concentraciones de MP plaquetarias en la preeclampsia reflejan la activación plaquetaria (42), lo cual es apoyado por la literatura (45). Las elevadas concentraciones de MP derivadas de los eritrocitos en la preeclampsia refleja la hemolisis o hemoconcentración y el aumento en el número de MP derivadas de leucocitos pueden indicar activación celular. Aunque las derivadas de las células endoteliales se han asociado con activación o disfunción endotelial (23,46), los hallazgos no son concluyentes sobre las concentraciones de MP derivadas del endotelio en las muestras plasmáticas de las preeclámpticas y las embarazadas normales (47). Aquellas derivadas de la placenta, las cuales constituyen una pequeña fracción del número total de MP circulantes en la sangre materna, están significativamente elevadas en la preeclampsia cuando se comparan con las embarazadas normales (48). En contraste, estas no se incrementan en la preeclampsia de aparición tardía o en la restricción del crecimiento intrauterino del feto (49). Los incrementos dependientes de la edad gestacional en el número de MP derivadas de la placenta reflejan probablemente un incremento del volumen placentario con una mayor cantidad de células trofoblásticas generando MP (35,48). En forma alternativa, la hipoxia y posterior apoptosis pueden afectar la liberación de tales MP en la preeclampsia.
FUNCIONES DE LAS MICROPARTÍCULAS EN LA PREECLAMPSIA
Las MP pueden modular la disfunción endotelial, inflamación, hemostasia y angiogénesis. También se debe mencionar que la mayoría de sus efectos han sido establecidos in vitro usando fracciones aisladas de MP. Si ejercen o no tales funciones in vivo, sin embargo, es solo parcialmente conocido.
DISFUNCIÓN ENDOTELIAL
Varias investigaciones han sugerido que las subpoblaciones de MP pueden (en forma diferencial) afectar la función endotelial. Meziani y col. (50) demostraron que la incubación de arterias del epiplón humano y aortas de ratón con MP plaquetarias produce la liberación de metabolitos vasoactivos del óxido nítrico, mientras que la incubación con MP derivadas de leucocitos estimulan no solo la liberación de óxido nítrico, sino también la liberación de metabolitos vasoconstrictores derivados de la ciclooxigenasa 2. El efecto general de las MP aisladas en las muestras de plasma sobre el endotelio es probable que sea un sutil balance entre varios efectos agonistas y antagonistas de varias poblaciones de MP presentes en tales muestras. Se ha demostrado que las fracciones aisladas en el plasma de las preeclámpticas alteran la dilatación dependiente del endotelio en arterias de resistencia aisladas (20,50). Por otra parte, las MP de las preeclámpticas inducen hiporreactividad vascular en arterias de ratón y humanas.
INFLAMACIÓN
La inflamación puede estar detrás de los efectos vasculares de las MP (50). Estas contienen plasma de las preeclámpticas que inducen activación endotelial en presencia de monocitos, y el plasma de las embarazadas y las preeclámpticas incrementan la exposición de la molécula de adhesión intercelular 1 a los monocitos y células endoteliales en cultivo comparado con el plasma de los controles no embarazados (51). Además, las MP de las preeclámpticas activan las células endoteliales en presencia de monocitos.
Aunque los granulocitos representan cerca del 75.% de los leucocitos en el embarazo, el porcentaje de MP derivadas de los granulocitos es solo de 17.%-25.%, sugiriendo que la subpoblación muestra diferentes tasa de liberación y/o remoción de la circulación (52). Las MP derivadas de los monocitos pueden afectar otras células activando la producción de citosinas. Estas también activan la expresión y producción de FT y factor de von Willebrand por las células endoteliales in vitro (53). Debido a que los monocitos y las MP derivadas de los monocitos constituyen una fracción relativamente menor de la población total de leucocitos y MP, respectivamente, sus efectos directos pueden ser enmascarados por otras poblaciones más prominentes de células y MP.
Las MP derivadas de las células T supresoras (CTS) están aumentadas en la preeclampsia comparado con los controles no embarazados, sugiriendo la activación de las CTS (34). Estas pueden disparar la expresión y producción de IL-1beta y el antagonista del receptor de IL-1 por los monocitos in vitro (54). Aunque se desconoce si las MP derivadas de las CTS se une a los monocitos in vivo, se ha reportado el aumento de la expresión de IL-1beta y el antagonista del receptor de IL-1 en leucocitos de preeclámpticas (42). También las MP derivadas de la placenta pueden unirse a los monocitos, activando la expresión y producción de citosinas pro-inflamatorias.
La activación del complemento puede ser parte de la respuesta inflamatoria sistémica en la preeclampsia. La proteína C reactiva (PCR) es una molécula activadora del complemento, que se une a la fosfatidilcolina presente en la superficie de las MP. La PCR expuesta en la superficie activa el sistema de complemento (55). Se debe determinar el papel biológico de las MP con PCR en su superficie, pero estas probablemente contribuyen al fenotipo proinflamatorio de la preeclampsia.
COAGULACIÓN
Las MP pueden contribuir en la preeclampsia a potenciar la activación de la coagulación que ya ocurre en el embarazo normal. Las plaquetas se adhieren al endotelio dañado, se activan y forma un tapón plaquetario. Las plaquetas activadas pueden contener FT e iniciar la coagulación (56). Existe evidencia que las MP contribuyen a la coagulación in vivo, ya que generan trombina in vitro (57). El hecho que las MP estén disminuidas en varios desórdenes hemorrágicos severos enfatiza el importante papel de estas en la coagulación (58).
ANGIOGÉNESIS
Se ha demostrado un efecto pro-angiogénicos de las MP plaquetarias in vitro (59). En contraste, las MP derivadas del endotelio alteran la angiogénesis (60). Es probable que en este aspecto, los efectos generales sean un balance entre las efectos pro y anti-angiogénicos de las diferentes subpoblaciones.
CONCLUSIÓN
En general, los diferentes estudios enfatizan la creciente importancia de las MP en la fisiología de procesos fundamentales para el embarazo normal al igual que su importancia en situaciones patológicas de este. Todas estas investigaciones aportan una interpretación relevante del papel de las MP en la preeclampsia. Los progresos recientes en la comprensión de la organización dinámica de las membranas plasmáticas y la plasticidad de sus respuestas deben suministrar nuevas bases para la identificación de otras funciones biológicas de las MP en el embarazo, la preeclampsia y otras complicaciones del embarazo.
REFERENCIAS
1. Tushuizen ME, Diamant M, Sturk A, Nieuwland R. Cell-derived microparticles in the pathogenesis of cardiovascular disease: Friend or foe? Arterioscler Thromb Vasc Biol. 2011;31:4-9. [ Links ]
2. Hugel B, Martínez MC, Kunzelmann C, Freyssinet JM. Membrane microparticles: Two sides of the coin. Physiology (Bethesda). 2005;20:22-27. [ Links ]
3. Camussi G, Deregibus MC, Bruno S, Cantaluppi V, Biancone L. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney Int. 2010;78:838-848. [ Links ]
4. Eken C, Sadallah S, Martin PJ, Treves S, Schifferli JA. Ectosomes of polymorphonuclear neutrophils activate multiple signaling pathways in macrophages. Immunobiology. 2013;218:382-392. [ Links ]
5. Théry C, Zitvogel L, Amigorena S. Exosomes: Composition, biogenesis and function. Nat Rev Immunol. 2002;2:569-579. [ Links ]
6. Walsh PN. Platelet coagulation-protein interactions. Semin Thromb Hemost. 2004;30:461-471. [ Links ]
7. Daleke DL. Regulation of transbilayer plasma membrane phospholipid asymmetry. J Lipid Res. 2003;44:233-242. [ Links ]
8. Yamaki M, Umehara T, Chimura T, Horikoshi M. Yamaki M, Umehara T, et al. Cell death with predominant apoptotic features in Saccharomyces cerevisiae mediated by deletion of the histone chaperone ASF1/CIA1. Genes Cells. 2001;6:1043- 1054. [ Links ]
9. Böse J, Gruber AD, Helming L, Schiebe S, Wegener I, Hafner M, et al. The phosphatidylserine receptor has essential functions during embryogenesis but not in apoptotic cell removal. J Biol. 2004;3:15. [ Links ]
10. Gwozdz AM, Leung R, Wang H, Bang KW, Packham MA, Freedman J, et al. Calpain inhibition by calpeptin does not prevent APLT activity reduction in PSexposing platelets, but calpeptin has independent pro apoptotic effects. Thromb Haemost. 2010;103:1218- 1227. [ Links ]
11. Prati C, Racadot E, Wendling D. Microparticles and inflammatory joint disease. Joint Bone Spine. 2010;77:496-498. [ Links ]
12. Jimenez JJ, Jy W, Mauro LM, Soderland C, Horstman LL, Ahn YS. Endothelial cells release phenotypically and quantitatively distinct microparticles in activation and apoptosis. Thromb Res. 2003;109:175-180. [ Links ]
13. Nickel W, Seedorf M. Unconventional mechanisms of protein transport to the cell surface of eukaryotic cells. Annu Rev Cell Dev Biol. 2008;24:287-308. [ Links ]
14. André F, Chaput N, Schartz NE, Flament C, Aubert N, Bernard J, et al. Exosomes as potent cell-free peptidebased vaccine. I. Dendritic cell-derived exosomes transfer functional MHC class I/peptide complexes to dendritic cells. J Immunol. 2004;172:2126-2136. [ Links ]
15. Berckmans RJ, Nieuwland R, Böing AN, Romijn FP, Hack CE, Sturk A. Cell-derived microparticles circulate in healthy humans and support low grade thrombin generation. Thromb Haemost. 2001;85:639- 646. [ Links ]
16. Carman CV, Jun CD, Salas A, Springer TA. Endothelial cells proactively form microvilli-like membrane projections upon intercellular adhesion molecule 1 engagement of leukocyte LFA-1. J Immunol. 2003;171:6135-6144. [ Links ]
17. Baj-Krzyworzeka M, Majka M, Pratico D, Ratajczak J, Vilaire G, Kijowski J, et al. Platelet-derived microparticles stimulate proliferation, survival, adhesion, and chemotaxis of hematopoietic cells. Exp Hematol. 2002;30:450-459. [ Links ]
18. Albanese J, Meterissian S, Kontogiannea M, Dubreuil C, Hand A, Sorba S, et al. Biologically active Fas antigen and its cognate ligand are expressed on plasma membrane-derived extracellular vesicles. Blood. 1998;91:3862-3874. [ Links ]
19. Rauch U, Nemerson Y. Circulating tissue factor and thrombosis. Curr Opin Hematol. 2000;7:273-277. [ Links ]
20. Vanwijk MJ, Svedas E, Boer K, Nieuwland R, Vanbavel E, Kublickiene KR. Isolated microparticles, but not whole plasma, from women with preeclampsia impair endothelium-dependent relaxation in isolated myometrial arteries from healthy pregnant women. Am J Obstet Gynecol. 2002;187:1686-1693. [ Links ]
21. Martin S, Tesse A, Hugel B, Martínez MC, Morel O, Freyssinet JM, et al. Shed membrane particles from T lymphocytes impair endothelial function and regulate endothelial protein expression. Circulation. 2004;109:1653-1659. [ Links ]
22. Boulanger CM, Scoazec A, Ebrahimian T, Henry P, Mathieu E, Tedgui A, et al. Circulating microparticles from patients with myocardial infarction cause endothelial dysfunction. Circulation. 2001;104:2649- 2652. [ Links ]
23. Densmore JC, Signorino PR, Ou J, Hatoum OA, Rowe JJ, Shi Y, et al. Endothelium-derived microparticles induce endothelial dysfunction and acute lung injury. Shock. 2006;26:464-471. [ Links ]
24. Freyssinet JM, Toti F. Formation of procoagulant microparticles and properties. Thromb Res. 2010;125(Suppl 1):46-48. [ Links ]
25. Mackman N. Role of tissue factor in hemostasis, thrombosis, and vascular development. Arterioscler Thromb Vasc Biol. 2004;24:1015-1022. [ Links ]
26. Diamant M, Nieuwland R, Pablo RF, Sturk A, Smit JW, Radder JK. Elevated numbers of tissue-factor exposing microparticles correlate with components of the metabolic syndrome in uncomplicated type 2 diabetes mellitus. Circulation. 2002;106:2442-2447. [ Links ]
27. Belting M, Dorrell MI, Sandgren S, Aguilar E, Ahamed J, Dorfleutner A, et al. Regulation of angiogenesis by tissue factor cytoplasmic domain signaling. Nat Med. 2004;10:502-509. [ Links ]
28. Morel O, Morel N, Freyssinet JM, Toti F. Platelet microparticles and vascular cells interactions: A checkpoint between the haemostatic and thrombotic responses. Platelets. 2008;19:9-23. [ Links ]
29. Huber J, Vales A, Mitulovic G, Blumer M, Schmid R, Witztum JL, et al. Oxidized membrane vesicles and blebs from apoptotic cells contain biologically active oxidized phospholipids that induce monocyteendothelial interactions. Arterioscler Thromb Vasc Biol. 2002;22:101-107. [ Links ]
30. Nomura S, Tandon NN, Nakamura T, Cone J, Fukuhara S, Kambayashi J. High-shear-stress-induced activation of platelets and microparticles enhances expression of cell adhesion molecules in THP-1 and endothelial cells. Atherosclerosis. 2001;158:277-287. [ Links ]
31. Redman CW, Sargent IL. Immunology of preeclampsia. Am J Reprod Immunol. 2010;63:534-543. [ Links ]
32. Redman CW, Sargent IL. Placental stress and preeclampsia: A revised view. Placenta. 2009;30(Suppl A):38-42. [ Links ]
33. Piccin A, Murphy WG, Smith OP. Circulating microparticles: Pathophysiology and clinical implications. Blood Rev. 2007;21:157-171. [ Links ]
34. VanWijk MJ, Nieuwland R, Boer K, van der Post JA, VanBavel E, Sturk A. Microparticle subpopulations are increased in preeclampsia: Possible involvement in vascular dysfunction? Am J Obstet Gynecol. 2002;187:450-456. [ Links ]
35. Lok CA, Van Der Post JA, Sargent IL, Hau CM, Sturk A, Boer K, et al. Changes in microparticle numbers and cellular origin during pregnancy and preeclampsia. Hypertens Pregnancy. 2008;27:344-360. [ Links ]
36. Desprez D, Zobairi F, Aucouturier JS, Leymarie F, Freyssinet JM, Grunebaum L, et al. Evolution of circulating procoagulant microparticles during normal pregnancy. Blood Coagul Fibrinolysis. 2008;19:179- 181. [ Links ]
37. Roberts JM, Taylor RN, Musci TJ, Rodgers GM, Hubel CA, McLaughlin MK. Preeclampsia: An endothelial cell disorder. Am J Obstet Gynecol. 1989;161:1200- 1204. [ Links ]
38. Karumanchi SA, Epstein FH. Placental ischemia and soluble fms-like tyrosine kinase 1: Cause or consequence of preeclampsia? Kidney Int. 2007;71:959-961. [ Links ]
39. Reyna-Villasmil E, Briceño-Perez C, Santos-Bolivar J. Alteración de la placentación profunda en la preeclampsia. Rev Obstet Ginecol Venez. 2012;72:269-276. [ Links ]
40. Oggé G, Romero R, Chaiworapongsa T, Gervasi MT, Pacora P, Erez O, et al. Leukocytes of pregnant women with small-for-gestational age neonates have a different phenotypic and metabolic activity from those of women with preeclampsia. J Matern Fetal Neonatal Med. 2010;23:476-487. [ Links ]
41. Reyna-Villasmil E, Briceño-Perez C, Torres-Cepeda D. Inmunología, inflamación y preeclampsia. Rev Obstet Ginecol Venez. 2009;69:97-110. [ Links ]
42. Lok CA, Nieuwland R, Sturk A, Hau CM, Boer K, Vanbavel E, et al. Microparticle-associated P-selectin reflects platelet activation in preeclampsia. Platelets. 2007;18:68-72. [ Links ]
43. Reyna-Villasmil E, Mejia-Montilla J, Reyna-Villasmil N, Torres-Cepeda D, Peña-Paredes E, Santos-Bolívar J, et al. Micropartículas plaquetarias en preeclampsia y eclampsia. Prog Obstet Ginecol. 2010;53:507-512. [ Links ]
44. Reyna-Villasmil E, Mejia-Montilla J, Reyna-Villasmil N, Torres-Cepeda D, Peña-Paredes E, Santos-Bolívar J, et al. Micropartículas endoteliales en preeclampsia y eclampsia. Med Clin (Barc). 2011;136:522-526. [ Links ]
45. Holthe MR, Lyberg T, Staff AC, Berge LN. Leukocyteplatelet interaction in pregnancies complicated with preeclampsia. Platelets. 2005;16:91-97. [ Links ]
46. González-Quintero VH, Smarkusky LP, Jiménez JJ, Mauro LM, Jy W, Hortsman LL, et al. Elevated plasma endothelial microparticles: Preeclampsia versus gestational hypertension. Am J Obstet Gynecol. 2004;191:1418-1424. [ Links ]
47. Toth B, Lok CA, Böing A, Diamant M, van der Post JA, Friese K, et al. Microparticles and exosomes: Impact on normal and complicated pregnancy. Am J Reprod Immunol. 2007;58:389-402. [ Links ]
48. Germain SJ, Sacks GP, Sooranna SR, Sargent IL, Redman CW. Systemic inflammatory priming in normal pregnancy and preeclampsia: The role of circulating syncytiotrophoblast microparticles. J Immunol. 2007;178:5949-5956. [ Links ]
49. Chen Y, Huang Y, Jiang R, Teng Y. Syncytiotrophoblastderived microparticle shedding in early-onset and lateonset severe pre-eclampsia. Int J Gynaecol Obstet. 2012;119:234-238. [ Links ]
50. Meziani F, Tesse A, David E, Martinez MC, Wangesteen R, Schneider F, et al. Shed membrane particles from preeclamptic women generate vascular wall inflammation and blunt vascular contractility. Am J Pathol. 2006;169:1473-1483. [ Links ]
51. Faas MM, van Pampus MG, Anninga ZA, Salomons J, Westra IM, Donker RB, et al. Plasma from preeclamptic women activates endothelial cells via monocyte activation in vitro. J Reprod Immunol. 2010;87:28-38. [ Links ]
52. Matsuo K, Ushioda N, Harman CR, Kimura T. Increased leukocyte distribution in the pre-clinical stage of pre-eclampsia. Int J Gynaecol Obstet. 2007;96:31-32. [ Links ]
53. Mostefai HA, Agouni A, Carusio N, Mastronardi ML, Heymes C, Henrion D, et al. Phosphatidylinositol 3-kinase and xanthine oxidase regulate nitric oxide and reactive oxygen species productions by apoptotic lymphocyte microparticles in endothelial cells. J Immunol. 2008;180:5028-5035. [ Links ]
54. Scanu A, Molnarfi N, Brandt KJ, Gruaz L, Dayer JM, Burger D. Stimulated T cells generate microparticles, which mimic cellular contact activation of human monocytes: Differential regulation of pro- and antiinflammatory cytokine production by high-density lipoproteins. J Leukoc Biol. 2008;83:921-927. [ Links ]
55. Biró E, Lok CA, Hack CE, van der Post JA, Schaap MC, Sturk A, et al. Cell-derived microparticles and complement activation in preeclampsia versus normal pregnancy. Placenta. 2007;28:928-935. [ Links ]
56. Braun OO, Slotta JE, Menger MD, Erlinge D, Thorlacius H. Primary and secondary capture of platelets onto inflamed femoral artery endothelium is dependent on P-selectin and PSGL-1. Eur J Pharmacol. 2008;592:128-132. [ Links ]
57. Berckmans RJ, Nieuwland R, Böing AN, Romijn FP, Hack CE, Sturk A. Cell-derived microparticles circulate in healthy humans and support low grade thrombin generation. Thromb Haemost. 2001;85:639- 646. [ Links ]
58. Sims PJ, Wiedmer T, Esmon CT, Weiss HJ, Shattil SJ. Assembly of the platelet prothrombinase complex is linked to vesiculation of the platelet plasma membrane. Studies in Scott syndrome: An isolated defect in platelet procoagulant activity. J Biol Chem. 1989;264:17049-17057. [ Links ]
59. Brill A, Dashevsky O, Rivo J, Gozal Y, Varon D. Platelet-derived microparticles induce angiogenesis and stimulate post-ischemic revascularization. Cardiovasc Res. 2005;67:30-38. [ Links ]
60. Klinkner DB, Densmore JC, Kaul S, Noll L, Lim HJ, Weihrauch D, et al. Endothelium-derived microparticles inhibit human cardiac valve endothelial cell function. Shock. 2006;25:575-580. [ Links ]