Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.76 no.2 Caracas jun. 2016
Patología tiroidea en el síndrome de ovario poliquístico
Drs. Evelyn Hernández1, Luis Figueroa1, Rita Pizzi1, Liliana Fung1
1 Servicio de Endocrinología y Metabolismo, Hospital Universitario de Caracas. Caracas, Venezuela.
RESUMEN
Objetivo: Determinar la función y ecoestructura tiroidea en pacientes con síndrome de ovario poliquístico, así como la asociación con la resistencia a la insulina.
Métodos: Se determinó función y ecoestructura tiroidea en 64 pacientes con diagnóstico reciente de síndrome de ovario poliquístico, sin tratamiento, divididas en dos grupos de 32 pacientes cada uno según la presencia de resistencia a la insulina, el grupo 1(G1) con HOMA-IR >2,5 y grupo 2 (G2)con HOMA-IR<2,5.
Resultados: Se observó en la función tiroidea, en el G1, 15/32 (46,9 %) pacientes con TSH>2,5 μUI/mL. Para el G2 7/32 (21,9 %) pacientes con TSH>2,5 μUI/mL, (P=0,035). La presencia de AntiTPO positivos se identificó en 11/32 (34,4 %) pacientes del G1 y 6/32 (18,8 %) del G2 (P=0,15), con un total de 53,2 % de enfermedad tiroidea autoinmune identificada de manera independiente a la presencia de resistencia a la insulina. La evaluación ecográfica de la glándula tiroides, reveló la presencia de nódulos en 12/32 (37,6 %) de las pacientes del G1, y 4/32 (12,5 %) del G2 (P= 0,025). Se observó sobrepeso y obesidad en 74,99 % de las pacientes del G1 y 37,49 % del G2 (P= 0,001). Otros parámetros fueron evaluados, como el hirsutismo, el cual se identificó en 96,9 % pacientes del G1, y 62,5 % en el G2 (P=0,002). El índice de andrógenos libres (IAL) fue >3,8 en 20/32 (62,5 %) pacientes del G1 y 14/32 (43,8 %) en el G2 (P=0,13).
Conclusiones: La prevalencia de enfermedad tiroidea autoinmune en síndrome de ovario poliquístico es mayor a la identificada en la población general, las bases moleculares se direccionan a un gen común, sin embargo, esto aun no ha sido bien aclarado. Los efectos de la resistencia a la insulina en síndrome de ovario poliquístico no se limitan a la función ovárica, su relación con valores elevados de TSH y cambios ecográficos de la glándula tiroides, en especial para la presencia de patología nodular, justifica su evaluación para un correcto abordaje terapéutico.
Palabras clave: Síndrome de ovario poliquístico. Función tiroidea. Enfermedad tiroidea autoinmune. Enfermedad nodular tiroidea. Resistencia a la insulina.
SUMMARY
Objective: The purpose of this study was to determine thyroid function and echostructure in policystic ovary syndrome, as well as the association of these with insulin resistance.
Methods: Echostructure and thyroid function were determined in 64 patients newly diagnosed with policystic ovary syndrome, without treatment, divided into two groups of 32 patients each according to the presence of insulin resistance, group 1 (G1) with HOMA-IR> 2.5 and Group 2 (G2) with HOMA-IR <2.5.
Results: The thyroid function in the G1 was, 15/32 (46.9 %) patients with TSH> 2.5 mUI / mL. For G2 7/32 (21.9 %) patients with TSH> 2.5 mUI / mL (P = 0.035). The presence of positive AntiTPO identified in 11/32 (34.4 %) patients in G1 and 6/32 (18.8 %) of G2 (P = 0.15), a total of 53.2 % of Autoimmune Thyroid Disease (ATD) independently of the presence of insulin resistance. Ultrasound evaluation of the thyroid gland, revealed the presence of nodules in 12/32 (37.6 %) of G1, and 4/32 (12.5 %) of G2 (P = 0.025). Overweight and obesity was observed in 74.99 % of patients in the G1 and G2 37.49 % (P = 0.001). Other parameters were assessed, as hirsutism, which was identified in 96.9 % of patients in G1 and G2 62.5 % (P = 0.002). The free androgen index was> 3.8 in 20/32 (62.5 %) patients in G1 and 14/32 (43.8 %) in G2 (P = 0.13).
Conclusions: The prevalence of Autoimmune Thyroid Disease in policystic ovary syndrome is higher than in the general population, the molecular basis point to a common gene, however this has not yet been well clarified. The effects of insulin resistance in policystic ovary syndrome are not limited to ovarian function, its relationship with elevated TSH and ultrasound changes of the thyroid gland, especially for the presence of nodular pathology justifies its evaluation for correct therapeutic approach.
Key words: Polycystic Ovary Syndrome. Thyroid function, Autoimmune Thyroid Disease. Thyroid Nodular Disease. Insulin resistance.
INTRODUCCIÓN
El síndrome de ovario poliquístico (SOP) es la enfermedad endocrina más común en mujeres especialmente en edad reproductiva, estimándose una prevalencia del 4 % al 15 % de la población femenina en edad fértil (1).
La expresión clínica del SOP es variable, pero comúnmente incluye oligo-ovulación o anovulación, hiperandrogenismo clínico o bioquímico y la morfología poliquística ovárica (1). La variabilidad en la expresión fenotípica sigue siendo motivo de investigación y debe ser considerada al momento del abordaje clínico (2).
La prevalencia de patología tiroidea en mujeres con SOP sigue siendo materia de debate. Varios estudios han demostrado una relación entre SOP y la presencia de hipotiroidismo y enfermedad tiroidea autoinmune (ETA) (3). La ETA en SOP, se plantea está relacionada con factores genéticos que también contribuyen a la propia fisiopatología de este síndrome, sugiriendo que mecanismos autoinmunes están involucrados en la patogenia del SOP (4).
Mientras que la resistencia a la insulina (RI) parece ser un evento fundamental para iniciar o perpetuar las condiciones patológicas más importantes de este síndrome se asocia en pacientes obesas con incremento de adipokinas – citokinas y otros marcadores inflamatorios (5-7), tales como, factor de necrosis tumoral α (TNFα) e IL-6, y está también relacionada con un defecto en la autofosforilación del receptor y fosforilación de moléculas de señalización acopladas al receptor de insulina de manera independiente de la obesidad e índice de masa corporal (IMC) (8). Cambios estructurales de la glándula tiroidea, han sido determinados en diferentes estados de resistencia a la insulina en relación con la enfermedad nodular tiroidea (9).
Los efectos descritos para la resistencia a la insulina, establecen fenómenos de selectividad, manteniéndose activada las vías mitogénicas que implican a esta hormona como factor importante de crecimiento y proliferación celular. El impacto de la RI en la glándula tiroidea ha sido evaluada recientemente, demostrando que pacientes con esta condición tienen un volumen tiroideo mayor, así como mayor prevalencia de nódulos tiroideos, e inclusive, recientemente ha sido relacionado con estadios tempranos de la carcinogénesis tiroidea; en vista de la sobreexpresión de receptores de insulina y de factores de crecimiento similares a la insulina tipo 1 y 2 (IGF-1 y 2), con elevada homología estructural y la existencia de tetrámeros híbridos, en cultivos celulares de tumores tiroideos, los cuales también han sido aislados en células de la granulosa y teca ovárica de pacientes con SOP (9-11).
Presentamos este estudio prospectivo que evalúa la prevalencia de patología tiroidea, tanto ETA como la presencia de nódulos, y su relación con la RI en pacientes con SOP, con la finalidad de incrementar el conocimiento de esta patología para su mejor atención clínica.
MÉTODOS
El estudio fue observacional, analítico de tipo transversal. La población estudiada correspondió a las pacientes de las consultas del Servicio de Endocrinología y de la Unidad de Endocrinología Ginecológica del Hospital Universitario de Caracas, durante el período 2012 – 2013. Se obtuvo un total de 76 pacientes, siendo seleccionadas al azar 32 pacientes con RI para ser comparadas con 32 pacientes sin RI.
La muestra estuvo representada por un número de 64 pacientes que reunieron los criterios de inclusión, seleccionadas mediante un muestreo intencional no probabilístico, para distribuirlas en los siguientes grupos: Grupo 1 (pacientes con resistencia a la insulina determinado por HOMA-IR>2,5), Grupo 2 (pacientes sin resistencia a la insulina determinado por HOMA-IR<2,5). Los criterios de inclusión establecidos fueron pacientes femeninas mayores de 13 años de edad con reciente diagnóstico de SOP sin tratamiento, cumpliendo con los Criterios del Consenso de Rotterdam (1).
Procedimiento
Para determinar el índice de resistencia a la insulina por cálculo de HOMA-IR, se utilizó la determinación de la glucemia venosa basal realizado mediante método enzimático de hexoquinasa y para la insulina plasmática basal, se utilizó método por micro-Elisa, con valores de referencia: 4-12 μUI/ mL, con estos datos se calculó el índice HOMA-IR mediante fórmula: insulina basal x glucemia en mmol/ dL (conversión con glucemia en mg/dL x 0,055)/ 22,5 para un HOMA-IR>2,5 (12). Se determinaron niveles de TSH, T3L, T4L y Anti-TPO, a través de método de micro-Elisa para definir funcionalismo tiroideo, con valores de referencia respectivos: 0,2-2,5 μUI/ mL, 1,4-4,2 pg/mL y 0,8-2 ng/dL.
También se diagnosticó hiperandrogenismo bioquímico cuando el valor del índice de andrógenos libres fue >3,8; para ello se utilizó determinación de niveles de testosterona Total (TT) mediante método micro-Elisa y globulina transportadora de hormonas sexuales (SHBG) a través de método de quimiluminiscencia, utilizando los siguientes valores de referencia respectivos: 0,2-0,95ng/mL y 18-114 nmol/L (13).
La ecoestructura tiroidea con énfasis en la determinación del volumen tiroideo y presencia de nódulos se realizó mediante ultrasonido tiroideo con equipo Aloka modelo Prosound SSD 3500SX utilizando sonda multifrecuencial de 5-10Mhz, este estudio fue realizado por el mismo observador experto. El mismo equipo fue utilizado para determinar volumen ovárico y morfología poliquística ovárica (1).
En cada grupo se determinó la presencia síntomas y signos de hiperandrogenismo como hirsutismo, acné y seborrea. Mediante interrogatorio clínico se definió la presencia de trastornos menstruales tipo oligomenorrea o amenorrea y con los datos antropométricos de la evaluación física (peso y talla) se calculó IMC en kg/m2, se utilizó la Clasificación de la Organización Mundial de la Salud (OMS) (14): normo peso (IMC 18 – 24,9 kg/m2) sobrepeso (IMC 25 – 29,9 kg/m2), obesidad clase I (IMC 30 – 34,9 kg/m2), obesidad clase II (IMC 35 – 39,9 kg/m2) y obesidad clase III (IMC > 40 kg/m2). Todos estos datos clínicos fueron evaluados por el mismo observador y con los mismos instrumentos (balanza estándar para peso y talla).
La dislipidemia fue definida según criterios del Adult Treatment Panel III (15): HDL<50mg/dL, LDL>110mg/dL y Triglicéridos >150mg/dL.
Tratamiento estadístico: Se calculó la media ± desviación estándar de las variables continuas y en el caso de las variables nominales se calculó sus frecuencias y porcentajes. Todas las variables mostraron una distribución normal.
Las diferencias entre los promedios de las variables continuas en el grupo problema versus control, se determinó mediante la aplicación de t de Student no pareado. La asociación de variables cualitativas se realizó mediante Chi Cuadrado. Se consideró significativo una P<0,05. Se utilizó el paquete estadísticos SPSS versión 22.0.
RESULTADOS
Caracterización de la muestra según edad:
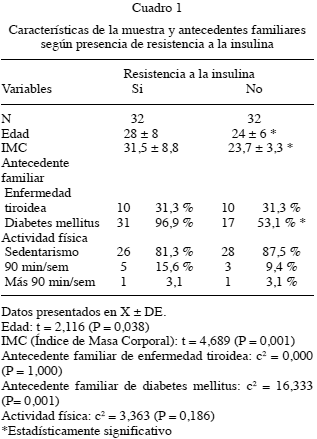
La edad promedio para el grupo 1 fue de 28 años ± 8 desviaciones estándar y para el grupo 2, estuvo comprendida en 24 años ± 6 desviaciones estándar. Ver Cuadro 1. (P=0,038)
Datos Antropométricos:
Para el grupo 1 el IMC fue en promedio 31,5 ± 8 kg/m2, con una distribución de 8/32 pacientes con normo-peso (25 %), 6/32 con sobrepeso (18,75 %), 7/32 con obesidad clase I (21,87 %), 6/32 (18,75 %) con obesidad clase II y 5/32 (15,62 %) con obesidad clase III, para un total de sobrepeso y obesidad de 74,99 %. Para el grupo 2, el promedio de IMC fue de 23,7 ± 3,3 kg/m2 con 19/32 (59,37 %) pacientes con normopeso, 11/32 con sobrepeso (34,37 %) y 1 paciente con obesidad clase I (3,12 %). Ver Cuadro 1. (P=0,001)
Función tiroidea:
En el grupo 1 se presentaron 17/32 pacientes con valores de TSH<2,5 μUI/mL (53,11 %), mientras que 15/32 pacientes tuvieron TSH>2,5 μUI/mL (46,9 %). Para el grupo 2, 25/32 pacientes tenían TSH< 2,5 μUI/ mL (78,1 %) y 7/32 pacientes con valores de TSH>2,5 μUI/mL (21,9 %). Ver Cuadro 2. (P=0,035).
En cuanto a los valores de hormonas tiroideas libres, T3L normal se encontró en 31/32 pacientes del grupo 1 (96,9 %) y 1/32 (3,1 %) pacientes con T3L por encima de valores de referencia. En el grupo 2 todos los pacientes 32/32 presentaron T3L normal (100 %). Ver Cuadro 2. (P=1)
Los valores de T4L, estuvieron bajo los valores de referencia en 5/32 (15,6 %) pacientes del grupo 1 y 2/32 (6,3 %) en el grupo 2, mientras que T4L normal estuvo presente en 26/32 (81,3 %) pacientes del grupo 1 y 30/32 (93,8 %) del grupo 2. Solo 1/32 (3,1 %) pacientes del grupo 1, presentó T4L por encima de los valores de referencia. Ver Cuadro 2. (P=0,27)
La presencia de Anti-TPO positivos se observó en 11/32 (34,4 %) pacientes del grupo 1 y 6/32 (18,8.%) en el grupo 2, siendo negativos en 21/32 (65,6 %) en el grupo 1 y 26/32 (81,2 %) del grupo 2. Ver Cuadro 2. (P=0,15)
Eco-estructura tiroidea:
La evaluación ecográfica de la glándula tiroides, reveló un estudio con hallazgos dentro de la normalidad en 12/32 (37,5 %) en el grupo 1 y 25/32 (78,1 %) del grupo 2. La presencia de nódulos se evidenció en 12/32 (37,6 %) de las pacientes del grupo 1, con las siguientes características: nódulo único 6/32 (18,8 %), glándula multinodular 3/32 (9,4.%), bocio multinodular 2/32 (6,3 %) y 1/32 (3,1 %) con glándula multinodular con hallazgos sugestivos de ETA. Para el grupo 2, 4/32 (12,5 %) presentó patología nodular tiroidea a saber: nódulo único 4/32 (12,5 %). Ver Cuadro 2. (P=0,025)
Los hallazgos ecográficos sugestivos de ETA estuvieron presentes en 9/32 (28,12 %) del grupo 1 y 3/32 (9,4 %) del grupo 2. Ver Cuadro 2.
Otra característica ecográfica evaluada fue el volumen tiroideo expresado en cm3, para el grupo 1 fue en promedio 7,15 ± 3,86 desviaciones estándar y para el grupo 2, 6,8 ± 2,4 desviaciones estándar. Ver Cuadro 2. (P=0,73)
Características fenotípicas:
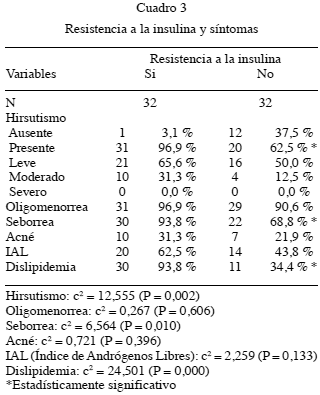
El hirsutismo estuvo presente en 31/32 (96,9 %) pacientes del grupo 1, con la siguiente distribución: 21/32 (65,6 %) con hirsutismo leve, 10/32 (31,3 %) con hirsutismo moderado. Para el grupo 2, 20/32 (62,5.%) pacientes presentaron el hirsutismo, con 16/32 (50 %) hirsutismo leve y 4/32 (12,5 %) hirsutismo moderado. Ver Cuadro 3. (P=0,002)
31/32 (96,9 %) pacientes del grupo 1, presentaban trastornos menstruales tipo oligomenorrea y 29/32 (90,6 %) en el grupo 2. Ver Cuadro 3. (P=0,6)
Otros síntomas de hiperandrogenismo como la dermatitis seborreica o seborrea, estuvo presente en 30/32 pacientes (93,8 %) del grupo 1 y 22/32 (68,8.%) pacientes del grupo 2 (P=0,010); mientras que 10/32 (31,3 %) pacientes del grupo 1 tenían acné y 7/32 (21,9.%) con acné en el grupo 2. Ver Cuadro 3. (P=0,39)
El IAL fue >3,8 en 20/32 (62,5 %) pacientes del grupo 1 y 14/32 (43,8 %) en el grupo 2.Ver Cuadro 3. (P=0,13)
Otros aspectos clínico evaluados, fue el comportamiento del perfil lipídico, se encontró algún tipo de dislipidemia en 30/32 (93,8 %) de las pacientes del grupo 1 y 11/32 (34,4 %) del grupo 2. Tanto hipertriacilgliceridemia e hipercolesterolemia se presentaron en conjunto en el 60 % de las pacientes del grupo 1 y 21,87 % del grupo 2. Ver Cuadro 3. (P=0,000)
DISCUSIÓN
El SOP resulta ser un síndrome muy complejo, y representa una de las enfermedades endocrinas más frecuentes en la mujer en edad fértil, con una expresión fenotípica muy variable, siendo la RI una de las manifestaciones endocrinas más común. Por otro lado, la prevalencia de ETA en pacientes con SOP, se ha estimado entre 27 % a 60 % (16). En este trabajo, la prevalencia de ETA se encontró dentro de lo esperado, siendo de 34 % en pacientes con RI, y 53,2.% en la muestra total, sin embargo, no se encontró una correlación estadísticamente significativa para la presencia de ETA con RI (P=0,157). Hasta la fecha, no hay estudios que evalúen la presencia de ETA solo en contexto de RI. Los resultados obtenidos en esta investigación solo demuestran la elevada prevalencia de ETA en esta población.
Los hallazgos ecográficos sugestivos de ETA, estuvieron presentes en 37,5 % de las pacientes, siendo similar a lo que reportan otros estudios, donde se estima que el 42 % de las pacientes con SOP tienen estos cambios ecográficos (16). El SOP y ETA tiene características patogénicas similares como la predisposición familiar, inflamación y adipoquinas (17). Ciertos antígenos leucocitarios humanos (HLA) codificados por el complejo mayor de histocompatibilidad (MHC, cromosoma 6p21), han sido reconocidos en ambos grupos. HLA – clase II (HLA-DR) presenta antígenos a las células T, y alelos HDLA-DR3 están significativamente asociados a ETA y contribuyen a la susceptibilidad genética. A parte de estos genes relacionados a MHC, se han identificado otros que también incrementan el riesgo, los loci con potencial susceptibilidad genética son los siguientes: CTLA4 (cromosoma 2q33), PTPN22 (cromosoma 1p13), IFIH1 (cromosoma 2q24), CD25 (cromosoma 10p15), PTPN2 (18p11), receptor TSH (14q31), entre otros (18).
Del mismo modo, la genética y su influencia en la etiopatogenia del SOP es evidenciada en estudios de asociación genómica, siendo varios los genes identificados e involucrados en la susceptibilidad para este síndrome. De esta manera se han identificado loci de riesgo para SOP en 8p23.1; 11p14.1 y 9q22.32, los cuales incluyen los loci de genes del receptor de gonadotropinas LHCGR y FSHR, así como polimorfismos de nucleótidos simple en genes THADA, DENND1A, YAP1, RAB5B y SOUX, entre otros (19). A través de los estudios en la búsqueda de los fundamentos genéticos que se asocian a los diferentes fenotipos observados en SOP, se pudo identificar también la participación de fibrillinas (FBN), especialmente en la resistencia a la insulina y disfunción de la célula βeta en estas pacientes. Las FBN son unas macromoléculas de la matriz extra celular, importante en la arquitectura del tejido conectivo. Estas se unen al receptor de factor de crecimiento transformante βeta (TGFβ), modulando de manera antagónica su vía de señalización. Otros ligandos para este receptor, incluyen, folistatinas, activinas, proteínas morfogenéticas óseas (BMPs), hormona antimülleriana (AMH), etc. A través de este receptor se modula la proliferación y diferenciación celular, en diversos procesos biológicos que incluyen, la reproducción, carcinogénesis o progresión en cáncer, formación de matriz extracelular, inflamación, metabolismo y desarrollo del tejido óseo, músculo esquelético y tejido adiposo (20).
FBN y folistatina son antagonistas extracelulares de los ligandos de este receptor. Variantes del gen de FBN-3 se ha asociado con SOP, específicamente con fenotipos metabólicos en mujeres con SOP y sus hermanos (20), pero resulta aún más interesante que este mismo gen, importante en la etiopatogenia del SOP y su relación con RI, este también asociado a la presencia de ETA en este síndrome (21). Considerando que el TGFβ es regulador fundamental de la tolerancia inmunológica por su influencia en las células T reguladoras, ambos factores se encuentran disminuidos en ETA y también en SOP (21).
Otros aspectos que también se han postulado como teorías para la asociación ETA y SOP es la proporción estrógenos/progesterona aumentada producto de la anovulación crónica, especulándose que el desequilibrio entre estas hormonas, contribuye a la autoinmunidad específica observada (21).
Por otro lado, la RI y consecuente hiperinsulinismo, se ha relacionado con alteración en la función y ecoestructura tiroidea, inclusive se ha verificado que existe alguna relación con la carcinogénesis de esta glándula (9,11,22).
Estudios que relacionan la RI con los cambios estructurales de la glándula tiroidea, observan un mayor volumen tiroideo y la presencia de nódulos en 40 % a 50 % de los pacientes evaluados (10,11,23- 25). La población estudiada en este trabajo de investigación, presentó un porcentaje de nódulos en el estudio ecográfico, de 37,5 % en el grupo con RI, determinado por un HOMA-IR >2,5; y solo en 4 % del grupo 2, aunque el total de pacientes con patología nodular en el grupo 1 es algo inferior al reportado en otros estudios, al relacionar la variable de RI con la presencia de patología nodular tiroidea, esta asociación resultó ser estadísticamente significativa (P=0,025), demostrando una asociación positiva con la presencia de RI y patología nodular tiroidea, tal y como lo demuestran los estudios evaluados como antecedentes de esta investigación.
La expresión de receptores de la insulina o sus receptores homólogos de IGF-1, e inclusive formas híbridas de estos receptores aislados en cultivos de células de lesiones nodulares y tejido correspondiente a cáncer diferenciado de tiroides (CDT), hace presumir la participación de la insulina, a través de su vía mitogénica en conjunción con otros factores, en esta patogenia, bien para la génesis o para la evolución y desarrollo de estas lesiones (9-11). La obesidad por su parte, ha sido asociada directamente como factor predisponente para diferentes tipos de cáncer, La Agencia Internacional para la Búsqueda e Investigación en Cáncer (IARC) (8) y La Fundación de Búsqueda o Investigación para el Mundo del Cáncer (WRCF) (8), reconocen que alrededor del 20 % de varios tipos de cáncer son originados en el contexto de sobre-peso y obesidad mediante diferentes mecanismos, estos incluyen: cáncer de mama en posmenopausia, cáncer endometrial, cáncer de colon, adenocarcinoma esofágico, cáncer renal, cáncer hepático, cáncer pancreático, linfoma no Hodgkin y cáncer de tiroides (10,11,26).
Concretamente, para los tumores tiroideos, los mecanismos detrás de la asociación de obesidad, resistencia a la insulina, patología nodular y más aún malignidad tiroidea, no están completamente establecidos, algunos estudios donde se observan asociaciones clínicas, pretenden evidenciar las vías fisiopatológicas que comprenden estas condiciones; tales como, TSH elevada en pacientes con sobrepeso y obesidad, generada por un efecto en la regulación hipotalámica para la secreción de TRH por las hormonas leptina e insulina, niveles más bajos de T4L, por incremento en la actividad desyodasa, en la cual, puede participar la leptina, activando la conversión de T4 a T3, contribuyendo a mayores valores de TSH, hormona que ha sido asociada a la génesis del cáncer tiroideo como estímulo para la proliferación del tirocito, mediante vías activadas de PI3K-Akt y RAS-BRAF 22; así como, los propios efectos de la insulina e IGF-1, a través de sus vías de señalización para el control del crecimiento y proliferación celular, favorecidas en situación de RI (26).
En esta población, en cuanto a los niveles de TSH, se encontró, que el grupo con RI tuvo valores de TSH>2,5 μUI/L en 46,9 % de las pacientes, mientras que el grupo sin RI, solo el 21,9 % presentó valores similares (P=0,035). Estudios en poblaciones con SOP, utilizando valores de corte para la TSH superiores a 4 μUI/L, estiman que 10,9 % de las pacientes tienen valores de TSH en el límite superior alto (16). Tal y como se ha mencionado, este factor pudiera ser fundamental o clave en los cambios estructurales de la glándula tiroidea, observados en este grupo de pacientes.
Los trastornos metabólicos asociados a la RI, como la dislipidemia y alteraciones en el metabolismo de hidratos de carbono en pacientes con SOP, tienen elevada prevalencia, por tal razón la de la Asociación Americana de Endocrinólogos clínicos (AACE) (27), el Colegio Americano de Endocrinología (ACE) (27) recomiendan en todas las pacientes con SOP evaluar la presencia de los componentes del síndrome metabólico: circunferencia abdominal (CA), hipertensión arterial, lípidos (HDL-colesterol y triglicéridos) alteraciones de la glucosa (prediabetes o diabetes mellitus tipo 2), se debe la realizar prueba de tolerancia a la glucosa oral (PTGO: Glucemia basal y 2 horas pos-carga 75 g de glucosa oral) en todas las pacientes con SOP (27). En Venezuela, estudios en pacientes con SOP (28), reportan que cerca del 13,3 % de las pacientes tienen valores de glucemia basal alterada y 6,5 % diagnóstico de intolerancia a los carbohidratos, y con respecto al diagnóstico de dislipidemia, su presencia es común en estas pacientes, de manera independiente del IMC y CA, siendo la hipertrigliceridemia (74,19 %) y la disminución del HDL (87,10 %) las más frecuentes. En nuestro estudio, el HDL bajo se presentó en 18/32 (56,25.%) y los niveles de triglicéridos altos en 60 % de las pacientes del grupo 1, con una relación directa con la presencia de RI.
Al evaluar los efectos de la insulina como hormona reproductiva, se sabe que el hiperinsulinismo es un factor fundamental en el hiperandrogenismo y anovulación, ejerciendo un efecto directo en las células de la teca ovárica, en la regulación de enzimas esteroidogénicas y síntesis de andrógenos, así como sus efectos en la producción hepática de SHBG, de tal manera que, los fenotipos hiperandrogénicos, presentan mayor RI (20). En este estudio, el hiperandrogenismo, estuvo presente en el 96,9 % de las pacientes con RI y en el 62 % de las pacientes del grupo control, para una relación estadística significativa (P=0,002). No así, para otras manifestaciones de hiperandrogenismo como la dermatitis seborreica y el acné. Desde el punto de vista bioquímico, a través de la determinación del IAL, estuvo elevado en 62,5 % de las pacientes con RI y solo 40 % en los controles.
Con respecto a las limitaciones de esta investigación son inherentes al tipo de diseño del estudio, lo cual no permite establecer la relación temporal y causal de las asociaciones obtenidas.
En conclusion, este estudio muestra mayor frecuencia de ETA en mujeres con SOP, con una frecuencia 5 veces mayor a la reportada en mujeres sin esta condición. La presencia de ETA no se asoció con RI. La TSH estuvo más elevada en pacientes con SOP y RI, lo cual puede estar en relación con los hallazgos ecográficos asociados a patología nodular y volumen aumentado de la glándula tiroidea en este grupo de pacientes.
Con estas evidencias, recomendamos la evaluación ecográfica y de la función tiroidea en pacientes con SOP a fin de instaurar las intervenciones terapéuticas pertinentes.
REFERENCIAS
1. The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004;19:41-47. [ Links ]
2. Deepika M, Ranjith K, Maruthi G, Jahan P. Polycystic ovary syndrome: A package of complex diseases. The IUP J Genetic Evolution Internet. 2011;4(1):54-59. [ Links ]
3. Palloti S, Gasbarrone A, Franzese I.T. Relationship between insulin secretion, and thyroid and ovary function in patients suffering from polycystic ovary. Minerva Endocrinol. 2005;30(3):193-197. [ Links ]
4. Ganie MA, Laway BA, Wanti TA, Zaryar MA, Nisar S, Ahamed F, et al. Association of subclinical hypotyroidism and phenotype, insulin resistance, and lipid parameters in Young women with polycystic ovary syndrome. Fertil Steril. 2001;95(6):2039-2043. [ Links ]
5. Dunaif A. Insulin resistence and the polycystic ovary syndrome: Mechanism and implications for pathogenesis. Endocr Rev. 1997;18(6):774-800. [ Links ]
6. Cosma M, Swiglo BA, Flynn DN, Kurtz DM, Labella M, Mullan RJ, et al. Clinical review: Insulin sensitizers for the treatment of hirsutism: A systematic review and metaanalyses of randomized controlled trials. J Clin Endocrinol Metab. 2008;93(4):1135-1142. [ Links ]
7. Lee H, Oh JY, Sung Ya, Chung H. Is insulin resistance an intrinsic defect in asian polycystic ovary syndrome? Yonsei Med J. 2013;54(3):609-614. [ Links ]
8. Mueller A, Schöfl C, Dittrich R, Cupisti S, Oppelt PG, Schild RL, et al. Thyroid – stimulating hormone is associated with insulin resistance independently of body mass index and age in women with polycystic ovary syndrome. Hum Reprod. 2009;11:2924-2930. [ Links ]
9. Rezzonico J, Rezzonico M, Pusiol E, Pitoia F, Niepmniszcze H. High prevalence of thyroid nodules in patients with achrocordons (skin tags), possible role of insulin – resistance. Medicina (B Aires). 2009;69(3):302-304. [ Links ]
10. Rezzonico J, Rezzonico M, Pusiol E, Pitoia F, Niepmniszcze H. Increased prevalence of insulin resistance in patients with differentiated thyroid carcinoma. Metab Synd Relat Disord. 2009;7(4):375- 380. [ Links ]
11. Gursoy A. Rising thyroid cancer incidence in the world migth be related to insulin resistance. Med Hypotheses. 2010;74(1):35-36. [ Links ]
12. Fung L, Pizzi R, Centeno I, Hernández E. Resistencia a la insulina en la mujer: ¿cómo y cuándo evaluarla? Rev Obstet Ginecol Venez. 2015;75:200-211. [ Links ]
13. Bui HN, Sluss PM, Hayes FJ, Blincko S, Knol DL, Blankenstein MA, et al. Testosterone, free testosterone, and free androgen index in women: Reference intervals, biological variation, and diagnostic value in polycystic ovary syndrome. Clin Chim Acta. 2015;450:227-232. [ Links ]
14. World Health Organization. Obesity: Preventing and Managing the Global Epidemic. WHO Obesity Technical Report Series 894. Geneva, Switzerland:World Health Organization; 2000. [ Links ]
15. Lorenzo C, Williams K, Hunt K., Haffner S. The National Cholesterol Education Program–Adult Treatment Panel III, International Diabetes Federation, and World Health Organization. Definitions of the Metabolic Syndrome as Predictors of Incident Cardiovascular Disease and Diabetes. Diabetes Care. 2007;30:8-13. [ Links ]
16. Janssen OE, Mehlmauer N, Hahn S, Höftner A, Gartner R. High prevalence of autoimmune thyroiditis in patients with polycystic ovary syndrome. Eur J Endocrinol. 2004;150(3):363-369. [ Links ]
17. Calvar C, Bengolea S, Deutsch S, Hermes R, Ramos G, Loyato M. High frecuency of thyroid abnormalities in polycystic ovary syndrome. Medicina (Buenos Aires) 2015;75:213-217. [ Links ]
18. Springer DA. Hashimotos thyroiditis. En: New look at hypothyroidism. Prague: Editorial Tech; 2012.p.48- 68. [ Links ]
19. Azziz R. New insights into the genetics of polycystic ovary syndrome. Nat Rev Endocrinol. 2016;12:1-2. [ Links ]
20. Diamanti-Kandarakis E., Dunaif A. Insulin resistance and the polycystic ovary syndrome revisited: An update on mechanisms and implications. Endocrin Rev. 2012;3(6):981-1030. [ Links ]
21. Gaberscek S, Zaletel K, Schwetz V, Pieber T, Obermayer-Pietsch B, Lerchbaum E. Mechanisms in Endocrinology: Thyroid and polycystic ovary syndrome. Eur J Endocrinol. 2015;172:9-21. [ Links ]
22. Marcello MA, Cunha L, Batista F, Ward L. Obesity and thyroid cancer. Endocr Relat Cancer. 2014;16:1-15. [ Links ]
23. Rezzonico J, Rezzonico M, Pusiol E, Niepomniszcze H. Introducing the thyroid gland as another victim of the insulin resistence syndrome. Thyroid. 2008;18(4):461-464. [ Links ]
24. Croniger C. Pathogenic features of insulin resistance and critical organ damage. Recent advances in the pathogenesis, prevention and management. Cleveland: Tech Editorial. 2011.p.303-322. [ Links ]
25. Vella V, Sciacca L, Pandini G, Mineo R, Squatrito S, Vigneri R, et al. The IGF system in thyroid cancer: New concepts. J Clin Pathol. 2001;54(3):121-125. [ Links ]
26. Levine RA. Current Guidelines for the management of thyroid nodules. Endocrine Pract. 2012;18(4):596- 599. [ Links ]
27. Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E. American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the best practices in the evaluation and treatment of Polycystic Ovary Syndrome – Part 2. Endocr Pract 2015;21:1415-1426. [ Links ]
28. Fung L, Curiel M, Pizzi R, Centeno I, Fermin M, Perez Y, et al. Evaluación de la resistencia a la insulina y el metabolismo de hidratos de carbono en pacientes con síndrome de ovario poliquístico. Rev Venez Endocrinol Metab. 2014;12(2):133. [ Links ]
29. Fung L, Fermin M, Pizzi R, Curiel M, Perez Y, Mendoza A, et al. Perfil lipídico en pacientes con síndrome de ovario poliquistico. Rev Venez Endocrinol Metab. 2014;12(2):133. [ Links ]
30. Morgante G, Musacchio MC, Orvieto R, Massaro MG, De Leo V. Alterations in thyroid function among the different polycystic ovary syndrome phenotypes. Gynecol Endocrinol. 2013;29:967-969. [ Links ]