Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.76 no.3 Caracas set. 2016
Doble transferencia embrionaria consecutiva D3/D5-6: una alternativa para mejorar las tasas de embarazo en pacientes sometidas a fertilización in vitro/transferencia embrionaria (FIV/TE)
Dr. Antonio Sanoja Breña1
1 Gineco-Obstetra–Especialista en Medicina Reproductiva. Centro Valenciano de Fertilidad y Esterilidad CEVALFES. Trabajo presentado para ascender a la categoría de Miembro Titular de la Sociedad Venezolana de Obstetricia y Ginecología.
RESUMEN
Objetivo: Evaluar la doble transferencia embrionaria consecutiva D3/D5-6 (DTEC D3/D5-6) como alternativa para mejorar las tasas de embarazo en pacientes sometidas a un programa de fertilización in vitro/transferencia embrionaria (FIV/TE) que obtengan más de dos embriones de día 3 (D3), independientemente del número de intentos previos, de la edad y de los criterios de inclusión al programa.
Métodos: Estudio observacional prospectivo realizado en un centro de fertilidad privado. Se aplicó la técnica de la DTEC D3/D5-6 de acuerdo al protocolo del Centro Valenciano de Fertilidad y Esterilidad (CEVALFES) a 58 pacientes durante el período septiembre 2012-2014 y que obtuvieron dos o más embriones de buena calidad.
Resultados: La tasa de éxito general fue de un 39,65 %. Estos resultados se compararon con las tasas de éxito de la aplicación de la TE de D3 y de D5-6 de un solo embrión y de dos y tres embriones llevadas a cabo en un solo momento. La tasa de éxito general fue superior a las obtenidas con las TE D3 dobles y triples (29,23 % y 31,01 % respectivamente) y a las TE de blastocistos desvitrificados únicas y dobles (15,38 % y 15,15 % respectivamente).
Conclusiones: La doble transferencia embrionaria consecutiva D3/D5-6 se perfila como una técnica eficaz para tomar la decisión de cuántos embriones transferir y el momento de hacerlo cuando la pareja cuenta con dos o más embriones de D3. Ello se traduce en una alternativa que puede mejorar los resultados de las técnicas de reproducción asistida en la actualidad.
Palabras claves: Doble transferencia embrionaria consecutiva, transferencia embrionaria, FIV/TE, embriones D3, blastocistos.
SUMMARY
Objective: The aim of this study was to evaluate a double consecutive embryo transfer day 3/ day 5-6 as an alternative to improve pregnancy rates among patients undergoing an IVF/ET program who obtain more than two day-3 embryos, without taking into account the number of previous attempts, age or IVF/ET program inclusion criteria.
Method: Prospective observational study at a private fertility center. The double consecutive embryo transfer day 3/ day 5-6 approach was performed, according to the protocol outlined at CEVALFES, on 58 patients of our fertility center who obtained two or more good quality embryos between September 2012 and September 2014.
Results: The overall pregnancy rate was 39,65%. These results were compared with single embryo transfers day 3 and day 5-6 and double and triple embryo transfers performed either on day 3 or on day 5-6. This overall pregnancy rate was higher than the rates obtained for double and triple day-3 ET (29,23% and 31,01% respectively) and for single and double thawed blastocyst ET (15,38% and 15,15% respectively).
Conclusions: The double consecutive embryo transfer day 3 and day 5-6 approach presents itself as an effective alternative to inform decision making when two or more day-3 embryos are available: how many day-3 embryos are to be transferred and if ET can be performed consecutively on day 3 and day-5-6. This, in turn, becomes a choice that can improve current pregnancy rates.
Key words: Double consecutive embryo transfer, embryo transfer, IVF/ET, day-3 embryos, blastocysts.
INTRODUCCIÓN
La transferencia embrionaria (TE) luego de una fertilización in vitro (FIV) o una inyección intracitoplasmática (ICSI) usualmente se lleva a cabo en un solo procedimiento: o bien en el estadio de clivaje (D2 o D3) o bien en el estadio de blastocisto (D5-6), independientemente del número de embriones que se transfieran. No obstante, la opción de repetir el procedimiento para llevar a cabo dos o más transferencias sucesivas en el mismo día o al día siguiente fue sugerida por Visser y col. (1), en 1993, para tratar de resolver intentos previos fallidos de TE cuando uno o más embriones permanecían en el catéter, lo cual disminuía las tasas de embarazo. Luego, en 1998, Tur-Kaspa y col. (2) estudiaron la repetición consecutiva en varias modalidades con la intención de asistir al equipo médico y orientar a los pacientes en la toma de decisiones en los casos en los que se presentaban dificultades técnicas durante la TE y concluyeron que la TE sucesiva o repetida no afectaba las tasas de embarazo. Posteriormente, Ashkenazi y col. (3), llevaron a cabo una nueva variación que contemplaba realizar una TE sucesiva, pero para la transferencia de embriones en dos estadios diferentes de desarrollo: en D3 y luego en D5, en pacientes con tres o más de tres ciclos previos fallidos.
El objetivo del presente trabajo es proponer la doble transferencia embrionaria consecutiva D3/D5-6 (DTEC D3/D5-6) como una alternativa para mejorar las tasas de embarazo en pacientes sometidas a FIV/TE que obtengan más de dos embriones de día 3 (D3), independientemente del número de intentos previos, de la edad y de los criterios de inclusión al programa.
La transferencia embrionaria doble: tipos.
La transferencia embrionaria doble (TED) como opción significativa para lograr el embarazo en las técnicas de reproducción asistida (TRA) comenzó a practicarse internacionalmente a partir de 1998, luego de la publicación de los resultados del trabajo de Templeton y col. (4) sobre la reducción del riesgo de los embarazos múltiples de alto orden con la TED en ciclos de FIV, sin que ello afectara las tasas de embarazo (5). A partir de ese momento y hasta el presente, la TED se considera como una de las alternativas más apropiadas en cuanto al número de embriones a transferir en un ciclo determinado para lograr el embarazo, obviamente tomando en cuenta factores tales como edad de la paciente, ciclos previos fallidos, la calidad embrionaria, la condición del endometrio, el deseo de los pacientes y el factor masculino involucrado. Así, la TED se ha establecido como una práctica frecuente, con múltiples variantes en cuanto al estadio de desarrollo del embrión a transferir y al tipo de transferencia. En tal sentido, los términos utilizados para la descripción de todas estas variantes no son comunes en la literatura, lo cual genera confusión al momento de interpretar los estudios publicados al respecto (3, 6 – 14). Con la intención de aclarar las diversas nomenclaturas utilizadas en la literatura y precisar los datos suministrados en el presente trabajo, a continuación, se describirá brevemente cada una de las posibles variaciones de la TED.
Una vez fertilizado el ovocito, es necesario que se cultive en ambientes y medios adecuados, como mínimo, 48 horas (D2) o 72 horas (D3) para que alcance el estadio de desarrollo a partir del cual se puede llevar a cabo la transferencia embrionaria (TE). Cuando esto ocurre, se habla de transferencia embrionaria de día 2 o 3 (TE D2 o TE D3). En los casos en los que se transfiere un solo embrión, se denomina transferencia embrionaria única día 2 o 3 (TEU D2 o TEU D3) y en los que se transfieren 2 embriones en un solo momento se denomina transferencia embrionaria doble día 2 o 3 (TED D2 o TED D3). Por último, cuando se llevan a cabo transferencias de tres embriones D3 en un solo ciclo se habla de transferencias embrionarias triples D3 (TET D3). En tal sentido, existen algunos reportes de estudios recientes en la literatura donde se han llevado a cabo transferencias embrionarias consecutivas D2-D3 dobles y triples (6). Cuando existe un excedente de embriones en este estadio, pero se decide la transferencia de un solo embrión y la criopreservación del excedente, se habla de transferencia embrionaria única electiva (TEUe). Las siglas en inglés para este tipo de transferencia es eSET (elective single embryo transfer).
En los casos en los que se mantiene el desarrollo del embrión hasta alcanzar el estadio de blastocisto, lo que ocurre a las 120 horas (D5) o las 144 horas (D6), así como ocurre con los embriones D2 y D3, la transferencia del embrión en este estadio puede ser única (TEU D5-6) o doble (TED D5-6). Y también, al igual que ocurre con los embriones D2 o D3, cuando existe un excedente de embriones en D5-6 y se decide la transferencia de un solo embrión con la criopreservación del excedente se habla de transferencia embrionaria única electiva (TEUe).
Como se mencionó al inicio de este trabajo, en el año 2000, Ashkenazi y col. (3) describieron por primera vez una variación de la transferencia embrionaria doble que involucró una transferencia sucesiva de tres a cinco embriones en dos estadios diferentes de desarrollo (D3 y D5-6). Los autores la describieron como doble transferencia (consecutiva); sin embargo, trabajos posteriores han descrito a transferencias similares con un número igual o menor de embriones como de intervalo (10), secuencial (15) o de pasos consecutivos (11). Con la intención de aclarar y unificar criterios para la denominación de esta técnica se propone utilizar el término doble transferencia embrionaria consecutiva D3/D5-6 (DTEC D3/D5-6). La propuesta de no utilizar el término transferencia embrionaria doble consecutiva sino el término doble transferencia embrionaria consecutiva se basa en el hecho que se considera que este último término hace énfasis en los dos momentos en los que se llevan a cabo las dos TE y no en el número de embriones a transferir que es con lo que mayormente se asocia el término TED. La cantidad de embriones a transferir reportados en la literatura ha oscilado entre dos y cinco embriones, dependiendo de factores tales como el número de embriones disponibles, la calidad embrionaria, la edad de la paciente, ciclos previos fallidos y el deseo de la pareja (3, 6, 11 - 13, 15). Machtinger y col. (15) reportaron que, de manera excepcional, transfirieron más de cuatro embriones, previa discusión y consentimiento de la pareja, en los casos de múltiples ciclos fallidos o cuando la calidad embrionaria fue baja.
Controversias actuales: transferencia embrionaria doble (TED) vs transferencia embrionaria única (TEU).
En general, hasta los momentos actuales, no ha habido un incremento significativo en los porcentajes de éxito de las TRA (tasas de implantación, de embarazo y de niños nacidos sanos), a pesar de los avances logrados en los medicamentos de estimulación ovárica, en los tipos de ecografía, en la evolución y la calidad de los medios de cultivo y de las incubadoras y en los catéteres de transferencia. El número ideal de embriones a transferir y el momento elegido para realizar la transferencia sigue siendo objeto de debate e internacionalmente existen posiciones encontradas al respecto (5, 16 - 20). No obstante, sí existe un consenso en cuanto a la necesidad de disminuir las probabilidades de obtener embarazos múltiples, sobre todo los de alto orden, por los riesgos que conllevan tanto para la madre como para su descendencia (21).
Al ser objetivo primordial de todo centro de reproducción el asistir a los pacientes para que alcancen su deseo de procreación, las alternativas que se ofrezcan deben estar dirigidas a maximizar las probabilidades de éxito y, a su vez, a disminuir los riesgos derivados de los diferentes tratamientos ofrecidos. Así, podemos ver en la evolución de los estudios reportados en la literatura durante los últimos 15 años (4, 17, 18), que ha habido una tendencia importante hacia la disminución del número de embriones a transferir. Antes de la publicación del estudio de Templeton y col. (4) se consideraba que la alternativa de transferir un mayor número de embriones era lo que aumentaba la probabilidad de lograr el embarazo. Sin embargo, estos autores encontraron que con la TE de dos embriones se lograban tasas de embarazo similares a las obtenidas con la TE de tres embriones o más trayendo como resultado que la TED se considere como un estándar de calidad en las TRA (5). Adicionalmente, y con la intención de reducir aún más las probabilidades de embarazos múltiples, se ha observado una tendencia que ha derivado en la recomendación de la transferencia embrionaria única como el estándar de excelencia de toda TRA (18). Sin embargo, la TEU ha puesto en evidencia que, si bien disminuye de manera significativa las probabilidades de embarazo múltiple, también disminuye las probabilidades de lograrlo (17 - 20). Es por ello que el debate entre los especialistas en fertilidad acerca de la elección de la TEU vs la TED o de un número mayor de embriones, dependiendo de factores tales como la edad de la paciente y la calidad embrionaria, se mantiene vigente en la actualidad. Adicionalmente, estudios recientes han mostrado que la participación de los pacientes en la toma de decisiones ha pasado a ser un componente importante para determinar el número ideal de embriones a transferir (16, 22) puesto que se ha reconocido que es necesario considerar las expectativas de los pacientes ante los posibles resultados de una TE múltiple junto con las consideraciones emanadas de estudios de medicina basada en evidencia, porcentajes y probabilidades de éxito y la experiencia clínica del especialista.
Rol del paciente en la toma de decisiones para la TE.
La relación médico-paciente en la toma de decisiones en cuanto a cuál TRA escoger, cuando esto es posible, y cuántos embriones transferir en un ciclo determinado, puede ser analizada desde múltiples puntos de vista. Por una parte, está la posición descrita como paternalista donde el médico tratante considera que sus conocimientos y formación le permiten tomar decisiones que deben ser ejecutadas a pesar de que puedan estar en contra de los deseos de la pareja (16). Por otro lado, está la interpretación de esta posición, no como una imposición, sino como el producto del ejercicio de un deber que vela por el bienestar, no de la pareja, sino de su descendencia (16). Adicionalmente, se puede encontrar en la literatura autores que clasifican la interrelación médico-paciente de acuerdo a dinámicas alternativas que se establecen en la toma de decisiones. Emanuel y col. (23), en 1992, contrastaron el abordaje paternalista con tres modelos que representan tres posibilidades en el desarrollo de la relación médico-paciente: el modelo informativo, el modelo interpretativo y el modelo deliberativo.
En el modelo informativo el paciente es considerado un consumidor y la relación que se establece entre ambos se circunscribe a suministrar información relevante al caso y el médico se limita a cumplir con los deseos de la pareja, sin que haya intervenciones de su parte que puedan influenciar la toma de decisiones. Por ejemplo, cuando una pareja decide no transferir en D3 y dejar en cultivo hasta blastocistos todos los embriones disponibles, lo cual genera el riesgo de que ningún embrión alcance este estadio (24) y, en consecuencia, se cancele la transferencia, pero el médico acepta dicha decisión sin cuestionarla. Jean y col. (16) consideran que este modelo es particularmente inapropiado en el área de la medicina reproductiva ya que los pacientes de esta área esperan que el médico tratante demuestre empatía, escuche y discuta las características particulares de cada caso.
En el modelo interpretativo el médico asume el rol de orientador e informa a la pareja acerca de los valores e información relevantes para la toma de decisiones. Por ejemplo, cuando la decisión se centra en el número de embriones a transferir, el médico les comunica las posibilidades de éxito del tratamiento y los riesgos para la madre y su descendencia, entre otros. También discute con la pareja las alternativas pertinentes al caso (por ejemplo, otros tipos de TRA). No obstante, no intenta convencerla para la toma decisiones.
En el modelo deliberativo, el médico se comporta como un maestro y trata de persuadir a la pareja de que tome las mejores decisiones, considerando tanto los datos clínicos disponibles como sus valores y necesidades. Así, este modelo favorece la toma de decisiones conjuntas y los acuerdos entre ambos. Por ejemplo, cuando una pareja tiene más de dos embriones de D5-6 y el médico le explica que en muchos países se considera que la TED conlleva riesgos que deben ser evitados (18, 20), la pareja manifiesta su deseo de llevar a cabo la TED aun conociendo estos riesgos y el médico acepta la decisión de la pareja cuando ésta no involucra peligros para la vida y salud ni de la madre ni de su descendencia.
Es importante tomar en cuenta, sin embargo, que tanto en el modelo interpretativo como en el deliberativo, en un momento determinado, el médico puede asumir un rol paternalista (16). Para evitarlo, él debe asegurarse que la pareja sea la que en última instancia tome la decisión final, siempre y cuando dicha decisión no involucre ir en contra de los principios de beneficencia y no maleficencia (9, 25).
Doble transferencia embrionaria consecutiva D3/D5-6 (DTEC D3/D5-6).
La opción de transferir dos o más embriones en dos momentos diferentes de desarrollo embrionario: el D2 o D3 y el D5-6, cuando dichos embriones se encuentran disponibles, fue descrita en la literatura por Ashkenazi y col. (3) para abordar casos de ciclos previos fallidos en número mayor a tres. Posteriormente, la técnica fue utilizada para tratar casos no sólo de fallas repetidas, sino en ciclos de primera vez, por Goto y col. (12). Actualmente, cuando se presentan casos en los que se dispone de dos a cuatro o más embriones en D3, se considera que la posibilidad de transferir uno o dos embriones en el D3, mantener en cultivo prolongado el resto de los embriones para su desarrollo a blastocisto (D5-6) y proponerles a los pacientes una segunda transferencia consecutiva en caso de que el o los embriones alcancen este estadio, es una alternativa que merece ser considerada (6, 11 - 15). Los criterios de inclusión han variado según los autores y encontramos que algunos no toman en cuenta la edad de la paciente sino el número de embriones disponibles (11, 12) o el que haya habido ciclos previos fallidos o no (6, 15), de tal manera que el número de embriones transferidos en esta técnica ha oscilado entre dos y cuatro. En primera instancia, este número de embriones a transferir luce elevado por el aumento de las probabilidades de obtener embarazos múltiples, bien sea gemelares o de alto orden. Sin embargo, los resultados positivos reportados en los estudios mencionados, en cuanto a las tasas de embarazo gemelar obtenidas, aunados al estricto control perinatal de estos embarazos (26), han generado tendencias actuales que consideran que el embarazo gemelar no representa un resultado adverso per se de una TRA (27).
MÉTODOS
El presente trabajo es un estudio observacional prospectivo llevado a cabo en un centro de fertilidad privado. La DTEC D3/D5-6 se aplicó a 58 pacientes que asistieron al Centro Valenciano de Fertilidad y Esterilidad (CEVALFES) durante el período comprendido entre septiembre de 2012 - 2014 y que obtuvieron dos o más embriones D3 de buena calidad. El protocolo desarrollado en esta institución para la aplicación de la DTEC D3/D5-6 incluye esquemas de estimulación ovárica controlada, indicaciones para el procedimiento de recuperación ovocitaria, condiciones indispensables para la fertilización, cultivo y desarrollo embrionario y, por último, esquemas de recepción embrionaria. Adicionalmente, se adaptan criterios actuales en cuanto a la evaluación de la calidad embrionaria para determinar las características mínimas necesarias para seleccionar los embriones de mejor calidad y determinar el número a transferir. Esta experiencia se compara con la aplicación de la TE de D3 y de D5-6 de un solo embrión, de dos y de tres embriones llevadas a cabo en un solo momento con el propósito de evaluar la efectividad de la DTEC D3/D5-6.
A continuación, se describe, en detalle, cada uno de estos esquemas, etapas y criterios.
Estimulación ovárica controlada, recuperación ovocitaria, cultivo y desarrollo embrionario y esquemas de recepción embrionaria.
La estimulación ovárica controlada se inicia mediante el uso de protocolos de análogos de la hormona liberadora de gonadotropinas (GnRH) o de antagonistas de la GnRH, luego se administran dosis de hormona folículo estimulante recombinante (FSH-r) y/o de gonadotropina menopáusica humana (HMG) para estimular la foliculogénesis. La dosis de las gonadotropinas se individualiza dependiendo de la edad de la paciente y de la historia de estimulaciones previas, en aquellos casos donde las haya habido. El proceso se monitorea por mediciones de estradiol sérico y controles ecográficos. Se administran 10.000 UI de gonadotropina coriónica humana (hCG) o 250 UI de gonadotropina coriónica humana recombinante (hCG-r) o 1 mg de análogo de la GnRH (Luprón®), según el caso, al observar folículos mayores de 18 mm de diámetro para culminar la maduración de los ovocitos; 36 horas después se realiza, bajo anestesia general, la aspiración ovocitaria transvaginal, utilizando, bajo guía ecográfica, una aguja de acero (Echotip® Norfolk Ovum Aspiration Needle, gage 17 length 35 cm, marca COOK). En los casos de ovodonación, el esquema de recepción se lleva a cabo administrando valerianato de estradiol, a dosis creciente de 2 mg hasta 6 mg diarios, vía oral, y progesterona micronizada, 800 mg diarios, vía vaginal; en los ciclos naturales se corrobora el día de la ovulación para así planificar la transferencia.
Los ovocitos se fertilizan mediante FIV o mediante ICSI, dependiendo de los casos, 4 horas después de la recuperación ovocitaria, en un ambiente de CO2 6 % y O2 5 % a 37ºC. La fertilización se evalúa 16-18 horas después y se define por la presencia de dos pronúcleos y dos cuerpos polares. Los embriones se cultivan en medios secuenciales comerciales, suplementados con HSA (G-1 PLUS, G-2 PLUS, Vitrolife Sweden AB Göteborg, Sweden). Los embriones se observan a las 48 horas (48h) (D2) y 72 horas (72h) (D3) después de la aspiración folicular.
Calidad embrionaria.
La calidad de los embriones clivados se evalúa de acuerdo a dos criterios: las pautas establecidas por Veeck (28), y el número de blastómeras presentes a las 48h y a las 72h. En cuanto a las primeras, Veeck (28) establece cinco grados posibles que dependen del tamaño y simetría de las blastómeras y la presencia o ausencia de fragmentación citoplasmática. A continuación, se describen estos cinco grados. Grado 1: embrión con blastómeras de igual tamaño y ausencia de fragmentación citoplasmática. Grado 2: embrión con blastómeras de igual tamaño con una fragmentación citoplasmática menor o igual al 10 %. Grado 3: embrión con blastómeras con tamaños evidentemente desiguales y fragmentación variable. Grado 4: embrión con blastómeras de tamaño igual o desigual y fragmentación citoplasmática de moderada a significativa, que abarca más del 10 %. Grado 5: embrión con pocas blastómeras de tamaños variables y fragmentación citoplasmática severa (mayor o igual a 50 %).
En cuanto al segundo criterio, se considera que a las 48 h deben estar presentes cuatro blastómeras y a las 72h deben haberse dividido en ocho o más. Así, la calificación de un embrión como de alta calidad se define por la presencia de cuatro blastómeras de Grado 1 o Grado 2 a las 48h, las cuales evolucionan a ocho o más, manteniendo el Grado 1 o 2 a las 72h.
Por su parte, para evaluar la calidad de los blastocistos, se utiliza una combinación de las escalas propuestas Gardner y col. (29), en 1999, y las propuestas por Veeck y col. (30). Los primeros establecen unos criterios de evaluación provenientes del grado de expansión del blastocele y el estatus de eclosión del blastocisto, que van del 1 al 6, acompañados de una escala de evaluación de la masa celular interna, sólo para los blastocistos expandidos, que va de 3 a 6. La masa celular interna y el trofoectodermo se evalúan con una escala alfabética de A, B o C en donde A representa la calificación para la morfología óptima y C para cuando se observan irregularidades severas.
En el año de 2003, Veeck y col. (30) modificaron las escalas de Gardner y col. (29) al introducir el concepto de mórula cavitada vs blastocisto cuando, al observar embriones compactados con una cavitación temprana y con un blastocele más pequeño que la mitad del volumen del embrión, estos se consideran mórulas cavitadas y no blastocistos. Así, el blastocisto se define como tal cuando el blastocele abarca más del 50 % del volumen del embrión y cuando se observen células que sugieran la formación de la masa celular interna (30).
La escala resultante está compuesta por puntajes alfanuméricos que evalúan tres categorías. La primera evalúa la expansión del blastocisto y oscila entre 1 y 6. El puntaje 3 indica que el blastocisto está completamente expandido y con una zona pelúcida delgada y el puntaje 2 cuando la zona pelúcida está ligeramente más delgada, debido al crecimiento del embrión. En CEVALFES se considera que estas dos calificaciones son las mínimas necesarias para decidir la transferencia embrionaria. El puntaje máximo de 6, considerado como óptimo en la escala de Veeck y col. (30) se asigna al embrión cuando se encuentra iniciando la eclosión. No obstante, lograr que el embrión alcance este estadio de desarrollo aún sigue siendo difícil en la actualidad, a pesar de la disponibilidad de nuevos medios de cultivo secuenciales (24, 31), por lo tanto, la transferencia de blastocistos en este estadio se aplica mayormente en pacientes jóvenes de buena prognosis (31).
La segunda categoría del puntaje es alfabética, oscila entre A y D y evalúa la masa celular interna. Un puntaje de A representa una masa desarrollada, bien diferenciada y sin células degenerativas. Un puntaje de B implica que carece de alguna de estas tres características. La tercera categoría, también alfabética, igualmente oscila entre A y D y evalúa la calidad del trofoectodermo. Un puntaje de A representa un trofoectodermo regular y bien definido. Un puntaje de B indica la carencia de alguna de estas dos características.
En CEVALFES, para tomar la decisión de transferir un blastocisto se califica como buena una evaluación de 3AA, 3AB y 2AA y como aceptable las evaluaciones de 3BB, 3BA y 2BB dado que en la experiencia de este centro, cuando los embriones alcanzan estas morfologías aún conservan su potencial de implantación a pesar de que el blastocisto no esté completamente expandido, su masa celular interna presente pequeñas áreas no definidas y/o el trofoectodermo no esté completamente delimitado. En aquellos casos en los que el blastocisto no ha alcanzado el desarrollo esperado en el día 5, se mantiene en cultivo hasta el día 6. En ese momento se verifica que haya alcanzado la evaluación mínima necesaria descrita anteriormente. En aquellos casos en los que ocurre un arresto, se considera que el embrión no es viable.
Selección y transferencia de embriones:
La TE se lleva a cabo, en un primer paso, el día 3 después de la recuperación ovocitaria. En este paso se escoge el o los dos embriones de mejor calidad, dependiendo del caso, y se transfiere(n) a la cavidad uterina con la ayuda de un catéter (Ultrasoft Frydman set echo with guide, Laboratoire C.C.D., Paris, Francia), bajo visión ecográfica y se deja a 1,0 cm del fondo del útero (Phillips y col., 2003 (13)). El resto de los embriones se cultivan en G-2 PLUS, (Vitrolife Sweden AB Göteborg, Sweden) para su desarrollo a blastocisto. El segundo paso se lleva a cabo el día 5 o 6, dependiendo del día en el cual el/los embriones alcanzan este estadio. En este paso se transfiere un blastocisto a la cavidad uterina de la paciente, dejándolo en esta segunda fase a 2,0 cm del fondo del útero de manera tal de no lastimar al embrión transferido en el D3 (Phillips y col. 2003 (13)). Los blastocistos restantes, en los casos en los que los haya, se criopreservan utilizando la técnica de cryotop (Kitazato®, BioPharma Co., Ltd. Japón).
La paciente recibe soporte de la fase lútea con valerianato de estradiol (Progynova®) entre 6-10 mg vía oral, dependiendo del grosor endometrial y 600 mg (800 mg en los casos de óvulo donado) de progesterona micronizada vía vaginal. En aquellos casos donde la doble transferencia consecutiva D3/D5-6 se lleve a cabo en ciclos naturales, las transferencias embrionarias se realizan en el día +3 y el día +5 /+6 a partir del día de la ovulación. A los 14 días luego de la TE D5-6 se miden los niveles séricos de β-hCG cuantificada y a los 21 días post transferencia D5-6 se practica ecografía transvaginal a los casos con β-hCG positiva, para verificar la presencia del o de los sacos gestacionales.
RESULTADOS
Como se observa en la Tabla 1, en el total de 58 pacientes, la tasa de embarazo clínico septiembre 2012-2014 es de 53,44 % (31/58) y la tasa de embarazo a término es de 64,52 % (20/31).
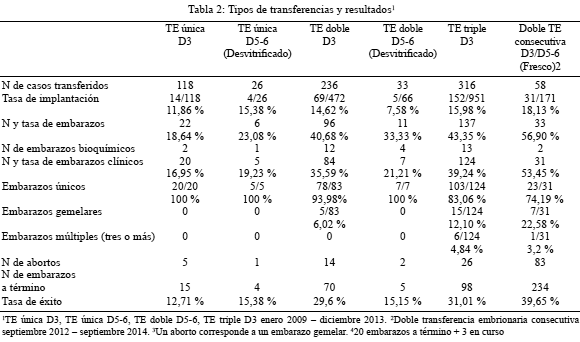
Los resultados arrojados por la aplicación de la DTEC D3/D5-6 durante el lapso septiembre 2012 - 2014, reflejados en la Tabla 2, indican una tasa de éxito de 39,65 %. En cuanto a los resultados obtenidos en los diferentes tipos de transferencia, se puede observar, en primer lugar, que el porcentaje de éxito obtenido con la DTEC D3/D5-6 (39,65 %) es superior a los obtenidos con las TE D3 dobles y triples (29,23 % y 31,01 % respectivamente).
DISCUSIÓN
En general, las técnicas de reproducción asistida (TRA) actuales todavía reportan tasas de implantación susceptibles de ser mejoradas; sin embargo, a pesar de los avances tecnológicos recientes, no ha sido posible identificar las razones por las cuales no ha habido incrementos significativos en los porcentajes de éxito (32). Algunas alternativas se han implementado para tratar de lograr estos incrementos: variar el día (D2, D3, estadio de clivaje o D5-6, estadio de blastocisto) de la transferencia embrionaria (TE) (6, 17, 33, 34); establecer la posibilidad de hacer una doble TE consecutiva (3, 12) y/o variar el número de embriones a ser transferidos, dependiendo de su estadio de desarrollo (35). El momento en el que se realiza la TE ha sido controversial (7), ya que naturalmente los embriones humanos llegan a la cavidad uterina en el estadio de blastocisto (D5-6) por lo cual se le ha considerado como un abordaje más fisiológico que la TE en el D3. Sin embargo, dejar la totalidad de los embriones en cultivo prolongado a blastocisto para su transferencia, en muchas ocasiones resulta en la cancelación de la TE debido a que los embriones no alcanzan dicho estadio (3, 12, 13, 18, 24). Por otra parte, ello se traduce en consecuencias negativas, tanto psicológicas como económicas, para los pacientes (13). La doble TE consecutiva D3/D5-6, representa una alternativa que ha sido estudiada en los últimos años para tratar de obtener mejores resultados (6, 10 - 13, 15).
El enfoque de la doble TE consecutiva D3/D5-6 propuesta por Ashkenazi y col. (3), en el año 2000, para evaluar los resultados de transferir embriones en etapas tempranas (D3) y en estadio de blastocisto (D5-6) durante un mismo ciclo, cuando hay un número de embriones que oscila entre dos y cinco o más, ha sido casi exclusivamente utilizado para el abordaje de casos con ciclos previos fallidos, generalmente en número de 3 o más de 3 (6, 10, 11, 15, 36). En contraste, en el estudio de Goto y col. (12), los autores investigaron acerca de la efectividad del método de la DTEC D3/D5-6, pero en un grupo de pacientes que no había ingresado a ciclos previos. Los autores afirman que el método es efectivo, sin haber obtenido un aumento significativo de la tasa de embarazos múltiples, lo cual es una de las preocupaciones mayores en la reproducción asistida actual (5, 18, 21, 25, 27, 35, 37). Por otra parte, una de las tendencias favorecidas en estos momentos, es aplicar esquemas de baja estimulación ovárica con el propósito de disminuir el número de embriones obtenidos en cada ciclo, tanto para reducir el número a transferir como el excedente para criopreservar (38).
En este punto, un elemento importante a considerar es que los intentos de disminuir la tasa de embarazos múltiples y los esquemas de baja estimulación ovárica tienden a reducir las probabilidades de lograr el embarazo para muchas pacientes (5). Algunas de estas pacientes se verían desasistidas si no existiesen otras opciones que ofrecerles en sus ciclos. Para otras, estas opciones alternativas les podrían evitar tener que pasar por la traumática experiencia de uno o varios ciclos fallidos (3, 5, 11, 15, 18, 25).
Los argumentos que subyacen a la propuesta de la doble TE consecutiva D3/D5-6 a pacientes con dos o más embriones de buena calidad a las 72 horas de cultivo, aunque fuesen casos de primera vez, son varios.
En primer lugar, se considera que no es ético esperar a que una TRA falle para ofrecerle a este tipo de paciente la oportunidad de acceder a otra TRA que ha dado buenos resultados con otras pacientes, a pesar de que pueda aumentar las posibilidades de un embarazo gemelar. En segundo lugar, se considera que es un deber tomar en cuenta la perspectiva del paciente y su deseo informado de obtener este tipo de embarazo (16, 21, 22) puesto que, aunque el embarazo gemelar ha sido considerado como un resultado adverso dentro de las TRA, un análisis detallado de la data disponible (21, 27) ha permitido incorporar la necesidad de tomar en cuenta en esta toma de decisiones las perspectivas de las parejas (16, 22). Por otra parte, el monitoreo cuidadoso del desarrollo del embarazo gemelar, producto de los diversos tratamientos en los casos de infertilidad, y la atención perinatal disponible en los momentos actuales inclusive han demostrado una morbi-mortalidad perinatal inferior a la de los embarazos gemelares obtenidos de forma natural (26). En tercer lugar, el hecho de transferir uno o dos embriones en día 3 y dejar en cultivo prolongado los embriones excedentes a día 5-6 permite que en los casos de embriones supernumerarios de D3, estos puedan ser vitrificados en el estadio de blastocisto, lo cual aumenta las probabilidades de éxito en caso de su utilización en ciclos posteriores, bien por falla en el logro del embarazo o para la búsqueda de una nueva gestación.
En cuarto lugar, y en cuanto al contexto bioético que debe enmarcar los actos médicos en el área de la reproducción asistida, todo avance científico tiene el compromiso de resaltar el hecho de que los intereses de los seres humanos en particular deben prevalecer siempre sobre los intereses de la sociedad en general y la ciencia. Los beneficios que se obtengan del uso de dichos avances y de las aplicaciones y técnicas de ellos derivadas, tienen como misión ser tanto individuales como colectivos (39). Así pues, el especialista en fertilidad debe ser cauto y prudente en la toma de decisiones sin olvidar ni los preceptos y criterios de actuación provenientes de su formación, ni los nuevos abordajes desarrollados por las investigaciones en las múltiples áreas relacionadas con la fertilidad humana. Siempre se debe integrar la perspectiva técnica con la ética (9). Sin duda, la medicina basada en evidencias y el aporte de la investigación científica contemporánea forman parte indispensable de la biomedicina reproductiva. La base de la ética médica constituye junto con los principios de justicia y de respeto por la autonomía del paciente, las normas básicas indispensables que permiten al especialista en fertilidad compartir un compromiso moral común y básico con los pacientes.
Cuando los pacientes deciden considerar la DTEC D3/D5-6 como una opción válida de tratamiento, se debe llevar a cabo un análisis conjunto de la misma, médico tratante-paciente, incluyendo dentro de la discusión toda la información detallada acerca de los riesgosbeneficios establecidos en la literatura (5, 17, 21, 24, 26, 27, 40).
Las limitaciones encontradas en este estudio son las propias de los estudios observacionales que, obviamente, requieren la realización de estudios aleatorios prospectivos controlados que permitan una mayor generalización de sus resultados. Así, los logros aquí obtenidos apuntan a la aplicación de la DTEC D3/D5-6 en estudios subsecuentes que permitan confirmar el aumento de las tasas de éxito que su aplicación ha generado en estas pacientes.
Conclusiones
Transferir embriones al interior de la cavidad uterina constituye el punto crucial en la fertilización in Vitro con TE porque el éxito o la falla dependen de la manera y el momento como la TE se lleve a cabo, de los materiales utilizados y del número de embriones transferidos. Los resultados obtenidos con la DTEC D3/D5-6 en el presente trabajo superan la tasa general de embarazo clínico en CEVALFES, no reportan un aumento significativo de la tasa de embarazo gemelar, en comparación con las publicadas en la literatura (8) para TED en pacientes respondedoras estándar, y reflejan una tasa de embarazo múltiple baja.
Con base en estos resultados y en los reportados en la literatura con este tipo de transferencia (6), se propone que la DTEC D3/D5-6 se ofrezca, en principio, a todas aquellas pacientes que ingresen a un programa de FIV y tengan dos o más embriones de buena calidad en el D3 de desarrollo embrionario, independientemente del número de intentos. Adicionalmente, también se propone que se ofrezca a pacientes que tengan más de dos óvulos vitrificados y que vayan a ingresar a un programa de reproducción asistida, dado que los resultados positivos han sido similares en estos casos.
La FIV/TE continúa siendo la TRA más utilizada y hasta ahora es la que ofrece una mayor posibilidad de éxito en cuanto al logro del embarazo se refiere. El autor está convencido que la oportunidad que brinda la doble transferencia embrionaria consecutiva constituye una alternativa viable y eficaz para mejorar las tasas de éxito de las TRA en la actualidad.
REFERENCIAS
1. Visser DS, Fourie FL, Kruger HF. Multiple attempts at embryo transfer: effect on pregnancy outcome in an in vitro fertilization and embryo transfer program. J Assist Reprod Genet. 1993; 10(1): 37-43. [ Links ]
2. Tur-Kaspa I, Yuval Y, Bider D, Levron J, Shulman A, Dor J. Difficult or repeated sequential embryo transfers do not adversely affect in-vitro fertilization pregnancy rates or outcomes. Hum Reprod. 1998; 13(9): 2452- 2455. [ Links ]
3. Ashkenazi J, Yoeli R, Ovieto R, Shalev J, Ben-Rafael Z, Bar-Hava I. Double (consecutive) transfer of early embryos and blastocysts: aims and results. Fertil Steril. 2000; 74(5): 936-940. [ Links ]
4. Templeton A, Morris JK. Reducing the risk of multiple births by transfer of two embryos after in vitro fertilization. N Engl J Med. 1998; 339(9): 573-577. [ Links ]
5. Gleicher N, Barad D. The relative myth of elective single embryo transfer. Hum Reprod. 2006; 21(6): 1337-1344. [ Links ]
6. Fang C, Huang R, Li TT, Jia L, Li LL, Liang XY. Day-2 and day-3 sequential transfer improves pregnancy rate in patients with repeated IVF-embryo transfer failure: a retrospective case-control study. Reprod Biomed Online. 2013; 26(1): 30-35. [ Links ]
7. Hayrinen LH, Sills ES, Fogarty AO, Walsh DJ, Lutsyk AD, Walsh AP. First Irish delivery following sequential, two-stage embryo and blastocyst transfer. Ir J Med Sci. 2012; 181(3): 349-351. [ Links ]
8. Jonsdottir I, Lundin K, Bergh C. Double embryo transfer gives good pregnancy and live birth rates in poor responders with a modest increase in multiple birth rates: results from an observational study. Acta Obstet Gynecol Scand. 2011; 90 (7): 761-766. [ Links ]
9. Berin I, McLellan S, Macklin EA, Toth TL, Wright DL. Frozen-thawed embryo transfer cycles: clinical outcomes of single and double blastocyst transfers. J Assist Reprod Genet. 2011; 28 (7): 575-581. [ Links ]
10. Almog B, Levin I, Wagman I, Kapustiansky R, Schwartz T, Mey-Raz N, Amit A, Azem F. Interval double transfer improves treatment success in patients with repeated IVF/ET failures. J Assist Reprod Genet. 2008; 25(8): 353-357. [ Links ]
11. Goto S, Shiotani M, Kitagawa M, Kadowaki T, Noda Y. Effectiveness of two-step (consecutive) embryo transfer in patients who have two embryos on day 2: comparison with cleavage stage embryo transfer. Fertil Steril. 2005; 83(3): 721-723. [ Links ]
12. Goto S, Takebayashi K, Shiotani M, Fujiwara M, Hirose M, Noda Y. Effectiveness of 2-step (consecutive) embryo transfer. Comparison with cleavage-stage transfer. J Reprod Med. 2003; 48(5): 370-374. [ Links ]
13. Phillips SJ, Dean NL, Buckett WM, Tan SL. Consecutive transfer of day 3 embryos and of day 5-6 blastocysts increases overall pregnancy rates associated with blastocyst culture. J Assist Reprod Genet. 2003; 20(11): 461-464. [ Links ]
14. Goto S, Takebayashi K, Shiotani M, Nakanishi K, Takakura K, Noda Y. A novel method of embryo transfer in human IVF-ET based on the concept of embryodependent induction of embryo receptivity: two-step embryo transfer. Fertil Steril. 2001; 76 (3): S113. [ Links ]
15. Machtinger R, Dor J, Margolin M, Levron J, Baum M, Ferber B, et al. Sequential transfer of day 3 embryos and blastocysts after previous IVF failures despite adequate ovarian response. Reprod BioMed Online. 2006; 13(3): 376-379. [ Links ]
16. Jean M, Tessier P, Bonnaud-Antignac A, Freour T, Barriere P, Dabouis G. Is the debate about single or double embryo transfer following in vitro fertilization really an ethical dilemma? Clin Ethics. 2013; 8: 61-69. [ Links ]
17. Glujovsky D, Blake D, Farguhar C, Bardach A. Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology. Cochrane Database Syst Rev. 2012; 7(11). [ Links ]
18. Practice Committee of Society for Assisted Reproductive Technology: Practice Committee of American Society for Reproductive Medicine. Elective single-embryo transfer. Fertil Steril. 2012; 97(4): 835-842. [ Links ]
19. Baruffi RL, Mauri AL, Petersen CG, Nicoletti A, Pontes A, Oliveira JB, Franco JG Jr. Single-embryo transfer reduces clinical pregnancy rates and live births in fresh IVF and Intracytoplasmic Sperm Injection (ICSI) cycles: a meta-analysis. Reprod Biol Endocrinol. 2009; 7: 36. [ Links ]
20. Pandian Z, Templeton A, Serour G, Bhattacharya S. Number of embryos for transfer after IVF and ICSI: A Cochrane review. Hum Reprod. 2005; 20(10): 2681- 2687. [ Links ]
21. Gleicher N, Barad D. Twin pregnancy, contrary to consensus, is a desirable outcome in fertility. Fertil Steril. 2009; 91(6):2426-2431. [ Links ]
22. Latar IL, Razali N. The desire for multiple pregnancy among patients with infertility and their partners. Intl J Reprod Med. 2014; (2014): 301-452. [ Links ]
23. Emanuel EJ, Emanuel LL. Four models of the physician-patient relationship. JAMA. 1992; 267: 2221-2226. [ Links ]
24. Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. Blastocyst culture and transfer in clinical-assisted reproduction: a committee opinion. Fertil Steril. 2013; 99 (3): 667-672. [ Links ]
25. Practice Committee of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. Criteria for number of embryos to transfer: a committee opinion. Fertil Steril- 2013; 99(1): 44-46. [ Links ]
26. Helmerhorst FM, Perquin DA, Donker D, Keirse MJ. Perinatal outcome of singletons and twins after assisted conception: a systematic review of controlled studies. BMJ. 2004; 328 (7434): 261. [ Links ]
27. van Wely M, Twisk M, Mol BW, van der Veen F. Is twin pregnancy necessarily an adverse outcome of assisted reproductive technologies? Hum Reprod. 2006; 21(11): 2736-2738. [ Links ]
28. Veeck LL. An atlas of human gametes and conceptuses. An illustrated reference for assisted reproductive technology. The Encyclopedia of Visual Medicine Series. New York and London: The Parthenon Publishing Group, 1999. [ Links ]
29. Gardner DK, Schoolcraft WB. Culture and transfer of human blastocysts. Curr Opin Obstet Gynecol. 1999; 11(3): 307-311. [ Links ]
30. Veeck LL, Zaninović N. An Atlas of Human Blastocysts. The Encyclopedia of Visual Medicine Series. New York and London: The Parthenon Publishing Group, 2003. [ Links ]
31. Chimote NM, Chimote NN, Nath NM, Mehta BN. Transfer of spontaneously hatching or hatched blastocyst yields better pregnancy rates than expanded blastocyst transfer. J Hum Reprod Scien. 2013; 6 (3): 183-188. [ Links ]
32. Edwards RG, Beard HK. Is the success of human IVF a matter of developmental biology? In: Jansen R, Mortimer D, editors. Towards Reproductive Certainty. Fertility and Genetics beyond 1999. New York: Parthenon Publishing Group, 1999; p 414-418. [ Links ]
33. Gardner DK, Vella P, Lane M, Wagley L, Schlenker T, Schoolcraft WB. Culture and transfer of human blastocysts increases implantation rates and reduces the need for multiple embryo transfers. Fertil Steril. 1998; 69(1): 84-88. [ Links ]
34. Papanikolaou EG, Kolibianakis EM, Tournaye H, Venetis CA, Fatemi H, Tarlatzis B, et al. Live birth rates after transfer of equal number of blastocysts or cleavage-stage embryos in IVF. A systematic review and meta-analysis. Hum Reprod. 2008; 23 (1): 91-99. [ Links ]
35. Vlaisavljevic V, Dmitrovic R, Sajko MC. Should the practice of double blastocyst transfer be abandoned? A retrospective analysis. Reprod Biomed Online. 2008; 16(5): 667-683. [ Links ]
36. Loutradis D, Drakakis P, Dallianidis K, Bletsa SR, Milingos S, Doumplis N, et al. A double embryo transfer on days 2 and 4 or 5 improves pregnancy outcomes in patients with good embryos but repeated failures in IVF or ICSI. Clin Exp Obstet Gynecol. 2004; 31(1): 63-66. [ Links ]
37. Kalu E, Thum MY, Abdalla H. Reducing multiple pregnancies in assisted reproduction technology: towards a policy of single blastocyst transfer in younger women. Fertil & asisst reprod. 2008; 115: 1143-1150. [ Links ]
38. Varghese A, Nagy ZP, Agarwal A. Current trends, biological foundations and future prospects of oocyte and embryo cryopreservation. Reprod Biomed Online. 2009; 19(1): 126-140. [ Links ]
39. Oñate N, Sanoja A, Arcay Hands E. Unidad de Biobancos CEVALFES: Conceptualización, desarrollo y funcionamiento. Valencia: CEVALFES, 2011. [ Links ]
40. van Loendersloot LL, van Wely M, Repping S, Bossuyt PM, van der Veen F. Individualized decision-making in IVF: Calculating the chances of pregnancy. Hum Reprod. 2013; 28 (11): 2972-2980. [ Links ]