Acta Botánica Venezuelica
versión impresa ISSN 0084-5906
Acta Bot. Venez. v.25 n.1 Caracas ene. 2002
ESTUDIO CROMOSÓMICO COMPARATIVO DE CINCO ESPECIES DE ALOE (ALOACEAE)
José IMERY BUIZA y Tatiana CALDERA ANDARA
Universidad de Oriente, Escuela de Ciencias, Departamento de Biología, Laboratorio de Genética. Apartado 245. Cumaná-Venezuela. Fax: 0293-4302344, jimeryb@cantv.net
RESUMEN
Se compararon las características cromosómicas de cinco especies de Aloe. Las observaciones cariológicas se realizaron a partir de meristemas radicales tratados con colchicina y preparados según la metodología usual. Los análisis de varianza, pruebas de promedios MDS y distancias euclidianas, basados en el tamaño de los cromosomas, longitud de sus brazos (l y s) e índice r (l/s), permitieron reconocer diferencias significativas entre especies y la conformación de agrupaciones entre A. arborescens y A. succotrina, seguida por A. vera y la separación de A. chinensis y A. saponaria como un grupo aparte. Adicionalmente, se observaron diferencias en la asimetría cariotípica y en el número y posición de constricciones secundarias. Se discute la variabilidad cariotípica interespecífica en función de posibles reordenamientos cromosómicos.
Palabras clave: Aloe, Aloaceae, cariotipo, cromosomas, satélites, constricciones secundarias.
ABSTRACT
Chromosome characteristics from five Aloe species were compared. The karyological observations were carried out from root tips treated with colchicine and following traditional procedures. ANOVA, DMS mean tests and euclidean distances, based on chromosome size, length of the arms (l and s) and ratio r (l/s), showed interspecific significant differences and clustering between A. arborescens and A. succotrina, followed by A. vera and separation of A. chinensis and A. saponaria as apart group. Moreover, differences for karyotypic asymmetry, number and position of secondary constrictions were observed. Karyotype variability among species from possible chromosomal rearrangements was discussed.
Key words: Aloe, Aloaceae, karyotype, chromosomes, satellites, secondary constriction.
INTRODUCCIÓN
Las plantas pertenecientes al género Aloe L. (1753) están incluidas actualmente en la familia Aloaceae (Van Wyk & Smith 1996). Son un grupo de plantas monocotiledóneas, perennes, con hojas suculentas, inflorescencias en panículas o racimos, con flores liliformes. Es una familia de amplia difusión, especialmente abundante en regiones tropicales y subtropicales, con enorme importancia económica y medicinal (Carter 1994).
El origen del género Aloe ha sido discutido por varios investigadores; Cowling (1982) sugiere que este grupo de plantas se originó en El Cabo oriental de Sur África; Holland (1978) agrega que el antecesor de estas plantas tuvo su origen en las tierras altas de esa región africana, tiempo antes de la invasión del mar al canal de Mozambique, a mediados del periodo Cretáceo; Smith (1991) argumenta que el género Aloe se desarrolló plenamente a principios del Jurásico, y también suministra evidencia de que el antecesor de este género fue una planta probablemente de unos 150 mm de altura. De aquí deriva que algunos autores consideren a las plantas de menor altura como las ancestrales de sus congéneres más altos.
Taxonómicamente, este grupo ha sufrido muchos cambios, probablemente debido a que en su ciclo de vida se presentan diferencias foliares marcadas entre el estado juvenil y el adulto (Riley & Majumdar 1979). Por otra parte, factores ambientales como luz, temperatura, humedad y fertilidad del suelo tienen efectos directos sobre la fase vegetativa, haciendo que ejemplares de una misma especie que se encuentren en áreas geográficamente diferentes muestren gran variación morfológica. Esta situación ha llevado a problemas de identificación y a la existencia de numerosas sinonimias, como los casos de A. vera (= A. barbadensis), A. saponaria (= A. maculata), A. succotrina (= A. perryi), A. zebrina (= A. ammophila), A. spectabilis (= A. marlothii), entre otros (Van Wyk & Smith 1996).
Desde el punto de vista citogenético, varios investigadores han estudiado los cariotipos de la familia Aloaceae (Taylor 1925a; Marshak 1934; Snoad 1951; Brandham 1971; Sapre 1975, 1978; Vij et al. 1980; Takahashi et al. 1997; Brandham & Doherty 1998), reiterando que este grupo de plantas es un ejemplo de gran estabilidad cromosómica, debido a la observación de un cariotipo bimodal constante, 2n = 14, con ocho cromosomas grandes y seis pequeños. Todas estas investigaciones se llevaron a cabo a partir de ejemplares conservados en jardines botánicos del viejo Mundo (Reino Unido, India, China y Filipinas), en cuyas observaciones se aplicaron metodologías diferentes y orientadas principalmente hacia la obtención de cariotipos para el estudio del número, tamaño y morfología de sus cromosomas. Algunas de estas publicaciones se fundamentan en el análisis de cromosomas haploides, observados en la primera división nuclear de la microspora, sin tomar en cuenta los reordenamientos que pudieran experimentar los cromosomas durante el proceso de meiosis y, que conllevarían a variaciones en la caracterización de la estructura cromosómica del esporófito.
La búsqueda de diversidad genética potencialmente aprovechable en programas de mejoramiento genético en sábila (Aloe vera (L.) Burm.f.), además del interés en reconocer posibles variaciones cariológicas entre los congéneres A. Arborescens Mill., A. chinensis Steud., A. succotrina Lam. y A. saponaria Haw., ampliamente distribuidos como plantas ornamentales por toda la geografía venezolana, motivaron la realización del presente trabajo con el objetivo de comparar las características cromosómicas esporofíticas entre estas cinco especies.
MATERIALES Y MÉTODOS
Por cada especie de Aloe se utilizaron diez plantas cultivadas bajo condiciones de vivero en el Departamento de Biología de la Universidad de Oriente, originalmente obtenidas en viveros comerciales de varias regiones de Venezuela. El estudio cromosómico se llevó a cabo siguiendo la metodología establecida por Fukui & Nakayama (1996). Entre las 8:00-9:00 a.m. (hora mitótica preestablecida por Mata 1977), se recolectaron 5-10 ápices radicales por planta, los cuales fueron sometidos a pretratamientos con solución de colchicina 0,05% m/v por dos horas y NaCl 0,03% m/v durante 10 min, a fin de incrementar la frecuencia de células metafásicas con cromosomas dispersos. Estas muestras fueron fijadas en Carnoy II (3:1 etanol absoluto-ácido acético glacial) por 24 horas y almacenadas en etanol 70% v/v a -4°C hasta su uso.
Para la preparación de láminas, cada ápice radical fue sumergido en agua destilada durante 10 min, sometido a HCl 1N por 15 min, nuevamente colocado en agua destilada por 10 min, disectado individualmente sobre un portaobjeto para seleccionar la zona meristemática y coloreado con orceína FLP 1,5% m/v por cuatro min. Finalmente, se colocó un cubreobjeto y se realizó el aplastamiento tisular para separar las células. Adicionalmente, se añadió una gota de ácido propiónico (45% v/v) a ambos lados del cubreobjeto para aclarar las muestras y practicar reaplastamiento del tejido (Imery 2000). A partir de estas preparaciones temporales se realizó una búsqueda sistemática de células metafásicas con cromosomas dispersos, claramente visibles al microscopio óptico, para analizar el cariotipo de cada especie.
Las imágenes cariológicas se tomaron en un microscopio de luz Bausch & Lomb PBV-4B mediante sistema digital (cámara de video 8 mm Cannon Es870 e interfase digitalizadora Snappy), editadas en computadora empleando el programa PhotoimpactTM SE Ulead e impresas con equipo Deskjet HP890 sobre papel con calidad fotográfica (Epson SO41141). Para determinar la longitud de los brazos cromosómicos (l = largo y s = corto), longitud completa (Lc) e índice r (l/s) de Levan et al. (1964), se evaluó la mejor fotomicrografía cariotípica por cada espécimen. El resto de las muestras fueron utilizadas en la confirmación del número de cromosomas esporofíticos. La identificación de los homólogos y su ordenamiento se realizó de acuerdo a Brandham (1971), tomando en cuenta el tamaño de los cromosomas y la longitud del brazo corto en orden decreciente.
El procesamiento estadístico de los resultados comprendió el cálculo de la distribución de las variables cromosómicas l, s, Lc y r, mediante promedios y error estándar con N = 20. La asimetría cariotípica se determinó por el método de Stebbins (1971) y los índices A1 y A2 propuestos por Romero (1986). Para reconocer las posibles diferencias cromosómicas entre especies, los valores individuales de l, s, Lc y r, para cada grupo de homólogos, se sometieron a análisis de varianza y comparación de promedios aplicando la prueba de mínima diferencia significativa (Sokal & Rohlf 1979). Finalmente, se construyeron dendrogramas que proponen la similitud cromosómica entre las cinco especies de Aloe, empleando como medida de afinidad la distancia euclidiana y la agrupación por promedios simples. En este análisis, las entidades estuvieron representadas por las especies y los atributos por las variables l, s, Lc y r de cada grupo de homólogos.
RESULTADOS
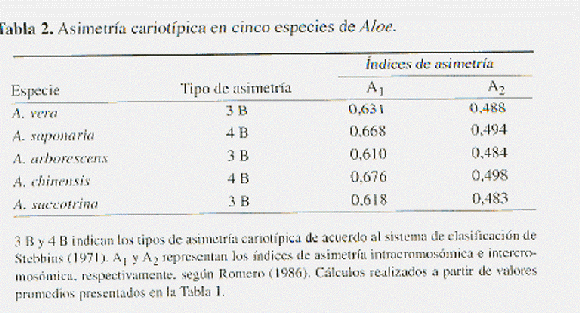
Las cinco especies de Aloe presentaron complementos diploides con 2n = 14 cromosomas en todas las muestras analizadas (Fig. 1-3). La longitud de los brazos largos (l), longitud de los brazos cortos (s), longitud cromosómica (Lc) e índice r (l/s) de estos cariotipos se resumen en la Tabla 1, manteniéndose de manera general una distribución bimodal en ocho cromosomas grandes (L) de 12,427 a 18,043 mm y seis cromosomas pequeños (S) de 4,307 a 6,292 mm. Las fórmulas idiogramáticas presentes en las especies fueron 2Lsm + 6Lst + 6Ssm para A. vera, A. arborescens y A. succotrina, y de 8Lst + 6Ssm para A. Saponaria y A. chinensis. Estas dos últimas especies mostraron los cariotipos más asimétricos, clasificados como tipo 4 B y con los mayores índices de asimetría intra e intercromosómica (Tabla 2).
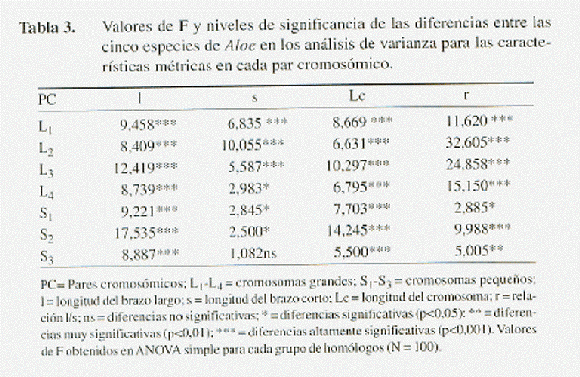
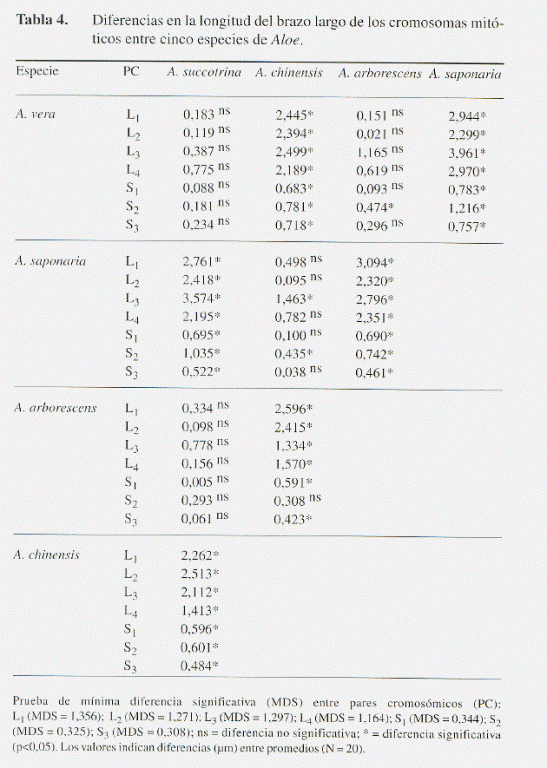
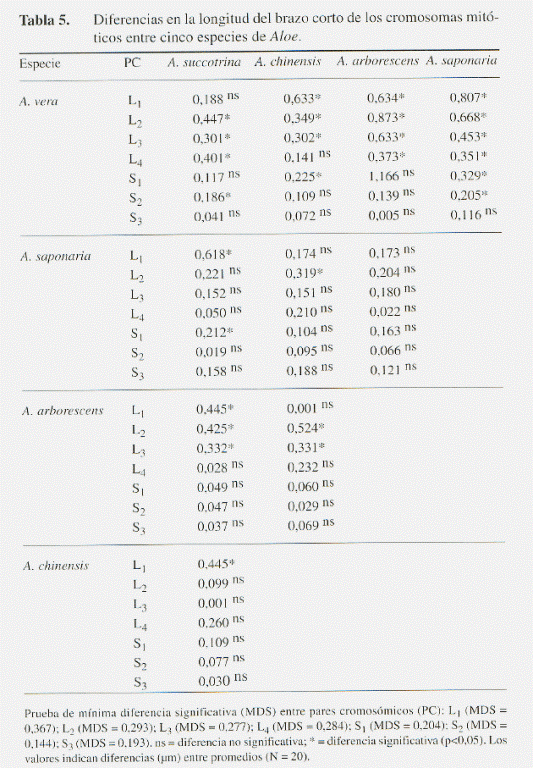
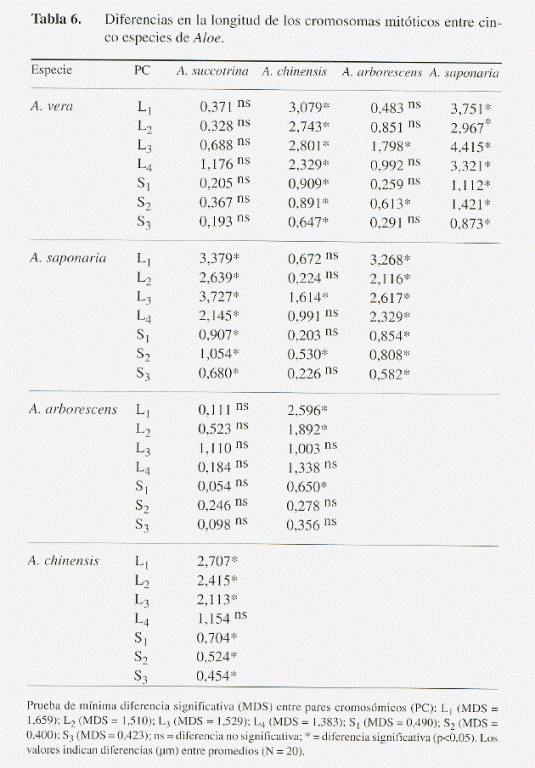
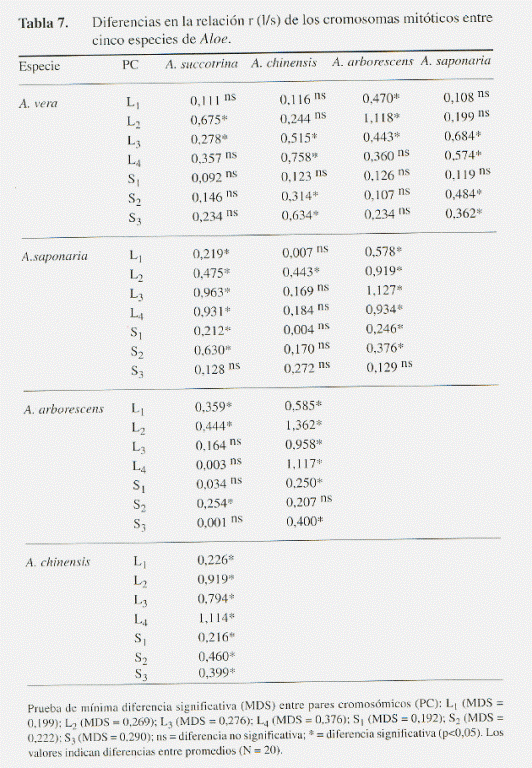
La diferencia entre especies resultó estadísticamente significativa en todas las variables cariológicas (l, s, Lc y r), a excepción del brazo corto en el cromosoma más pequeño S3 (Tabla 3). Al comparar los promedios de estas variables, se hizo evidente que las diferencias interespecíficas en el tamaño de los cromosomas esporofíticos se deben principalmente a variaciones en la longitud del brazo largo y en menor grado al brazo corto (Tabla 4 y 5). Estas variaciones se reflejan de manera significativa en la sumatoria Lc y en el índice r entre los brazos cromosómicos l y s (Tabla 6 y 7).
La observación detallada del número y posición de las constricciones secundarias permitió evidenciar diferencias cariológicas adicionales entre las especies estudiadas. En la Fig.1 se indican los satélites presentes en los cariotipos de cada una de las especies; A. arborescens (Fig. 1a) y A. chinensis (Fig. 1b) presentaron cuatro constricciones secundarias, dos en el segundo par de cromosomas (L2) y las otras dos constricciones en el par L4; A. succotrina (Fig. 1c) y A. vera (Fig. 1e) mostraron constricciones secundarias en L1 y L4; por otro lado, A. saponaria (Fig. 1d) presentó sólo tres constricciones secundarias, dos en los L4 y una en el primer par cromosómico de menor tamaño (S1).
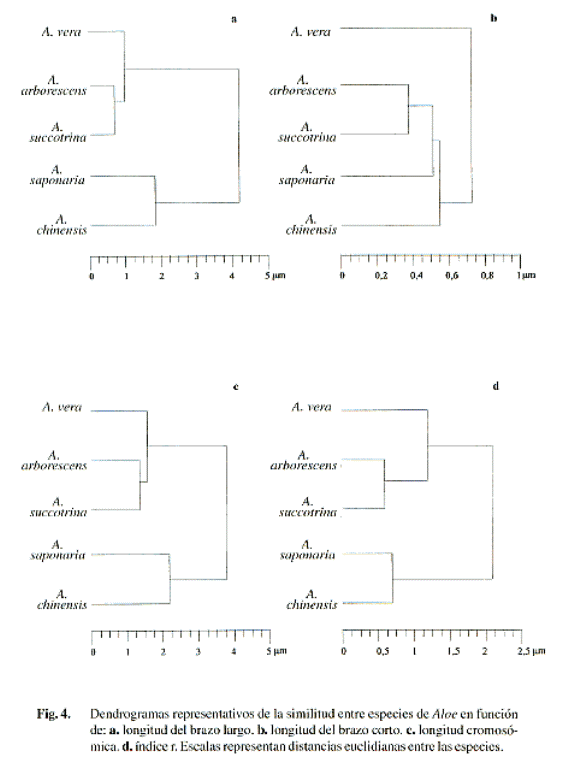
Una visión integral de la similitud cromosómica entre las especies analizadas se muestra en la Fig. 4. Las distancias euclidianas, determinadas a partir de los promedios simples para las variables l, Lc y r, indican que las especies más análogas son A. arborescens y A. succotrina, formando un grupo al cual se une cercanamente A. vera. Por otro lado, A. saponaria y A. chinensis forman un grupo estrechamente relacionado, separado del resto de las especies. Al considerar la longitud del brazo corto, se mantiene el agrupamiento entre A. arborescens y A. succotrina; sin embargo, la afinidad de este primer grupo con respecto a A. vera difiere de la tendencia anterior, observándose mayor similitud con A. saponaria y A. Chinensis.
DISCUSIÓN
Las diferencias cariológicas observadas en las cinco especies de Aloe son claras evidencias de que la estabilidad cromosómica sugerida en este grupo de plantas ha sido sustentada principalmente en la presencia de un mismo número de cromosomas (2n = 14) y la tendencia asimétrica de sus cariotipos, prestando menor importancia a las variaciones individuales en la longitud de los brazos cromosómicos de cada grupo de homólogos. En este sentido, Mata (1982) indica la necesidad de realizar estudios minuciosos en los cariotipos de las especies de Aloe, a fin de determinar de modo más preciso la similitud cariológica dentro de este género.
El interés por estudiar las características cromosómicas de las especies de Aloe ha estado presente desde comienzos del siglo XX. Taylor (1925a) estudia los cromosomas de algunas especies de Aloe, Gasteria y Haworthia, principales géneros de la familia Aloaceae, llegando a la conclusión de que la mayoría poseen ocho cromosomas grandes (L) y seis pequeños (S). Snoad (1951) realiza un estudio más detallado de estos tres géneros y clasifica a los cromosomas en cuatro grupos discriminados por talla y posición del centrómero (grupo A = dos cromosomas grandes con brazos cortos de mayor tamaño, B = cuatro cromosomas grandes con brazos cortos de tamaño intermedio, C = dos cromosomas grandes con brazos cortos de menor tamaño y C = seis cromosomas pequeños).
Según Brandham (1971), la morfología de los cromosomas es similar en la mayoría de las especies de Aloe, manteniéndose cuatro cromosomas grandes en el set básico (haploide), los cuales pueden ser identificados individualmente. El primer cromosoma L1 posee el brazo corto más largo y más fácilmente reconocible. L4 es el cromosoma que presenta menor tamaño y sus brazos cortos son los más pequeños. L2 y L3 son intermedios y no se distinguen fácilmente. Entre los cromosomas pequeños, el S3 se distingue de S1 y S2 por presentar la longitud más corta.
Una manera de diferenciar estos cariotipos es por la presencia de constricciones secundarias. Sapre (1975), en su investigación sobre A. vera, concluye inicialmente que no hay constricciones secundarias en esta especie, a diferencia de lo observado por sus antecedentes (Taylor 1925b; Sato 1937, 1942) en A. arborescens, A. saponaria y A. spuria. Posteriormente, Sapre (1978) repite la experiencia en A. vera y logra reconocer constricciones secundarias en los pares L1 y L4, lo que pudo asimismo constatarse en el presente estudio, además de observar diferencias en el número y posición de estas constricciones en los cariotipos del resto de las especies evaluadas.
La dificultad para observar constricciones secundarias y la variación de longitud en los cromosomas haploides reportadas por Sapre (1975) y Marshak (1934), respectivamente, sugieren la existencia de posibles reordenamientos cromosómicos durante la meiosis que influyen en la morfología de los cromosomas y dificultan la comparación cariológica entre especies. En tal sentido, la evaluación cromosómica en los meristemas radicales de los esporófitos y el mantenimiento de condiciones experimentales similares ofrecen mayor confiabilidad para determinar posibles variaciones cromosómicas interespecíficas.
Brandham (1971) expresa que las plantas de Aloe presentan una considerable variabilidad en el número y posición de los satélites, indicando que estas estructuras son observadas generalmente en los brazos largos de los cromosomas L1 y en uno o dos de los otros pares grandes. Menciona además, que no existen reportes de constricciones secundarias en los brazos cortos de los cromosomas grandes, ni en los brazos largos de los cromosomas pequeños; incluso sugiere que las supuestas constricciones secundarias presentes en regiones intermedias de los brazos largos, son provocadas por un efecto de torsión o enrollamiento de las cromátidas hermanas en regiones de heterocromatina. En el presente trabajo la observación de constricciones secundarias terminales en los brazos largos de los cromosomas grandes permitió establecer analogías entre las especies. No se encontraron constricciones secundarias en los brazos largos de los cromosomas pequeños, sino más bien en el brazo corto de uno de los cromosomas pequeños (A. saponaria) y en los brazos largos de los cromosomas L1, L2 y L4 en las otras especies estudiadas.
Matos et al. (1998) identificaron bandas Ag-NORs en los brazos cortos de los pares cromosómicos L1, L4, S2 y S3 de A. vera, siendo los cromosomas pequeños los que más frecuentemente presentaron este tipo de afinidad por el nitrato de plata. Por el contrario, en el presente estudio no se observaron constricciones secundarias en los brazos cortos, con excepción de un solo satélite localizado en uno de los cromosomas pequeños (S1) de A. saponaria. Tomando en cuenta los estudios citogenéticos de Lacadena et al. (1984), Dolezel et al. (1989), Vieira et al. (1990),Wajahatullah & Vahidy (1990), Moscone et al. (1995) y Nogueira et al. (1995), en los que se sugiere de manera reiterada la ubicación de organizadores nucleolares (NORs) a lo largo de las constricciones secundarias, en por lo menos un cromosoma del complemento diploide, es necesario dilucidar la presencia excepcional de bandas Ag-NORs en regiones no asociadas a las constricciones secundarias de los cromosomas de A. vera. Las observaciones de Matos et al. (1998) pueden ser atribuidas a la presencia de regiones de heterocromatina altamente condensadas que muestren coloración similar a la apariencia de bandas Ag-NORs o ser el resultado de la tinción inespecífica de otras regiones ricas en ARN que se asocian al nitrato de plata utilizado para revelar la expresión de ARN ribosómico.
Las variaciones en la longitud de los brazos cromosómicos, así como en el número y posición de las constricciones secundarias en las especies estudiadas, pueden ser el resultado de translocaciones recíprocas y/o no recíprocas, además de posibles deleciones terminales con pérdida de fragmentos cromosómicos que involucren a dichas constricciones. Esta idea es compartida por Brandham (1971), al presentar cariotipos homocigotos y heterocigotos para el número y posición de satélites, atribuidas a intercambios de fragmentos cromosómicos terminales. Los reordenamientos cromosómicos en especies de Aloe pueden llegar incluso a establecer marcadas diferencias a nivel de poblaciones, debido a mutaciones cromosómicas como deleciones, intercambios, inversiones paracéntricas y pericéntricas (Brandham 1975, 1976, 1977; Brandham & Johnson 1977; Adams et al. 2000). Para esclarecer estas variaciones cromosómicas es recomendable analizar los patrones de bandeo intracromosómicos mediante procedimientos de tinción diferencial de la cromatina y regiones específicas del cromosoma.
Algunos híbridos de Aloe generados por cruzamientos entre especies de origen cercano presentan dificultad para diferenciar a los miembros de una pareja de homólogos; mientras que al cruzar especies que se presumen son diferentes en su tiempo de origen (ancestrales x derivadas), las diferencias cromosómicas son más notables. Este planteamiento sugiere que existen variaciones en la longitud de los cromosomas que pueden ser interpretadas como evidencias de divergencia entre estas especies vegetales, considerando como más derivadas a las que presentan cromosomas de mayor longitud, lo cual debe obedecer a incrementos proporcionales en ambos brazos cromosómicos (Brandham & Doherty 1998).
Smith (1991) sugiere que el ancestro del género Aloe fue posiblemente una planta de escasos 150 mm de longitud. De acuerdo a esta teoría, un ensayo incipiente sobre el origen de las cinco especies estudiadas, tomando en cuenta sus hábitos de crecimiento, ubicaría en primer lugar a A. chinensis, por ser una pequeña planta que no supera los 200 mm de altura; en segundo lugar el grupo conformado por A. saponaria, A. succotrina y A. vera, que son hierbas acaules de 400 a 750 mm; y finalmente A. arborescens, un arbusto que alcanza más de 3 m de altura. No obstante, cualquier intento por proponer relaciones filogenéticas entre estas especies debería sustentarse en el análisis de numerosas características morfológicas, involucrando el mayor número de especies posibles, lo cual sería aún arriesgado si no se consideran caracteres auxiliares, incluyendo el cariotipo. Los análisis de las variables cromosómicas l, s, Lc y r realizados en la presente investigación, permiten reconocer analogías cariológicas que pudieran complementar estudios filogenéticos posteriores.
Los agrupamientos de A. chinensis y A. saponaria, y por otro lado, A. succotrina, A. arborescens y A. vera, basados en las distancias euclidianas para las variables cromosómicas, guardan en mayor o menor grado asociación con la estructura vegetativa en dichas especies. Una vez más, estas asociaciones fenéticas deberán considerarse como auxiliares en el análisis integral del género Aloe debido a que los reordenamientos cromosómicos comunes entre especies no indican que exista estrecha relación filogenética entre ellas. Esta sugerencia se sustenta aún más, al evidenciarse controversias entre los criterios para el establecimiento de relaciones evolutivas propuestos por algunos autores. De acuerdo a la teoría de Smith (1991), de las cinco especies analizadas, A. chinensis y A. saponaria podrían ubicarse como las más ancestrales por su menor tamaño; sin embargo, considerando lo establecido por Stebbins (1971), Brandham (1976), Valdés (1997) y Adams et al. (2000), estas especies se ubicarían como derivadas por presentar los cariotipos más asimétricos y cromosomas de mayor tamaño. Esta situación reafirma la necesidad de extender los análisis cariológicos en combinación con otros estudios morfoanatómicos, citológicos, bioquímicos y moleculares que proporcionen mayor cantidad de atributos para determinar de forma más completa la magnitud de la diversidad genética y relaciones filogenéticas dentro de este grupo de plantas.
AGRADECIMIENTOS
Los autores agradecen al Consejo de Investigación de la Universidad de Oriente por el financiamiento parcial de este trabajo a través del proyecto CI-5- 1001-0900/99. Igualmente agradecen la asesoría del Profesor Williams Lampe durante las fases de microscopía y procesamiento de imágenes fotomicrográficas.
BIBLIOGRAFÍA
1. Adams, S.P., I.J. Leitch, M.D. Bennett & A.R. Leitch. 2000. Aloe L. A second plant family without (TTTAGGG)n telomeres. Chromosome 109: 201-205. [ Links ]
2. Brandham, P.E. 1971. The chromosomes of the Liliaceae: II. Polyploidy and karyotype variation in the Aloineae. Kew Bull. 25(3): 381-389. [ Links ]
3. Brandham, P.E. 1975. Stabilised breakage of a duplicated chromosome segment in Aloe. Chromosoma 51: 269-278. [ Links ]
4. Brandham, P.E. 1976. The frecuency of spontaneous structural change. In: Current chromosome research (Jones, K. & P.E. Bradham, eds.), pp. 77-87. Elsevier, Amsterdam. [ Links ]
5. Brandham, P.E. 1977. The meiotic behaviour of inversions in polyploid Aloineae. Chromosoma 62: 69-84. [ Links ]
6. Brandham, P.E. & M.A. Johnson. 1977. Population cytology of structural and numerical chromosome variants in the Aloineae (Liliaceae). Pl. Syst. Evol. 128: 105-122. [ Links ]
7. Brandham, P.E. & M.J. Doherty. 1998. Genomic size variation in the Aloaceae, an Angiosperm family displaying karyotypic orthoselection. Ann. Bot. 82 (supl. A): 67-73. [ Links ]
8. Carter, S. 1994. Flora of tropical east Africa. Aloaceae. Royal Botanic Gardens, Kew. [ Links ]
9. Cowling, R.M. 1982. Patterns of plant endemism in the south east Cape. The Naturalist 27: 17-36. [ Links ]
10. Dolezel, J., J. Cihalikova & O.V. Zakchlenjuk. 1989. Sequential estimation of nuclear DNA and silver staining of nucleoli in plant cells. Stain tech. 64(1): 9-13. [ Links ]
11. Fukui, K. & S. Nakayama. 1996. Plant chromosomes: laboratory methods. CRC Press, Boca Ratón. [ Links ]
12. Holland, P.G. 1978. An evolutionary biogeography of the genus Aloe. J. Biogeogr. 5: 213-226. [ Links ]
13. Imery, J. 2000. Inducción de tetraploidía en Aloe vera (L.) Burm.f. Tesis de Maestría.Postgrado en Biología aplicada. Universidad de Oriente. Cumaná. [ Links ]
14. Lacadena, J.R., M.C. Cermeño, J. Orellana & J.L. Santos. 1984. Evidence for wheatrye nucleolar competition (amphiplasty) in triticale by silver staining procedure. Theor. Appl. Genet. 67: 207-211. [ Links ]
15. Levan, A., K. Fredga & A. Sandberg. 1964. Nomenclature for centromeric position on chromosomes. Hereditas 52: 201-220. [ Links ]
16. Marshak, A. 1934. Chromosomes and compatibility in the Aloinae. Amer. J. Bot. 21: 592-597. [ Links ]
17. Mata, A. 1977. Estudio citogenético de las especies Aloe ciliaris Haw., Aloe tenuior Haw., Aloe variegata L. y Aloe vera L. (Liliaceae). Trabajo de Ascenso. Escuela de Ciencias. Universidad de Oriente. Cumaná. [ Links ]
18. Mata, A. 1982. Estudios cromosómicos y análisis de bandas heterocromáticas de siete especies de la familia Liliaceae. Trabajo de Ascenso. Universidad de Oriente. Cumaná. [ Links ]
19. Matos, A., J. Molina & D. Acosta. 1998. Localización de NORs en cromosomas de Aloe vera L. (Aloaceae). Acta Bot. Venez. 21(2): 1-9. [ Links ]
20. Moscone, E.A., J. Loidl, F. Ehrendorfer & A.T. Hunziker. 1995. Analysis of active nucleolus organizing regions in Capsicum (Solanaceae) by silver staining. Amer. J. Bot. 82(2): 276-287. [ Links ]
21. Nogueira, C.Z., P.M. Ruas, C.F. Ruas & M.S. Rerrucci. 1995. Karyotypic study of some species of Serjania and Urvillea (Sapindaceae; Tribe Paullinieae). Amer. J. Bot. 82(5): 646-654. [ Links ]
22. Riley, H.P. & S.K. Majumdar. 1979. The Aloinae. A biosystematic survey. The University Press, Kentucky. [ Links ]
23. Romero, C. 1986. A new method for stimating karyotype asymmetry. Taxon 35: 526-530. [ Links ]
24. Sapre, A. 1975. Meiosis and pollen mitosis in Aloe barbadensis Mill. Cytologia 40: 525-553. [ Links ]
25. Sapre, A. 1978. Karyotype of Aloe barbadensis Mill.: A reinvestigation. Cytologia 43: 237-241. [ Links ]
26. Sato, D. 1937. Karyotype alteration and phylogeny. I. Analysis of karyotypes in Aloineae with special reference to the SAT-chromosome. Cytologia Fujii Jub. vol. 80-95 pp. [ Links ]
27. Sato, D. 1942. Karyotype alteration and phylogeny in Liliaceae and allied families. Jap. J. Bot. 12: 57-161. [ Links ]
28. Smith, G. 1991. Additional notes on the taxonomic status and habitat of Aloe bowiea (Asphodelaceae: Aloideae). Aloe, J. Succ. Soc. S.A. 28(1): 9-17.
29. Snoad, B. 1951. Chromosome numbers of succulent plants. Heredity 5: 279-283. [ Links ]
30. Sokal, R. & F. Rohlf. 1979. Biometría, principios y métodos estadísticos en la investigación biológica. H. Blume, Madrid. [ Links ]
31. Stebbins, G.L. 1971. Chromosomal evolution in higher plants. Edward Arnold, London. [ Links ]
32. Takahashi, C., I. Leitch, A. Ryan, M. Bennett & P. Brandham. 1997. The use of genomic in situ hybridization (GISH) to show transmission of recombinant chromosomes by a partially fertile bigeneric hybrid, Gasteria lutzii x Aloe aristata (Aloaceae), to its progeny. Chromosoma 105: 342-348. [ Links ]
33. Taylor, W.R. 1925a. Cytological studies on Gasteria. II. A comparison of the chromosomes of Gasteria, Aloe, and Haworthia. Amer. J. Bot. 12: 219-223. [ Links ]
34. Taylor,W.R. 1925b. Chromosome constrictions as distinguishing characteristics in plants. Amer. J. Bot. 12: 238-244. [ Links ]
35. Valdés, B. 1997. Caracteres taxonómicos: citología y citogenética. In: Botánica (Izco, J., E. Barreno, M. Brugués, M. Costa, J. Devesa, F. Fernández, T. Gallardo, X. Llimosa, E. Salvo, S. Talavera & B. Valdés, eds.), pp. 133-154. McGraw-Hill, Madrid. [ Links ]
36. Van Wyk, B.E. & G. Smith. 1996. The Aloes of South Africa. Briza Publications, Pretoria. [ Links ]
37. Vieira, R., A. Queiroz & W. Viegas. 1990. Visualization of nucleolar organizing regions in nucleoli of interphase plant cells. Cytologia 55: 339-347. [ Links ]
38. Vij, S.P., M. Sharma & I.S. Toor. 1980. Cytogenetical investigations into some garden ornamentals II. The genus Aloe L. Cytologia 45: 515-532. [ Links ]
39. Wajahatullah, W.K. & A.A. Vahidy. 1990. Karyotyping and localization of nucleolar organizer regions in garlic, Allium sativum L. Cytologia 55: 501-504. [ Links ]












 uBio
uBio