Acta Botánica Venezuelica
versión impresa ISSN 0084-5906
Acta Bot. Venez. v.28 n.2 Caracas 2005
RELACIÓN ENTRE LA MORFOANATOMÍA FOLIAR DE TRES ESPECIES DE MICONIA (MELASTOMATACEAE) CON SU HÁBITAT Y DISTRIBUCIÓN ALTITUDINAL EN EL PARQUE NACIONAL SIERRA NEVADA DE MÉRIDA, VENEZUELA
Relationship between leaf structure of three species of Miconia (Melastomataceae) and their habitat and altitudinal distribution in the Sierra Nevada National Park, Mérida, Venezuela
Francisca ELY, Fresia TORRES y Juan GAVIRIA
Centro Jardín Botánico de Mérida. Facultad de Ciencias. Núcleo La Hechicera. Universidad de Los Andes. Mérida. fely@ula.ve
RESUMEN
En la Sierra Nevada de Mérida, entre los 3.000 - 4.000 m snm, crecen tres especies de Miconia (Melastomataceae): M. chionophylla, M. latifolia y M. tinifolia. La primera es un arbusto enano de los bosques de Polylepis sericea y las dos últimas son árboles del bosque paramero. Con el objeto de describir y comparar en estas especies sus patrones de distribución y su hábitat, se realizaron estudios morfoanatómicos foliares, colectando material de diferentes individuos a lo largo del gradiente altitudinal. Miconia latifolia y M. tinifolia ascienden hasta los 3.500 m y presentan hojas típicamente xeromórficas: venación reticulada, cutícula gruesa, densidad estomática alta, epidermis de células pequeñas, hipodermis pluriestratificada y mesofilo muy compacto. M. chionophylla, en cambio, presenta hojas mesomórficas: venación y mesofilo laxo, cutícula delgada, densidad estomática baja, células epidérmicas grandes y carece de hipodermis, pero asciende a 4.000 m snm.
Palabras clave: Melastomataceae, Miconia, Morfología foliar,Anatomía foliar, Venación, Andes venezolanos
ABSTRACT
In the Sierra Nevada National Park, in Mérida, three species of Miconia (Melastomataceae) occur between 3.000 and 4.000 m asl. These species are: M. chionophylla, M. latifolia and M. tinifolia. The first is a dwarf shrub of the Polylepis sericea forests, whilst the other two species are trees of the upper montane forests. With the purpose of describing and comparing these three species, their distribution and habitat, the morphoanatomical characters of the leaves were studied in samples collected from individuals growing at different altitudes, along this gradient. Miconia latifolia and M. tinifolia reach 3.500 m and exhibit typical xeromorphic leaves: reticulated vein pattern, thick cuticles, elevated stomatal density, small epidermic cells, multistratified hypodermis and a compact mesophyll. M. chionophylla, instead, exhibits typical mesomorphic leaves, characterized by a lax vein pattern and mesophyll, thin cuticles, relatively low stomatal density and lacks a hypodermis, yet reaches 4.000 m asl.
Key words: Melastomataceae, Miconia, Leaf morphology, Leaf anatomy,Vein patterns, Venezuelan Andes
INTRODUCCIÓN
Las melastomatáceas se destacan entre las familias más vistosas de los trópicos por sus numerosos géneros que se estiman entre 170-200 con 4.500-4.550 especies (Wurdack 1973, 1980; Mentink & Baas 1992). En Venezuela se han descrito hasta el presente 50 géneros y 500 especies distribuidas entre la Cordillera de los Andes, la Cordillera de la Costa, las sabanas naturales y los tepuyes (Wurdack 1973). La nerviación acródroma de las hojas, que constituye un carácter típico de la familia, permite distinguir fácilmente a las especies en cualquier formación vegetal. Las melastomatáceas están ampliamente representadas en la selva nublada (Wurdack 1973, 1980; Vareschi 1978, 1980; Schneider 2001), no obstante, muchos de sus géneros, en especial el género Miconia, colonizan zonas recientemente intervenidas como los claros de los bosques nublados y bosques secundarios y con mucha frecuencia, las orillas de las carreteras (Garcé 1998; Schneider 2001). La capacidad para adaptarse a ambientes tan diversos sugiere que se trata de un género con un gran potencial para recuperar zonas que hayan sufrido perturbaciones.
Pese a ser una familia tan prolífica en especies y de tan amplia distribución (Wurdack 1973, 1980; Vareschi 1980), se puede afirmar que en Venezuela, hasta el presente, los estudios anatómicos realizados en melastomatáceas son relativamente escasos (Roth 1973; Ely & Torres 1993, 1995; Ely 1996; Garcé 1998). Las características anatómicas foliares constituyen una herramienta muy útil para dilucidar los patrones de distribución de las especies vegetales, que están siempre condicionadas a la presencia de determinados patrones anatómicos y estructurales que les permiten adaptarse exitosamente a diferentes ambientes. Las melastomatáceas reflejan con gran precisión la situación hídrica y climática de su hábitat, mediante modificaciones en su morfología y dimensiones foliares (Richter 1991) y muchas de sus especies se destacan por abarcar extensos rangos altitudinales (Wurdack 1973, 1980; Dudley 1978).
En el presente estudio se comparan los rangos de distribución, hábitat y caracteres foliares de tres especies de esta familia: Miconia chionophylla Naudin, M. latifolia (D.Don) Naudin y M. tinifolia Naudin, que crecen en las formaciones vegetales boscosas que se distribuyen a lo largo de la vertiente húmeda de Sierra Nevada. Las dos primeras especies habitan el bosque paramero o chirivital (conocido también como bosque nublado montano alto y subpáramo), el cual asciende hasta los 3.500 m snm y limita con la vegetación del páramo, y la tercera, en los bosques de Polylepis sericeaWedd. que crecen entre el límite superior del páramo y el superpáramo hasta los 4.100 m snm. Estas especies de Miconia están bien representadas en la flora de la Cordillera de Los Andes, debido a que se distribuyen desde Venezuela hasta Bolivia (Wurdack 1973, 1980).
El objetivo del estudio fue describir la estructura foliar de las tres especies mencionadas y relacionarlas con su hábitat y distribución altitudinal, teniendo en cuenta que se trata de un género típico del neotrópico (Smith & Cleef 1988), particularmente de zonas mesotérmicas (Wurdack 1973, 1980), por lo que se presume que las especies que crecen en la cordillera andina deben presentar caracteres foliares especializados que les permitieron adaptarse a las condiciones ambientales que distinguen las altas montañas tropicales (Vareschi 1978; Azócar & Monasterio 1980; Vareschi 1980; Schneider 2001).
ÁREA DE ESTUDIO
El estudio se realizó en el Parque Nacional Sierra Nevada del estado Mérida, Venezuela, ubicado al SE de la ciudad de Mérida, en el Municipio Libertador, entre los 8° 34 y 8° 36 Lat. N. y los 71° 4 y los 71° 7 Long. O (Petit 1984).
El clima a lo largo de esta vertiente se destaca por fluctuaciones bruscas en los ciclos diarios de temperatura, con temperaturas diurnas de hasta 17°C en los días más cálidos del año, pero que en la noche pueden descender hasta 0°C e inclusive aún más a partir de los 3.800 m snm. La temperatura promedio en el límite inferior del gradiente, es decir a los 3.000 m snm es de 10°C, a los 3.400 m snm desciende a 7°C, y a partir de dicha elevación desciende dos grados cada 400 m; en consecuencia, a los 3.800 m snm la temperatura promedio es 5°C y a los 4.000 m snm desciende a 4°C (Monasterio & Reyes 1980). Las bajas temperaturas retardan los procesos de degradación de materia orgánica en el suelo y originan suelos oligotróficos. A estas condiciones se suman la intensa radiación, el escaso contenido de anhídrido carbónico atmosférico, las fuertes corrientes de viento y las limitaciones hídricas en las zonas de pendiente acentuada (Vareschi 1978, 1980; Azócar & Monasterio 1980).
MATERIALES Y MÉTODOS
La recolección de muestras foliares se realizó a lo largo de un gradiente altitudinal de 1.000 m, cuyo límite inferior se ubicó a 3.000 m snm y el superior a 4.000 m snm. Se muestrearon las comunidades vegetales propias de los diferentes pisos altitudinales que se ubican a lo largo de este gradiente: el bosque paramero o chirivital (Vareschi 1978; Ricardi 2000), la vegetación del páramo, hasta el límite inferior del superpáramo, ubicado a 4.000 m snm (Berg 1996) y los bosques de Polylepis sericea que ascienden hasta los 4.000 m snm. Por ello se delimitó una transecta coincidente con el trayecto cubierto por el teleférico Mérida-Pico Espejo; es decir, desde los alrededores de la Estación "La Aguada" (3.330 m snm) hasta la Estación "Loma Redonda" (4.050 m snm), y se muestreó a partir de 3.000 m snm, a 3.400, 3.800 y 4.000 m snm. La recolección de muestras se realizó desde diciembre de 1994 hasta mayo de 1995. Los especimenes recolectados fueron depositados en el herbario del Centro Jardín Botánico de La Universidad de Los Andes (MERC), ubicado en el núcleo universitario La Hechicera, estado Mérida,Venezuela.
Miconia chionophylla Naudin VENEZUELA:MÉRIDA: Municipio Libertador, alrededores de la Estación "Loma Redonda", 3.800-4.000 m snm 12/11/1994; 14/10/1995. F. Ely& J. Gaviria. N° 409, 414-416. MERC.
Miconia latifolia (D.Don) Naudin VENEZUELA:MÉRIDA: Municipio Libertador, trayecto de Estación "La Aguada-Loma Redonda", 3.000-3.500 m snm 12/11/1994; 14/10/1995. F. Ely& J. Gaviria. N° 410, 413, 417, 418. MERC.
Miconia tinifolia Naudin VENEZUELA: MÉRIDA: Municipio Libertador, trayecto Estación "La Aguada-Loma Redonda", 3.000-3.500 m snm. 12/11/1994; 14/10/1995. F. Ely& J. Gaviria. N° 411, 419-421. MERC.
La venación se estudió en hojas diafanizadas según la técnica de Foster (1950) con las modificaciones de Hickey (1973).
Para los estudios anatómicos se utilizaron hojas adultas colectadas de porciones de ramas cortadas aleatoriamente a diferentes alturas de plantas en floración, y se fijaron en FAA (Johansen 1940). Las epidermis se desprendieron empleando el método de Jeffrey (Johansen 1940) y se tiñeron con la doble coloración de fucsina básica (0,2%) y azul de astra (0,5%) empleada por Luque et al. (1996). Como medio de montaje se utilizó una solución acuosa de glicerina al 50% (Johansen 1940).
El mesofilo y el nervio medio se estudiaron en secciones transversales de la región media de la lámina de muestras seleccionadas de diferentes hojas. Para ello, se realizaron secciones a mano alzada, montadas en solución acuosa de glicerina al 50% (Johansen 1940), y secciones de material deshidratado en la serie de alcoholes butílicos e incluido en paraplast (Johansen 1940). Éstos fueron cortados en un micrótomo de deslizamiento y las preparaciones se montaron en bálsamo de Canadá. Tanto los cortes a mano alzada como los deshidratados se tiñeron con la doble coloración de safranina–azul de alcian empleada por Tolivia & Tolivia (1987).
La presencia de elementos lignificados se determinó empleando fluoroglucina disuelta en etanol al 95% y ácido clorhídrico concentrado (Johansen 1940).
La morfología y posición de las esclereidas se estudiaron en macerados de hojas aclaradas con hipoclorito de sodio (Johansen 1940), posteriormente diafanizadas con hidrato de cloral (Foster 1950) y coloreadas con safranina disuelta en etanol al 0,5% (Johansen 1940). Estos macerados se montaron en glicerina acuosa al 50%. El tipo de esclereidas se determinó utilizando la clasificación propuesta por Tschirch (1885, en Metcalfe 1979) y de acuerdo a su posición según Foster (1947) y Rao & Das (1979).
La presencia de taninos se determinó en secciones transversales realizadas a mano alzada sumergidas en solución acuosa de cloruro férrico al 10% (Johansen 1940).
El tamaño de las células epidérmicas, estomas, células hipodérmicas, células del parénquima en empalizada y esclereidas se determinaron midiendo 20 unidades seleccionadas aleatoriamente en cinco campos diferentes (Torres 1996 a, b). El mismo procedimiento se empleó para determinar la densidad estomática en las diferentes especies. El índice estomático se calculó utilizando la fórmula de Salisbury (1927, en Wilkinson 1979). Todos los dibujos fueron efectuados en una cámara lucida incorporada a un microscopio Zeiss modelo Axioscop 20 y las fotomicrografías se tomaron en una cámara MC80 incorporada a dicho microscopio. La simbología de la proporción floema-xilema utilizada en los dibujos de nervio medio es la propuesta por Metcalfe & Chalk (1957).
RESULTADOS
Las especies de Miconia recolectadas se determinaron según las claves del género elaboradas por Wurdack (1973).
Miconia chionophylla Naudin
Hábito: Arbusto procumbente de 5-10 cm de alto, que crece a elevaciones de 3.600-3.900 m (Wurdack 1973). Hábitat: En la Sierra Nevada crece exclusivamente en los bosques de Polylepis sericea entre 3.800-4.000 m snm, bajo agrupaciones de rocas o troncos caídos.
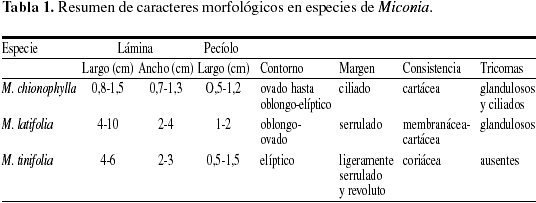
Caracteres morfológicos y venación (Tabla 1).
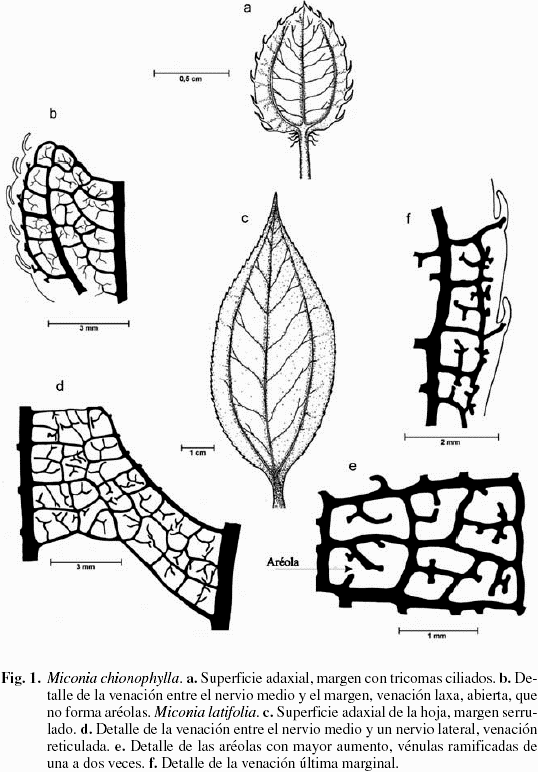
Hojas opuestas, simples, pecíolo de 0,5-1,2 cm de largo, lámina de 2,5-3 mm de grosor, elíptica a ovada, de 0,8-1,5 cm de largo por 0,7-1,3 cm de ancho; de consistencia cartácea, ápice agudo, base obtusa y margen ciliado (Fig. 1a, b), sin indumento, pero con escasos tricomas glandulares esparcidos sobre la lámina (Tabla 1). Venación acródroma basal imperfecta; nervio primario delgado, recto, con ramificaciones; nervios secundarios delgados y arqueados (Fig. 1a); venas terciarias con un ángulo agudo-moderado, laxamente ramificadas formando ojales; las venas de cuarto orden forman ángulos agudos, muy delgados, laxamente ramificadas, exmediales; venación última marginal ojalada, las vénulas se ramifican de una a dos veces y no forman aréolas (Fig. 1b).
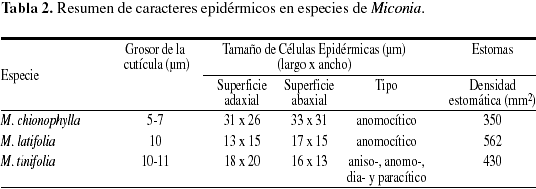
Caracteres anatómicos (Tabla 2, 3 y 4).
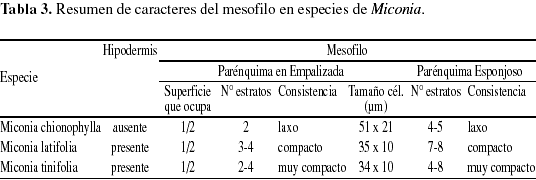
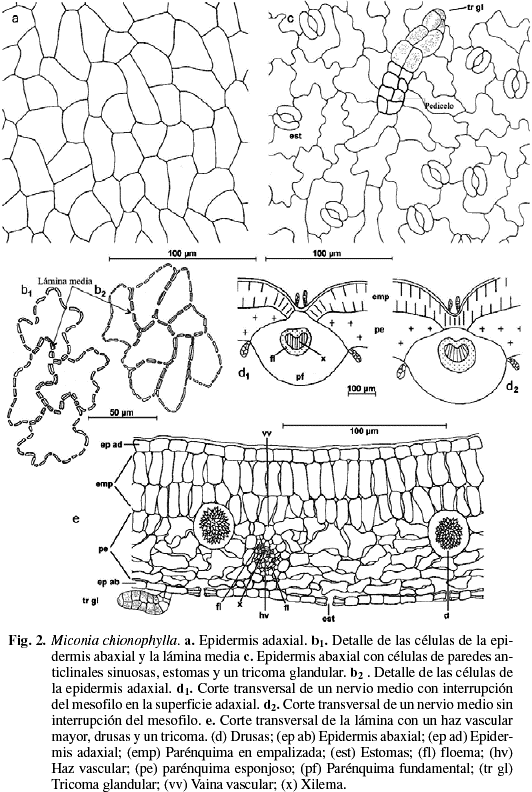
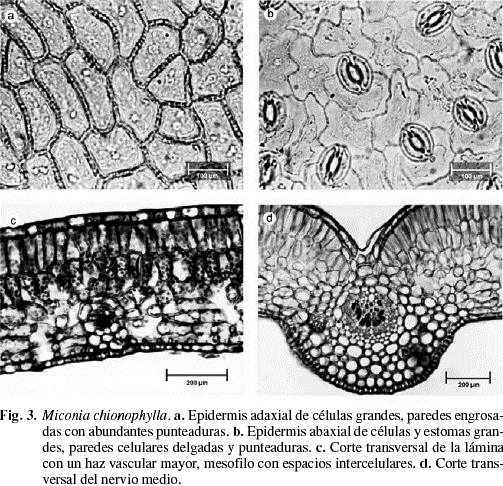
Sobre la haz y el envés presenta tricomas esparcidos de tipo glandular, claviformes de acuerdo a la clasificación propuesta por Wurdack (1983), en la haz son de pedicelo corto, biseriado, de 2-4 células y con la cabeza ovalada, de 4-6 células de paredes delgadas y se restringen a las nervaduras (Fig. 2d1 y d2). En el envés son de mayor tamaño y más abundantes, allí se concentran principalmente sobre las venas, el pedicelo es de 8-10 células y la cabeza de 6-8 células (Fig. 2c-e). Cutícula lisa en ambas superficies de 5-7 µm de grosor. Epidermis uniestratificada en ambas superficies (Fig. 2e y 3c). Epidermis adaxial de células epidérmicas grandes, de un promedio de 31 (16-51) µm de largo por 26 (15-54) µm de ancho; isodiamétricas, polimórficas, o con el eje mayor paralelo a la lámina, poliédricas, de 4-8 caras y paredes ligeramente sinuosas, engrosadas con abundantes punteaduras (Fig. 2a, b1 y 3a). En sección transversal son rectangulares. Epidermis abaxial con abundantes tricomas glandulares, similares a los de la cara adaxial pero de mayor tamaño, concentrados principalmente alrededor del nervio medio y los nervios laterales. Las células epidérmicas son grandes, de 33 (15-46) µm de largo por 31 (17-45) µm, desde isodiamétricas hasta polimorfas, de paredes anticlinales muy sinuosas, ligeramente engrosadas, con abundantes punteaduras (Fig. 2b2 y 3b). En sección transversal, las células son rectangulares. Estomas sólo abaxiales, no sobresalen con respecto al resto de las células epidérmicas (Fig. 2e y 3c), su tamaño promedio es de 22 (20-25) µm de largo por 17 (11-19) µm de ancho, de tipo anomocítico o ranunculáceo (Fig. 2c y 3b). Densidad estomática: 350 estomas/mm2 (Tabla 2). Índice estomático: 19,8%. Mesofilo bifacial, muy laxo (Fig. 2e y 3c); el parénquima en empalizada ocupa aproximadamente la mitad del mesofilo, generalmente es biestratificado, y el tamaño promedio de las células es 51 (41-58) µm de largo por 21 (17-27) µm de ancho, de paredes delgadas y ligeramente onduladas; parénquima esponjoso de 4-6 estratos de células polimorfas, de tamaño variable y paredes onduladas; el tamaño de las células disminuye desde las capas externas hacia las internas (Tabla 3). Tejido vascular formado por haces mayores bicolaterales y menores colaterales (Fig. 2e y 3c), la mayoría de los haces posee conexiones paradermales. Vaina vascular parenquimática, uniestratificada; en los haces mayores, presenta prolongaciones hacia la epidemis abaxial, formadas por células de paredes engrosadas (Fig. 3c). Nervio medio convexo hacia la superficie abaxial y en la superficie adaxial, el parénquima en empalizada puede estar interrumpido sobre el nervio (Fig. 2d1 y 3d), o puede estar reducido a una capa de células (Fig. 2d2). Tejido fundamental constituido por parénquima de células de paredes delgadas; sistema vascular formado por un sólo haz vascular perifloemático, en forma de arco, convexo hacia la superficie abaxial; vaina vascular parenquimática de 1-2 capas de células. Drusas abundantes, de tamaño variable, presentes en todos los tejidos del mesofilo y en el parénquima fundamental del nervio medio (Fig. 2e). Taninos presentes en todas las células del mesofilo.
Miconia latifolia (D.Don) Naudin
Hábito: Arbolito de 1-3 m de alto que crece a elevaciones comprendidas entre los 3.100-3.500 m (Wurdack 1973). Hábitat: En Sierra Nevada, forma parte del bosque paramero que crece entre los 3.000-3.500 m.
Caracteres morfológicos y venación (Tabla 1).
Hojas opuestas, simples, pecíolo de 1-2 cm de largo, lámina oblongo-ovada de 4-10 cm de largo x 2-4 cm de ancho; ápice acuminado y base obtusa (Fig. 1c); consistencia membranácea hasta ligeramente cartácea y margen serrulado. La lámina carece de indumento en las dos superficies, pero presenta tricomas glandulares sobre las nervaduras y la lámina, y tricomas pluricelulares setulosos sobre los nervios principales y los nervios secundarios de la cara abaxial. Venación acródroma basal perfecta; nervio primario grueso, recto, con ramificaciones; nervios secundarios moderados, arqueados (Fig. 1c); nervios terciarios con un ángulo de divergencia casi uniforme, delgados, densamente ramificados y forman venas intramarginales (Fig. 1d); las venas de cuarto orden son recto-obtusas y forman un retículo más o menos ortogonal (Fig. 1e); la venación última marginal es ojalada, las vénulas están ramificadas de una a dos veces y forman aréolas cuadrangulares (Fig. 1f).
Caracteres anatómicos
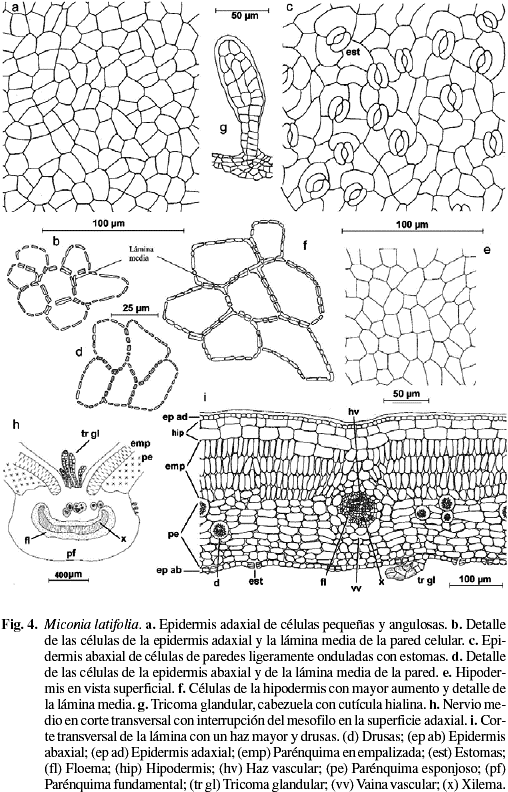
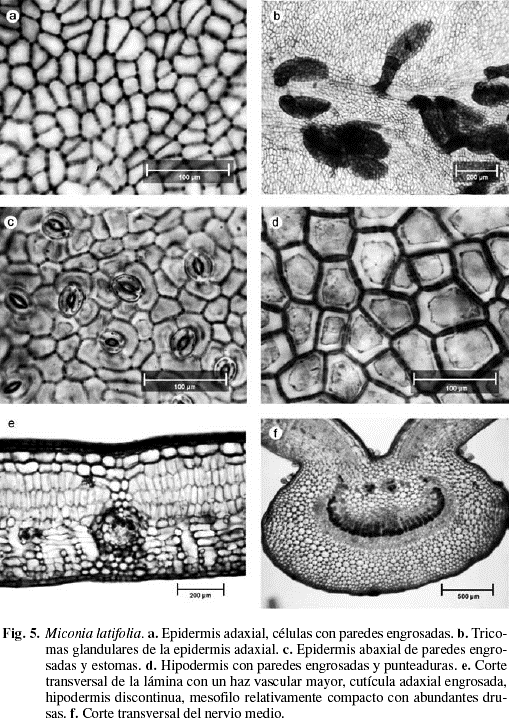
Cutícula lisa de 10 µm de grosor en ambas superficies. Epidermis adaxial con tricomas glandulares de tamaño variable, muy similares a los descritos por Wurdack (1983) (Fig. 4h y 5b), que se ubican sobre el nervio medio y los laterales; el pedicelo es biseriado de 6-10 células con la pared externa impregnada de sustancias grasas y cabeza de 10-16 células de paredes delgadas cubiertas por una cutícula hialina (Fig. 4g). Células epidérmicas pequeñas, casi isodiamétricas, de un promedio de 13 (7-20) µm de largo por 15 (8-22) µm de ancho, polimorfas y angulosas de 4-7 caras, paredes anticlinales casi rectas, engrosadas, con los engrosamientos más acentuados en los ángulos y abundantes punteaduras (Fig. 4a, b y 5a). Epidermis abaxial con dos tipos de tricomas; sobre las nervaduras, tricomas pluricelulares, setulosos, lisos y tricomas glandulares muy semejantes a los descritos para la superficie adaxial, pero en menor densidad (Fig. 4i). Las células epidérmicas son pequeñas, de un promedio de 17 (10-25) µm de largo por 15 (6-24) µm de ancho; polimórficas, poliédricas, de 4-8 caras, paredes anticlinales ligeramente sinuosas, engrosadas, con abundantes punteaduras (Fig. 4c, d y 5c). En sección transversal las células epidérmicas de ambas superficies se aprecian isodiamétricas con el eje mayor paralelo a la lámina (Fig. 4i). Estomas siempre abaxiales (Fig. 4i), de 17 (14-22) µm de largo por 13 (11-16) µm de ancho, de tipo anomocítico o ranunculáceo (Fig. 4c y 5c). Densidad estomática: 562 estomas/mm2. Hipodermis de células grandes, angulosas de 31 (23-34) µm de largo por 34 (23-46) µm de ancho; polimorfas, poliédricas de 5-7 caras, paredes anticlinales rectas, ligeramente engrosadas, con abundantes punteaduras (Fig. 4e, f y 5d) y de 2-3 estratos de células rectangulares, el tercer estrato está interrumpido irregularmente por la empalizada (Fig. 4i y 5e). Mesofilo bifacial, bien diferenciado y relativamente compacto (Fig. 4i y 5e); parénquima en empalizada de 3-4 estratos de células que ocupan aproximadamente la mitad del mesofilo, células de 35 (28-39) µm de largo por 10 (7-14) µm de ancho; de paredes delgadas, las células de los estratos internos son por lo general más cortas; parénquima esponjoso de 7-8 estratos de células, de tamaño y forma variable; los estratos adaxiales son de mayor tamaño con el eje mayor paralelo a la lámina, y los más internos presentan células más pequeñas y polimorfas; tejido vascular formado por haces vasculares bicolaterales incluidos en el parénquima esponjoso; vaina vascular parenquimática de 2-3 estratos de células; en los haces mayores la vaina vascular presenta prolongaciones hacia la cara adaxial conectadas con la hipodermis y hacia la cara abaxial con la epidermis, en los medianos presenta prolongaciones sólo hacia la cara abaxial y los haces menores carecen de prolongaciones epidérmicas. Todos los haces presentan conexiones paradermales entre ellos. Nervio medio prominente hacia la superficie abaxial y con interrupción del mesofilo hacia la superficie adaxial (Fig. 4h y 5f); tejido fundamental constituido por parénquima de células grandes de paredes delgadas; el sistema vascular está formado por un haz bicolateral grande en forma de arco convexo hacia la superficie abaxial y 4-6 haces bicolaterales, pequeños, libres y concéntricos hacia la cara adaxial (Fig. 4h); vaina vascular parenquimática de 2-3 estratos de células pequeñas. Drusas abundantes de tamaño variable distribuidas en la hipodermis, la empalizada, el parénquima esponjoso y el parénquima fundamental del nervio medio, rodeando el tejido vascular (Fig. 4i). Taninos presentes en las células del mesofilo.
Miconia tinifolia Naudin
Hábito: Árbol de 2,5-5 m de alto que crece entre los 1.800-3.400 m (Wurdack 1973). Hábitat: En Sierra Nevada forma parte del bosque paramero que asciende hasta los 3.500 m.
Caracteres morfológicos y venación
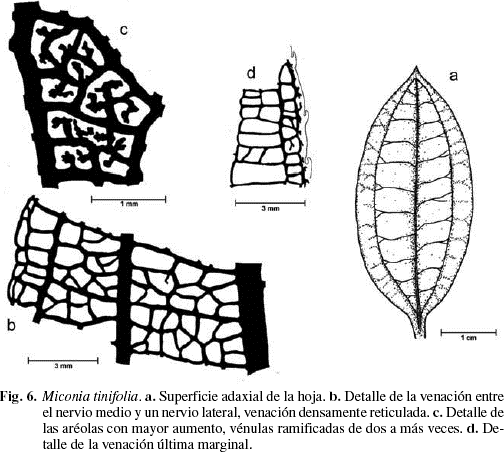
Hojas opuestas, simples, pecíolo de 0,5-1,5 cm de largo, lámina elíptica, de unos 4-6 cm de largo por 2-3 cm de ancho; ápice agudo y base obtusa (Fig. 6a), consistencia coriácea, margen ligeramente serrulado, revoluto. Lámina glabra en la haz y en el envés. Venación acródroma basal perfecta; nervio primario fuerte, derecho, con ramificaciones (Fig. 6a); nervios secundarios moderados, arqueados; nervios terciarios con ángulos recto-obtusos, uniformes, densamente ramificados, que forman venas intramarginales (Fig. 6b); venas de cuarto orden recto-obtusas, que forman un retículo ortogonal; venación última marginal ojalada (Fig. 6c), vénulas ramificadas de 3 a más veces, formando aréolas perfectas, pequeñas, cuadrangulares a pentagonales (Fig. 6d).
Caracteres anatómicos
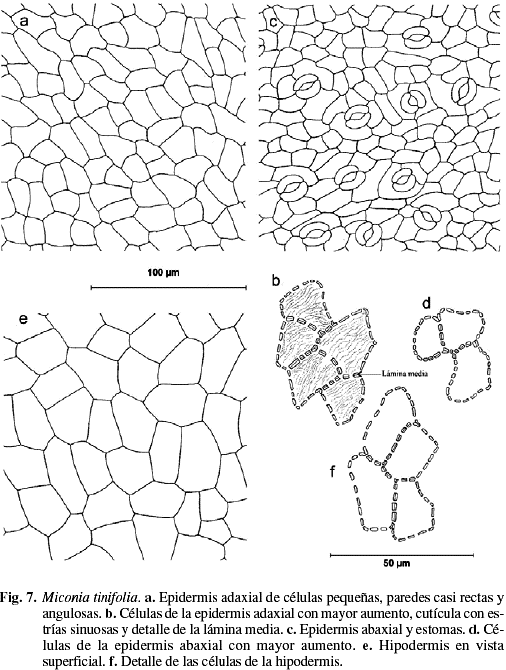
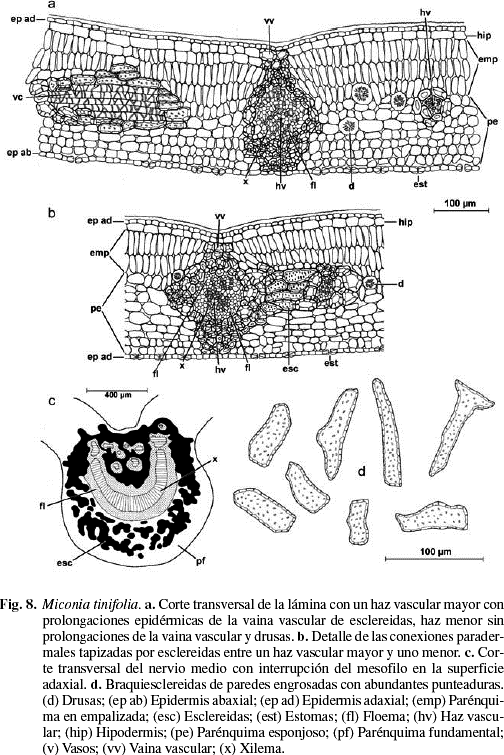
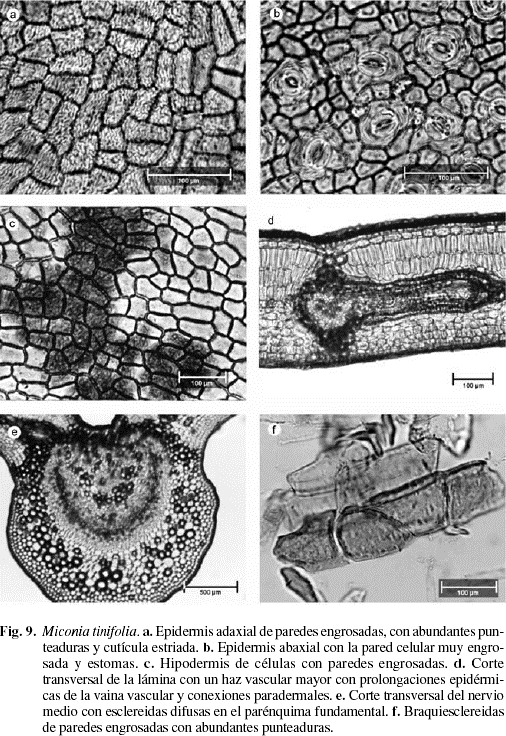
Cutícula en ambas superficies de 10-11 µm de grosor, la adaxial es ornamentada con estrías sinuosas (Fig. 7b y 9a). Cutícula abaxial con estrías paralelas a las células subsidiarias estomáticas (Fig. 9b). Epidermis adaxial y abaxial uniestratificada, de células pequeñas isodiamétricas y estomas sólo abaxiales (Fig. 8a, b). Epidermis adaxial glabra de células pequeñas, casi isodiamétricas de 18 (10-34) µm de largo por 20 (9-38) µm de ancho; polimorfas, de 4-7 caras, angulosas, con paredes anticlinales ligeramente sinuosas, engrosadas y con abundantes punteaduras (Fig. 7a, b y 9a). Epidermis abaxial glabra de células pequeñas de 16 (7-32) µm de largo por 13 (6-21) µm de ancho, polimorfas, de 4-7 caras, paredes anticlinales ligeramente sinuosas, engrosadas con abundantes punteaduras (Fig. 7c, d y 9b). Estomas sólo abaxiales de 18 (16-22) µm de largo por 15 (13-17) µm de ancho, con frecuencia agrupados de 2-4 y de tipo variable: diacítico, paracítico, anisocítico y anomocítico (Fig. 7c y 9b). Densidad estomática: 430 estomas/mm2. Hipodermis de 1-2 estratos de células, el segundo está interrumpido irregularmente por la empalizada (Fig. 8a, b y 9d), células grandes, polimorfas, poliédricas a isodiamétricas, angulosas, de 25 (16-39) µm de largo por 25 (11-42) µm de ancho, de 5-7 caras, con las paredes anticlinales casi rectas, engrosadas y con abundantes punteaduras (Fig. 7e, f y 9c). Mesofilo bifacial, bien diferenciado y muy compacto (Fig. 8a, b y 9d); el parénquima en empalizada ocupa casi la mitad del mesofilo, de 2-4 estratos de células de 34 (23-44) µm de largo por 10 (10-13) µm de ancho; el último estrato es muy discontinuo; parénquima esponjoso de 4-8 estratos de células isodiamétricas, polimorfas, o con el eje mayor paralelo a la lámina; el tamaño de las células disminuye hacia la superficie abaxial; tejido vascular formado por abundantes haces bicolaterales, incluidos en el parénquima esponjoso; vaina vascular constituida externamente por 1-2 estratos de células parenquimáticas e internamente por 2-3 estratos de esclereidas isodiamétricas. En los haces mayores la vaina presenta prolongaciones epidérmicas hacia las dos caras (Fig. 8a, b y 9d), los medianos sólo hacia la cara abaxial, y los menores carecen de prolongaciones epidérmicas. Las conexiones paradermales son muy frecuentes entre los haces, tapizados siempre por las esclereidas (Fig. 8b y 9d). Nervio medio prominente hacia la superficie abaxial y con interrupción del mesofilo en la superficie adaxial (Fig. 8c y 9e); tejido fundamental formado por parénquima de células de paredes engrosadas y abundantes esclereidas isodiamétricas las cuales forman un anillo que rodea los haces hacia la superficie adaxial y están dispersas hacia la superficie abaxial; sistema vascular formado por un haz bicolateral grande en forma de arco convexo hacia la superficie abaxial y 4-6 haces pequeños, bicolaterales, libres y concéntricos hacia la superficie adaxial; vaina vascular formada por esclereidas hacia la superficie adaxial, y por parénquima y algunas esclereidas hacia la superficie abaxial (Fig. 8c). Drusas abundantes de tamaño variable, en idioblastos en la empalizada, en el parénquima esponjoso y en el parénquima fundamental del nervio medio (Fig. 8a). Esclereidas de tipo braquiesclereida (Rao & Das 1972), de 73 (43-106) µm de largo por 23 (17-28) µm de ancho; isodiamétricas, polimórficas y alargadas, de paredes engrosadas con abundantes punteaduras (Fig. 8d y 9f), de disposición vascular-terminal en las venas y difusas en el parénquima fundamental del nervio medio y los nervios laterales (Fig. 8a, b y 9d, e). Taninos presentes en las células del mesofilo.
DISCUSIÓN
Las tres especies descritas de Miconia exhiben diferencias en cuanto a su morfología externa, anatomía y distribución ecológica.
Miconia chionophylla se diferencia de M. latifolia y de M. tinifolia por su ubicación altitudinal al ocupar un rango más elevado, de 3.800-3.900 m snm y porque su hábitat se restringe a sitios sombreados y húmedos, generalmente debajo de troncos caídos y rocas en los bosques de Polylepis que se encuentran a estas alturas y muy rara vez, en la periferia. La estructura foliar de M. chionophylla sugiere como estrategia primordial, la de crecer en ambientes más protegidos, que la resguarden de las bajas temperaturas, la fuerte irradiación y los vientos que caracterizan dichas elevaciones. Esta especie presenta caracteres típicos de una planta mesomórfica (Shields 1950; Fahn 1967, 1986; Esau 1977), adaptada a ambientes de baja irradiación (Dengler 1994):
1- Lámina foliar delgada por el escaso desarrollo del parénquima en empalizada (Dengler 1994).
2- Cutícula lisa y delgada en ambas superficies.
3- Células epidérmicas adaxiales con paredes periclinales ensanchadas que facilitan el paso de la luz a las células del parénquima en empalizada en ese ambiente umbrófilo y paredes anticlinales rectas y engrosadas que incrementan la rigidez de la lámina foliar que carece de tejidos esclerenquimáticos y posee una venación bastante laxa.
4- Estomas y células epidérmicas relativamente grandes asociados a una densidad estomática relativamente baja.
5- Mesofilo laxo y relativamente poco diferenciado (Roth 1990; Dengler 1994). Los espacios intercelulares en el mesofilo aumentan la superficie interna de la hoja y el aire intercelular puede contribuir también a amortiguar las fluctuaciones de temperatura como sugiere Ragonese (1990). El interior de los bosques de Polylepis proporciona un microclima menos inhóspito que el páramo, gracias a que el dosel mitiga las fluctuaciones térmicas diarias, en consecuencia, las temperaturas mínimas nunca llegan a ser equivalentes a las del páramo abierto (Azócar & Monasterio 1980). A pesar de ello, el primer estrato de estos bosques nunca recibe la radiación solar directa, por lo que las temperaturas máximas son siempre inferiores a las del páramo abierto (Azócar & Monasterio 1980). M. chionophylla, por su hábito procumbente, debe tolerar temperaturas considerablemente bajas durante todo el año, razón para suponer que estos espacios intercelulares deben resultarle beneficiosos en estas condiciones. Adicionalmente, el aire intercelular contribuye a la rigidez mecánica de la hoja (Ortega 1982; Torres 1996b), cuya lámina carece de tejidos esclerenquimáticos, como se mencionó anteriormente.
Miconia latifolia y M. tinifolia difieren en la amplitud de su rango altitudinal, el cual se sitúa entre los 3.000-3.500 m snm, para la primera especie, y entre 1.800-3.400 m snm para la segunda, lo cual implica que M. tinifolia fue muestreada en el límite superior de su rango de distribución altitudinal. Estas dos especies difieren también en su ubicación dentro del bosque paramero, ya que M. latifolia se asocia por lo general, con un dosel cerrado, mientras que M. tinifolia se asocia con mayor frecuencia a claros y bordes de esta formación, y su preferencia por ambientes más heliófilos se ve reflejada en una lámina más reducida, de consistencia coriácea con márgenes revolutos.
Pese a las diferencias en cuanto a distribución altitudinal y microclimática, M. latifolia y M. tinifolia presentan muchos caracteres foliares comunes, catalogados como xeromórficos por diversos autores y que en este caso, probablemente las capacitaron para ocupar las altitude mencionadas, aun cuando se trata de un género típicamente neotropical (Smith & Cleef 1988). Ellos son:
1- Cutícula gruesa (Shields 1950; Johnson 1975; Esau 1977; Ehrlinger & Comstock 1987) y en el caso de M. tinifolia, presenta estrías sinuosas en la superficie adaxial que pueden contribuir a reflejar el exceso de luz incidente sobre la lámina.
2- Células epidérmicas muy pequeñas en ambas superficies, con paredes anticlinales muy engrosadas (Shields 1950) y una hipodermis pluriestratificada de paredes engrosadas, estos atributos incrementan la rigidez de la hoja, a la vez que controlan el paso de luz a la empalizada.
3- Densidad estomática elevada y estomas muy pequeños (Shields 1950; Roth 1990).
4- Mesofilo compacto y bien diferenciado (Pyykkö 1966; Esau 1977; Roth 1990; Dengler 1994).
5- Haces vasculares mayores con prolongaciones de la vaina vascular hacia las dos superficies que incrementan la difusión del agua en toda la hoja (Roth 1990; Torres 1996b).
6- Hojas muy vascularizadas con espacios muy reducidos entre las vénulas (Maximov 1931, en Shields 1950).
Otro carácter que realza la xeromorfía foliar de M. tinifolia, y que está ausente en M. latifolia, son las esclereidas vascular-terminales y las esclereidas difusas. Las esclereidas vascular-terminales en las nervaduras posiblemente desempeñan las funciones de acumular agua e incrementar su conducción y difusión en el mesofilo. Estas funciones fueron demostradas por Heide-Jørgensen (1990) en Hakea suaveolens. Dicho autor descubrió que el agua fluía desde las terminaciones de las venas a las extensiones de la vaina vascular de los haces y desde allí, a la epidermis; dicha ruta "xilema-esclereida-epidermis" compensaba la alta resistencia del mesofilo e incrementaba la conducción del agua a las células de la empalizada y a las epidérmicas. Es posible que las esclereidas difusas también intervengan en el almacenamiento de agua en estos tejidos (De Roon 1967; Torres 1996b).
Los tricomas glandulares presentes en M. chionophylla y M. latifolia son típicos de muchas especies de esta familia (Winkler 1965; Wurdack 1983; Ely 1996). En ambas especies se encuentran sobre las nervaduras de ambas superficies pero en mayor densidad en las invaginaciones que forma la lámina sobre el nervio medio y los nervios laterales. Dichos tricomas pueden incluirse entre los caracteres xeromórficos (Fahn 1967, 1986), pues tricomas como éstos, que evidentemente no desempeñan una función de secreción, se les ha atribuido, por el contrario, la absorción del agua que se deposita sobre la hoja (Volkens 1887, en Pyykö 1966; Spalding 1906, en Shields 1950; Zanfireschu 1931, en Shields 1950). Este papel ha sido demostrado en melastomatáceas de El Salvador por Winkler (1965).
Las drusas y los taninos son caracteres propios de la familia Melastomataceae (Metcalfe & Chalk 1957; Costa 1977; Baumgratz & Ferreira 1980, 1984; Mentink & Baas 1992; Ely & Torres 1993; 1996; Garcé 1998) y probablemente contribuyen a reducir la herbivoría, ya que los especímenes recolectados exhibían escasos daños ocasionados por insectos. Garcé (1998) encontró que el contenido de taninos era superior en melastomatáceas de los géneros Miconia y Monochaetum que crecían en sitios muy intervenidos como los bordes de las carreteras, comparados con individuos de las mismas especies que crecían en ambientes menos intervenidos como bosques secundarios y nublados. Winkler (1965) propuso que las drusas pueden almacenar agua que posteriormente puede ser utilizada por la hoja, sin embargo no se han publicado evidencias de ello.
El engrosamiento de las paredes de las células de la epidermis adaxial usualmente se asocia con una disminución en el tamaño de las células acompañado de un engrosamiento de la lámina foliar (Shields 1950; Tanner & Kapos 1982; Rada et al. 1987), esta relación se cumple para Miconia latifolia y M. tinifolia, más no para M. chionophylla. Sin embargo, en la epidermis abaxial es evidente que existe una relación entre el tamaño de las células y la densidad estomática, correlación observada ya por Roth & Mérida (1979) en las hojas de diferentes estratos de un bosque nublado.
Comparando los patrones anatómicos de las tres especies y estableciendo una relación directa entre los mismos y su distribución a lo largo del gradiente, se puede concluir:
Miconia chionophylla, pese a crecer a mayores altitude que M. latifolia y M. tinifolia, presenta el patrón estructural más simple y es probable que ello haya influido en su rango de distribución y hábitat tan restringido, que se limita a los bosques de Polylepis, y aun en éstos, su densidad es muy baja, como lo indicó León (1991). Esta especie no presenta ningún carácter estructural ni anatómico común con las otras dos especies del género, fuera de las prolongaciones epidérmicas de la vaina vascular de los haces mayores y el parénquima en empalizada pluriestratificado, situación especial que merece ser tomada en cuenta al realizar una evaluación sistemática y filogenética del género, el cual cuenta con alrededor de 200 especies (Wurdack 1973, 1980) y es muy heterogéneo (Mentink & Baas 1992). Miconia latifolia y M. chionophylla pertenecen a la sección Chaenopleura; sin embargo, es interesante señalar que el único carácter morfoanatómico que tienen en común son los tricomas glandulares, los cuales posiblemente constituyen un carácter típico de dicha sección; pero esta hipótesis sólo podría ser confirmada mediante estudios morfológicos y filogenéticos, basados estos últimos en estudios genéticos de un número representativo de especies de esta sección y de otras secciones del género Miconia. Hasta la fecha, no se han realizado estudios de esta naturaleza para las especies de Miconia de la flora venezolana.
M. tinifolia pertenece a la sección Cremanium, pese a ello, no solo comparte el mismo hábitat y hábito arbóreo con M. latifolia, sino que además, comparte todos los caracteres morfoanatómicos foliares comunes mencionados, lo cual sugiere una estrategia adaptativa muy similar, y en el caso de M. tinifolia, la xeromorfía foliar más acentuada la ha capacitado para ocupar un rango altitudinal más amplio, del cual sólo se muestreó su límite superior de crecimiento en este caso. El límite atitudinal superior de M. tinifolia coincide y abarca a su vez el rango de distribución de M. latifolia que, pese a poseer un rango más reducido, se ubica a mayores elevaciones dentro del gradiente. Ambas especies están bien representadas en la vegetación del bosque paramero, pero su ausencia en la vegetación del páramo abierto a las mismas elevaciones, en la Sierra Nevada, indica que su hábito y presumiblemente su morfología y fisiología no son apropiadas para sobrevivir en el páramo abierto, como sucede con la mayoría de las especies arbóreas (Vareschi 1978, 1980).
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento al CDCHT por haber financiado esta investigación bajo el proyecto C-708-95-01-F. También agradecen a la Dra. Rebeca Luque y al Dr. Javier Estrada, a Giusseppe Adamo y a la Lic. Josefina Peraza por su valiosa colaboración durante su ejecución.
BIBLIOGRAFÍA
1. Azócar, A. & M. Monasterio. 1980. Estudio de la variabilidad meso y microclimática en el Páramo de Mucubají. In: Estudios ecológicos en los páramos andinos (Monasterio, M., ed.), pp. 225-262. Universidad de Los Andes. Mérida,Venezuela. [ Links ]
2. Baumgratz, J. F. & G.L. Ferreira. 1980. Estudo da nervação e epiderme foliar das Melastomataceae do Municipio do Río de Janeiro. Gênero Miconia. Sêçao Miconia. Rodriguésia 32(54): 161-169. [ Links ]
3. Baumgratz, J.F. & G.L. Ferreira. 1984. Nervação e epiderme foliar das Melastomacaceae do Estado Río de Janeiro. Gênero Miconia. Sêçao Tamonea (Aubl.) Cogniaux. Rodriguésia 36(58): 84-94. [ Links ]
4. Berg, A. 1996. Die vegetation der Superpáramos des "Parque Nacional Sierra Nevada de Mérida"/Venezuela. Diplomarbeit. Systematisch-Geobotanischen Institut der Georg-August-Universität zu Göttingen. Köln. Deutschland. [ Links ]
5. Costa, G.R. 1977. Miconia theaezans (Bonpl.) Logn. (Melastomataceae) consideraçiões anatõmicas. Rodriguésia 19(43): 7-89. [ Links ]
6. De Roon, A.C. 1967. Foliar sclereids in the Marcgraviaceae. Acta Bot. Neerl. 15: 585-623. [ Links ]
7. Dengler, N.G. 1994. The influence of light on leaf development. In: Growth patterns in vascular plants (Iqbal, M., ed.), pp. 100-136. Dioscorides Press. Portland. U.S.A. [ Links ]
8. Dudley, E.C. 1978. Adaptative radiation in the Melastomataceae along an altitudinal gradient in Peru. Biotropica 10(2): 134-143. [ Links ]
9. Ehrlinger, J.R. & J. Comstock. 1987. Leaf absorptance and leaf angle: mechanisms for stress avoidance. Tenhunen et al. Eds. Springer-Verlag. Berlin-Heidlberg. pp. 55-76. [ Links ]
10. Ely, F. 1996. Anatomía foliar de Melastomataceae a lo largo de un gradiente altitudinal en el Parque Nacional Sierra Nevada de Mérida. Trabajo Especial de Grado. Facultad de Ciencias. Universidad de Los Andes. Mérida,Venezuela. [ Links ]
11. Ely, F. & F. Torres. 1993. Anatomía Foliar de Axinaea grandifolia Triana (Melastomataceae). XI Congreso Venezolano de Botánica. Pittieria p. 243. Mérida. Venezuela. [ Links ]
12. Ely, F. & F. Torres. 1995. Anatomía Foliar de Chaetolepis lindeniana (Naud.) Triana (Melastomataceae) a lo largo de un gradiente altitudinal en el Parque Nacional Sierra Nevada de Mérida. III Congreso Latinoamericano de Ecología. Sección 3. p. 15 Mérida. Venezuela. [ Links ]
13. Esau, K. 1977. Anatomy of seed plants. 2nd ed. John Wiley & Sons. U.S.A. [ Links ]
14. Fahn, A. 1967. Plant Anatomy. 4th ed. (1979). Pergamon Press. Canada. [ Links ]
15. Fahn, A. 1986. Structural and functional properties of trichomes of xeromorphic leaves. Ann. Bot. 57: 631-637. [ Links ]
16. Foster, A.S. 1947. Structure and ontogeny of the terminal sclereids in the leaf of Mouriri huberi Cong. Amer. J. Bot. 34: 501-14. [ Links ]
17. Foster, A.S. 1950. Techniques for the study of venation patterns in the leaves of angiosperms. 7th. Int. Bot. Cong. Stockholm. 1950: 586-587. [ Links ]
18. Garcé, N. 1998. Localización de taninos en Melastomataceae: comparación entre los géneros Clidemia, Miconia y Monochaetum. Trabajo Especial de Grado. Facultad de Ciencias. Universidad de Los Andes. Mérida, Venezuela. [ Links ]
19. Heide-jørgensen, H.S. 1990. Xeromorphic leaves of Hakea suaveolens R.Br. IV. Ontogeny, structure and function of the sclereids. Austral. J. Bot. 38: 25-43. [ Links ]
20. Hickey, L. 1973. Classification of the architecture of dicotyledonous leaves. Amer. J. Bot. 60: 17-33. [ Links ]
21. Johansen, D. 1940. Plant Microtechnique. Mc Graw-Hill. New York. U.S.A. [ Links ]
22. Johnson, H. 1975. Plant pubescence, an ecological perspective. Bot. Rev. 41(3): 233-253. [ Links ]
23. León,V.L. 1991. Estudio vascular de tres bosques de Polylepis sericeaWedd. Ubicados en la Sierra Nevada de Mérida. Trabajo Especial de Grado. Facultad de Ciencias. Universidad de Los Andes. Mérida,Venezuela. [ Links ]
24. Luque, R., H.C. Sousa & J.E. Kraus. 1996. Métodos de coloração de Roeser (1972) modificado e Kropp (1972) visando a substituição do Azul de Astra por Azul de Alcião 86S ou 86X. Acta Bot. Brasil. 10: 199-212. [ Links ]
25. Mentink, H. & P. Baas. 1992. Leaf anatomy of the Melastomataceae, Memecylaceae and Crypteroniaceae. Blumea 37: 189-225. [ Links ]
26. Metcalfe, C.R. 1979. Some basic types of cells and tissues. In: Anatomy of the Dicotyledons (Metcalfe, C.R. & L. Chalk, eds.), pp. 637-649. 2n. ed. Clarendon Press. Oxford. [ Links ]
27. Metcalfe, C.R. & L. Chalk. 1957. Anatomy of the Dicotyledons. pp. 627-649. Clarendon Press. Oxford. [ Links ]
28. Monasterio, M. & S. Reyes. 1980. Diversidad ambiental y variación de la vegetación en los Páramos de los Andes Venezolanos. In: Estudios ecológicos en los páramos andinos (Monasterio, M., ed.), pp. 47-92. Universidad de los Andes. Mérida,Venezuela. [ Links ]
29. Ortega, T. 1982. Anatomía foliar de tres especies de Espeletiinae Cuatr. y sus variaciones adaptativas. Trabajo Especial de Grado. Facultad de Ciencias. Universidad de Los Andes. Mérida,Venezuela [ Links ]
30. Petit, A.P.M. 1984. Variación altitudinal de la vegetación en los Andes Venezolanos. Trabajo Especial de Grado. Facultad de Ciencias Forestales y Ambientales. Escuela de Geografía. Universidad de los Andes Mérida, Venezuela. [ Links ]
31. Pyykkö, M. 1966. The leaf anatomy of East Patagonia xeromorphic plants. Ann. Bot. Fenn. 3: 453-622. [ Links ]
32. Rada, F., G. Goldstein, A. Azócar & F. Torres. 1987. Supercooling along an altitudinal gradient in Espeletia schultzii, a caulescent giant rosette species. J. Exp. Bot. 38(188): 491-97. [ Links ]
33. Ragonese, A. 1990. Caracteres xeromorfos foliares de Nassauvia lagascae (Compositae). Darwiniana 30(1-4): 1-10. [ Links ]
34. Rao, A.T. & S. Das. 1979. Leaf sclereids -occurrence and distributions in the angiosperms. Bot. Not. 132: 319-24. [ Links ]
35. Ricardi, M.H. 2000. Visión fitogeográfica de Venezuela. Ediciones PlantULA. Centro Jardín Botánico, Mérida. [ Links ]
36. Richter, M. 1991. Methoden der Klimaindikation durch Pflanzenmorphologische Merkmale in den Kordilleren der Neotropis. Dierde 122: 267-289. [ Links ]
37. Roth, I. 1990. Leaf structure of a Venezuelan cloud forest in relation to the microclimate. Encyclopedia of Plant Anatomy. pp. 244. Gebrüder Borntraeger. Berlin. Stuttgart. [ Links ]
38. Roth, I. & T. Mérida. 1979. Morphological and anatomical studies of leaves of the plants of a Venezuelan cloud forest. II. Stomata density and stomatal patterns. Acta Biol. Venez. 10(1): 69-107. [ Links ]
39. Schneider, J. 2001. Diversity, structure and biogeography of a successional and mature upper montane rain forest of the Venezuelan Andes (La Caña, Valle San Javier, Mérida State). Der Andere Verlag. Frankfurt. Germany. [ Links ]
40. Shields, L.M. 1950. Leaf xeromorphy as related to physiological and structural influences. Bot. Rev. 16(8): 394-447. [ Links ]
41. Smith, J.M.B. & A.M. Cleef. 1988. Composition and origins of the worlds tropicalpine floras. J. Biogeogr. 15: 631-645. [ Links ]
42. Tanner, E.V. & V. Kapos. 1982. Leaf structure of Jamaican upper montane rain forest trees. Biotropica 14(1): 16-24. [ Links ]
43. Tolivia, D. & J. Tolivia. 1987. Fasga: a new polychromatic method for simultaneous and differential staining of plant tissues. J. Microscop. 48: 113-117. [ Links ]
44. Torres, F. 1996a. Anatomía foliar de Oritrophium (H.B.K.) Cuatr. del Páramo Sierra Nevada, estación "Loma Redonda". PlantULA 1(1): 65-73. [ Links ]
45. Torres, F. 1966b. Anatomía foliar en Proteaceae sudamericanas con énfasis en las esclereidas. PlantULA 1(2): 1-43. [ Links ]
46. Van Der Hammen, T. & A.M. Cleef. 1986. Development of high Andean páramo vegetation. In: High altitude tropical biogeography (Vuillemier, F & M. Monasterio, eds.), pp. 153-198. Oxford University Press. [ Links ]
47. Vareschi, V. 1978. Flora de los Páramos de Venezuela. Universidad de Los Andes. Ediciones Rectorado. Mérida. Venezuela. [ Links ]
48. Vareschi,V. 1980. Ecología de la vegetación tropical. Edición Especial de la Sociedad Venezolana de Ciencias Naturales. Caracas. [ Links ]
49. Wilkinson, H.P. 1979. The plant surface (mainly leaf). Part I: stomata. In: Anatomy of Dicotyledons (Metcalfe, C.R. & L. Chalk, ed.), pp. 97-165. Clarendon Press. Oxford. [ Links ]
50. Winkler, S. 1965. Die Melastomataceae von El Salvador. Bot. Jahrb. 83(4): 331-369. [ Links ]
51. Wurdack, J.J. 1973. Melastomataceae. In: Flora de Venezuela (Lasser, T., ed.). Tomos 1 y 2. Instituto Botánico de Caracas. Venezuela. [ Links ]
52. Wurdack, J.J. 1980. Melastomataceae. In: Flora de Ecuador (Harling G. & B. Sparre, ed.). Nº 13. [ Links ]
53. Wurdack, J.J. 1983. Atlas of hairs for Neotropical Melastomataceae. Smithsonian Contr. Bot. 63:1-80. [ Links ]












 uBio
uBio