Acta Botánica Venezuelica
versión impresa ISSN 0084-5906
Acta Bot. Venez. v.30 n.1 Caracas 2007
Dinámicade crecimiento de hymenachne Amplexicaulis en un humedalherbáceo en el Estado miranda(venezuela).
Growth dynamics of hymenachne amplexicaulis in a herbaceous wetland in Miranda state (venezuela).
Elizabeth GORDON1 y Yasmira FEO2
1 Instituto de Zoología Tropical.
2 Escuela de Biología, Facultad de Ciencias,Universidad Central de Venezuela, Aptdo. Postal 47058, Caracas 1041-A, Venezuela. egordon@strix.ciens.ucv.ve
RESUMEN
Hymenachne amplexicaulis (Poaceae) es una hierba perenne, estolonífera, que forma densas colonias en ambientes que se inundan y a lo largo de los bancos de los ríos en zonas tropicales y subtropicales de América. El objetivo de este trabajo fue determinar el efecto de los cambios estacionales de la profundidad del agua sobre el crecimiento, biomasa en pie y producción de H. amplexicaulis medidos entre febrero y diciembre de 2001 en un humedal herbáceopermanentemente inundado ubicado en el estado Miranda. Esta especie presentó variaciones en sus características biométricas (altura y densidad de culmos, longitud de las hojas y de los entrenudos) durante el lapso de estudio. La altura media de los culmos varió entre 1,40 y 1,80 m, con su valor más alto cuando la profundidad fue mayor. La densidad media de culmos fue 35 culmos/m2, y varió entre 23 y 45 culmos/m2, con los valores más altos durante el primerperíodo lluvioso. La media de la biomasa total fue de 1015±351 g seco/m2 y varió entre 310 y 1465 g seco/m2 con el valor más bajo en diciembre (segundo período de lluvias), y el más alto en agosto (primer período de lluvias). La floración y fructificación de H. amplexicaulis empezó en octubre y finalizó en febrero; la biomasa de inflorescencias (que incluyó flores y frutos) varió entre 1,40 g/m2 - 14,9 g/m2 y representó menos del 1% de la biomasa total. La producción primaria anual fue de 822 g seco/m2/año, comparativamente menor a lo reportado por otros autores. H. amplexicaulis tolera condiciones de inundación continua, sin embargo cuando la profundidad del agua resultó más elevada hubo un decrecimiento sustancial en la biomasa total y sus componentes (foliar, culmos, muerto en pie e inflorescencias), que evidencian limitaciones en el intercambio gaseoso y la absorción de nutrientes.
Palabras clave: Biomasa, Crecimiento, Humedales, Hymenachne amplexicaulis, Producción, Venezuela.
ABSTRACT
Hymenachne amplexicaulis (Poaceae) is a robust, rhizomatous perennial grass; it forms dense monospecific colonies in seasonally flooded environments and along riverbanks in tropical and subtropical wetlands of America. The objective of this study was to determine the effects of seasonal variations of water depth on the growth, above ground biomass and production of H. amplexicaulis in a freshwater marsh situated in Miranda State (Venezuela) between February and December 2001. H. amplexicaulis showed variations in the biometric characteristics, such as height, length of internode, density of culms related to changes of water depth. The mean height of culms varied between 1.4 and 1.8 m, with the highest value in deep water. Mean density of culms was 35 culm/m2 and ranged between 24 y 49 culms/m2, with the highest values during the first rain period (August). Mean total biomass was 1015±351 dry g/m2 and varied between 310 and 1465 dry g/m2, with the lowest value during the second rain period (December) and the highest value during the the first rain period. Flowering and fructification began in October and finished in February; inflorescence biomass, including flowers and fruits, ranged between 1.4 and 14.9 dry g/m2, and it represented less than 1% of total biomass. The annual net primary production was of 822 dry g/m2/year. H. amplexicaulis tolerate continual flood conditions, but in deep water there was a significative decreasing in the total biomass and their components (leaf, culms, standing dead material and inflorescences), which may indicate limitations of gaseous interchange and nutrient uptake.
Key words: Biomass, Growth, Hymenachne amplexicaulis, Production, Venezuela,Wetlands
INTRODUCCIÓN
Hymenachne amplexicaulis (Rudge) Nees (Poaceae) es una hierba perenne, estolonífera; fisiológicamente se comporta como una C3 típica (Medina & Motta 1990); con culmos que se dispersan sobre el suelo húmedo o flotan sobre la superficie del agua, a partir de los cuales se producen raíces; H. amplexicaulis puede formar densas colonias en tierras que se inundan y a lo largo de los bancos de los ríos en zonas tropicales y subtropicales de América (Hill 1996; Csurhes et al. 1999). Esta especie ha sido introducida en las regiones tropicales y subtropicales de Australia (Inglis et al. 1996; Csurhes et al. 1999) y en el estado de Florida (USA) (Hill 1996; University of Florida 2007), donde ha sido designada como especie invasora (maleza). Ahora se encuentra en los trópicos de ambos hemisferios (Langeland & Craddoks 2005), al ser introducida como especie forrajera que produce toneladas de forraje de alta calidad y palatabilidad (Hill 1996), es pastoreada por búfalos y por ganado vacuno cuando la lámina de agua disminuye (FAO 2001). Bulla et al. (1990) reportaron para sabanas estacionalmente inundadas de Venezuela que la dieta de chigüires (capibara), caballos y ganado vacuno estaba formada en alta proporción por H. amplexicaulis. Santos et al. (2002) y Silva & Mauro (2002) indicaron que H. amplexicaulis es la especie forrajera de mejor calidad en el Pantanal de Brasil. Forero-Montaña et al. (2003) señalan que es la hierba más frecuente en la dieta del chigüire de los llanos inundables de Colombia.
El régimen de inundación es el factor más importante que controla el crecimiento y la composición de especies en muchas partes del mundo. En los humedales las variaciones en la profundidad del agua tienen inmensas consecuencias sobre procesos ecológicos como germinación de semillas, crecimiento, productividad, descomposición y dinámica de nutrientes. A través de estos procesos, los patrones de variación en el nivel de la lámina de agua (estacional, anual y a largo plazo) pueden determinar la estructura de las comunidades y sucesión en estos ecosistemas (Gerritsen & Greening 1989). La inundación causa una reducción inmediata en el intercambio gaseoso entre la planta y el ambiente (Armstrong
et al. 1991), y dependiendo de la profundidad, duración e intensidad, se afectan entre otros las funciones de las raíces y rizomas (respiración, soporte, almacenamiento de reservas, absorción de nutrientes) y la biomasa aérea a través de la actividad fotosintética y suministro de oxígeno de las plantas (Ernest 1990). Los mecanismos de tolerancia a la inundación envuelven caracteres y estrategias como plasticidad morfológica y modificación en el patrón de distribución de los recursos energéticos (biomasa aérea y subterránea), lo que facilita la supervivencia de las plantas a un amplio intervalo de cambios en la profundidad del agua (Coops et al. 1996). Las respuestas de ajustes morfológicos a incrementos en la inundación que han sido denominadas respuestas de acomodación, incluyen la rápida elongación de los tallos hacia la superficie del agua, permitiendo el acceso a la luz, oxígeno y CO2 (Cronk & Fennessy 2001).Hymenachne amplexicaulis crece en ambientes donde fluctúa la lámina de agua y en aquellos que se inundan periódicamente, sin embargo requiere un período seco para establecerse (Hill 1996). Cuando está sujeta a inundación su respuesta es la rápida elongación de los tallos y la producción de materia seca en los tallos o culmos y raíces adventicias (Kibbler & Bahnisch 1999). Las investigaciones y observaciones muestran que la máxima profundidad que esta especie puede tolerar es variable, desde 1m hasta 3-4 m en sabanas estacionalmente inundadas (Tejos 1980; Bulla et al. 1990) y en cuerpos de agua permanentes y profundos (Kalmbacher et al. 1998; Csurhes et al. 1999). Sin embargo, Tejos (1980), Bulla (1980b), Inglis et al. (1996) y Kalmbacher et al. (1998) indicaron que esta especie no puede crecer en sitios permanentemente inundados; Csurhes et al. (1999) plantearon que H. amplexicaulis no es buena competidora con especies tolerantes a la inundación, que puede sobrevivir en áreas permanentemente húmedas, y no persiste enraizada en aguas profundas (ej. 1,2 m), es decir no crece en aguas permanentes y requiere períodos alternos de inundación y sequía para establecerse y sobrevivir, e indicaron que las poblaciones de plantas más vigorosas se encuentran en lugares que reciben aguas de escorrentía ricas en nutrientes. El análisis de la literatura consultada indica contradicción en cuanto a la tolerancia y supervivencia de
H. amplexicaulis en ambientes estacionalmente inundados; a su vez muestra que se han hecho pocos trabajos en condiciones de inundación permanente y asimismo que se conoce poco sobre el grado de tolerancia a la inundación de las hierbas forrajeras tropicales, y cuales son los mecanismos envueltos en sus respuestas (Dias-Filho 2002). De allí se planteó en este trabajo analizar los cambios estacionales en el crecimiento y en la biomasa en pie, y estimar la producción primaria neta de H. amplexicaulis en un humedal herbáceo permanentemente inundado ubicado en el estado Miranda (Venezuela), lo cual permitirá determinar su potencial para usar el hábitat en situaciones de estrés y contribuir a un mejor conocimiento de su biología poblacional.MATERIALES Y MÉTODOS
El trabajo se realizó en la localidad El Clavo (estado Miranda) a 10 m snm, 10°1534 Lat. N y 66°728 Long. O. La precipitación total anual es 2484 mm, presenta distribución bimodal, con máximos entre julio–agosto y noviembre– diciembre; la precipitación mínima ocurre entre febrero–marzo, por lo cual la estación seca es corta (MARN 1996). De acuerdo al sistema de clasificación de Holdridge (Ewel & Madriz 1968), la zona de vida corresponde a un bosque húmedo tropical. El humedal herbáceo es inundado por el Río Colorado, afluente del Río Tuy, y está dominado por H. amplexicaulis. En algunos sitios se encuentran otras especies como: Montrichardia arborescens (L.) Schott, Mimosa sp.,
Polygonum acuminatum Kunth, Ludwigia octovalvis (Jacq.) Raven, Ipomoea sp., Ludwigia helminthorrhiza (Mart.) Hara, Pistia stratiotes L., Eichhornia crassipes (Mart.) Solms., Lemna sp., Salvinia auriculata Aubl., Azolla filiculoides Lam. y Utricularia sp. La textura de los suelos del humedal es arcillosa (72% arcilla, 22,4% limo y 5,6% arena); la media de porcentaje promedio de materia orgánica total del suelo fue 2,7%, y la de pH del suelo 6,4. La conductividad del agua varía entre 116 y 294,7 mS/cm, y el pH del agua entre 6-8 (Feo 2002).En un área dominada por Hymenachne, con cobertura de 100% se estableció una parcela de 225 m2, en la cual se ubicaron al azar 20 cuadratas de 0,36 m2 permanentes. Durante el período de estudio (febrero a diciembre 2001) en cada cuadrata se realizó la medición de las siguientes variables: número y altura de culmos, y longitud del segundo y tercer entrenudo. En el centro de cada cuadrata se midió la profundidad del agua. Fuera de las cuadratas y dentro de la parcela se cosecharon 10 culmos completos y se colocaron en bolsas plásticas, se refrigeraron y se trasladaron al laboratorio, el material vegetal cosechado fue lavado para eliminar restos de detritus; luego fue separado en material vivo (hojas, tallos e inflorescencias) y muerto en pie, se determinó el número de hojas, y se midió su longitud; posteriormente se procedió al secado a 80°C por 48 h y pesado de cada fracción vegetal. La biomasa área o en pie expresada en g peso seco/m2 se estimó sobre la base de la densidad de culmos y la media en peso seco de tallos, hojas, material muerto en pie e inflorescencias (flores y frutos) (Bradbury & Grace 1983; Cronk & Fennessy 2001). La producción primaria neta anual (PPNA; g seco/m2/año) se calculó de acuerdo al método de Smalley (Cronk & Fennessy 2001), lo cual permitió realizar comparaciones con otros trabajos realizados en Venezuela. El método de Smalley se basa en la producción de material vivo y muerto, sin tomar en cuenta la descomposición, durante un intervalo de tiempo. También se calculó la relación entre la PPNA y la biomasa máxima) (P/B), la que se presume equivalente a la tasa de recambio (Cronk & Fennessy 2001).
Análisis estadístico
Se utilizó la prueba no paramétrica de Kruskall–Wallis, debido a que la data no se ajustaba a distribución normal y para probar diferencias estadísticas en la densidad, altura, longitud de los entrenudos y biomasa en pie respecto a los meses de muestreo. También se calculó el coeficiente de correlación no paramétrico de Spearman entre las variables dependientes y la profundidad del agua. Para el análisis de los datos se utilizó el programa Statistica, versión 5.0.
RESULTADOS
Profundidad del agua
La profundidad del agua varió entre 16 y 72 cm. De febrero a mayo decreció de 35 a 19cm (período seco); luego incrementó hasta julio (58,25cm) y después decreció hacia octubre (segundo período seco) con una media de 28 cm; la máxima se observó en diciembre. La profundidad del agua mostró un comportamiento bimodal como la precipitación (Fig. 1) (r = 1; p<0,0001). En este humedal, durante el período de estudio no se observaron sitios en la parcela que estuvieran completamente secos.
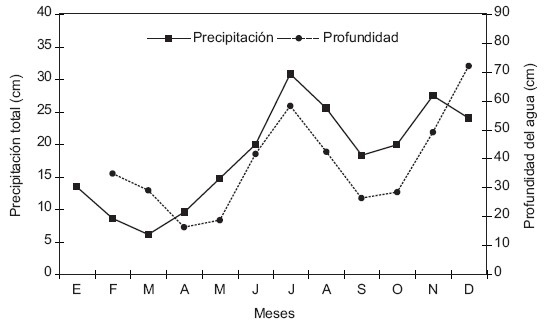
Fig. 1. Precipitación total (media de 10 años) de El Clavo y profundidad del agua durante el lapso de estudio.
Características biométricas
La media de la altura de los culmos fue de 1,5 cm y varió entre 1,4 y 1,8 cm, donde el mayor valor se midió en diciembre y el menor en marzo (Fig. 2a). La altura difiere significativamente entre los meses de muestreo (H = 35,58, p <0,0001); la correlación entre la altura de los culmos y la profundidad del agua fue significativa (r = 0,87, p< 0,05). La media de la longitud de las hojas fue de 33,51 cm y varió entre 26 cm y 39 cm; la longitud de las hojas difiere significativamente entre los meses (H = 43,06, p <0,0001) (Fig. 2b); sin embargo, la longitud de las hojas no mostró correlación con la profundidad del agua. La longitud de hojas, excepto para el mes de octubre, presentó una distribución parecida a la altura de los culmos.
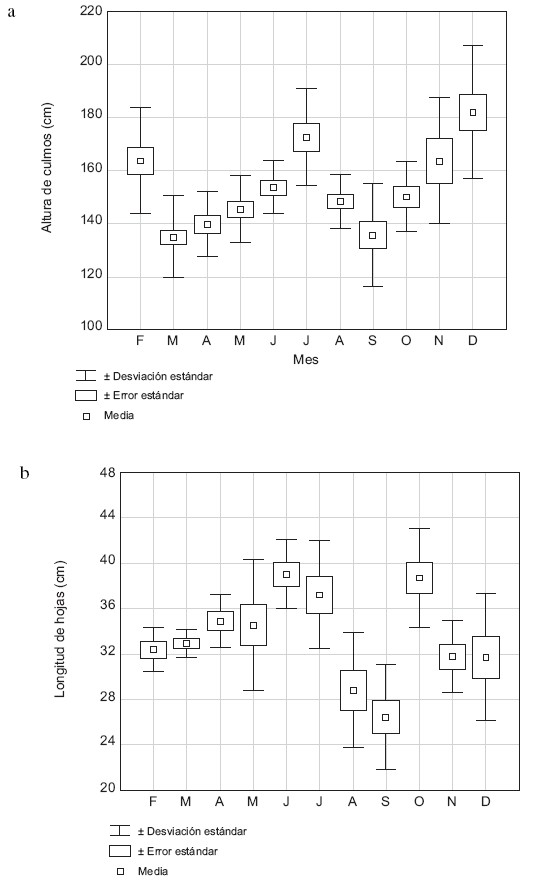
Fig. 2. Media de la altura de los culmos (a) y media de la longitud de las hojas (b) de H.
La densidad media de culmos fue de 35 culmos/m2, y varió entre 23 y 45 culmos/m2, con los valores más altos en febrero y el lapso mayo–agosto, y los más bajos en marzo, y entre septiembre–noviembre (Fig. 3a); la densidad de culmos difiere significativamente entre los meses (H = 91,39, p<0,001), pero no mostró amplexicaulis durante el intervalo de estudio. correlación significativa con la profundidad del agua. La media del número de hojas por culmo fue de 6 y varió entre 5 y 8, con la excepción de los meses de febrero y octubre; el número de hojas/culmo no mostró patrón alguno respecto a los meses (Fig. 3b); el número de hojas difiere estadísticamente entre los meses (H = 28,20; p<0,05), sin embargo, no se correlacionó con la profundidad del agua.
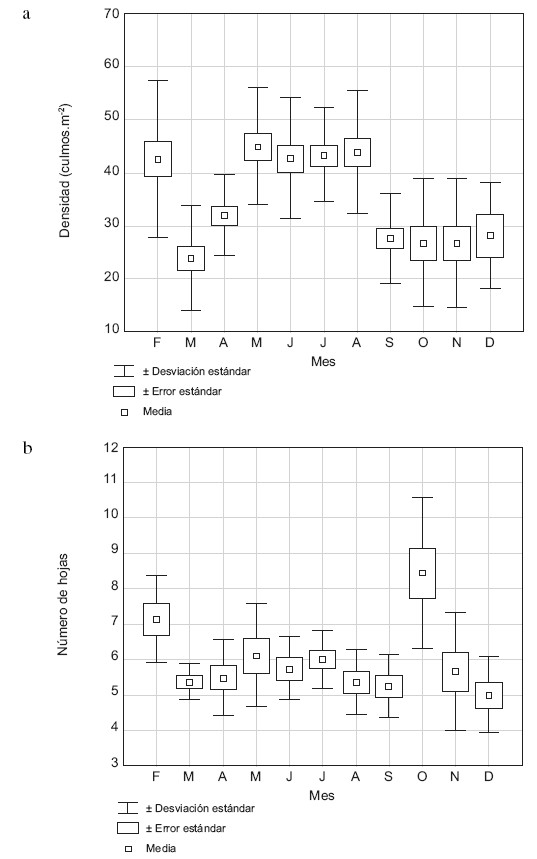
Fig. 3. Media de la densidad de culmos (a) y número de hojas por culmo (b) de H. amplexicaulis durante el período de estudio.
Las medias de la longitud del segundo y tercer entrenudo difieren estadísticamente entre los meses de muestreo (H = 59,89 y H = 78,88, respectivamente, p<0,001), pero no mostraron correlación significativa con la profundidad del agua. La media del segundo entrenudo fue 10,5 cm, y varió entre 7,5 cm y 13,3 cm; de febrero a junio los valores no cambian sustancialmente, luego aumentan hacia agosto con su valor más alto (Fig. 4a). La media de la longitud del tercer entrenudo fue 15,2 cm y varió entre 12,5 y19,3 cm, con valores más altos en el lapso mayo–junio (primer período de lluvias) (Fig. 4b).
Al comparar las variables biométricas entre sí, sólo la densidad y la longitud del tercer entrenudo mostraron correlación significativa (r = 0,73, p<0,01), lo cual sugiere que para futuros trabajos podrían medirse sólo una de esas variables. Cabe mencionar que aunque el número de cuadratas fue relativamente alto (n = 20) y la parcela era homogénea en cuanto a la cobertura de H. amplexicaulis, los resultados presentaron altas desviaciones estándar, atribuible a que la parcela presentaba variaciones en su microtopografía.
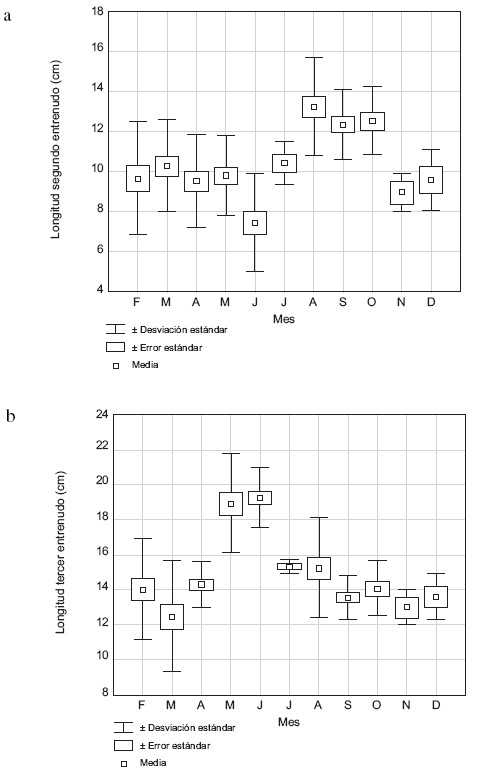
Fig. 4. Media de la longitud del segundo(a) y del tercer (b) entrenudo de H. amplexicaulis durante el período de estudio.
Biomasa en pie y producción anual
La biomasa de tallos representó 68% de la biomasa total y varió entre 203,16 y 958,81 g seco/m2, con una media anual de 691,61 ± 241,42 g seco/m2; la mayor biomasa de tallos se determinó en agosto (primer período de lluvias), y la más baja en diciembre (Fig. 5a); la biomasa de tallos no mostró correlación con la profundidad del agua, aunque de acuerdo a la prueba de Kruskal-Wallis difiere significativamente entre los meses de muestreo (H = 76,69, p<0,001).
La biomasa foliar que correspondió a 23% de la biomasa total, con una media anual de 232 g seco/m2, varió entre 92 y 370 g seco/m2, presentó dos máximos, uno en mayo y otro en agosto; decreció desde agosto hacia diciembre, mes donde se estimó el valor más bajo (Fig.5b). La biomasa foliar mostró una correlación negativa con la profundidad, sin embargo ésta no fue significativa; la prueba de Kruskal-Wallis mostró diferencias significativas entre los meses (H = 133,49; p<0,0001).
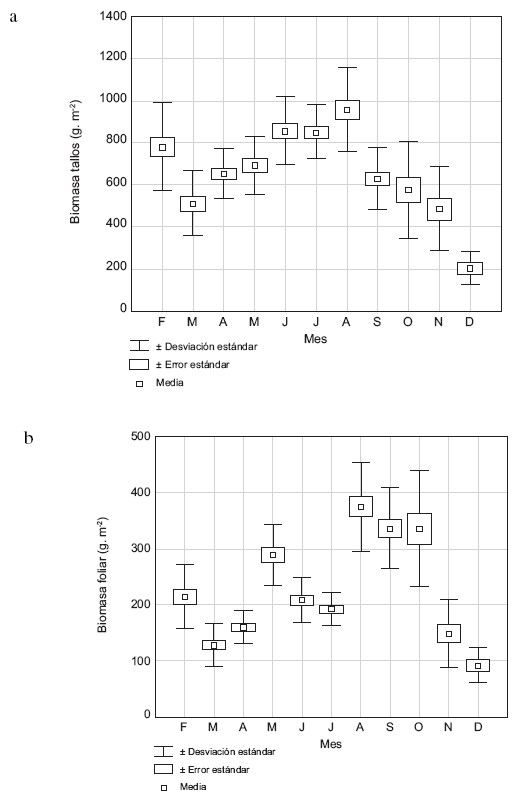
Fig. 5. Media de la biomasa de tallos (a) y de la biomasa foliar (b) de H. amplexicaulis durante el período de estudio.
La biomasa muerta en pie constituyó 9% de la total, mostró una relación negativa con la profundidad, pero ésta no fue significativa. La prueba de Kruskal- Wallis mostró diferencias estadísticas entre los meses de muestreo (H = 144,28; p = <0,0001). La biomasa muerta, excepto para el mes de mayo, tiende a ser menor en el lapso marzo–julio, y en diciembre (Fig. 6a). La floración y fructificación de H. amplexicaulis comenzó en octubre y finalizó en febrero; la biomasa de inflorescencias (que incluyó flores y frutos), varió entre 1,39 y 14,90 g seco/m2, y representó menos de 1% de la biomasa total. El valor más bajo de biomasa de inflorescencias fue en diciembre y el máximo en octubre (Fig. 6b).
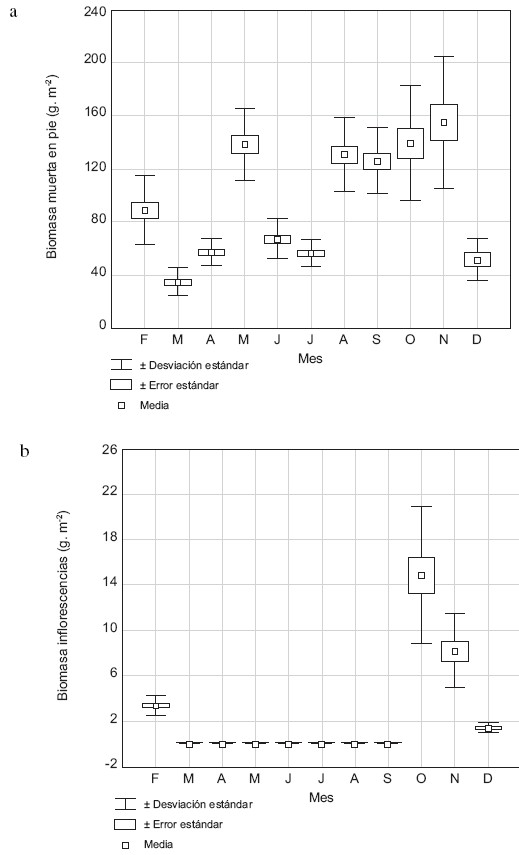
Fig. 6. Media de la biomasa muerta en pie (a) y de inflorescencias (b) de H. amplexicaulis durante el período de estudio.
La media de la biomasa total fue de 1015 g seco/m2 y varió entre 310 y 1464,6 g seco/m2 y difiere significativamente entre meses (H = 71,02, p < 0,0001), determinándose el valor más bajo en diciembre (segundo período de lluvias) y el más alto en agosto (primer período de lluvias) (Fig. 7). La biomasa total no mostró correlación con la profundidad del agua. La producción primaria neta anual (PPNA) de la biomasa total fue de 824,24 g seco/m2/año. La relación entre la PPNA y la biomasa máxima viva fue 0,62. De acuerdo a la tasa de cambio de la producción de la biomasa viva (tallos, hojas, flores y frutos) se encontró que el período de crecimiento activo fue de 120 días.
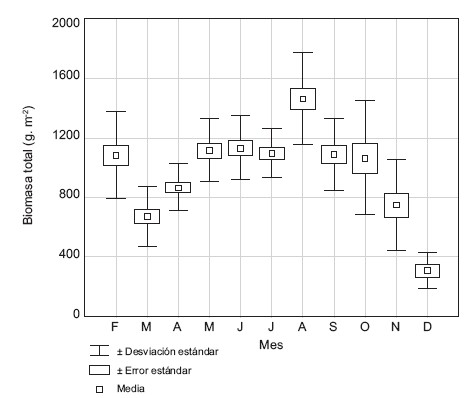
Fig. 7. Media de la biomasa total de H. amplexicaulis durante el período de estudio.
Comparando los distintos componentes de la biomasa total con las variables biométricas, destaca que la biomasa total y la de culmos mostraron correlaciones significativas con la longitud del tercer entrenudo (r = 0,83 y 0,66 respectivamente, p<0,05). Asimismo, la biomasa de frutos mostró correlación significativa con el número de hojas (r = 0,68, p<0,05).
DISCUSIÓN
Características biométricas
Las observaciones y resultados de este trabajo muestran que H. amplexicaulis exhibió variaciones en sus características biométricas (altura, densidad, longitud de los entrenudos, densidad de culmos) entre los meses de muestreo; sin embargo, sólo la altura de los culmos tuvo una relación significativa y positiva con la profundidad del agua, lo cual indica que responde a la profundidad a través de la distribución de recursos hacia los tallos. Varios autores, entre ellos Clevering et al. (1996), Coops et al. (1996), Fenster (1997), Kirtkman & Sharitz (1993), Cronk & Fennessy (2001), Vretare et al. (2001), Dias-Filho (2002), Sorrell et al. (2002) y Medeiros & Esteves (2002), han reportado que la profundidad afecta la biomasa y estructura de las plantas, y su respuesta es la elongación de los tallos (respuesta de acomodación) como resultado de la acumulación de etileno en los tejidos sumergidos, que promueve la actividad celular (Blom et al. 1990; Mitsch & Gosselink 2000). Esta respuesta de acomodación representa una estrategia de ajuste morfológico a las fluctuaciones de la lámina de agua, lo que permite a las plantas emerger rápidamente el follaje y mantener así la actividad fotosintética.
Bulla et al. (1980b) reportaron que H. amplexicaulis mostró un patrón definido en las variaciones de la altura de los culmos semejante a la profundidad del agua; indicaron que esta especie tiene un comportamiento estrictamente sincronizado con los cambios en el nivel del agua, y que cuando las hojas son sumergidas mueren en corto tiempo. Kibbler & Bahnisch (1999) reportaron que H. amplexicaulis muestra rápida elongación de los culmos, formación de raíces adventicias, emergencia del follaje cerca o sobre la superficie del agua en condiciones de inundación permitiéndole mantener el intercambio gaseoso y una actividad fotosintética completa, lo cual tiene importantes implicaciones para la supervivencia y distribución de las plantas en su hábitat. Esta respuesta es posible debido a la continua producción y elongación de nuevos entrenudos, para lo cual requiere de carbohidratos adicionales que pueden provenir de la redistribución de los recursos desde las hojas senescentes o desde los órganos subterráneos hacia hojas nuevas.
La mayor densidad de culmos en H. amplexicaulis se registró durante el lapso mayo-agosto (primer período lluvioso). Los datos reportados sobre densidad de culmos respecto a la profundidad del agua son contradictorios. Así, Bulla et al. (1980b) reportaron que la mayor densidad de culmos de H. amplexicaulis fue en marzo (período seco), debido a la aparición de tallos nuevos que mueren cuando se inician las lluvias, y luego la población se estabiliza con pocos cambios hasta el siguiente período seco. En Eleocharis interstincta se ha mostrado que la densidad de culmos aumenta en la época de lluvia y decrece en el período seco (Gordon & Velásquez 1989). En Eleocharis sphacelata, el número de culmos decreció con la profundidad (Sorrell et al. 2002). Esto puede deberse a que cuando el nivel del agua decrece (estación seca), los culmos adoptan una posición horizontal, de los cuales aparecen yemas jóvenes desde los nudos de los tallos viejos (Bulla et al. 1990), formándose así nuevas poblaciones de culmos, que luego son contados como nuevos en el período lluvioso (Entrena 1976). Kibbler & Bahnisch 1999, reportaron que a la semana de inundación, los tallos de H. amplexicaulis se reorientan desde una posición postrada a una erecta o vertical.
El número de hojas no exhibió un patrón definido con los cambios en la profundidad del agua, lo que sugiere que las hojas continuamente son renovadas. Especies con respuestas morfológicas de acomodación con la profundidad del agua, también tienen un continuo y rápido reclutamiento de hojas (Cooling et al. 2001), lo cual asegura que las hojas jóvenes siempre estén presentes en el dosel (Voesenek & Blom 1989). La longitud de las hojas, con la excepción del mes de octubre, tiende a una distribución similar a la profundidad del agua, indicando un incremento en el uso de recursos hacia nuevo crecimiento foliar (Kibbler & Bahnisch (1999). La longitud de los entrenudos no mostró correlación con la profundidad y tampoco entre ellos; sin embargo, parece que tienen un comportamiento inverso, lo cual puede indicar división del trabajo o un efecto de compensación entre estas estructuras. H. amplexicaulis puede crecer en un ambiente continuamente inundado, y al mismo tiempo responder a las variaciones en el estado hidrológico de su hábitat modificando sus características biométricas. Asimismo, tolera aguas más profundas a través de la elongación de los tallos, floreciendo y fructificando durante el agotamiento total de oxígeno. En general, las especies tolerantes a la inundación aseguran la reproducción a pesar del ambiente desfavorable causado por la inundación (Blom et al. 1990). El éxito de H. amplexicaulis en su hábitat, principalmente en ambientes más profundos, parece estar ligado con la eficiencia en los mecanismos que regulan el crecimiento de los tallos. En aguas más profundas parte de la energía es canalizada hacia la reproducción y dispersión y a mantener el tejido fotosintético por encima de la superficie del agua, lo cual es una prioridad para estas especies.
Variación de la biomasa
Bulla et al. (1980b) considerando la biomasa total como la sumatoria de la biomasa viva y muerta, encontraron en H. amplexicaulis que la biomasa total más alta se registró durante el período de inundación, y la más baja en la estación seca; por su parte, la biomasa verde alcanzó su máximo cuando los culmos estuvieron sumergidos y la porción aérea era pequeña. Gordon & Velásquez (1989) determinaron en
Eleocharis interstincta que la mayor biomasa total se registró en el período seco, pero la biomasa viva máxima se determinó durante la época de inundación. Kirkman & Sharitz (1993) encontraron en Panicum hemitomon y Leersia hexandra que la biomasa aérea fue mayor en condiciones de inundación. En esta investigación, para H. amplexicaulis, la biomasa total y de hojas aumentó durante el primer período de lluvias (junio–agosto). Sin embargo, la biomasa total y sus componentes fueron más bajos en el mes de máxima inundación (diciembre, segundo período lluvioso, profundidad mayor), el cual podría considerarse el mes de mayor estrés para las plantas. En diciembre el incremento en la altura es simplemente una respuesta de elongación estimulada por la inundación sin el concomitante aumento en el peso seco; este comportamiento es similar a lo reportado por otros autores (Kirtkman & Sharitz 1993; Finlayson 1991). Kibbler & Bahnisch (1999) encontraron que la relación peso fresco a peso seco en H. amplexicaulis resultó tres veces mayor en plantas inundadas en comparación con plantas no inundadas.En el período de aguas más profundas hay una reducción en el suministro de carbono en relación al tamaño total de la planta, debido a limitaciones en la fotosíntesis de las hojas sumergidas por la menor disponibilidad de dióxido de carbono (Sorrell et al. 2002), lo que trae como consecuencia la senescencia de hojas y tallos y la disminución en la biomasa total. Vretare et al. (2001) indicaron que las plantas en aguas más profundas tienen el compromiso entre elongar sus culmos por encima de la superficie del agua, producir raíces para absorber nutrientes y rizomas para almacenar carbohidratos, y dispersarse; así mismo, están expuestas a disminuciones en el transporte de oxígeno y de radiación, y a la necesidad de mantener las reservas de carbohidratos. En H. amplexicaulis la rápida elongación de los tallos demanda recursos energéticos, sin embargo, ésta parece estar balanceada positivamente por tallos más altos que requieren menos soporte, evidenciado por cutículas más estrechas y paredes celulares parenquimatosas más delgadas, los cuales colapsan cuando se cosechan (Kibbler & Bahnisch 1999).
La biomasa muerta en pie, que en términos de porcentaje representó menos de 10% del total, no mostró un comportamiento definido con la profundidad. Sin embargo, descartando el mes de mayo, esta biomasa tiende a ser menor en el lapso marzo–julio, y en diciembre (segundo período lluvioso, máxima profundidad). Bulla et al. (1980a) encontraron en una sabana modulada que la biomasa muerta en pie tenía comportamiento homogéneo, donde la mortalidad de las plantas era causada por la sequía y en menor proporción por la inundación. En este trabajo, la biomasa muerta en pie y la biomasa foliar tuvieron una relación significativa. La proporción baja de la biomasa muerta en pie indica que esta es incorporada rápidamente a la hojarasca tan pronto como los tallos y hojas mueren (Bulla et al. 1980b), contribuyendo a la entrada y transferencia de energía al sistema, y cuyo proceso de entrada no depende de los cambios en el nivel del agua.
Producción anual
Los datos de biomasa y PPNA son importantes para establecer modelos de energía y flujos de nutrientes y carbono dentro del ecosistema (Bradbury & Grace 1983). Sin embargo, los resultados de biomasa, productividad y producción anual en muchos casos no son comparables, debido a diferencias en la metodología y a la especie objeto de estudio (Cronk & Fennessy 2001). La PPNA está limitada o regulada por diversos factores ambientales, entre ellos, nutrientes, luz, temperatura, hidrología, herbivoría o suelos que promueven o limitan el crecimiento de las plantas (Kaul 1985; Cronk & Fennessy 2001), lo que permite explicar las diferencias de los valores de biomasa total de H. amplexicaulis dentro y fuera de Venezuela. Medina & Motta (1990) reportaron para sabanas inundadas una biomasa total asimilatoria de 905g seco/m2, donde H. amplexicaulis representaba 40% (362 g seco/m2, 3,62 t/ha) de ella. En el Lago Camaleão (Brasil), poblaciones mezcladas de especies de plantas tenían una biomasa total de 1120 g seco/m2 (11,2 t/ha), donde H. amplexicaulis contribuía con 190 g seco/m2 (1,9 t/ha, 17%) (Junk & Piedade 1993). Kalmbacher et al. (1998) en Florida reportaron para H. amplexicaulis valores entre 154 y 291 g seco/m2. En este caso, la biomasa total de H. amplexicaulis varió entre 310,41 y 1464g/m2, con una media de 1015 g/m2 (10,15t/ha).
Comparando el resultado de PPNA de H. amplexicaulis con otros estudios que usaron el método de Smalley, se tiene que Bulla et al. (1980b) reportaron una PPNA de 1118 g seco/m2/año; Entrena (1976) en una sabana modulada reportó valores que varían entre 689 g/m2/año – 2143 g/m2/año, y en una sabana dominada por H. amplexicaulis de 1097 g/m2/año. Finlayson (1991) en la llanura de inundación de Magela (Australia) estimó para Hymenachne acutigluma una PPNA de 2090 g/m2/año. Mitsch & Gosselink (2000) señalaron que los humedales herbáceos continentales son muy productivos, con una producción anual mayor de 1000 g/m2/año, hasta de 6000 g/m2/año, atribuible al buen suministro de nutrientes, y al bajo estrés hídrico a lo largo del año (Bradbury & Grace 1983). En este trabajo, la PPNA de H. amplexicaulis resultó menor a la reportada por los autores antes citados; si bien esta especie tolera inundación prolongada, posiblemente se afectan tanto las funciones de raíces y rizomas (respiración, soporte, almacenamiento de reservas, absorción de nutrientes), como de la biomasa a través de la actividad fotosintética y el suministro de oxígeno de las plantas (Ernest 1990).
La productividad de un sitio también puede ser examinada a través de la relación producción/biomasa (P/B), que se considera una medida del porcentaje de crecimiento por año o eficiencia de producción (Mitsch 1991; Cronk & Fennessy 2001). Westlake (1992) indicó que la relación P/B varía entre sitios y años debido a diferencias en la longitud en la estación de crecimiento, en la emergencia y mortalidad de los tallos, y que independientemente del ambiente, cada especie tiene un comportamiento característico y un rango limitado de P/B. En zonas templadas, algunas especies tienen ciclos y períodos de crecimiento definidos, y baja relación P/B (<1), mientras que en el otro extremo hay especies con poca acumulación de biomasa viva, rápido crecimiento, estación de crecimiento indefinida y alta P/B (>1). En zonas tropicales, especies con una biomasa aparentemente constante pueden tener alto recambio y alta P/B (>1); mientras que otras explotan el clima tropical estable acumulando biomasa en sus tallos vivos, y tienden a tener una relación P/B<1 (Westlake 1992). Esto último coincide con lo reportado aquí para H. amplexicaulis, ya que la relación P/B fue <1 (0,62), con una biomasa que se acumula en los tallos que representó 68% de la biomasa total.
CONCLUSIONES
H. amplexicaulis responde a las variaciones en la profundidad del agua a través de diferencias en el peso seco y en características biométricas. La gran producción de tallos durante el primer lapso de inundación podría considerarse ejemplo de adaptación de esta especie; sin embargo, en aguas más profundas producen tallos más altos, pero de menor peso, es decir, las plantas experimentan disminución en el crecimiento y menor tasa de dispersión, por cuanto disminuye la biomasa de flores y frutos. En estas situaciones el carbono ganado por fotosíntesis puede ser reducido significativamente, trayendo como consecuencia disminución en la producción de materia seca. El éxito de H. amplexicaulis en ocupar un hábitat permanentemente inundado y con fluctuaciones estacionales de la lámina de agua parece estar ligado a la eficiencia en los mecanismos que regulan el crecimiento de los tallos para mantener un balance positivo de carbono y un efectivo intercambio de gases.
AGRADECIMIENTOS
Al Lic. Sergio Pacheco y a la Br. Gladys Flores por su ayuda en el trabajo de campo.
BIBLIOGRAFÍA
1. Armstrong, W.S.H., F.W. Justin, P.M. Beckett & S. Lythe. 1991. Root adaptation to soil water lagging. Aquatic Bot. 39: 57-73. [ Links ]
2. Bradbury, I.K. & J. Grace. 1983. Primary production in wetlands. In:
Ecosystems of the World. 4A. Mires, swamp, bog, fen and moor (Gore, A.J.P., ed.), pp. 285-310. Elsevier Scientific Publishing Company, Amsterdam. [ Links ]3. Blom, M., G. Bögemann, A. Laan, M. van der Sman, H. van der Steeg & L. Voesenek. 1990. Adaptation flooding in plants from river areas.
Aquatic Bot. 38: 29-47. [ Links ]4. Bulla, L., R. Miranda & J. Pacheco. 1980a. Producción, descomposición, flujo de materia orgánica en una sabana de banco del Módulo Experimental de Mantecal (estado Apure,Venezuela). Acta Ci. Venez. 31: 331-338. [ Links ]
5. Bulla, L., R. Miranda & J. Pacheco. 1980b. Ciclo estacional de la biomasa verde, muerta y raíces en una sabana inundada de estero en Mantecal (Venezuela). Acta Ci. Venez. 31: 339-344. [ Links ]
6. Bulla, L., J. Pacheco & L.G. Morales. 1990. Seasonally flooded Neotropical savanna closed by dikes. In: Managed grasslands: Regional studies (Breymeyer, A., ed.), pp. 177-211. Elsevier, Amsterdam. [ Links ]
7. Clevering, O., C. Blom & W. van der Vierssen. 1996. Growth and morphology of Scirpus lacustris and S. maritimus as affected by water level and light availability. Funct. Ecol. 10: 289-296. [ Links ]
8. Cronk, J.K. & M.S. Fennessy. 2001. Wetland plants. Lewis, New York. [ Links ]
9. Cooling, M.P., G.G. Ganf & K.F. Walker. 2001. Leaf recruitment and elongation: an adaptive response to flooding in Villarsia reniformis. Aquatic Bot. 70: 281-294. [ Links ]
10. Coops, H., F. van den Brink & G. van der Velde. 1996. Growth and morphological responses of four helophyte species in an experimental water depth gradient. Aquatic Bot. 54: 11-24. [ Links ]
11. Csurhes, S., A.P. Mackey & L. Fitzsimmons. 1999. Hymenachne (
Hymenachne amplexicaulis) in Queensland, Pest status rewiew series, Land Protection Department of Natural Resources, Brisbane. [ Links ]12. Dias-Filho, M.B. 2002. Tolerance to flooding in five Brachiaria brizantha accessions. Pesq. Agropecu. Brasil. 37: 439-447. [ Links ]
13. Entrena, I. 1976. Estudio comparativo de la biomasa aérea, producción primaria aérea neta y composición florística a lo largo de un gradiente microtopográfico en el Módulo Experimental de Mantecal. Trabajo Especial de Grado. Facultad de Ciencias. Universidad Central de Venezuela, Caracas. [ Links ]
14. Ernest, W.H.O. 1990. Ecophysiology of plants in waterlogged and flooded environments. Aquatic Bot. 38: 73-90. [ Links ]
15. Ewel, J.J. & A. Madriz. 1968. Zonas de vida de Venezuela. Ministerio de Agricultura y Cría, Caracas. [ Links ]
16. FAO. Animal feed resources informative systems. Disponible: www.fao.org/ag. [ Links ]
17. Fenster, C.B. 1997. Ecotypic differentiation for flood – tolerance and its morphological correlates in Chamaecrista fasciculata. Aquatic Bot. 56: 215-231. [ Links ]
18. Finlayson, C.M. 1991. Production and major nutrient composition of three grass species on the Magela floodplain, Northern Territory, Australia. Aquatic Bot. 41: 263-280. [ Links ]
19. Feo, C.Y. 2002. Dinámica de crecimiento de Hymenachne amplexicaulis (Rudge) Nees en un humedal herbáceo localizado en El Clavo (estado Miranda). Trabajo Especial de Grado. Facultad de Ciencias. Universidad Central de Venezuela, Caracas. [ Links ]
20. Forero-Montaña, J., J. Betancur & J. Cavelier. 2003. Dieta del capibara
Hydrochaeris hydrochaeris (Rodentia: Hydrochaeridae) en Caño Limón, Arauca, Colombia. Revista Biol. Trop. 51: 571-578. [ Links ]21. Gerritsen, J. & H.S. Greening. 1989. Marsh seed banks of the Okefenokee swamp: effects of hydrologic regime and nutrients. Ecology 70: 750-763. [ Links ]
22. Gordon, E. & J. Velásquez. 1989. Variaciones estacionales de la biomasa de
Eleocharis interstincta (Vahl) R. & S. (Cyperaceae) en la laguna El Burro (Guárico – Venezuela). Rev. Hidrobiol. Trop. 22: 201-212. [ Links ]23. Hill, K. 1996. Hymenachne amplexicaulis: A review of the literature and summary of work in Florida. http:/naples.net/~kuh/hymen.htm. [ Links ]
24. Inglis, G.J., P.A. Pittaway & H. Kibbler. 1996. Environmental vandalism? Towards an objective assessment of weed status. Proceedings of the 8th Australian Agronomy Conference, Toowoomba. www.regional.or.au/au/asa. [ Links ]
25. Junk,W.J. & M.T. Piedade. 1993. Biomass and primary production of herbaceous plant communities in the Amazon floodplain. Hydrobiol. 263: 155-162. [ Links ]
26. Kalmbacher, R., J. Mullarey & K. Hill. 1998. Limpograss and Hymenachne grown on flatwoods range pond margins. J. Range Managem. 51: 282-287. [ Links ]
27. Kaul, V. 1985. Primary productivity of inland aquatic ecosystems under varying climate. A review. Trop. Ecol. 26: 164-178. [ Links ]
28. Kibbler, H. & L.M. Bahnisch. 1999. Physiological adaptations of
Hymenachne amplexicaulis to flooding. Austral. J. Exp. Agric. 39: 429-435. [ Links ]29. Kirkman, L. & R. Sharitz. 1993. Growth in controlled water regimes of three grasses common in freshwater wetlands of the Southeastern USA.
Aquatic Bot. 44: 345-359. [ Links ]30. Langeland, K.A. & K. Craddoks (eds.). 2005. Identification and biology of nonnative plants in Floridas natural areas. [Libro en línea]. Florida exotic pest plant council. Disponible: http://www.fleppc.org/id_book/Hymenachne. [ Links ]
31. Linthurst, R.A. & R.J. Reimold. 1978. An evaluation of methods for estimating the net aerial primary productivity of estuarine angiosperms.
J. Appl. Ecol. 15: 919-931. [ Links ]32. MARN. 1996. Información hidrológica y climatológica de Panaquire. Dirección de Hidrología y Meteorología. Caracas. [ Links ]
33. Medina, E. & N. Motta. 1990. Metabolism and distribution of grasses in tropical flooded savannas in Venezuela. J. Trop. Ecol. 6: 77-89. [ Links ]
34. Medeiros dos Santos, A. & F.A. Esteves. 2002. Primary production and mortality of Eleocharis interstincta in response to water level fluctuations. Aquatic Bot. 74: 189-199. [ Links ]
35. Mitsch, W.J. 1991. Estimating primary productivity of forested wetland communities in different hydrologic landscapes. Landscape Ecol. 5: 75-92. [ Links ]
36. Mitsch,W.J. & J.G. Gosselink. 2000. Wetlands. Wiley, New York. [ Links ]
37. Piedade, M.T.F., W.J. Junk & S.P. Long. 1997. Nutrient dynamics of the highly productive C4 macrophyte Echinochloa polystachya on the Amazon floodplain. Funct. Ecol. 11: 60-65. [ Links ]
38. Santos, S.A., C. Costa, G. Souza, A. Pott, J.M. Alvarez & S.R. Machado. 2002. Botanical composition of cattle diet on rangelands in the Pantanal Wetland, Brazil. R. Bras. Zootec. 31: 1648-1662. [ Links ]
39. Silva, M.P. & R. Mauro. 2002. Utilización de pasturas nativas por mamíferos herbívoros en el pantanal. Arch. Zootec. 51: 161-173. [ Links ]
40. Sorrell, B.K., C.C. Tanner & J.P.S. Sukias. 2002. Effects of water depth and substrate on growth and morphology of Eleocharis sphacelata: implications for culm support and internal gas transport. Aquatic Bot. 73: 93-106. [ Links ]
41. Tejos, M.R. 1980. Producción de la hierba paja de agua (Hymenachne amplexicaulis (Rudge) Ness) durante un período en una sabana. Congreso Venezolano de Zootecnia, Guanare, Venezuela. [ Links ]
42. University of Florida. 2007. Hymenachne amplexicaulis, an invasive semi-aquatic grass from South America [PDF en línea] Disponible: http://kgioeli. ifas.ufl.edu/hymenachne.pdf [ Links ]
43. Voesenek, L.A.C.J. & C.W.P.M. Blom. 1989. Growth responses of Rumex species in relation to submergence and ethylene. Pl. Cell Environm. 12: 433-439. [ Links ]
44. Vretare,V., S.E.B. Weisner, J.A. Strand & W. Granéli. 2001. Phenotypic plasticity in Phragmites australis as a functional response to water depth. Aquatic Bot. 69: 127-145. [ Links ]
45. Westlake, D.F. 1982. The primary productivity of water plants. In:
Studies on aquatic vascular plants (Symoens, J.J., A. Hooper & P. Compere, eds.), pp. 165-180. Royal Bot. Soc. of Belgium, Brussels. [ Links ]











 uBio
uBio 
