Acta Botánica Venezuelica
versión impresa ISSN 0084-5906
Acta Bot. Venez. v.30 n.2 Caracas 2007
Flora marina de la Península de Macanao, Isla de Margarita, Venezuela. I. Chlorophyta y phaeophyceae
Marine flora of the Peninsula of Macanao, Margarita Island, Venezuela. I. Chlorophyta and Phaeophyceae
Paola Pardo y María A. Solé
Herbario-Ficoteca MOBR. Estación de Investigaciones Marinas de Margarita. Fundación La Salle de Ciencias Naturales. Apartado 144, Porlamar 6301. Isla de Margarita, Venezuela. msole@edimar.org
RESUMEN
Se presenta el estudio taxonómico de las algas marinas bentónicas del phylum Chlorophyta y la clase Phaeophyceae para la Península de Macanao, Isla de Margarita, Venezuela. Se describen 26 especies, las cuales representan nuevos registros para el área, ampliando la lista ficoflorística de la región y el rango de distribución nacional de los taxa. Se aportan claves diagnósticas para cada grupo, descripciones taxonómicas, figuras con detalles de cada especie y se discuten particularidades taxonómicas de éstas.
Palabras clave: Algas marinas, Chlorophyta, Isla de Margarita, Península de Macanao, Phaeophyceae, Taxonomía, Venezuela
ABSTRACT
A taxonomic study of the benthic marine algae of the phylum Chlorophyta and the class Phaeophyceae is given for the Peninsula of Macanao, Margarita Island, Venezuela. Twenty six species are described that represent new records for the area, enlarging the phycofloristic catalog of the region and the range of national distribution of the taxa. Complete diagnostic description and figures are given for each species. The taxonomy of the species is discussed.
Key words: Chlorophyta, Macanao Peninsula, Margarita Island, Marine algae, Phaeophyceae, Taxonomy, Venezuela
INTRODUCCIÓN
Los estudios ficoflorísticos de los litorales de las costas de Venezuela han estado enfocados principalmente hacia la región oriental del país, particularmente el estado Sucre y la Isla de Margarita en el estado Nueva Esparta. Los inventarios y estudios taxonómicos de Rodríguez (1959), Hammer & Gessner (1967), Díaz-Piferrer (1967, 1970), Lemus (1970, 1979, 1984), Ríos (1972), Bertossi (1973) y Ganesan (1978, 1989) son importantes contribuciones al conocimiento de la ficoflora para la región oriental del país, sin embargo siguen siendo pocos los trabajos taxonómicos con descripción detallada de las algas marinas de la Isla de Margarita; sólo destaca el estudio de Aponte (1985), quien realiza un trabajo de evaluación taxonómica en la región noreste. La ficoflora marina de los ecosistemas litorales de la Península de Macanao es desconocida a excepción de los reportes de las especies Acrosorium uncinatum (Turner) Kylin, Giffordia rallsiae (Vickers) Taylor, Halymenia floridana J. Agardh y Sargassum cymosum C. Agardh publicados por Díaz-Piferrer (1970).
La Península de Macanao se encuentra en la región sur-occidental de la Isla de Margarita; cuenta con ambientes diversos que van desde costas rocosas y playas con sustrato arenoso, areno-limoso, areno-gravoso hasta áreas fangosas; en proporción los sedimentos superficiales de esta región se encuentran constituídos principalmente por arena, en menor cantidad gravas y muy poca cantidad de guijarros. Las aguas son claras durante todo el año y presentan un oleaje generalmente suave. En la zona sur de la península la batimetría se hace profunda a pocos metros de la costa, las corrientes marinas tienen una dirección preponderante hacia el noreste y predominan las terrazas y acantilados desde bajos hasta de cierta altura, presentándose condiciones ecológicas variadas (Llano et al. 2001, 2002).
La región sur de la Península de Macanao está especialmente influenciada de forma intensa por los vientos alisios que generan el fenómeno de surgencia durante los primeros meses del año, variando las condiciones ambientales de las aguas las cuales se tornan densas, con temperaturas bajas y alta salinidad, ocasionando el crecimiento masivo y establecimiento de especies bentónicas, características de mares de zona templada (Díaz-Piferrer 1967; Ginés 1972; Castellanos et al. 2002) añadiendo diversidad florística temporal a la zona.
Debido a la importancia ecológica de la Península de Macanao y a la escasa información referente a la ficoflora de la zona, se desarrolló el estudio taxonómico de las algas marinas bentónicas de la región sur de la Península, como un aporte al conocimiento del fico-bentos marino de la Isla de Margarita y de las costas del país.
MATERIALES Y MÉTODOS
Área de estudio
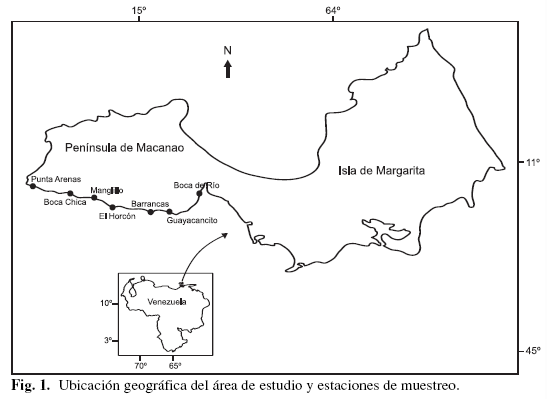
El área de estudio abarca la región sur de la Península de Macanao con una extensión de 28 km de longitud, desde Boca del Río (10°5800" Lat. N, 64°1045" Long. O) hasta Punta Arenas (10°5820" Lat. N, 64°2355" Long. O) (Fig.1). Dicha área cuenta con ambientes diversos que van desde costas rocosas, arenosas hasta fangosas, aguas claras durante todo el año, oleaje generalmente suave, presentándose condiciones ecológicas variadas (Llano et al. 2001).
Muestreos
Para la colecta de ejemplares se realizaron salidas mensuales, desde julio de 2002 hasta junio de 2003, hacia siete estaciones ubicadas dentro del área de estudio: Boca de Río, Guayacancito, Barrancas, El Horcón, El Manglillo, Boca Chica y Punta Arenas. Las muestras se obtuvieron de diferentes zonas del litoral las cuales se caracterizaron de acuerdo al sistema de zonación propuesto por Guillot & Márquez (1978) y Rodríguez (1959) para litorales del trópico, hasta 1 m de profundidad.
Taxonomía y sistemática
Se realizaron estudios morfoanatómicos de los ejemplares haciendo cortes a mano alzada, y en algunos de talo blando se empleó el método de congelación instantánea; las algas calcáreas se trataron con ácido clorhídrico 50%; posteriormente, los cortes fueron montados en una solución de glicerina 30% y jarabe de maíz Karo® 10% y 30%.
Para la identificación del material colectado se emplearon claves y descripciones taxonómicas para la ficoflora de Venezuela, el Caribe y del Atlántico occidental así como comparaciones taxonómicas con material previamente colectado para la región. Se siguieron los criterios taxonómicos propuestos por Hoek et al. (1995), Hayden et al. (2003) y Wynne (2005).
Se elaboró una colección de referencia de muestras secas y húmedas la cual está depositada en el herbario y ficoteca del Museo Oceanológico Hermano Benigno Román (MOBR) de Edimar y duplicados en el Herbario Nacional de Venezuela (VEN). Para cada una de las especies se presentan sinonimia, literatura de referencia, descripción diagnóstica completa, distribución regional y fotografías del hábito y otros detalles. Todos los ejemplares examinados en este trabajo pertenecen al herbario MOBR.
RESULTADOS Y DISCUSIÓN

Descripción de las especies de Chlorophyta
Ulva flexuosa Wulfen (Fig. 2)
Enteromorpha flexuosa (Wulfen) J. Agardh, E. lingulata J. Agardh
Taylor (1960); Joly (1967); Lemus (1970); Ríos (1972); Schnetter (1978); Aponte (1985); Steyermark (1994); Littler & Littler (2000); García & Gómez (2001).
Alga pluriseriada, aspecto tubular, color verde claro, 5,61 cm de alto, gregaria, adherida al sustrato por un disco basal formado por células rizoidales finas. Ramificación sólo en la parte basal, generalmente irregular, alterna. Margen liso. Eje principal cilíndrico de (307,2) 453,81 (712,8) (desviación estándar DS = 152,7) µm de diámetro, parte media comprimida y expandida hacia la parte terminal de (0,4) 1,12 (2,91) (DS = 0,78) mm de ancho; ramas con constricciones a lo largo de toda la lámina dando aspecto enrollado. Células a nivel superficial ovaladas, ordenadas longitudinal y transversalmente. Talos parenquimatosos, monoestromáticos, formados por células rectangulares en corte transversal de (8,2) 10,25 (16,4) (DS = 3,48) µm de ancho y (8,20) 13,12 (16,40) (DS = 3,23) µm de largo. Creciendo sobre sustrato rocoso, fangoso, epífita sobre Thalassia testudinum en la zona infralitoral.
Para Ulva flexuosa se han presentado criterios poco claros de identificación, sin embargo García & Gómez (2001), Aponte (1985), Joly (1967) y Taylor (1960) consideran que el ordenamiento longitudinal y transversal de las células superficiales en toda la extensión del talo, hacen que esta especie se distinga de otras. Los ejemplares estudiados presentaron talos con constricciones, característica que fue utilizada por Schnetter (1978) para diferenciar a Ulva flexuosa. El carácter diagnóstico preponderante es el ordenamiento celular, por lo tanto los ejemplares estudiados se identificaron como Ulva flexuosa.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, El Horcón,25/7/2002, P. Pardo A-975; El Manglillo, 25/8/2002, P. Par-do A-978; 6/2003, P. Pardo A-976; Guayacancito, 11/7/2002, P. Pardo A-877; Punta Arenas, 8/8/2002, P. Pardo A-977; SUCRE: Caigüire, 8/2/1966, Díaz-Piferrer E-2720.
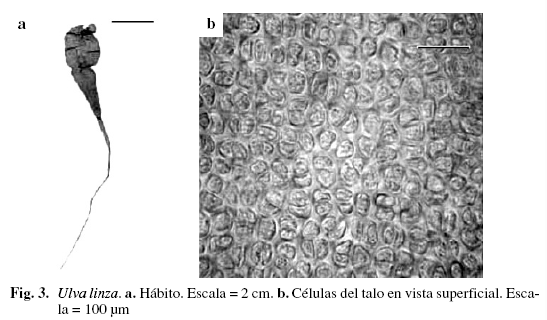
Ulva linza L. (Fig. 3)
Enteromorpha linza (L.) J. Agardh
Taylor (1960); Díaz-Piferrer (1970); Schnetter (1978).
Alga multiseriada, aspecto tubular, color verde claro, 12,5 cm de largo, adherida al sustrato por rizoides. Eje principal cilíndrico de (567) 628,7 (680,4) (DS = 50,89) µm de diámetro, comprimiéndose hacia la parte media, formando una lámina foliar plana de (3,11) 7,94 (12,35) (DS = 2,92) mm de ancho, con pequeñas constricciones. Margen ondulado. Células a nivel superficial ovaladas, ligeramente ordenadas en la porción basal, de (12,3) 16,86 (20,5) (DS = 3,62) µm de ancho y (24,6) 27,06 (28,71) (DS = 2,24) µm de largo. Talo parenquimatoso, monoestromático sólo en la parte basal, lámina formada por dos filas de células rectangulares de (8,2) 12,3 (16,4) (DS = 2,36) µm de ancho y (16,4) 22,55 (28,71) (DS = 4,9) µm de largo, separadas sólo en el margen por una porción tubular hueca. Creciendo sobre sustrato fangoso, en las zonas mesolitoral e infralitoral.
Ulva linza se caracteriza, según Schnetter (1978) y Taylor (1960), por tener lámina de gran tamaño, formada internamente por dos hileras de células separadas hacia el margen por una porción tubular hueca, característica que se observó en los ejemplares estudiados.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Laguna La Restinga, 24/3/1966, Díaz-Piferrer E-2752; Macanao, El Manglillo, 26/6/2003, P. Pardo-J. Madrazo A-541.
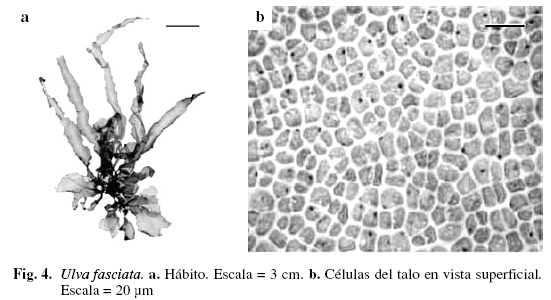
Ulva fasciata Delile (Fig. 4)
Taylor (1960); Ríos (1972); Richardson (1975); Lemus (1984); Aponte (1985); Ardito et al. (1995); García (1999); Littler & Littler (2000).
Alga cintiforme, color verde brillante, 22,84 cm de alto, adherida al sustrato por un háptero córneo de 3 mm de ancho; células rizoidales alargadas, claviformes, de (8,2) 16,40 (20,52) (DS = 5,02) µm de ancho. Láminas extendidas, lobulares, de las cuales emergen las ramificaciones, algunas veces dicótomas o tricótomas en la parte apical; láminas sin perforaciones. Margen entero y ligeramente ondulado. Células superficiales circulares y ovaladas. Talo formado por dos hileras de células rectangulares de (8,2) 11,79 (16,41) (DS = 3,42) µm de ancho y (32,8) 37,41 (41) (DS = 3,42) µm de largo, las cuales se encuentran separadas por un espacio intercelular de (8,2) 11,13 (16,4) (DS = 3,1) µm de ancho. Láminas de (90,21) 106,9 (129,62) (DS = 15,02) µm de espesor. Creciendo sobre sustrato arenoso, fangoso y rocoso, en la zona mesolitoral e infralitoral.
Ulva fasciata es una especie distinguible por presentar láminas cintiformes largas y amplias en algunos casos, características que fueron utilizadas por García (1999), Aponte (1985), Richardson (1975) y Taylor (1960) para separarla de otras especies de Ulva.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Coche, Playa El Bichal, 7/3/1966, Díaz-Piferrer E-5952; Isla Cubagua, 9/3/1966, Díaz-Piferrer E-5996; Isla de Margarita, Macanao, Boca de Río, 11/7/2002, P. Pardo-J. Madrazo A-987; 20/8/2002; El Horcón, 22/8/2002, P. Pardo A-988; El Manglillo, junio/2003, P. Pardo-J. Gutiérrez A-822; Punta Arenas, 5/9/2002, P. Pardo A-989.
Ulva lactuca L. (Fig. 5)
Taylor (1960); Lemus (1970); Ríos (1972); Aponte (1985); García (1999).
Alga lobulada, lanceolada, color verde oscuro, 14,52 cm de largo, adherida al sustrato por un disco córneo del cual emergen una o varias láminas de 7,69 cm de ancho, divididas varias veces; células rizoidales claviformes de (12,3) 15,89 (20,5) (DS = 3,42) µm de ancho. Margen liso y ondulado. Células superficiales, ovaladas y cuadradas. Talo formado por dos capas de células ovaladas de (8,2) 12,23 (16,2) (DS = 3,57) µm de ancho y (4,1) 6,83 (12,3) (DS = 3,34) µm de largo, separadas por un espacio intercelular menor de 8,2 µm, el cual se evidencia sólo en la parte basal. Lóbulos de (48,6) 56,93 (64,8) (DS = 7,25) µm de espesor en la parte media y de (113,2) 127,41 (139,4) (DS = 11,89) µm en la parte basal. Creciendo sobre sustrato rocoso y arenoso en el mesolitoral e infralitoral, epífita sobre Thalassia testudinum.
García (1999), Ardito et al. (1995), Aponte (1985), Ríos (1972) y Taylor (1960) separan a Ulva lactuca y U. fasciata solamente por la forma de los frondes; sin embargo, en este estudio se observó similaridad en la forma, mientras que internamente se pudieron diferenciar por la forma de las células y por la presencia de un espacio intercelular entre las dos capas que poseen las láminas; éste es claramente visible en Ulva fasciata mientras que en U. lactuca el espacio no supera los 8,20 µm de ancho.
Material examinado: VENEZUELA: ANZOÁTEGUI: Isla Arapo, Farallón, 12/2/1966, Díaz-Piferrer E-5989; NUEVA ESPARTA: Isla de Coche, Punta Conejo, 7/3/1966, Díaz-Piferrer E-5994; Isla de Margarita, El Tirano, Punta Baja, 21/4/1966, Díaz-Piferrer E-5998; Macanao, Boca de Río, 18/7/2002, P. Pardo A-1053.
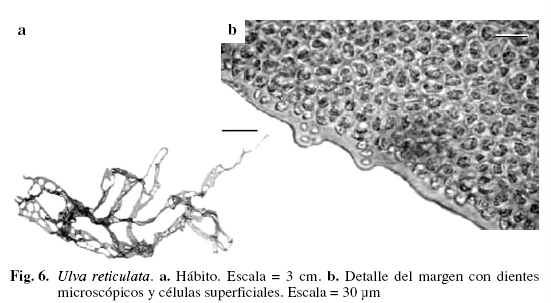
Ulva reticulata Forsskål (Fig. 6)
Aponte (1985)
Alga laminar, color verde claro, 21,5 cm de alto. Láminas con numerosas perforaciones dando apariencia de red. Células superficiales ovaladas. Margen liso, en algunas partes presenta pequeños dientes microscópicos ubicados irregularmente. Láminas formadas por dos capas de células ovaladas, redondeadas, de (8,2) 11,71 (14,35) (DS = 3,06) µm de ancho y (12,3) 17,87 (20,5) (DS = 3,09) µm de largo, separadas por un espacio intercelular de 8,2 µm ancho. Láminas de (49,2) 54,47 (57,41) (DS = 3,09) µm de espesor. Creciendo entremezclada con Ulva fasciata, Hypnea musciformis y Gracilaria domingensis, en el mesolitoral e infralitoral.
Ulva reticulata se distingue por presentar perforaciones en la lámina, ausencia de células rizoidales y pocos dientes microscópicos en el margen, esta última característica es señalada por Littler & Littler (2000) para Ulva rigida C. Agardh, sin embargo Aponte (1985) observó que U. reticulata puede tener dientes microscópicos muy raros e irregulares mientras que los dientes de U. rigida son tanto macroscópicos como microscópicos, ubicados a intervalos regulares en el margen, dando un aspecto áspero a la lámina.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla Cubagua, Charagato, 12/11/1981, M. Aponte A-152; Isla de Margarita, Macanao, Barrancas, 26/6/2003, P. Pardo A-846; Boca de Río, 18/7/2002, P. Pardo A-1056; El Horcón, 20/3/2003, P. Pardo A-1048; 26/6/2003, P. Pardo-G. Arias A-847; Guayacancito, 18/7/2002, P. Pardo A-1059; 29/5/2003, P. Pardo A-844; 26/6/2003, P. Pardo-J. Gutiérrez A-845.
Chaetomorpha linum (O.F.Müller) Kützing (Fig. 7)
Taylor (1960); Hammer & Gessner (1967); Almodóvar et al. (1972); Ríos (1972); Richardson (1975); Schnetter (1978); Lemus (1979); Aponte (1985); Littler & Littler (2000); Mendoza et al. (2000).
Alga filamentosa gregaria de color verde oscuro, 4,5 cm de largo, filamentos delgados formando gregarios flexibles y enrollados; sin ramificación; adheridos al sustrato por una célula basal cuadrada a rectangular de (147,8) 171 (194,4) (DS = 26,79) µm de ancho y (437,4) 617,6 (729) (DS = 118,9) µm de largo. Células superiores con constricciones dando aspecto segmentado al talo. Células del filamento cuadradas y ovaladas de (97,2) 182,8 (243) (DS = 47,43) µm de ancho y de (114,8) 19 (225,5) (DS = 40,69) µm de largo. Creciendo sobre sustrato rocoso, arenoso y epífita sobre Ulva, Hypnea, Gracilaria y Thalassia testudinum en el mesolitoral e infralitoral.
Chaetomorpha linum presenta una célula rizoidal de forma igual a las células siguientes, por tal razón autores como Schnetter (1978) y Taylor (1960) la señalan como difícil de distinguir, sin embargo esta característica la diferencia de otras especies de Chaetomorpha. Ríos (1972) diferencia a Chaetomorpha antennina por presentar constricciones en la célula rizoidal, mientras que Chaetomorpha linum tiene constricciones en las células superiores, producto de divisiones celulares desiguales (Schnetter op. cit.).
Material examinado: VENEZUELA: DEPENDENCIAS FEDERALES: Los Hermanos, 10/6/1966, Díaz-Piferrer E-3905; NUEVA ESPARTA: Isla de Coche, Bichal, 07/3/1966, Díaz-Piferrer E-1295; Isla de Margarita, Macanao, Barrancas, 29/5/2003, P. Pardo-J. Gutiérrez-J. Madrazo A-282; El Manglillo, 15/8/2002, P. Pardo A-1011.
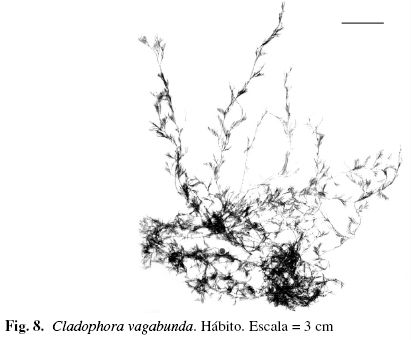
Cladophora vagabunda (L.) Hoek (Fig. 8)
Cladophora fascicularis (C.Agardh) Kützing
Taylor (1960); Joly (1967); Lemus (1970); Ríos (1972); Acosta (1974); Schnetter (1978); Aponte (1985); Ardito et al. (1995); Littler & Littler (2000).
Alga filamentosa erecta, color verde oliva, 17,82 cm de largo, fija al sustrato mediante rizoides incoloros unicelulares. Eje principal con ramificación alterna, escasa hacia la base, en algunos casos opuesta y lateral; ramas secundarias pectinadas, pseudodicótomas y curvas, terminando en pequeñas ramas fasciculadas. Ápice obtuso. Células del eje principal rectangulares, (210,6) 268,81 (324) (DS = 36,53) µm de ancho y (0,07) 0,09 (0,17) (DS = 0,045) mm de largo; células de las ramas pectinadas, de (48,61) 74,93 (97,2) (DS = 17,18) µm de ancho y (81) 190,41 (275,42) (DS = 67,49) µm de largo, atenuadas hacia el ápice. Creciendo sobre sustrato rocoso, areno-fangoso y epífita sobre Thalassia testudinum, en el mesolitoral e infralitoral.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Laguna Las Marites, 15/3/1966, Díaz-Piferrer E-1475; El Tirano, 21/4/1966, Díaz-Piferrer E-1476; Macanao, Barrancas, 11/7/2002, P. Pardo-J. Madrazo A-303; P. Pardo-J. Madrazo-J. Gutiérrez A-304; Boca Chica, Boca de Río, 20/8/2002, P. Pardo-M. Solé A-305; El Manglillo, 15/9/2002, P. Pardo-J. Madrazo A-1001; 26/6/2003, P. Pardo A-307; Guayacancito, 11/7/2002, P. Pardo-M. Solé A-301; 29/5/2003, P. Pardo-J. Madrazo A-302.
Bryopsis pennata Lamouroux (Fig. 9)
Taylor (1960); Joly (1967); Lemus (1970); Ríos (1972); Richardson (1975); Schnetter (1978); Lemus (1979); Aponte (1985); Steyermark (1994); Ardito et al. (1995); Littler & Littler (2000).
Alga cenocítica, erecta, color verde oliva, 8,52 cm de alto, adherida al sustrato por rizoides. Eje principal de (208) 410,12 (540,82) (DS = 140,91) µm de ancho. Ramificación opuesta, irregular. Frondes lineales, lanceolados, compuestos por pínnulas de (83,2) 142,61 (166,4) (DS = 40,6) µm de ancho y (0,5) 1,12 (1,52) (DS = 0,38) mm de largo, contraídas en la base, dispuestas uni o bilateralmente. Ápice agudo hasta redondeado. Creciendo sobre sustrato areno-fangoso, rocoso y entre Thalassia testudinum y Padina antillarum, en la zona mesolitoral e infralitoral.
Bryopsis es un género reconocible por su carácter cenocítico. Taylor (1960) presenta cinco especies que las diferencia, al igual que Schnetter (1978) y Littler & Littler (2000), basándose en la ubicación y forma de las pínnulas, las cuales son lineales-lanceoladas para Bryopsis pennata y triangular-lanceoladas para Bryopsis plumosa. En este estudio se observó que las pínnulas de Bryopsis pennata son más cortas y angostas que las de B. plumosa; se encontraron ejemplares de B. pennata más grandes que los reportados por Schnetter (1978) en material colombiano.
Material examinado: CUBA: GUÁNICA: Playa Tamarindo, 31/1/1962, Díaz-Piferrer E-6813. ESTADOS UNIDOS: FLORIDA: Earle-Siesta Key, 12/7/1966, S. Earle E-6812. VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, Barrancas, 29/5/2003, P. Pardo-J. Madrazo A-213.
Bryopsis plumosa (Hudson) C.Agardh (Fig. 10)
Taylor (1960); Hammer & Gessner (1967); Joly (1967); Lemus (1970); Almodóvar et al. (1972); Schnetter (1978); Aponte (1985); Mendoza et al. (2000).
Alga cenocítica, color verde oscuro, 6,51 cm de alto. Eje principal (cauloide) distinguible de (291,6) 414,41 (665,6) (DS = 161) µm de ancho. Ramificación radial; frondes piramidales, lanceolados, compuestos por pínnulas de (131,2) 153,81 (178,2) (DS = 16,77) µm de ancho y (0,6) 1,51 (3,52) (DS = 0,97) mm de largo, ubicadas bilateralmente dando así un aspecto plumoso al alga. Ápice redondeado. Creciendo sobre sustrato rocoso y epífita sobre Thalassia testudinum en la zona infralitoral.
Material examinado: CUBA: Bahía de Naranjos, 25/8/1960, Díaz-Piferrer E-662. VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, Barrancas, 11/7/2002, P. Pardo-J. Madrazo A-214.
Caulerpa cupressoides (West) C.Agardh (Fig. 11)
Taylor (1960); Ríos (1972); Schnetter (1978); Aponte (1985); Steyermark (1994); Littler & Littler (2000).
Alga cenocítica, color verde brillante, 12,45 cm de alto. Eje principal rastrero, adherido al sustrato por medio de rizoides ramificados, de (1,21) 2,9 (4,52) (DS = 1,4) cm de largo, ensanchados hacia la parte proximal. Cauloide de (2,16) 2,47 (2,84) (DS = 0,26) mm de diámetro. Filoides erectos de (2,5) 6,28 (8,51) (DS = 2,24) cm de alto, sujetos por un pedicelo libre de pínnulas de (1,2) 1,54 (1,87) (DS = 0,23) cm de largo, el cual puede estar ramificado varias veces. Filoides con pínnulas teretes, curvas, ligeramente comprimidas en su base, de (499,2) 617 (790,41) (DS = 115,93) mm de ancho y (0,83) 1,09 (1,45) (DS = 0,23) mm de largo, organizadas en tres hileras sobre el filoide. Ápice mucronado. Creciendo sobre sustrato rocoso, en la zona infralitoral.
De esta especie polimórfica se conocen ocho variedades y seis formas diferentes (Wynne 2005) de las cuales sólo dos variedades se encuentran reportadas para Venezuela. Autores como Aponte (1985) y Ríos (1972) las describen como Caulerpa cupressoides únicamente debido a la complejidad de características que presentan entre una variedad y otra, que dificulta su identificación.
Material examinado: CURAÇAO: Wacawa, Boca Grandi, 27/9/1968, Díaz-Piferrer E-861. VENEZUELA: ARAGUA: Choroní, 14/4/1965, Díaz-Piferrer E-6961; NUEVA ESPARTA: Isla Cubagua, 9/3/1966, Díaz-Piferrer E-862; Isla de Margarita, Macanao, Punta Arenas, 8/8/2002, P. Pardo A-953; julio/2003, P. Pardo-M. Solé A-952; SUCRE: Mochima, 17/4/1966, Díaz-Piferrer E-850.
Caulerpa mexicana Sonder ex Kützing (Fig. 12)
Taylor (1960); Hammer & Gessner (1967); Ríos (1972); Bula-Meyer (1977); Schnetter (1978); Aponte (1985); Steyermark (1994); Littler & Littler (2000); Mendoza et al. (2000).
Alga cenocítica, erecta, color verde claro-oscuro, 9,01 cm de alto, adherida al sustrato por rizoides en forma de penachos finos e incoloros de (0,51) 0,83 (1,21) (DS = 0,26) mm de ancho y (3,35) 6,25 (8,52) (DS = 1,72) mm de largo. Eje principal rastrero, sosteniendo los filoides por medio de un pedículo cilíndrico de (1,28) 1,69 (2,54) (DS = 0,53) mm de ancho y (1,08) 4,84 (6,45) (DS = 1,81) mm de largo. Cauloide de (0,2) 1,71 (3,74) (DS = 1,21) mm diámetro. Filoides simples o raramente ramificados; pínnulas opuestas, aplanadas, fusiformes, curvas, arqueadas hacia arriba, sin constricciones proximales, de (0,51) 1,72 (2) (DS = 0,64) mm de ancho y (1) 3,9 (6) (DS = 1,92) mm de largo. Ápices agudos. Creciendo sobre sustrato arenoso, rocoso en la zona mesolitoral e infralitoral.
Caulerpa mexicana se distingue de otras especies de Caulerpa por presentar pínnulas planas, carentes de constricciones proximales, criterios que utiliza Schnetter (1978) para separarlas, mientras que Ríos (1972) diferencia a esta especie por la forma de su ápice. Los ejemplares encontrados en la Península de Macanao fueron de menor tamaño que los reportados por Aponte (1985) para la zona nororiental de Isla de Margarita, los cuales llegaron a medir hasta 26 cm de alto, mientras que el tamaño de las pínnulas y la forma se encuentran dentro del rango y descripción dada por este autor.
Material examinado: CURAÇAO: Piscadera, 18/9/1962, Díaz-Piferrer E-953. PUERTO RICO: Guayama, Las Mareas, 30/3/1968, Díaz-Piferrer E-1032. VENEZUELA: DEPENDENCIAS FEDERALES: Isla Orchilla, 12/6/1966, Díaz- Piferrer E-901; NUEVA ESPARTA: Isla de Margarita, Macanao, Boca Chica, 26/6/2003, P. Pardo-J. Madrazo A-236.
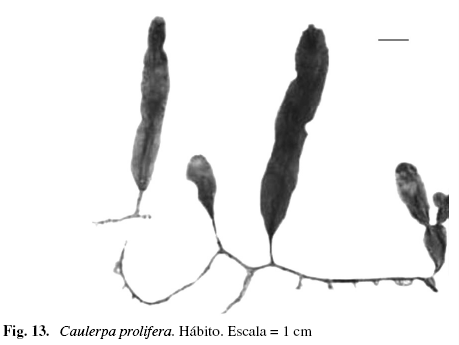
Caulerpa prolifera (Forsskål) Lamouroux (Fig. 13)
Taylor (1960); Lemus (1970); Ríos (1972); Schnetter (1978); Bula-Meyer (1983); Aponte (1985); Steyermark (1994); Littler & Littler (2000).
Alga cenocítica, erecta, color verde oscuro, 8,25 cm de alto, adherida al sustrato por rizoides incoloros. Cauloide de (291,2) 381,9 (499,2) (DS = 76,29) µm de ancho. Filoides erectos, ovoides, laminares de (2,11) 3,77 (5) (DS = 1,08) mm de ancho y (1) 2,45 (3,5) (DS = 0,93) cm de largo, sujetos por un pedicelo grueso que alcanza (1,5) 6,5 (3) (DS = 3,45) mm de largo y (332,8) 416 (499,2) (DS = 43,17) µm de ancho; proliferaciones superficiales presentes. Creciendo sobre sustrato rocoso y arenoso en la zona mesolitoral e infralitoral.
Caulerpa prolifera es distinguible de otras especies de Caulerpa ya que presenta filoides enteros, laminares, ovalados, características que fueron utilizadas por Aponte (1985), Schnetter (1978) y Ríos (1972). El material estudiado presentó pocas proliferaciones superficiales en sus filoides.
Material examinado: PUERTO RICO: Isabela San Antonio, 8/2/1969, Díaz-Piferrer E-937. VENEZUELA: NUEVA ESPARTA: Isla de Coche, 8/3/1966 Díaz-Piferrer E-931; Isla de Margarita, La Guardia, 24/4/1966, Díaz-Piferrer E-934; Macanao, El Horcón, 22/05/2002, P. Pardo A-1192; Punta Arenas, 26/12/2002, P. Pardo A-1054; 20/2/2003, P. Pardo- J. Madrazo A-950; 26/6/2003, P. Pardo A-239.
Caulerpa racemosa (Fisher) Stokes var. occidentalis (J.Agardh) Børgesen (Fig. 14)
Taylor (1960); Ríos (1972); Bula-Meyer (1983); Aponte (1985); Littler & Littler (2000).
Alga cenocítica, color verde oscuro, 8,85 cm de alto, adherida al sustrato por rizoides largos y ramificados de (3,45) 5,81 (7,98) (DS = 1,38) mm de largo; pedicelo desnudo de (3,02) 3,32 (4,21) (DS = 0,7) mm de largo. Cauloide de (1,32) 1,96 (2,52) (DS = 0,48) mm de ancho. Filoides de (3,45) 4,39 (6,12) (DS = 0,97) cm de alto, cubiertos por numerosas ramas pequeñas, teretes, de (2,13) 2,75 (3,31) (DS = 0,38) mm de ancho y (3,2) 4,16 (5,23) (DS = 0,53) mm de largo, las cuales se ensanchan gradualmente hacia el ápice, dispuestas en varios planos. Ápice obtuso, esférico. Creciendo sobre sustrato areno-fangoso, rocoso y en la zona mesolitoral e infralitoral.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, Boca Chica 11/07/2002, P. Pardo A-966; 03/2003, P. Pardo A-965; Boca de Río, 11/7/2002, P. Pardo-M. Solé A-245; Punta Arenas, 20/2/2003, P. Pardo-J. Madrazo A-949; Sucre: Bahía de Mochima, 17/4/1966, Díaz-Piferrer E-1008.
Caulerpa peltata Lamouroux (Fig. 15)
Caulerpa racemosa var. laetevirens Montagne
Taylor (1960); Schnetter (1978); Aponte (1985); Mendoza et al. (2000).
Alga cenocítica, erecta, color verde claro a oscuro, 7,45 cm de alto, adherida al sustrato por rizoides gruesos, cortos incoloros. Filoides erectos, de (2,56) 3,79 (5,62) (DS = 1,17) cm de alto, cubiertos densamente por ramas teretes, imbricadas, de (1,35) 1,62 (2,01) (DS = 0,36) mm de ancho y (5,81) 6,42 (7,85) (DS = 0,8) mm de largo, ensanchándose abruptamente hacia la parte terminal; ubicadas irregularmente en varios planos. Ápice claviforme, peltado. Creciendo sobre sustrato rocoso y arenoso en la zona mesolitoral.
Caulerpa racemosa presenta seis variedades, las cuales se diferencian por la forma de sus ramas, que puede ser desde achatada hasta muy delgada y globosa (Taylor 1960). Schnetter (1978) y Bula-Meyer (1983) consideran a las ramas de Caulerpa racemosa var. peltata como rámulos que pueden ser cilíndricos a claviformes, mientras que Aponte (1985) los describe como pínnulas desde esféricas hasta claviformes, coincidiendo con la descripción de los ejemplares estudiados. Sin embargo, Caulerpa racemosa var. peltata y C. racemosa var. occidentalis muestran gran similitud, su diferenciación fue basada en la forma y tamaño de las ramas; para C. peltata las ramas fueron más largas que las de C. racemosa var. occidentalis, esta última presentó ensanchamiento gradual de las ramas, formando un ápice obtuso a esférico, mientras que C. racemosa var. peltata tiene ramas ensanchándose abruptamente, terminado en ápices claviformes o peltados.
Lipkin & Silva (2002) así como South & Skelton (2003) rechazan las conclusiones originales realizadas por Eubank (1946) según las cuales Caulerpa peltata debería estar referida a una variedad de Caulerpa racemosa.
Material examinado: PUERTO RICO: La Pitahaya, 20/6/1963, Díaz-Piferer E-7017. VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, Boca de Río, 20/2/2003, P. Pardo-G. Arias A-963; 29/5/2003, P. Pardo-J. Madrazo A-248; 26/6/2003, P. Pardo-G. Arias A-249; Punta Arenas, 20/8/2002, P. Pardo A-945; 20/2/2003, P. Pardo-M. Solé A-240.
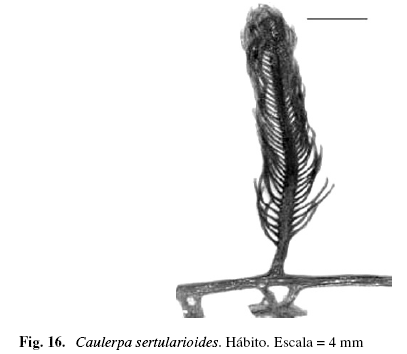
Caulerpa sertularioides (Gmelin) Howe (Fig. 16)
Taylor (1960); Ríos (1972); Schnetter (1978); Lemus (1979); Aponte (1985); Ardito et al. (1995); Littler & Littler (1997).
Alga cenocítica, erecta, color verde, 10,12 cm de alto, adherida al sustrato por rizoides incoloros de (1,50) 3,21 (4,87) (DS = 1,83) mm de largo, ramificados en su parte terminal; filoides enteros con un pedicelo desnudo, de (2,5) 4,1 (5,5) (DS = 1,12) mm de alto, parte pinnada de (1) 3,61 (6,84) (DS = 1,71) cm de alto. Pínnulas bilaterales, opuestas, teretes, curvas hacia la parte superior, de (425) 492 (574) (DS = 59,42) µm de ancho y (2,52) 3,51 (5,01) (DS = 0,92) mm de largo. Ápice mucronado. Creciendo en sustrato areno-fangoso, en el mesolitoral e infralitoral.
Material examinado: VENEZUELA: NUEVA ESPARTA: Macanao, Boca de Río, 11/7/2002, P. Pardo-M. Solé A-257; 26/06/2003, P. Pardo-J. Gutiérrez A-258; 26/6/2003, P. Pardo-J. Gutiérrez A-258; El Horcón, 26/7/2002, P. Pardo-J. Madrazo A-954; Punta Arenas, 8/8/2002, P. Pardo-J. Madrazo A-957; 12/6/2003, P. Pardo A-1029.
Caulerpa sertularioides f. longiseta (Bory) Svedelius (Fig. 17)
Taylor (1960); Lemus (1979).
Alga cenocítica, erecta, color verde oscuro,12, 47 cm de alto, adherida al sustrato por medio de rizoides delgados, ramificados, incoloros de (0,51) 4,83 (9) (DS = 3,11) mm de largo y (83,2) 196,65 (457,6) (DS = 131,67) µm de ancho. Filoides pinnados, erectos, de (4,25) 6,02 (9,65) (DS = 1,65) cm de largo y (1) 1,85 (2,54) (DS = 0,54) cm de ancho, con ramificación dicótoma y algunas veces tricótoma, sujetados por un pedicelo cilíndrico, libre de pínnulas, de (4,16) 6,38 (9,35) (DS = 2,22) mm de alto; pínnulas teretes, de (291,21) 360 (457,62) (DS = 74,32) µm ancho y (2,41) 3,82 (5,4) (DS = 1,18) mm de largo. Ápice agudo, mucronado. Creciendo sobre sustrato rocoso, areno-fangoso en el mesolitoral e infralitoral.
Caulerpa sertularioides f. longiseta se diferencia de C. sertularioides según Taylor (1960) por presentar ramificaciones dicótomas y algunas veces tricótomas, ambas especies poseen pedículo libre de pínnulas.
Material examinado: VENEZUELA: DEPENDECIAS FEDERALES: Isla La Blanquilla, 11/6/1966, Díaz-Piferrer E-1094; NUEVA ESPARTA: Isla de Margarita, Punta de Piedras, 10/3/1966, Díaz-Piferrer E-1093; Macanao, Barrancas, 18/7/2002, P. Pardo-J. Madrazo A-964; 29/5/2003, P. Pardo A-261; Boca de Río, 29/5/2003, P. Pardo-J. Madrazo A-259; 11/07/2003, P. Pardo-M. Solé A-257; Boca Chica, 11/6/2002, P. Pardo-M. Solé A-961; El Horcón, 22/8/2002, P. Pardo A-960; El Manglillo, 26/7/2002, P. Pardo-J. Madrazo A-962; Punta Arenas, 12/6/2003, P. Pardo-J. Madrazo A-1029.

Descripción de especies de Phaeophyceae
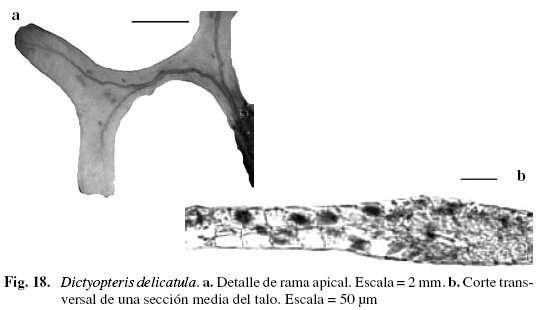
Dictyopteris delicatula Lamouroux (Fig. 18)
Vickers (1908); Taylor (1960); Ríos (1972); Lemus (1974); Richardson (1975); Schnetter (1976); Allender & Kraft (1983); Aponte (1985); Széchy & Cordeiro (1991); Ardito et al. (1995); García (1999); Littler & Littler (2000); Wysor & De Clerck (2003).
Alga de color verde a marrón, 6,88 cm de alto, formando masas entrelazadas, adherida al sustrato por medio de rizoides que se ubican en diferentes partes del talo. Ramificación dicótoma. Lámina de 1,74 mm de ancho, con vena central claramente distinguible; grupos de pelos incoloros ubicados en el margen cubriendo los soros y a los lados de la vena central. Margen liso. Ápice obtuso, con una sola célula de crecimiento. Región medular formada por dos capas de células rectangulares, de (28,7) 41 (53,3) (DS = 10,61) µm de ancho y (28,71) 33,4 (36,91) (DS = 2,83) µm de largo que desaparecen hacia los extremos de la lámina, corteza formada por una capa de células cuadradas, rectangulares, de (20,5) 33,31 (45,11) (DS = 8,06) µm de ancho y (28,71) 43,7 (57,4) (DS = 7,67) µm de largo, fuertemente pigmentadas. Vena central con cuatro a seis estratos de células rectangulares pequeñas de (12,3) 19,9 (28,7) (DS = 5,52) µm de ancho y (8,2) 15,8 (20,51) (DS = 4,38) µm de largo. Creciendo en sustrato rocoso en las zonas mesolitoral e infralitoral.
Este género presenta siete especies diferentes para el Atlántico (Wynne 2005) de las cuales cinco se encuentran registradas para aguas venezolanas y tres de éstas presentes en la Isla de Margarita. Dictyopteris delicatula fue reportada para Venezuela por García (1999), Aponte (1985) y Ríos (1972) como una especie fácilmente distinguible por la ausencia de venas laterales a los lados de la vena o costilla central y por presentar margen liso, características que fueron observadas en los ejemplares estudiados ubicándolos así en esta especie.
El número de capas celulares de los frondes generalmente se encuentra entre dos a seis, según Littler & Littler (2000), Allender & Kraft (1983) y Vickers (1908); sin embargo, varía en la zona donde se encuentra la vena central. García (1999) reportó especies con hasta ocho hileras de células en la vena y Wysor & De Clerck (2003) señalan hasta nueve células, incluso afirman que estas capas pueden variar también en los márgenes, observando ejemplares que presentaban más de dos estratos de células en el margen.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla Cubagua, 9/3/1966, Díaz-Piferrer E-2668; Isla de Coche,La Uva,8/3/1966, Díaz-Piferrer E-2658; Isla de Margarita, Juan Griego, 21/3/1966, Díaz-Piferrer E-2670; Macanao, Boca Chica,12/6/2003, P. Pardo-J. Gutiérrez A-528; Guayacancito, 22/07/2002, P. Pardo A-1280; Punta Arenas, 20/8/2002, P. Pardo A-994; 20/2/2003, P. Pardo-M. Solé A-526; 26/6/2003, P. Pardo-J. Gutiérrez A-529; 8/8/2003, P. Pardo-J. Gutiérrez A-531.
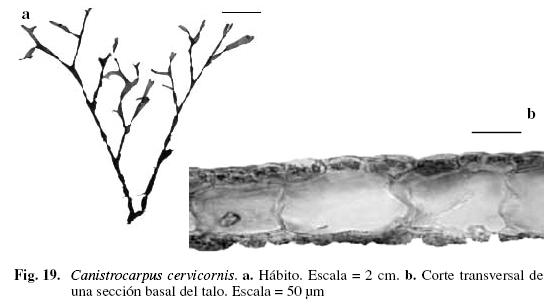
Canistrocarpus cervicornis (Kütz.) De Paula et De Clerck (Fig. 19)
Dictyota cervicornis Kütz.
Taylor (1960); Díaz-Piferrer (1970); Ríos (1972); Lemus (1974); Richardson (1975); Schnetter (1976); Delascio & González (1988); Széchy & Cordeiro (1991); Hörnig & Schnetter (1992); Steyermark (1994); Solé & Foldats (2003); De Clerck et al. (2006).
Alga color marrón oscuro, 12,52 cm de alto, adherida al sustrato por rizoides simples, marginales y superficiales, dispuestos en grupos y algunas veces en hileras. Talos aplanados, arrollados en espiral, caracterizados por presentar en la parte apical una rama pequeña curva, antes de cada dicotomía. Ramificación subdicótoma y alterna. Ángulos de bifurcación apical, agudos, de 39-72° y de 41-62° en la parte basal. Segmentos de (0,71) 2,08 (2,5) (DS = 0,26) mm de ancho; entrenudos de (1,2) 4,2 (7) (DS = 0,31) mm de ancho; proliferaciones marginales de 0,45 mm de largo, ubicadas entre las bifurcaciones de las ramas y a lo largo del talo. Margen liso. Ápices cervicornis. Región medular formada por una fila de células incoloras, de (61,5) 122 (156,01) (DS = 37,1) µm de ancho y (94,3) 132 (160,01) (DS = 22,5) de largo; corteza con una capa de células pigmentadas, rectangulares y alargadas de (12,3) 19,5 (28,71) (DS = 6,12) µm de ancho y de (20,3) 23,9 (28,71) (DS = 4,03) µm de largo. Esporangios globosos de (61,52) 101 (130,02) (DS = 27,3) µm de ancho y (61,52) 115 (146,02) (DS =29,1) µm de alto, rodeados por células formando un involucro, el cual permanece después de la dehiscencia, esporangios solitarios o en grupos de tres a cinco en ambos lados de la lámina. Creciendo sobre sustrato rocoso, epífita sobre Thalassia testudinum, en el infralitoral.
Esta especie es distinguible por poseer ramificación dicótoma a subdicótoma; sus últimas ramas generalmente con desarrollo desigual, divergentes, con una rama atenuada y curva; esporangios con involucro basal y proliferaciones marginales y superficiales características que también fueron observadas por Wysor & De Clerck (2003), Solé & Foldats (2003) y Széchy & Cordeiro (1991).
Material examinado: VENEZUELA: MIRANDA: Chirimena, 24/10/2000, M. Solé A-384; NUEVA ESPARTA: Isla de Margarita, Macanao, El Horcón, 20/8/2002 P. Pardo-J. Gutiérrez A-1052; Punta Arenas, agosto/2002, P. Pardo-M. Solé A-378.
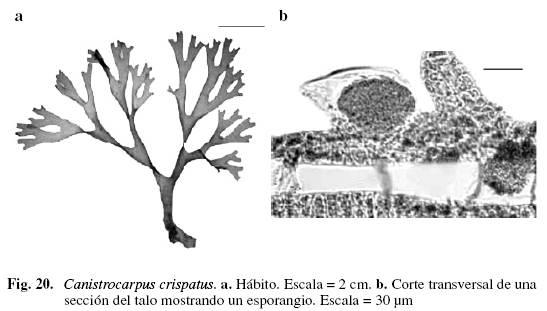
Canistrocarpus crispatus (Lamouroux) De Paula et De Clerck (Fig. 20)
Dictyota crispata Lamouroux, Dictyota bartayresiana Lamouroux sensu Vickers "(1908)"
Taylor (1960); Ríos (1972); Schnetter (1976); Allender & Kraft (1983); Solé & Foldats (2003); Wysor & De Clerck (2003); De Clerck et al. (2006).
Alga de color marrón oscuro, 9,72 cm de alto, adherida al sustrato por rizoides simples, incoloros, delgados, agrupados hacia el margen de la lámina. Talos laminares. Ramificación dicótoma. Ángulos de bifurcación agudos de 32-72°; segmentos de (2) 3,41 (4,8) (DS = 0,96) mm de ancho, estrechándose hacia la parte media; entrenudos de (2,91) 4,45 (5,21) (DS = 1,6) mm de ancho; proliferaciones de (0,8) 2,48 (4,31) (DS = 1,41) mm de largo, especialmente en la parte basal del talo, algunas sobre la superficie. Margen entero. Ápice obtuso. Región medular formada por una hilera de células incoloras, cuadradas, de (82) 111 (164,1) (DS = 31,9) µm de ancho y (103) 121 (144) (DS = 14,8) µm de largo; corteza formada por células pigmentadas, rectangulares, de (12,3) 16,41 (20,5) (DS = 4,12) µm de ancho y (16,41) 24 (32,8) (DS = 4,98) µm de largo. Esporangios globosos de (65,6) 74,41 (103) (DS = 17,62) µm de ancho y (57,41) 79,8 (110) (DS = 22,7) µm de largo, rodeados por una corona de células basales delgadas y altas, que generan el involucro, el cual permanece como huella después de la dehiscencia, ubicados sobre la parte media de la lámina. Creciendo sobre sustrato arenoso, rocoso en el mesolitoral e infralitoral.
De Clerck & Coppejans (1997), al estudiar Dictyota bartayresiana Lamouroux y D. crispata, determinaron que la presencia de proliferaciones sobre la lámina y esporangios con involucro son características típicas de D. crispata mientras que en D. bartayresiana están ausentes, a pesar que éstas comparten características morfológicas como el tipo de ramificación, margen y ángulo de bifurcación. Según estos criterios de separación, Solé & Foldats (2003) introducen los reportes hechos por Lemus (1974), Schnetter (1976) y Allender & Kraft (1983) para D. bartayresiana y D. bartayresii sensu Vickers (1908) dentro de D. crispata.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, Barrancas, 26/6/2003, P. Pardo A-416; Boca de Río, 26/6/2003, P. Par-do A-415; El Manglillo, 18/7/2002, P. Pardo A-991; Guayacancito, 25/10//2002, P. Pardo A-992; 29/5/2003, P. Pardo-J. Madrazo A-414.
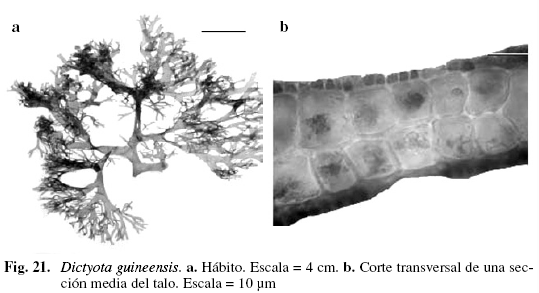
Dictyota guineensis (Kütz.) P.Crouan & H.Crouan (Fig. 21)
Dilophus guineensis (Kütz.) J.Agardh
Vickers (1908); Taylor (1960); Schnetter (1976); Hörnig & Schnetter (1992); Solé & Foldats (2003).
Alga de color verde a marrón claro, 12 cm de alto, adherida al sustrato por medio de rizoides simples, largos, incoloros, agrupados en la superficie y marginalmente. Talos aplanados. Ramificación dicótoma, subdicótoma. Ángulos de bifurcación apical agudos, de 38-73° y los basales desde agudos a obtusos de 53-105°; segmentos de (0,71) 2,09 (3,3) (DS = 0,81) mm de ancho, entrenudos de (1,60) 4,11 (8,71) (DS = 2,27) mm de ancho, con abundantes proliferaciones en la parte basal y parte interna de las bifurcaciones. Margen entero. Ápices obtu-sos. Región medular con dos capas de células rectangulares, incoloras, de (45,11) 90,31 (123) (DS = 38,1) µm de ancho y (90,21) 110 (127,1) (DS = 10,4) µm de largo; capa cortical formada por células rectangulares, pigmentadas, de (16,4) 20,52 (24,6) (DS = 4,1) µm de ancho y (12,3) 15 (20,51) (DS = 4,73) µm de largo. Esporangios globulares, de (53,30) 74,62 (103) (DS = 25,70) µm de ancho y (53,3) 78,7 (107) (DS = 24,2) µm de alto, con ausencia de involucro, ubicadas irregularmente en ambos lados de la lámina. Creciendo sobre sustrato arenoso, entre Thalassia testudinum, en la zona infralitoral.
Las características como capa medular poliestromática por lo menos en alguna parte del talo, ramificación subdicótoma a irregular, fueron propuestas por Solé & Foldats (2003) para Dictyota guineensis; los ejemplares estudiados mostraron estas características y también presentaron los anchos de los segmentos entre los rangos reportados por este autor. Además, se observaron proliferaciones numerosas en la parte basal y apical siendo esta característica nueva para este taxon en Venezuela; Vickers (1908) en sus ilustraciones muestra a D. guineensis con numerosas proliferaciones, y Hörnig & Schnetter (1992) también des-criben a esta especie con proliferaciones en la base y en las partes terminales de los talos, además aclaran que la región medular puede ser poliestromática sólo hacia el centro de la médula, mientras que Dictyota pinnatifida Kütz., especie con características morfológicas muy afines a D. guineensis, tiene gran número de proliferaciones y médula poliestromática sólo hacia el margen del talo.
Material examinado: PUERTO RICO: Guayanés, 4/2/1969, Díaz-Piferrer E-3000. REPÚBLICA DOMINICANA: Bayahibe, 9/7/1977, Díaz-Piferrer E-3001. VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, Guayacancito, 22/7/2002, P. Pardo A-508.
Padina antillarum (Kütz.) Piccone (Fig. 22)
Padina tetrastomatica Hauck
Schnetter (1976); Aponte (1985); Wynne (1998); Wynne & De Clerck (1999); Nunes & Paula (2000).
Alga de color amarillo a marrón, 8 cm de alto. Talos laminares de 5,32 cm de ancho, ondulados, enteros o divididos varias veces hasta la parte basal, adheridos al sustrato por un disco basal del cual se desprende un pedicelo corto de (103) 135,2 (139) (DS = 3) µm de ancho, calcificado. Láminas con dos zonas distinguibles, una zona fértil de (416) 510,12 (624) (DS = 58,81) µm de ancho, la cual está compuesta por pelos piriformes y esporangios y la zona estéril, libre de pelos y esporangios, intercaladas a ambos lados del fronde. Margen enrollado hacia el envés. Láminas formadas por dos hileras de células cuadradas de (24,6) 28,71 (32,8) (DS = 3,09) µm de ancho en la región apical y de cuatro hileras de células de (36,9) 41,6 (49,2) (DS = 4,98) µm de ancho en la región basal. Esporangios globosos, de (48,6) 79,52 (103,21) (DS = 16) µm de diámetro, sin involucro, distribuidos por encima y por debajo de la zona de pelos. Creciendo sobre sustrato rocoso, en la zona mesolitoral.
La presencia de dos hileras de células de espesor en la parte apical y de cuatro hileras en la parte media-baja, esporangios sin involucro ubicados por encima y por debajo de la zona pilífera, ancho de la zona fértil de 0,5 mm, son características que ubican a los ejemplares estudiados dentro de la descripción dada para la especie (Misra 1966; Srinivasan 1969; Nunes & De Paula 2000), para Padina antillarum. Al ser estas dos especies tan similares, Wynne (1998) estudia los holótipos y determina que P. tetrastomatica es sinónimo de P. antillarum. Aponte (1985) reporta por primera vez para Venezuela Padina tetrastomatica, sin embargo este reporte fue diagnosticado con dudas pues no coincidían el número de capas de células basales y el grosor del área fértil según la diagnosis de la especie reportada con anterioridad.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, El Manglillo, 25/7/2002, P. Pardo-M. Solé A-722.
Padina boergesenii Allender & Kraft (Fig. 23)
P. gymnospora sensu W.R.Taylor "(1960)"
Taylor (1960); Ríos (1972); Schnetter (1976); Allender & Kraft (1983); Ardito et al. (1995); Wynne & De Clerck (1999); Nunes & De Paula (2000).
Alga color marrón oscuro, 14 cm de altura. Talos laminares, enteros, redondeados y divididos hasta tres veces, adheridos al sustrato por un disco basal formado de filamentos rizoidales compactos; pedicelo de 145,82 µm de ancho. Margen enrollado hacia el envés. Láminas formadas por una zona fértil de (518,4) 562,73 (631,81) (DS = 55,03) µm de ancho, la cual se presenta a intervalos regulares en ambas caras del fronde, pelos cortos por debajo de la zona esporangial, alternados con la zona fértil de la lámina. Médula formada por tres hileras de células cuadradas, rectangulares, pigmentadas, de (20,5) 27,5 (32,8) (DS = 5,48) µm de ancho y (36,9) 43,9 (49,2) (DS = 3,88) µm de largo, que van disminuyendo su tamaño a medida que se acerca al ápice y al pedicelo. Esporangios globosos, de (61,51) 69,69 (77,91) (DS = 8,2) µm de ancho y (61,5) 92,25 (106,6) (DS = 20,21) µm de largo, sin involucro. Creciendo sobre sustrato rocoso y arenoso en las zonas mesolitoral e infralitoral.
Padina boergesenii y P. gymnospora son especies que fueron simultáneamente descritas. Según Allender & Kraft (1983), el carácter de separación entre éstas se basa en el número de capas celulares, Padina gymnospora presenta de tres a seis capas de células, mientras que P. boergesenii tiene tres a lo largo de todo el fronde. Por esta razón, en el catálogo de la ficoflora venezolana (Ganesan 1989) se incluye a Padina gymnospora en sinonimia con P. boergesenii para los reportes realizados por Taylor (1960), Ríos (1972), Lemus (1974, 1979) y Acosta (1974).
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, Boca de Río, 24/11/2002, P. Pardo-J. Madrazo A-725; 29/5/2003, P. Pardo A-1004; 26/6/2003, P. Pardo A-728; Guayacancito, 29/5/2003, P. Pardo-J. Madrazo A-727; Punta Arenas 20/2/2003, P. Pardo A-1002.
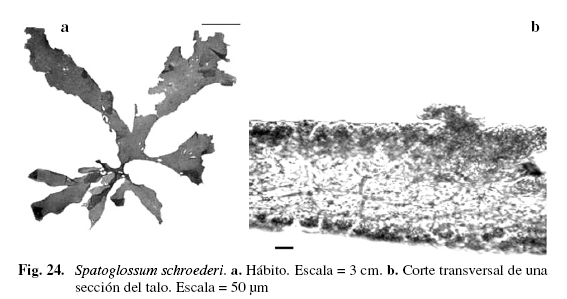
Spatoglossum schroederi (C.Agardh) Kütz. (Fig. 24)
Vickers (1908); Taylor (1960); Hammer & Gessner (1967); Joly (1967); Ríos (1972); Lemus (1974); Richardson (1975); Schnetter (1976); Lemus (1979); Széchy & Cordeiro (1991); Littler & Littler (2000).
Alga de color marrón oscuro, 17,52 cm de alto. Talos cintiformes, laminares, ondulados, de (0,75) 1,13 (1,09) (DS = 0,32) cm de ancho; proliferaciones en la parte basal. Ramificación subdicótoma, irregular, grupos de pelos largos sobre la superficie, ubicados irregularmente en ambas caras. Margen dentado. Ápices obtusos y algunas veces agudos, con células de crecimiento ordenadas en una fila longitudinal. Región medular próxima al ápice del talo, compuesta por dos hasta cuatro capas de células, pigmentadas, de (20,5) 37,31 (53,3) (DS = 11) µm de ancho y (49,21) 64,82 (86,1) (DS = 11,1) µm de largo; porción basal hasta de siete capas de células; corteza formada por una capa de células cuadradas, rectangulares, pigmentadas, de (12,3) 22 (69,71) (DS = 19,51) µm de ancho y (16,4) 30,8 (53,30) (DS = 12,4) µm de largo. Creciendo sobre sustrato rocoso, en la zona mesolitoral.
El número de capas celulares reportadas para Spatoglossum schroederi presenta gran variabilidad, puede tener desde cuatro (Ríos 1972) hasta 10 capas celulares (Vickers 1908); sin embargo, Széchy & Cordeiro (1991) consideran que este número varía de acuerdo al crecimiento de esta especie, ya que el número mayor de capas se encuentra en la zona basal (20 capas) dando así mayor rigidez y dureza, mientras que la parte apical posee como máximo dos capas, es más flexible y se encuentra expuesta al movimiento directo del agua. En los ejemplares estudiados se observaron alturas dentro de los rangos reportados por Lemus (1974), Ríos (1972) y Taylor (1960).
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Coche: La Uva, 8/3/1966, Díaz-Piferrer E-6332; Isla de Margarita, El Tirano, 21/4/1966, Díaz-Piferrer E-6336; Macanao, Barrancas, 18/7/2002, P. Pardo-M. Solé A-803; Boca de Río, 5/11/2002, P. Pardo-J. Madrazo A-805; 24/10/2002, P. Pardo-G. Arias A-804; 27/2/2003, P. Pardo A-1035; 26/6/2003, P. Pardo A-806; Punta Arenas, 8/8/2002, P. Pardo A-1034.
Sargassum cymosum Kütz. (Fig. 25)
Taylor (1960); Díaz-Piferrer (1970); Ríos (1972); Bertossi (1973); Schnetter (1978); Lemus (1979); Széchy & Cordeiro (1991); Ardito et al. (1995); Camacho (2003).
Alga color marrón oscuro, 13,5 cm de alto; eje y ramas cilíndricas con protuberancias; sin espinas. Ramificación lateral, alterna y abundante. Filoides simples, aplanados, lanceolados a lineales, de (0,2) 0,33 (0,36) (DS = 0,12) cm de ancho, (1,50) 1,71 (2) (DS = 0,33) cm de largo, con base simétrica; filoides en la parte media del talo oblongos lanceolados; criptóstomas de (113) 170,12 (208) (DS = 32,1) µm de diámetro, ubicados irregularmente, cerca de la vena central; aerocistes ausentes. Margen de los filoides ondulado, entero. Región interna de los filoides formada por más de seis capas de células ovaladas, circulares, incoloras, de (98,4) 107,38 (131,5) (DS = 19,68) µm de ancho y de (24,6) 43,73 (61,5) (DS = 15,04) µm de largo; células de la corteza, cuadradas, pigmentadas, de (12,3) 13,94 (16,4) (DS = 2,24) µm de ancho y de (16,4) 18,04 (20,5) (DS = 2,24) µm de largo. Receptáculos verrugosos, creciendo en forma de racimos de (3,2) 3,98 (5,12) (DS = 0,87) mm de ancho, con un pedicelo corto que las sostiene. Ramificación dicótoma, presentes en ramitas de primer y segundo orden, disminuyendo el tamaño y el número de filoides por rama. Creciendo sobre sustrato rocoso, en la zona mesolitoral.
Los ejemplares estudiados concuerdan con las características dadas por Lemus (1979) y Bertossi (1973) en estudios para Venezuela.
Material examinado: VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Manzanillo, 13/3/1966, Díaz-Piferrer E-5397; Macanao, La Pared, 8/6/1966, Díaz-Piferrer E-5597; Punta Arenas, 20/2/2003, P. Pardo-G. Arias A-1018; 26/6/2003, P. Pardo A-763.
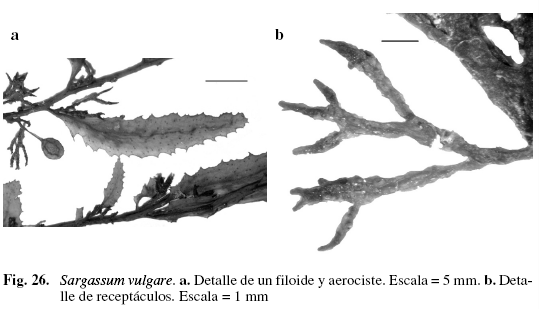
Sargassum vulgare C.Agardh "nom. illeg." (Fig. 26) Taylor (1960); Ríos (1972); Bertossi (1973); Schnetter (1976); Lemus (1979); Aponte (1985); Széchy & Cordeiro (1991); García (1999); Littler & Littler (2000); Camacho (2003).
Alga de color marrón claro, 33,52 cm de alto; eje y ramas terete con espinas, de (0,05) 1,37 (2,49) (DS = 1,2) mm de largo, adheridas al sustrato por medio de un disco córneo del cual se desprenden varios ejes. Ramificación alterna y radial. Filoides oblongos, lineales, de (0,41) 0,52 (0,68) (DS = 0,13) cm de ancho y (1,52) 2,42 (3,35) (DS = 0,66) cm de largo. Margen dentado; base asimétrica; criptóstomas circulares de (48,6) 75 (103) (DS = 15,21) µm de diámetro, esparcidos por ambos lados de la vena; aerocistes esféricos de (2,7) 3,38 (4,16) (DS = 0,57) mm de diámetro, con un pedicelo de 3,34 mm de largo. Región interna de los filoides formada por dos a cuatro capas de células ovaladas, incoloras, de (49,2) 69,7 (82) (DS = 14,2) µm de ancho y de (28,7) 36,9 (45,1) (DS = 6,48) µm de largo; células de la corteza rectangulares, ovaladas, pigmentadas, de (16,4) 18 (20,4) (DS = 2,19) µm de ancho y de (12,3) 14,76 (16,4) (DS = 2,24) µm de largo. Receptáculos verrugosos, pedicelados, dispuestos en grupos, con ramificación dicótoma y tricótoma de (4,1) 5,58 (7,45) (DS = 1,14) mm de largo. Creciendo sobre sustrato rocoso, arenoso en las zonas mesolitoral e infralitoral.
Sargassum vulgare se diferencia morfológicamente de S. cymosum por la forma y tamaño de sus filoides,los cuales son de cuatro a seis veces más anchos que largos y presentan margen dentado, características que coinciden con la descripción realizada por Széchy & Cordeiro (1991); internamente S. vulgare muestra de dos a cuatro capas, mientras que S. cymosum tiene más de cuadro capas celulares, además las células de esta especie son más grandes que las de S. vulgare.
Material examinado: CURAÇAO: Boca Grandi, 27/11/1968, Díaz-Piferrer E-5629. PUERTO RICO: Sardinera, 24/3/1963, Díaz-Piferrer E-5617. VENEZUELA: NUEVA ESPARTA: Isla de Margarita, Macanao, Boca de Río, 20/2/2003, P. Pardo A-1051; El Manglillo, 20/2/2003, P. Pardo-G. Arias A-796. SUCRE: Punta Arenas, 12/4/1966, Díaz-Piferrer E-5623.
En este estudio se identificaron en total 25 especies de macroalgas distribuidas en 16 Chlorophyta (64%) y 9 Phaeophyceae (36%), todos nuevos reportes para la región de la Península de Macanao. Esta tendencia coincide con los reportes de Aponte (1985) para la parte norte de la Isla de Margarita, Lemus (1970) para el Golfo de Cariaco en el estado Sucre y Ríos (1972) para las costas venezolanas. Esta distribución porcentual de las macroalgas es típica de aguas del trópico y subtrópico con estabilidad ambiental, caracterizadas por una alta riqueza y variedad de especies (Díaz-Piferrer 1969).
BIBLIOGRAFIA
1. Acosta,J. 1974. Estudio de las comunidades vegetales en la Bahía de los Totumos. Bol. Soc. Venez. Ci. Nat. 1: 79-112. [ Links ]
2. Allender, B. & G. Kraft. 1983. The marine algae of Lord Howe Island (New South Wales): Dictyotales and Cutleriales (Phaeophyta). Brunonia 6: 73-130. [ Links ]
3. Almodóvar, I., H. Blomquist, A. Ortiz & E. Ortiz. 1972. A key to the genera of the marine Chlorophyta from Puerto Rico. Caribbean J. Sci. 12: 205-213. [ Links ]
4. Aponte, M. 1985. Evaluación taxonómica de las algas de la costa noreste de la Isla de Margarita. Venezuela. Tesis de Maestría. Instituto Oceanográfico. Universidad de Oriente. Cumaná. [ Links ]
5. Ardito, S., S. Gómez & B. Vera. 1995. Estudio sistemático de las macroalgas marinas bentónicas en la localidad de Taguao. Litoral Central. Distrito Federal. Venezuela. Acta Bot. Venez. 18: 53-66. [ Links ]
6. Bertossi, A. 1973. El género Sargassum C.Agardh (Feofita) en el oriente de Venezuela. Lagena 31: 3-22. [ Links ]
7. Bula-Meyer, G. 1977. Algas marinas bénticas indicadoras de un área afectada por aguas de surgencia frente a la costa Caribe de Colombia. Anales Inst. Invest. Mar. Punta de Betin 9: 45-71. [ Links ]
8. Bula-Meyer, G. 1983. El género Caulerpa. Museo del Mar 28. Universidad Jorge Tadeo Lozano. Bogotá. [ Links ]
9. Camacho, O. 2003. El género Sargassum (C.Agardh 1820) (Phaeophyta-Fucales) del Parque Nacional Natural Tayrona. Caribe colombiano. Trabajo Especial de Grado. Facultad de Biología Marina. Universidad Jorge Tadeo Lozano. Santa Marta. Colombia. [ Links ]
10. Castellanos, P., R. Varela & F. Muller-Karger. 2002. Descripción de las áreas de surgencia al sur del Mar Caribe examinadas por el sensor infrarrojo AVHRR. Mem. Fund. La Salle Ci. Nat. 154: 55-76. [ Links ]
11. De Clerk, O. & E. Coppejans. 1997. The genus Dictyota (Dictyotaceae, Phaeophyta) from Indonesia in the herbarium Weber-Var Bosse. Including the description of Dictyota canaliculata sp. nov. Blumea 42: 199-289. [ Links ]
12. De Clerck, O., F. Leliaert, H. Verbruggen, C. Lane, J.C. De Paula, D. Payo & E. Coppejans. 2006. A revised classification of the Dictyotaceae (Dictyotales. Phaeophyceae) based on rbcL and 26S ribosomal DNA sequence analyses. J. Phycol. 42: 1271-1288. [ Links ]
13. Delascio, F. & A. González. 1988. Flórula del Monumento Natural Tetas de María Guevara. Isla de Margarita. Estado Nueva Esparta. Instituto Nacional de Parques. Jardín Botánico de Caracas. Herbario Nacional de Venezuela, Caracas. [ Links ]
14. Díaz-Piferrer, M. 1967. Efecto de las aguas de afloramiento en la flora marina de Venezuela. Caribbean J. Sci. 7: 1-13. [ Links ]
15. Díaz-Piferrer, M. 1969. Distribution of the marine benthic flora of the Caribbean sea. Caribbean J. Sci. 9: 151-178. [ Links ]
16. Díaz-Piferrer, M. 1970. Adiciones a la flora marina de Venezuela. Caribbean J. Sci.10 (3-4): 159-197. [ Links ]
17. Eubank, L. 1946. Hawaiian representatives of the genus Caulerpa. Univ. Calif. Publ. Bot. 18: 409-431. [ Links ]
18. Ganesan, E.K. 1978. Studies on the marine algal flora of Venezuela. Bol. Inst. Oceanogr. Univ. Oriente 7: 129-136. [ Links ]
19. Ganesan, E.K. 1989. A catalog of benthic marine algae and seagrasses of Venezuela. Fondo Editorial CONICIT, Caracas. [ Links ]
20. García, M. 1999. Estudio florístico de las macroalgas bénticas marinas de la localidad de Carmen de Uria. Litoral central. Estado Vargas. Trabajo Especial de Grado. Facultad de Ciencias. Universidad Central de Venezuela, Caracas. [ Links ]
21. García, M. & S. Gómez. 2001. Nuevos registros ficoflorísticos para el estado Vargas. Litoral Central. Venezuela. Acta Bot. Venez. 24: 1-12. [ Links ]
22. Ginés, Hno. 1972. Carta Pesquera de Venezuela 1. Areas del Nororiente y Guayana. Fundación La Salle de Ciencias Naturales. Monografía 16, Caracas. [ Links ]
23. Guillot,G. & G. Márquez. 1978. Estudios en la vegetación béntica marina del Parque Nacional Tayrona costa Caribe colombiana I: relaciones vegetación – zonación – sustrato. Anales Inst. Invest. Mar. Punta de Betin 10:127-148. [ Links ]
24. Hammer, I. & F. Gessner. 1967. La taxonomía de la vegetación marina en la costa oriental de Venezuela. Bol. Inst. Oceanogr. Univ. Oriente 6: 186-265. [ Links ]
25. Hayden, H., J. Blomster, C. Maggs, P.C. Silva, M. Stanhope & J. Waaland. 2003. Linnaeus was right all along: Ulva and Enteromorpha are not distinct genera. Eur. J. Phycol. 38: 277-294. [ Links ]
26. Hoek van den, C., D. Mann & H. Jahns. 1995. Algae, an introduction to phycology. Cambridge University Press, Cambridge. [ Links ]
27. Hörnig, I. & R. Schnetter. 1992. The genus Dictyota (Phaeophyceae) in the north Atlantic. II. key to the species. Nova Hedwigia 59: 397-402. [ Links ]
28. Joly, A. 1967. Generos de algas marinhas do Costa Atlantica Latino-Americana. Universidad de São-Paulo, São Paulo. [ Links ]
29. Lemus, A. 1970. La flora macrobentónica y algunos parámetros físico-químicos del Golfo de Cariaco. Lagena 25-26: 3-11. [ Links ]
30. Lemus, A. 1974. Estudio taxonómico de la familia Ectocarpaceae. Sphacelariaceae y Dictyotaceae (Phaeophyta) de las costas occidentales del estado Sucre. Venezuela. Bol. Inst. Oceanogr. Univ. Oriente 13: 10-17. [ Links ]
31. Lemus, A. 1979. Las algas marinas del Golfo de Paria. Venezuela. I Chlorophyta y Phaeophyta. Bol. Inst. Oceanogr. Univ. Oriente 18: 17-36. [ Links ]
32. Lemus,A. 1984. Las algas marinas del Golfo de Paria. Venezuela. II.- Rhodophyta. Bol. Inst. Oceanogr. Univ. Oriente 23: 55-112. [ Links ]
33. Lipkin, Y. & P.C. Silva. 2002. Marine algae and seagrasses of the Dahlak Archipelago. Southern Red Sea. Nova Hedwigia 75: 1-90 [ Links ]
34. Littler, D.S. & M.M. Littler. 1997. An illustrated marine flora of the Pelican Cays. Belize. Bull. Biol. Soc. Washington 9: 1-149. [ Links ]
35. Littler, D.S. & M.M. Littler. 2000. Caribbean reef plants. OffShore Graphics, Inc. Washington, D.C. [ Links ]
36. Llano, M., N. Seguías. F., Velásquez, A. Chaves, P. Guevara, F. Buitrago & C. Salazar. 2001. Caracterización oceanográfica y meteorológica del sur de la Isla de Margarita para la elaboración del plan de contingencia de la Planta de suministro de combustible El Guamache. Informe Técnico No. 266. EDIMAR. Fundación La Salle de Ciencias Naturales, Caracas. [ Links ]
37. Llano, M., H. Hernández, J. Buitrago, P. Guevara, F. Buitrago, M. Segura & A. Chaves. 2002. Estudio ambiental de tres localidades en la Península de Macanao para la instalación de una planta desalinizadora. Informe Técnico No. 271. EDIMAR. Fundación La Salle de Ciencias Naturales, Caracas. [ Links ]
38. Mendoza, C., I. Mateo & R. Searles. 2000. New records of benthic marine algae from Isla Cozumel. Mexico: Phaeophyta and Chlorophyta. Bull. Mar. Sci. 66: 119-130. [ Links ]
39. Misra, J.N. 1966. Phaeophyceae in India. Indian Council of Agriculture Research, New Delhi. [ Links ]
40. Nunes, J. & E. De Paula. 2000. Estudios taxonomicos do género Padina Adanson (Dictyotaceae-Phaeophyta) no litoral do Estado da Bahía. Acta Bot. Malac. 25: 21-43. [ Links ]
41. Richardson, W.D. 1975. The marine algae of Trinidad. West Indies. Bull. Brit. Mus. (Nat. Hist.) Bot. 5: 71-143. [ Links ]
42. Ríos, N. 1972. Contribución al estudio sistemático de las algas macroscópicas de las costas de Venezuela. Acta Bot. Venez. 7: 219-310. [ Links ]
43. Rodríguez, G. 1959. The marine communities of Margarita Island. Venezuela. Bull. Mar. Sci. 9: 237-280. [ Links ]
44. Schnetter, R. 1976. Marine Algen der Karibischen Küsten von Kolumbien. I Phaeophyceae. Biblioth. Phycol. 24: 1-125. [ Links ]
45. Schnetter, R. 1978. Marine Algen der Karibischen Küsten von Kolumbien. II Chlorophyceae. Biblioth. Phycol. 42: 1-199. [ Links ]
46. Sóle, M. & E. Foldats. 2003. El género Dictyota (Phaeophyceae, Dictyotales) en el Caribe Venezolano. Acta Bot. Venez. 26: 41-82. [ Links ]
47. South, G. & P. Skelton. 2003. Catalogue of the marine benthic macroalgae of the Fiji Islands. South Pacific. Austral. Syst. Bot. 16: 699-758. [ Links ]
48. Srinivasan, K. 1969. Phycologia Indica. (Icones of Indian Marine Algae). Vol. I, Botanical Survey of India, Calcutta. [ Links ]
49. Steyermark, J. 1994. Flora del Parque Nacional Morrocoy. Estado Falcón. Venezuela. Instituto Botánico de Venezuela. AECI, Caracas. [ Links ]
50. Széchy, M. & M. Cordeiro. 1991. Feofíceas do litoral norte do Estado do Río de Janeiro. Brasil. Hoehnea 18: 205-241. [ Links ]
51. Taylor, W.R. 1960. Marine algae of the eastern tropical and subtropical coasts of the Americas. The University of Michigan Press, Ann Arbor, Michigan. [ Links ]
52. Vickers, A. 1908. Phycologia Barbadensis. Iconographie des algues marines récoltées à lile Barbade (Antilles). Avec texte explicatif par M. H. Shaw, Paris. [ Links ]
53. Wynne, M. 1998. A study of Padina antillarum (Kützing) Piccone and a comparison with P. tetrastomatica Hauck (Dictyotales, Phaeophyta). Cryptog. Algol. 4: 271-289. [ Links ]
54. Wynne, M. 2005. A checklist of benthic marine algae of the tropical and subtropical western Atlantic: second revision. Nova Hedwigia Beiheft 129: 1-152. [ Links ]
55. Wynne, M. & O. De Clerck. 1999. First reports of Padina antillarum and P. glabra (Phaeophyta-Dictyotaceae) from Florida with a key to the western Atlantic species of the genus. Caribbean J. Sci. 35: 286-295. [ Links ]
56. Wysor, B & O. De Clerck. 2003. An updated and annotated list of marine brown algae (Phaeophyceae) of the Caribbean coast of the Republic of Panamá. Bot. Mar. 46: 151-160. [ Links ]












 uBio
uBio