Acta Botánica Venezuelica
versión impresa ISSN 0084-5906
Acta Bot. Venez. v.32 n.2 Caracas dic. 2009
Dinámica del nitrógeno en un humedal herbáceo (Estado Miranda, Venezuela) Dominado por HymenacHne amplexicaulis
Nitrogen dynamics in an herbaceous wetland (Miranda state, Venezuela) dominated by Hymenachne amplexicaulis
Elizabeth Gordon1 y Yasmira Feo2
1 Instituto de Zoología Tropical. Caracas-Venezuela.
2 Escuela de Biología, Facultad de ciencias, Universidad central de Venezuela, Apdo. Postal 47058, Caracas 1041-a, Caracas-Venezuela. egordon@ciens.ucv.ve; egordoncolon@gmail.com
RESUMEN
Se determinó el efecto de los cambios estacionales de la profundidad del agua sobre la concentración de nitrógeno (N) en Hymenachne amplexicaulis en un humedal herbáceo permanentemente inundado (estado Miranda). La concentración de N en el suelo incrementó desde febrero a diciembre. La concentración media de N fue mayor en el material muerto en pie, seguido de las hojas, las inflorescencias y los tallos. El contenido total de N fue menor en diciembre y mayor en agosto. La absorción neta y eficiencia de uso del N para hojas y tallos mostraron comportamientos distintos durante el período de estudio. Los cambios estacionales en la profundidad del agua influyeron sobre la concentración, absorción y eficiencia de uso del nitrógeno por H. amplexicaulis.
Palabras clave: Humedales, Hymenachne amplexicaulis, nitrógeno, Venezuela
ABSTRACT
The effect of seasonal changes in water depth in an herbaceous, permanently waterlogged wetland on the nitrogen concentration of Hymenachne amplexicaulis is reported (Miranda State, Venezuela). The soils nitrogen concentration increased from February to December. Nitrogen mean concentration was higher on dead aboveground biomass, followed by leaves, inflorescences and stems. Total nitrogen was lower on December and higher on August. Net absorption and N-use efficiency of leaves and stems showed different behaviors study period. Seasonal changes of water depth influenced concentration, absorption and nitrogen-use efficiency by the grass H. amplexicaulis.
Key words: Hymenachne amplexicaulis, nitrogen, Venezuela, wetlands
ISSN 0084-5906 Depósito Legal 196902DF68
INTRODUCCIÓN
En los humedales, la profundidad del agua y sus variaciones estacionales afectan los ciclos de nutrientes y disponibilidad de éstos para las plantas (Mitsch & Gosselink 2007). El nitrógeno en el suelo y en sedimentos puede estar presente como amonio, nitrógeno molecular, nitrato, nitritos y en sustancias orgánicas complejas, lo que depende de la descomposición y mineralización de la materia orgánica, la fijación, deposición atmosférica e inundación (Bai et al. 2005). Las transformaciones del nitrógeno son microbianas y reguladas por procesos físicos y químicos (Ponnamperuma 1972), e incluyen mineralización de la materia orgánica, difusión del amonio, nitrificación y desnitrificación; períodos alternos de desecación e inundación tienden a incrementar la mineralización del nitrógeno orgánico y a producir pérdidas de nitrógeno a través de la desnitrificación (Mitsch & Gosselink 2007), por lo que la dinámica del nitrógeno en el suelo está relacionada con las condiciones aerobias o anaerobias, que influyen en la absorción, inmovilización, lavado, volatilización de amonio y desnitrificación (Mitsch & Gosselink 2007; Reddy & DeLaune 2008). En los pantanos herbáceos de agua dulce los cambios estacionales en la disponibilidad del nitrógeno son sustanciales, incluso mayores que en los ecosistemas estuarinos, en donde los procesos de absorción y transformación producen fuertes flujos de nitrógeno en los sedimentos de estos pantanos (Rizzo & Christian 1996).
En estos ecosistemas, el régimen de inundación se considera el factor más importante que controla el crecimiento y composición de especies, ya que afecta procesos ecológicos como germinación de semillas, crecimiento, productividad, descomposición y dinámica de nutrientes (Gerritsen & Greening 1989; Mitsch & Gosselink 2007). Dependiendo de la profundidad, duración e intensidad, se afectan entre otras, las funciones de raíces y rizomas (respiración, soporte, almacenamiento de reservas, absorción de nutrientes), la biomasa aérea y el suministro de oxígeno a las plantas (Ernest 1990; Armstrong et al. 1991, 1994; Pezeshki 1999, 2001; Chen et al. 2005), lo que se traduce en reducciones en el crecimiento, en la biomasa, en la actividad fotosintética y modificaciones en la distribución de asimilados fotosintéticos, así como en alteraciones en la absorción de nutrientes (Chen et al. 2005).
La variabilidad espacial y temporal en la disponibilidad de nutrientes, principalmente nitrógeno (N) y fósforo (P), afecta considerablemente las interacciones de las plantas, y en sus estrategias para obtenerlos de manera suficiente para su crecimiento. A su vez, la absorción y la recuperación (retranslocación) de nutrientes desde las hojas senescentes son los componentes principales del ciclo de nutrientes en el ecosistema (Shaver & Melillo 1984). Investigaciones con una variedad de especies de plantas y formas de crecimiento, sugieren que en la medida en que la disponibilidad de nutrientes (N y P) aumenta: 1) la proporción de nutrientes disponibles absorbidos por las plantas podría decrecer, 2) la proporción de N y P en las hojas maduras que ha sido recuperado antes que las hojas mueran decrece, y 3) la cantidad de biomasa producida por unidad de N y P absorbido decrece (Shaver & Melillo 1984).
En especies de humedales existen numerosos estudios relacionados con nutrientes, específicamente sobre el nitrógeno y sus efectos sobre el crecimiento y fisiología de las plantas, la riqueza de especies (Niinements & Kull 2005) y la productividad en hábitats ricos y pobres (Shaver & Melillo 1984; Miao & Sklar 1998; Eckstein & Karlsson 2001; Güsewell & Koerselman 2002; Miao 2004; Yang et al. 2004). Muchos de los trabajos sobre las respuestas del crecimiento de las plantas a los cambios en la profundidad del agua y disponibilidad de nutrientes se han realizado en experimentos de laboratorio y campo (Chen et al. 2002; Niinements & Kull 2005); sin embargo, en pocos se ha investigado la variabilidad temporal en la concentración de N en el suelo y en la biomasa en condiciones naturales, así como su asimilación o absorción por parte de las plantas (Piedade et al. 1997; Stribiling & Cornwell 2001; Chen et al. 2005), principalmente en especies herbáceas tropicales (Dias-Filho 2002).
Las alteraciones del régimen hidrológico por actividades humanas y el cambio de los patrones de precipitación asociados con los cambios climáticos podrían modificar los patrones de inundación de los humedales dominados por Hymenachne amplexicaulis (Rudge) Nees (Poaceae, hierba perenne estolonífera); en esta especie han sido poco estudiados los efectos de los cambios estacionales de la profundidad del agua sobre la dinámica del nitrógeno, la cual se presume afecta la concentración y absorción de N en esta especie. El objetivo del presente trabajo fue determinar los cambios estacionales en la profundidad del agua, en la concentración de nitrógeno en el suelo, y en los componentes de la biomasa en pie de H. amplexicaulis, así como la absorción y eficiencia de uso del nitrógeno de dicha especie en un humedal herbáceo permanentemente inundado (El Clavo, estado Miranda, Venezuela).
MATERIALES Y MÉTODOS
El trabajo se realizó en un humedal herbáceo dominado por Hymenachne amplexicaulis, el cual es inundado por la quebrada Colorado afluente del río Tuy (planicie de inundación del río Tuy), localizado en El Clavo (estado Miranda) a 10 m snm, 10º1534 N y 66º728 O. La precipitación total anual es 2484 mm, con distribución bimodal, con una máxima entre julio-agosto, y otra entre noviembrediciembre; la estación seca es corta y ocurre entre febrero-marzo (MARN 1996). La zona de vida del área de estudio, así como características del humedal en cuanto a la presencia de otras especies fueron reportadas por Gordon & Feo (2007). La textura de los suelos del humedal es arcillosa (72% arcilla, 22% limo, 6% arena); la media del porcentaje de materia orgánica total del suelo fue 2,7%, y la del pH del suelo 6,4. El pH y la conductividad del agua variaron entre 6-8 y entre 116294,7 mS/cm, respectivamente (Feo 2002).
En un área dominada por H. amplexicaulis, con cobertura de 100%, se estableció una parcela de 225 m2 en la cual se cosechó el material vegetal desde febrero a diciembre de 2001, cuyo procesamiento fue descrito por Gordon & Feo (2007) para estimar la biomasa. Durante cada muestreo se colectaron con un barreno dos muestras compuestas de suelo (diámetro = 7 cm), cada una conformada por tres submuestras provenientes de los primeros 10 cm del suelo. Las muestras de suelo se dejaron secar al aire por dos semanas, luego se homogeneizaron y se pasaron por un tamiz de 2 mm de apertura de malla. Para el análisis de nitrógeno, el material vegetal (previamente triturado) y la fracción del suelo < 2 mm fueron digeridos con ácido sulfúrico al 96% y peróxido de hidrógeno, luego se aplicó el método de N-Kjeldahl para determinar N-total (A.P.H.A 1992). La profundidad del agua se midió con una vara graduada y los datos de precipitación corresponden a la información del MARN (1996).
Análisis Estadístico
Durante los meses de febrero, abril (primer lapso de sequía), junio, agosto (primer máximo de lluvias), octubre (segundo período de sequía) y diciembre (segundo máximo de lluvias), se determinaron los siguientes parámetros:
1. Concentración de N-total en las plantas y en el suelo expresada como porcentaje en peso seco.
2. Contenido de nitrógeno (pool de N) en g peso seco/m2, como indicador de la acumulación del nutriente en la biomasa; se calculó a partir del producto de la biomasa y la concentración del nitrógeno en el tejido (Miao & Sklar 1998), usando los datos de biomasa área o en pie reportados por Gordon & Feo (2007).
3. Absorción y pérdidas de N-total; se estimaron a partir de las diferencias positivas y negativas del contenido de nitrógeno entre los meses de muestreo (Shaver & Melillo 1984; Piedade et al. 1997; Windham & Ehrenfeld 2003; Hefting et al. 2005).
4. Eficiencia de uso de N-total. La eficiencia de uso de un nutriente particular, específicamente del nitrógeno (EUN), es una medida de la efectividad con la cual las plantas lo usan para producir biomasa (Reddy & DeLaune 2008. La EUN se puede estimar a partir del inverso de su concentración en el tejido vegetal (Shaver & Melillo 1984; Lissner et al. 2003) o en base a la relación entre la producción de materia orgánica seca (g seco/m2) y el contenido de nitrógeno (g N/m2) durante un tiempo determinado (Shaver & Melillo 1984; Hernández-Valencia & López-Hernández 2000; este último fue el empleado en este trabajo, pero se calculó entre intervalos de tiempo (meses), a los fines de comparar con los resultados de la absorción neta de N-total, para observar la tendencia de ambas variables en las hojas y tallos.
5. Se calculó la producción anual de N-total (PN) mediante la suma de los incrementos positivos de los contenidos de N-total entre los meses de muestreo, lo cual es similar al método de Smalley (Cronk & Fennessy 2001) empleado por Gordon & Feo (2007) para determinar la producción primaria neta anual.
6. Debido a que los datos no presentaban una distribución normal, se utilizó la prueba no paramétrica de Kruskall-Wallis para probar diferencias estadísticas de las variables dependientes como concentración y contenido de N en las partes de las plantas, concentración de N en el suelo, entre los meses de muestreo. Asimismo, se calculó el coeficiente de correlación de Spearman entre la concentración de N en las plantas y en el suelo, así como entre la profundidad del agua y la concentración de N en los tejidos vegetales y en el suelo. Para el análisis de los datos se utilizó el programa Statistica, versión 5.5.
RESULTADOS
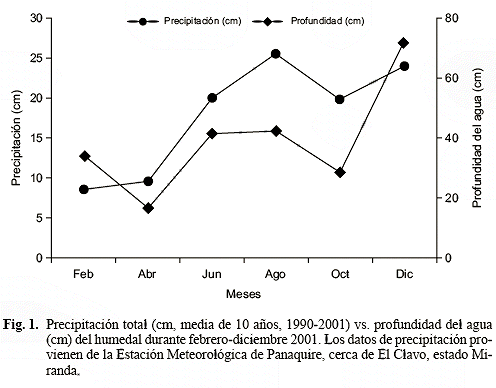
La profundidad del agua varió entre 16 cm y 72 cm, mostrando una distribución parecida a la precipitación (Fig. 1); los valores menores se midieron en abril y en octubre, y los mayores en el lapso junio-agosto, y en diciembre, mes de mayor aumento de la lámina de agua. Durante el período de estudio, en el humedal no se observaron sitios en la parcela que estuvieran completamente secos, lo que permitió de acuerdo al hidroperíodo caracterizarlo como permanentemente inundado.
Concentración de nitrógeno en el suelo y los tejidos vegetales
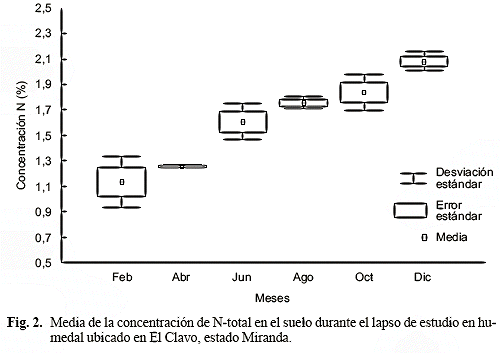
La media anual de la concentración de N en el suelo fue 1,61 ± 0,36%, con el valor más bajo en febrero y el más alto en diciembre (Fig. 2), con una variación entre ellos de casi el doble. La concentración de N en el suelo incrementó casi linealmente con los meses de muestreo; el coeficiente de correlación de Spearman entre la profundidad del agua y la concentración de N-total en el suelo no fue significativa (rs = 0,54, p < 0,28).
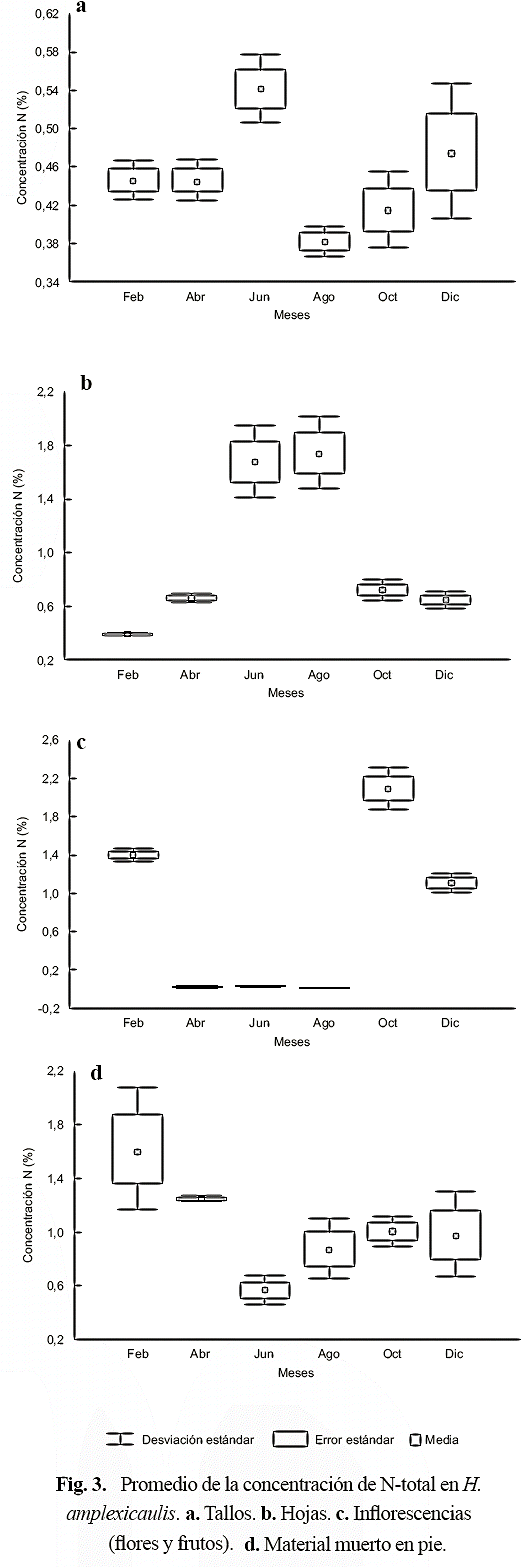
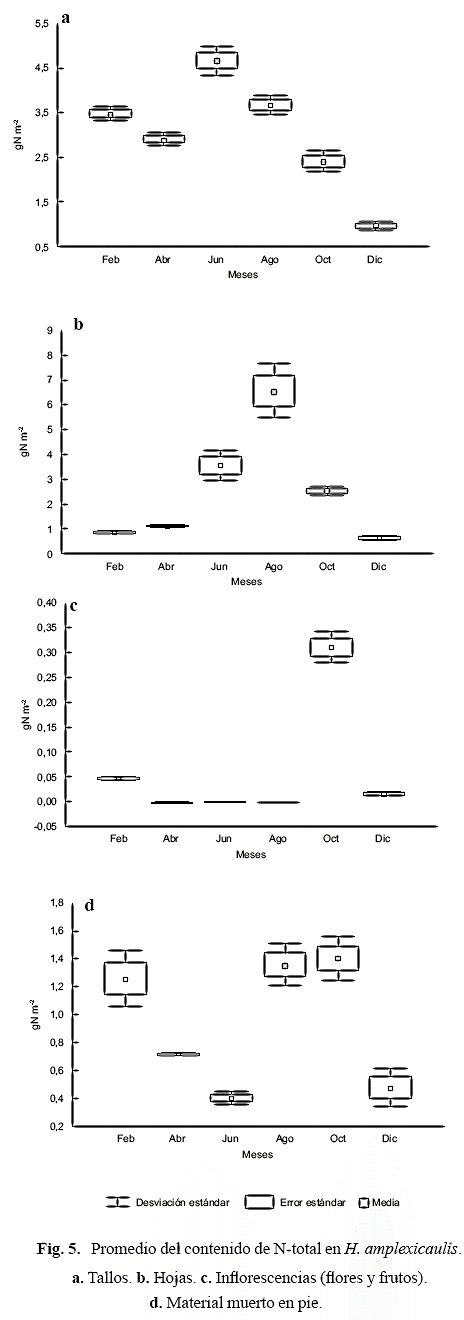
En los tallos la concentración de N-total varió entre 0,38-0,54% peso seco, con una media anual de 0,45 ± 0,06% peso seco; si bien los valores difieren significativamente (H = 12,03; p < 0,03), éstos no mostraron tendencia definida durante el período de estudio (Fig. 3a). La concentración de N-total en las hojas varió entre 0,37-1,73% peso seco, con una media de 0,96 ± 0,57%, y difiere significativamente entre los meses (H = 15,53, p < 0,008), donde los valores medios menores y mayores fueron en febrero y en el lapso junio -agosto, respectivamente (Fig. 3b). En las estructuras reproductoras (inflorescencias), la concentración de N-total varió entre 1,21 y 2,10% peso seco, con una media de 0,77 ± 0,85% peso seco, y siendo menor en diciembre (Fig. 3c). En el material muerto en pie, la media anual de N-total fue 1,05 ± 0,40% peso seco, variando entre 0,57 y 1,63%; los valores de N en el material muerto en pie difieren significativamente (H = 12,41, p < 0,03), y fueron mayores y menores en febrero y en junio, respectivamente (Fig. 3d).
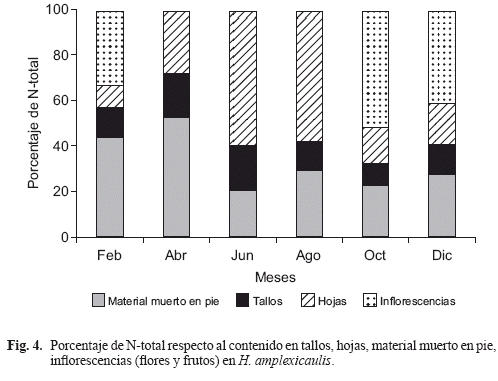
Respecto al total, porcentualmente la concentración de nitrógeno en las partes de las plantas fue mayor en el material muerto en pie (32%), seguido de las hojas (29%), inflorescencias (25%) y tallos (14%). La concentración de nitrógeno en los tallos no mostró tendencia alguna durante el lapso de estudio (Fig. 3d), en términos de porcentajes ésta fue poco variable (Fig. 4). En las hojas y estructuras reproductoras, se diferencian dos máximos de aumento proporcional en la concentración de N (Fig. 4), uno de ellos para el crecimiento foliar (junio-agosto), y otro para la reproducción (octubre-febrero); en el material muerto en pie, proporcionalmente la mayor concentración de N ocurre en el lapso febrero-abril (primera temporada de sequía), y luego se mantiene poco variable durante los meses restantes (Fig. 4).
Correlación entre la concentración de n en los tejidos y en el suelo
Se encontró una correlación negativa y significativa sólo entre la concentración de nitrógeno en el suelo y la del material muerto en pie (rs = -0,83, p < 0,05). No hubo correlación entre la profundidad del agua y la concentración de N en los tejidos vegetales.
Contenido de nitrógeno en el material vegetal
Los resultados de nitrógeno en función de la masa por unidad de área (g seco N/m2) se denominaron contenidos de nitrógeno (pool de N), para lo cual se utilizaron los datos de biomasa reportados por Gordon & Feo (2007). En los tallos el contenido de N-total difiere estadísticamente entre los meses (H = 16,29, p < 0,006), con una variación de cinco veces entre el valor mayor y menor; la media anual fue de 2,99 ± 1,20 g seco N/m2, alcanzando el valor más alto en junio (4,65 g seco N/m2), para luego decrecer hacia diciembre (0,93 ± 0,09 g seco N/m2) (Fig. 5a). La media anual del contenido de N en las hojas fue de 2,47 ± 2,17 g seco N/ m2, con una variación de once veces entre el mayor y el menor valor, dando como resultado diferencias estadísticamente significativas (H = 16,65 p < 0,005); el valor más bajo se determinó en diciembre (0,59 ± 0,05 g seco N/m2), mes de máxima profundidad (segundo período de lluvias), en tanto que el valor más alto fue en agosto (6,49 ± 1,15 g seco N/m2) (Fig. 5b). El contenido de N en las inflorescencias varió entre 0,02-0,31 g seco N/m2, con media de 0,06 ± 0,12 g seco N/m2, con el valor más alto en octubre (Fig. 5c) y con una variación de siete veces entre el mayor y el menor valor. El contenido de N en el material muerto en pie tuvo una media anual de 0,93 ± 0,61 g seco N/m2, con el valor más bajo en diciembre (Fig. 5d) y una variación de nueve veces; si bien las medias difieren significativamente (H = 13,12, p < 0,02), los valores no mostraron patrón alguno respecto a los meses de muestreo.
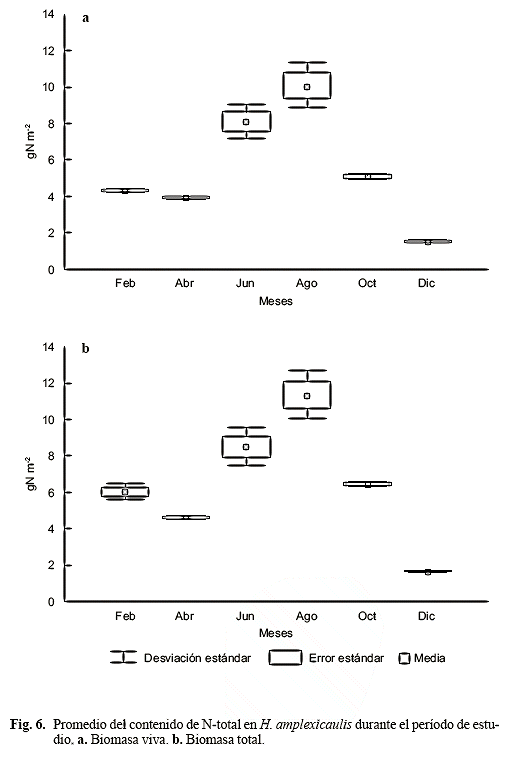
La variación en el contenido de N del material vivo fue de siete veces, difirió significativamente entre los meses (H = 16,59; p < 0,005), presentó una media anual de 5,51 ± 2,94 g seco N/m2, con el valor mayor en agosto (10,13 ± 1,22 g seco N/m2) y el menor en diciembre (1,57 ± 0,10 g seco N/m2) (Fig. 6a). En general, el contenido total de N varió de 1,69 a 11,35 g seco N/m2, media anual 6,46 ± 3,15 g seco N/m2; el valor más bajo se determinó en diciembre (segundo máximo de lluvias, aguas más profundas), cuando la biomasa total y sus componentes fueron mínimos (Gordon & Feo 2007), mientras que el mayor valor fue en agosto (Fig. 6b) (primer máximo de lluvias).
Absorción neta y eficiencia de uso del nitrógeno
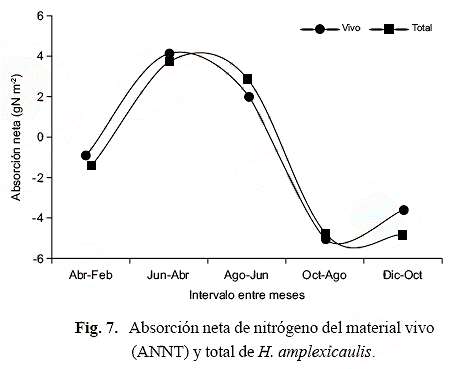
La absorción neta de N-total (ANNT) por parte del material vivo (tallos y hojas) y del material vegetal total ocurre desde febrero hasta agosto, luego decrece hacia octubre, para luego aumentar ligeramente hacia diciembre (Fig. 7). Valores positivos y negativos indican ganancia (acumulación) o pérdida del nutriente, respectivamente.
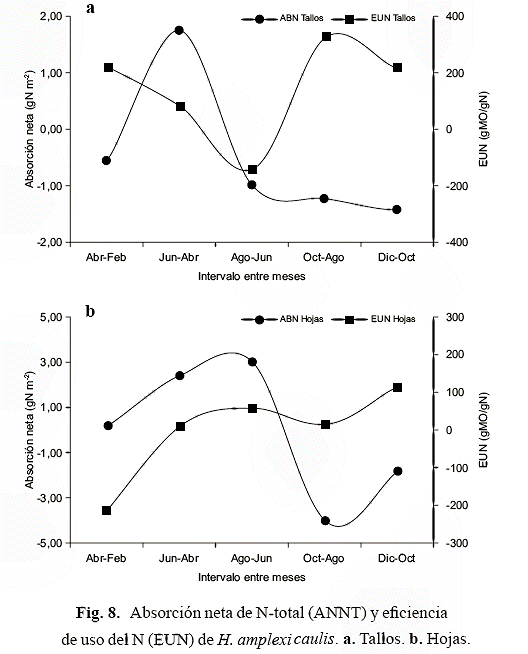
Al comparar hojas y tallos, se encontró que hay un desfase en la absorción neta de N, así primero ocurre en los tallos, manteniéndose poco variable después de la máxima absorción entre abril y junio, mientras que en las hojas la máxima absorción neta ocurrió hacia agosto, disminuyendo en octubre, para luego aumentar en diciembre (Fig. 8). Se encontró un comportamiento inverso en la eficiencia de uso del N y absorción neta en los tallos (Fig. 8a), esto es, hay un desfase temporal entre la absorción neta (ANNT) y eficiencia de uso de N (EUN), en tanto que en las hojas ambas variables tienen un patrón similar, con la tendencia a aumentar en agosto y diciembre (Fig. 8b).
Sumando los valores positivos y negativos para los tallos, las ganancias y pérdidas fueron 2 y 4 g seco N/m2, respectivamente. En las hojas el balance neto entre las ganancias (6 g seco N/m2) y pérdidas (6 g seco N/m2) fue cero. La producción anual de nitrógeno de la biomasa total fue 7 g seco N/m2/año y en la biomasa viva fue 6 g seco N/m2/año.
Concentración de nitrógeno en el suelo
La media anual de la concentración de nitrógeno en el suelo hallada en este trabajo resultó similar a la reportada por Bedford et al. (1999) para humedales herbáceos de Norte América (media = 1,41 ± 0,28% peso seco; variación: 0,72-1,72% peso seco). La concentración de nitrógeno en el suelo incrementó gradualmente desde febrero-abril (primer período seco, 1,13-1,25% peso seco) hacia diciembre (máxima profundidad, segundo máximo de lluvia, 2,09% peso seco), lo que coincide con lo obtenido por Gerritsen & Greening (1989), Koerselman et al. (1993), Bai et al. (2005), para distintos humedales de la zona templada, quienes encontraron que el N-total y la concentración de amonio en el agua y en el sustrato aumentan con la profundidad del agua. Feo (2002), en el humedal dominado por H. amplexicaulis, encontró igual tendencia para la concentración de N-total en el agua.
La relación positiva entre la concentración de nitrógeno en el suelo y en el agua con el aumento en la profundidad del agua se atribuye a restricciones en el proceso de desnitrificación (Andersen 2003). En suelos anaerobios, el nitrato es transformado por desnitrificación a nitrógeno molecular (N2), gas que escapa a la atmósfera; en estos suelos, la falta de oxígeno produce acumulación de amonio debido a que se detiene la conversión de amonio a nitrato (Ponnamperuma 1972), y por consiguiente se limita o restringe la desnitrificación, proceso que es rápido (Andersen 2003), que depende de la presencia de nitrato (Reddy & Patrick 1984; Reddy & DeLaune 2008) y que es gobernado por el gradiente de concentración y difusión del amonio y nitrato entre las capas aerobias y anaerobias del suelo (Cronk & Fennessy 2001; Reddy & DeLaune 2008). Asimismo, en suelos inundados hay menor inmovilización de nitrato por los microorganismos debido a la menor actividad microbiana, dado que sus requerimientos de nitrógeno son menores (Broadbent & Reyes 1971). La desnitrificación está ausente o es lenta en suelos con baja proporción de materia orgánica (suelos minerales) (Ponnamperuma 1972).
Lo antes expuesto permite suponer que los resultados de N-total en el suelo se deben a los cambios en la profundidad del agua y duración de los períodos de inundación, que influyen en el proceso de mineralización y desnitrificación. En suelos anaerobios o inundados el nitrato es sustituido por el amonio, lo que implica disminución en el suministro de nitrato para las plantas (Mitsch & Gosselink 2007), y al mismo tiempo ocurre acumulación de N-amonio debido a restricciones en el proceso de desnitrificación, dando como resultado aumentos en la concentración de N. Asimismo, en estos suelos hubo variaciones estacionales sustanciales en la concentración de N-total a lo largo del período de estudio, lo que coincide con lo señalado por Rizzo & Christian (1996) para humedales herbáceos de agua dulce.
Concentración de nitrógeno en el material vegetal
La concentración de nutrientes (N y P) en los tejidos vegetales ha sido ampliamente utilizada para inferir sobre la disponibilidad de éstos para el crecimiento de las plantas, y el grado en el cual lo limitan, ya que se presume representa el flujo integrado de nutrientes hacia las plantas durante un lapso de tiempo (Güsewell & Koerselman 2002). Miao & Sklar (1998) consideraron que la concentración de nutrientes en el tejido es una expresión integrada de varias funciones de las plantas, tal como la absorción y almacenamiento, el crecimiento y la defensa. La concentración de nitrógeno en los tejidos vegetales es altamente variable y depende de la edad de las plantas, de la habilidad genética para asimilarlo, de la disponibilidad y del tipo de suelo y de las condiciones ambientales (Güsewell & Koerselman 2002).
La concentración media de N-total en el material vegetal aéreo o en pie (vivo + muerto) (2,3-4,5% peso seco) de H. amplexicaulis resultó superior a lo reportado por Hutchinson (1975) para diferentes especies de plantas acuáticas, por McJannet et al. (1995) para especies emergentes de distintos humedales de Canadá por Güsewell & Koerselman (2002) para diversas especies de humedales herbáceos de Europa, y a su vez son similares a los valores mostrados por Kadlec & Knight (1996) para varias especies de plantas emergentes de Norte América.
Respecto a los tejidos vivos (hojas + tallos + inflorescencias) y muertos la concentración media total de N-total de H. amplexicaulis fue de 3,44% y 1,01% peso seco, respectivamente. Al respecto, Bedford et al. (1999) reportaron para varias especies de humedales de Norte América concentraciones medias de N en tejidos vivos y muertos de 1,4 y 1,05% peso seco, respectivamente, donde en los pantanos herbáceos las concentraciones de N fueron de 1,97% en los tejidos vivos y 1,13% en los tejidos muertos; en las hierbas vasculares, forma de crecimiento con mayores concentraciones que cualquier otro grupo biológico, los valores de N en el material vivo (0,64-4,20%, media: 1, 71%) fueron mayor que en el material muerto (0,74 -1,94% peso seco, media: 1,15% peso seco, respectivamente) (Bedford et al. 1999). Las altas concentraciones de N en los tejidos vegetales de H. amplexicaulis pueden indicar que la producción primaria no está limitada por la disponibilidad de N, sino por otros factores como incidencia de luz o cambios estacionales en la profundidad del agua (Gordon & Feo 2007).
La concentración media de N en el material muerto en pie fue mayor que en las hojas y en los tallos durante los meses secos (febrero, abril y octubre), lo cual puede atribuirse a que durante la senescencia ocurren procesos de reabsorción por parte de las hojas y tallos. Kok et al. (1990), Bouchard & Lefeuvre (2000), Gessner (2000) y Villar et al. (2001) encontraron que la concentración de N en el material muerto (hojarasca) aumentó durante el proceso de descomposición, atribuido a la acumulación de proteínas microbianas; sin embargo, Kok et al. (1990) consideraron que era poco probable que sólo la fracción microbiana fuese el factor causante del tal incremento, ya que las proteínas microbianas contribuían relativamente poco a la biomasa del detritus.
Hymenachne amplexicaulis contribuye, a través del material muerto en pie, a transferir nitrógeno al sistema constituyéndose en un reservorio de N durante los meses secos, que disminuye en los meses lluviosos debido a procesos de lavado del N, o a que las plantas lo desvían hacia otras partes de las plantas como consecuencia del aumento en la demanda de N. En los meses lluviosos alguna fracción del N presente en el tejido senescente puede ser transportada y almacenada hacia los órganos subterráneos, o dependiendo de la temporada hacia las hojas o hacia los tallos, quedando muy poco N en el tejido muerto. Davis (1991) planteó que las plantas de humedales parecen afectar el balance de nutrientes en la medida que acumulan nutrientes en la biomasa cuando crecen, retienen nutrientes en la biomasa cuando mueren o reservan nutrientes cuando se descomponen.
La concentración de nitrógeno en los tallos de H. amplexicaulis no mostró patrón temporal alguno, a su vez con menor concentración respecto a hojas, lo que concuerda con lo encontrado por Piedade et al. (1997) para echinochloa polystachya. Respecto a la concentración de N en las hojas, hubo un cambio temporal asociado con las variaciones estacionales en la profundidad del agua puesto que el promedio de la concentración de nitrógeno en las hojas fue más bajo en los meses más secos (febrero, abril, octubre) que en los de lluvia (junio, agosto, diciembre) cuando las concentraciones en el suelo y en el agua fueron más elevadas; este comportamiento coincide con lo reportado por Gerritsen & Greening (1989) y Davis (1991). Piedade et al. (1997) consideraron que el incremento en la concentración de N en las hojas durante el período de inundación sugiere que puede ser absorbido directamente desde el agua.
La proporción de nutrientes (N y P) en los tejidos depende de la especie, así en unas la mayor proporción de éstos se halla en tejidos asociados con el crecimiento (hojas, raíces, rizomas), mientras que en otras se relaciona con funciones de almacenamiento (base del tallo) (Miao & Sklar 1998). En el caso de H. amplexicaulis, dependiendo de la temporada, una mayor proporción de N se encuentra en los tejidos asociados con el crecimiento (hojas) o con la reproducción (estructuras reproductoras). Entre octubre y febrero ocurrió el proceso de fructificación y dispersión, período de mayor porcentaje de N en dichos tejidos, mientras que entre junio-agosto el mayor porcentaje del N se encuentra en las hojas.
Discusión
Correlación entre el n de los tejidos vegetales y del suelo
En este trabajo la concentración de N en los tejidos vivos (tallos y hojas) y en el suelo no mostró correlación significativa. Güsewell & Koerselman (2002) encontraron similar tendencia, atribuyéndolo a la alta disponibilidad de N; estos autores indicaron que en humedales esta baja correlación se debe a que el indicador utilizado como disponibilidad de nutrientes en el suelo no es el apropiado, ya que el análisis clásico del suelo sólo mide disponibilidad instantánea, es decir, representa sólo un momento en el año, sin tomar en cuenta que fluctúa fuertemente en el espacio y en el tiempo (Güsewell & Koerselman 2002). Hefting et al. (2005) no hallaron relación entre la biomasa aérea y la disponibilidad de N (nitrato o amonio extraíble) en el suelo; asimismo, no había signos de aumento en la producción y en la absorción de N con el incremento de su concentración en el suelo. Hefting et al. (2005) plantearon que esto se debía a la falta de sincronía entre la disponibilidad de N en el suelo y la liberación del N por descomposición y mineralización, causando un retardo en la absorción por parte de la planta. Adicionalmente, la inmovilización del N en la hojarasca durante los primeros estados de descomposición puede temporalmente reducir la cantidad de N-inorgánico en el agua intersticial, lo que también podría explicar la falta de relación entre la concentración de N en el suelo y en las plantas (Hefting et al. 2005).
contenido y producción de n por los tejidos vegetales
El promedio del contenido de N encontrado en la biomasa foliar (2,47 ± 2,17g seco N/m2, máximo 6,49g seco N/m2) resultó menor a lo reportado por Anten et al. (1998) en una sabana inundable en Venezuela, quienes hallaron que la media del contenido de N en todo el follaje de H. amplexicaulis y de Leersia hexandra fueron de 4,04 ± 0,16g N/m2 y 4,52 ± 0,45g N/m2, respectivamente. La producción anual de N de la biomasa total y de la biomasa viva de H. amplexicaulis estuvo por debajo de los valores reportados por Güsewell & Koerselman (2002) para especies de humedales europeos, cuyas medias fueron de 8 a 17 g seco N/m2/año; cabe destacar que los datos proporcionados por estos autores provienen de experimentos con fertilización. La concentración y contenido de nitrógeno y otros nutrientes varían tanto dentro como entre especies y sitios (Shaver & Melillo 1984; Miao & Sklar 1998; Bedford et al. 1999; Güsewell & Koerselman 2002; Hefting et al. 2005).
Absorción y eficiencia de uso de N por los tejidos vegetales
La absorción y pérdida de nitrógeno por parte de las hojas y tallos en H. amplexicaulis varió temporalmente, y hubo entre ellos desfase en la absorción de N posiblemente como respuesta a los cambios estacionales en la profundidad del agua o a la disponibilidad de nutrientes en el medio. El crecimiento y absorción de nutrientes por parte de las plantas puede ser restringido por diversos factores (nutrientes disponibles, temperatura, pH, anoxia, actividad microbiana o competencia). Asimismo, el tiempo o período de acumulación de la materia orgánica y de nutrientes proporciona información sobre el estatus de nutrientes en las plantas (Hopkinson & Shubauer 1984; Reddy & DeLaune 2008). El balance negativo del N (suma de los valores positivos y negativos) en los tallos sugiere que éste se desvía hacia las hojas o hacia los órganos subterráneos. Las plantas cuando maduran y mueren pueden retranslocar el nitrógeno hacia los rizomas para almacenarlo en el período seco o inmediatamente retransferirlo para el crecimiento de los tallos en el período lluvioso. La declinación de la absorción del N en el segundo período de lluvias (diciembre) se puede atribuir al aumento en la demanda para el alargamiento de los tallos. La mayor pérdida de N en las hojas ocurrió en octubre, lo que puede indicar que se pierde por lavado o que las plantas asignan la mayor cantidad de N hacia la reproducción. Estos resultados pueden deberse además de los estados de desarrollo de las plantas, al pobre acoplamiento entre los procesos de absorción y las tasas de flujo del nitrógeno (Shaver & Melillo 1984).
La eficiencia de uso del N (EUN) por parte de la vegetación es altamente variable, depende del tipo de humedal (boscoso o herbáceo), tipo de suelo, condición de nutrientes y el clima (Reddy & DeLaune 2008). En estos ecosistemas los cambios estacionales en la profundidad del agua y en la concentración de N en el medio deben afectar la EUN por parte de las plantas (Güsewell & Koerselman 2002). En H. amplexicaulis la EUN varió a nivel de los tejidos y en el tiempo, quizás debido a los ajustes en la cinética de absorción y a las variaciones en la proporción de la biomasa con los cambios estacionales en la profundidad del agua.
Los resultados apoyan la presunción de que la estacionalidad influye de manera importante sobre la extensión en la cual la inundación afecta la supervivencia, crecimiento, concentración, contenido, absorción y eficiencia de uso de N por parte de H. amplexicaulis. El desplazamiento temporal entre la absorción neta de N-total (ANNT) y EUN de los tallos, es decir, primero ocurre absorción y luego aumento en la eficiencia, parece confirmar que en dicho lapso el N se desvía ha-cia la reproducción, mientras que en las hojas la ANNT y la EUN tienen comportamiento bimodal aumentando simultáneamente con el lapso de mayor biomasa foliar y total (junio-agosto), y el de mayor estrés (Gordon & Feo 2007); este último corresponde al momento de máxima inundación (diciembre), cuando son más altas las concentraciones de N en el suelo y en el agua, hay reducciones entre 7577% en la biomasa de hojas y tallos, alargamiento de tallos para mantener el follaje por encima de la superficie del agua (Gordon & Feo 2007) y mayores pérdidas de N en la biomasa total y en sus componentes, pero al mismo tiempo aumenta la EUN foliar. Shaver & Melillo (1984) indicaron que las variaciones en la eficiencia de uso pueden ser debido a cambios: 1) en la concentración de nutrientes en alguno o todos los tejidos vegetales, y 2) en el patrón de distribución de la biomasa, de modo que la abundancia relativa de los tejidos con respecto a las concentraciones de nutrientes cambia.
La mayor EUN foliar cuando las concentraciones del N en el medio externo son altas es contrario al supuesto de que en áreas donde la disponibilidad de N aumenta las plantas son ineficientes en usar los nutrientes disponibles (Reddy & De Laune 2008), lo que es atribuido a la saturación en la capacidad de absorción por las plantas. Los resultados obtenidos en este trabajo en cuanto a la EUN foliar posiblemente se deben a que el nitrógeno no está disponible o que otros factores regulan el crecimiento y absorción de las plantas. Durante la inundación el crecimiento de las plantas puede ser afectado por varios factores (disponibilidad de nutrientes, anaerobiosis), y dependerá de su capacidad para absorber amonio, a través de la oxidación del amonio en la rizósfera, o directamente desde el medio (Mitsch & Gosselink 2007); asimismo, la supervivencia dependerá de la aireación del agua, de la aireación del sistema radical a través de las pérdidas radiales de oxígeno y de la capacidad para cambiar su morfología (Clevering et al. 1996; Coops et al. 1996; Miller & Zedler 2003; Kercker & Zedler 2004).
AGRADECIMIENTOS
Al Lic. Sergio Pacheco y a la Lic. Gladys Flores por su ayuda en el trabajo de campo. Al Dr. Ismael Hernández por la asesoría en los cálculos de eficiencia de uso de nitrógeno.
BIBLIOGRAFÍA
1. Andersen, H.E. 2003. Hydrology, nutrient processes and vegetation in floodplain wetlands. National Environmental Research Institute, Ministry of the Environment, Denmark. [ Links ]
2. Anten, N.P.R., M.J.A. Werger & E. Medina. 1998. Nitrogen distribution and leaf area indices in relation to photosynthetic nitrogen use efficiency in savanna grasses. Pl. ecol. 138: 63-75. [ Links ]
3. Armstrong, W.R., S. Justin, P. Beckett & S. Lythe. 1991. Root adaptation to soil water logging. aquatic bot. 39: 37-73. [ Links ]
4. Armstrong, W., R. Brandle & M.B. Jackson. 1994. Mechanisms of flood tolerance in plants. acta bot. neerl. 43: 307-358. [ Links ]
5. A.P.H.A. 1992. Standard Methods. 18th edition. Washington DC. [ Links ]
6. Bai, J., H. Ouyang, W. Deng, Y. Zhu, X. Zang & Q. Wang. 2005. Spatial characteristics of organic matter and total nitrogen of marsh soils in river marginal wetlands. Geoderma 124: 181-192. [ Links ]
7. Bedford, B.L., M.R. Walbridge & A. Aldous. 1999. Patterns in nutrient availability and plant diversity of temperate North American wetlands. ecology 80: 2151-2169. [ Links ]
8. Broadbent, F.E. & O.C. Reyes. 1971. Uptake of soil and fertilizer nitrogen by rice in some Philippine soils. Soil Sci. 112: 200-205. [ Links ]
9. Bouchard, V. & J.C. Lefeuvre. 2000. Primary production and macro-detritus dynamics in a European salt marsh: carbon and nitrogen budgets. aquatic bot. 67: 23-42. [ Links ]
10. Chen, H., R.G. Qualls & G.C. Miller. 2002. Adaptive responses of Lepidium latifolium to soil flooding: biomass allocation, adventitious rooting, aerenchyma formation and ethylene production. environm. exp. bot. 48: 119-128. [ Links ]
11. Chen, H., R.G. Qualls & R. Blank. 2005. Effect of soil flooding on photosynthesis, carbohydrate partitioning and nutrient uptake in the invasive exotic Lepidium latifolium. aquatic bot. 82: 250-268. [ Links ]
12. Clevering, O., C. Blom & W. van der Vierssen. 1996. Growth and morphology of Scirpus lacustris and S. maritimus as affected by water level and light availability. Funct. ecol. 10: 289-296. [ Links ]
13. Coops, H., F. Van den Brink & G. van der Velde. 1996. Growth and morphological responses of four helophyte species in an experimental water depth gradient. aquatic bot. 54: 11-24. [ Links ]
14. Cronk, J.K. & M.S. Fennessy. 2001. Wetland plants. Lewis, New York. [ Links ]
15. Davis, S. 1991. Growth, decomposition and nutrient retention of cladium jamaicense Crantz and typha dominguensis Pers. in the Florida Everglades. aquatic bot. 40: 203-224. [ Links ]
16. Dias-Filho, M.B. 2002. Tolerance to flooding in five brachiaria brizantha accessions. Pesq. agropecu. bras. 37: 439-447. [ Links ]
17. Eckstein, R.L. & P.S. Karlsson. 2001. Variation in nitrogen-use efficiency among and within subarctic graminoids and herbs. New Phytol. 150: 641-651. [ Links ]
18. Ernest, W.H.O. 1990. Ecophysiology of plants in waterlogged and flooded environments. aquatic bot. 38: 73-90. [ Links ]
19. Feo, C.Y. 2002. Dinámica de crecimiento de Hymenachne amplexicaulis (Rudge) Nees en un humedal herbáceo localizado en El Clavo (estado Miranda). Trabajo Especial de Grado. Facultad de Ciencias. Universidad Central de Venezuela, Caracas. [ Links ]
20. Gerritsen, J. & H.S. Greening. 1989. Marsh seed banks of the Okefenokee Swamp: effects of hydrologic regime and nutrients. ecology 70: 750-763. [ Links ]
21. Gessner, M. 2000. Breakdown and nutrient dynamics of submersed Phragmites shoots in the littoral zone of a temperate hardwater lake. aquatic bot. 66: 6-20. [ Links ]
22. Gordon, E. & Y. Feo. 2007. Dinámica de crecimiento de Hymenachne amplexicaulis en un humedal herbáceo situado en El Clavo, estado Miranda. acta bot. venez. 30: 1-18. [ Links ]
23. Güsewell, S. & W. Koerselman. 2002. Variation in nitrogen and phosphorus concentrations of wetland plants. Perspect. ecol. evol. Syst. 5/1: 37-61. [ Links ]
24. Hefting, M.M., J.C. Clement, P. Bienkowski, D. Dowrick, C. Guenat, A. Butturini, S. Topa, G. Pinay & J.T.A. Verhoeven. 2005. The role of vegetation and litter in the nitrogen dynamics of riparian buffer zones in Europe. ecol. engineer. 24: 465-482. [ Links ]
25. Hernández-Valencia, I. & D. López-Hernández. 2000. Dinámica del fósforo en el estrato herbáceo de una sabana de trachypogon sometida a quema y pastoreo. acta. biol. venez. 20: 53-66. [ Links ]
26. Hopkinson, C.S. & J.P. Shubauer. 1984. Static and dynamic aspects of nitrogen cycling in the salt marsh graminoid Spartina alterniflora. ecology 65: 961-969. [ Links ]
27. Hutchinson, G.E. 1975. A treatise on Limnology. III. Limnological Botany. Wiley, New York. [ Links ]
28. Kadlec, R. & I. Knight. 1996. Treatment wetlands. Lewis Pub. New York. [ Links ]
29. Kercker, S.M. & J.B. Zedler. 2004. Flood tolerance in wetland angiosperms: a comparison of invasive and noninvasive species. aquatic bot. 80: 89-102. [ Links ]
30. Koerselman, W., M.B. van Kerkhoven & J.T.A. Verhoeven. 1993. Release of inorganic N, P, and K in peat soil; effect of temperature, water chemistry and water level. biogeochemistry 20: 63-81. [ Links ]
31. Kok, C., H. Meesters & A. Kempers. 1990. Decomposition rate, chemical composition and nutrient recycling of nymphaea alba L. floating leaf blade detritus as influenced by pH, alkalinity and aluminium in laboratory experiments. aquatic bot. 37: 215-227. [ Links ]
32. Lissner, J., I.A. Mendelssohn, B. Lorenzen, H. Brix, K. McKee & S. Miao. 2003. Interactive effects of redox intensity and phosphate availability on growth and nutrient relations of cladium jamaicense (Cyperaceae). amer. J. bot. 90: 736-748. [ Links ]
33. MARN. 1996. Información hidrológica y climatológica de Panaquire. Dirección de Hidrología y Meteorología. Caracas. [ Links ]
34. McJannet, C.L., P.A. Keddy & F.R. Pick. 1995. Nitrogen and phosphorus tissue concentrations in 41 wetland plants: a comparison across habitats and functional groups. Funct. ecol. 9: 231-483. [ Links ]
35. Miao, S.L. 2004. Rhizome growth and nutrient resorption: mechanisms underlying the replacement of two clonal species in Florida Everglades. aquatic bot. 78: 55-66. [ Links ]
36. Miao, S.L. & F.H. Sklar. 1998. Biomass and nutrient allocation of sawgrass and cattail along a nutrient gradient in the Florida Everglades. Wet. ecol. Manag. 5: 245-263. [ Links ]
37. Mitsch, W.J. & J.G. Gosselink. 2007. Wetlands. Wiley, New York. [ Links ]
38. Niinements, Ü. & K. Kull. 2005. Co-limitation of plant primary productivity by nitrogen and phosphorus in a species-rich wooded meadow on calcareous soils. acta oecol. 28: 345-356. [ Links ]
39. Pezeshki, S.R. 2001. Wetland plant responses to soil flooding. environm. exp. bot. 46: 299-312. [ Links ]
40. Pezeshki, S.R., A.D. DeLune & P.H. Anderson. 1999. Effect of soil flooding on photosynthesis, carbohydrate partitioning and nutrient uptake in the invasive exotic Lepidium latifolium. aquatic bot. 82: 250-268. [ Links ]
41. Piedade, M.T.F., W.J. Junk & S.P. Long. 1997. Nutrient dynamics of the highly productive C4 macrophyte echinochloa polystachya on the Amazon floodplain. Funct. ecol. 11: 60-65. [ Links ]
42. Ponnamperuma, F.N. 1972. The chemistry of submerged soils. advances agron. 24: 29-96. [ Links ]
43. Reddy, K.R. & R. DeLaune. 2008. biogeochemistry of wetlands. CRC Press, New York. [ Links ]
44. Reddy, K.R. & W.H. Patrick. 1984. Nitrogen transformations and loss in flooded foils and sediments. crit. Rev. environm. control 13: 273-309. [ Links ]
45. Rizzo, W.M. & R.R. Christian.1996. Significance of subtidal sediments to heterotrophically-mediated oxygen and nutrient dynamics in a temperate estuary. estuaries 19: 475-487. [ Links ]
46. Shaver, G.R. & J.M. Melillo. 1984. Nutrient budgets of marsh plants: Efficiency concepts and relation to availability. ecology 65: 1495-1510. [ Links ]
47. Stribling, J.M. & J.C. Cornwell. 2001. Nitrogen, phosphorus, and sulphur dynamics in a low salinity marsh system dominated by Spartina alterniflora. Wetlands 21: 629-638. [ Links ]
48. Villar, C., L. Cabo, P. Vaithiyanathan & C. Boneto. 2001. Litter decomposition of emergent macrophytes in a flood plain marsh of the lower Parana river. aquatic bot. 70: 105-116. [ Links ]
49. Windham, L. & J. Ehrenfeld. 2003. Net impact of a plant invasion on nitrogen cycling processes within a brackish tidal marsh. ecol. appl. 13: 883-896. [ Links ]
50. Yang, C., L. Yang, Y. Yang & Z. Ouyang. 2004. Rice root growth and nutrient uptake as influenced by organic manure in continuously and alternately flood paddy soils. agric. Water Manag. 70: 67-81. [ Links ]












 uBio
uBio