Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
versión impresa ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia v.25 n.2 Maracaibo ago. 2002
Optimization of the potentiometric technique with ion selective electrode for evaluating sulfate ion in aqueous samples
Dalia Cubillán, Neida Núñez, Graciela González y Nuris Camargo
Laboratorio de Electroquímica, Ciclo Básico. Facultad de Ingeniería. Universidad del Zulia, Apartado postal 10259. E-mail: gracielagonpe@cantv.net. Maracaibo, Venezuela. Telefax: (0261) 7598736.
Abstract
An optimization of the potentiometric technique using ion selective electrodes for sulfate analysis is discussed. The determination of SO=4 ion in water column samples (Latitude N 09°5117", Lengt W 71º3141") of the Lake Maracaibo was performed following the optimum parameters. Response time 30 s shorter was exhibited when using NaNO3 as ISA solution compared with conventional NaClO4 ISA solution. The titrant solution containing Pb(NO3)2 does not interfere with the lead ion selective electrode, the optimum titration rate being 0,008 mL/s. Sulfate ion was titrated against standard Pb(NO3)2 4,83x10-3 mol/L solution using a lead ion selective electrode vs Ag/AgCl reference electrode. Samples of water colected every two m from 1 m to 27 m depth were analyzed, and levels of SO=4 ion from 171,84 ± 4,26 to 306,72 ± 9,46 mg/L were found. Significative differente values of sulfate vs depth are shown within 95% of probability.
Key words: Sulfate, ion selective electrode, water column of Lake Maracaibo.
Optimización de la técnica potenciométrica con electrodo selectivo para evaluar sulfato en muestras acuosas
Resumen
Se optimizó la técnica potenciométrica con electrodo selectivo para la determinación de sulfato, y se aplicó a muestras de la columna de agua (Latitud N 09°5117", LongitudO71º3141") del Lago de Maracaibo. El NaNO3 utilizado como regulador de fuerza iónica (ISA), permitió disminuir el tiempo de respuesta del sensor de Pb+2 en 30 s con respecto al ISA convencional (NaClO4). El Pb(NO3)2 usado como titulante no representa una interferencia para el sensor. La velocidad óptima de titulación fue 0,008mL/s. Se tituló SO=4 con solución patrón de Pb(NO3)2 4,83x10-3 mol/L, usando un electrodo selectivo de Pb+2 vs Ag/AgCl en 14 muestras de agua del Lago de Maracaibo; captadas desde 1 m hasta 27 m de profundidad con una separación de 2 m entre ellas. Los niveles de sulfato encontrados fueron 171,84 ± 4,26 a 306,72 ± 9,46 mg/L, mostrando diferencia significativa, al 95% de probabilidad con la profundidad.
Palabras clave: Sulfato, electrodo selectivo de Pb++, columna de agua del Lago de Maracaibo.
Recibido el 10 de Julio de 2001
En forma revisada el 08 de Mayo de 2002
Introducción
El Lago de Maracaibo está situado al noroeste de Venezuela, es el mayor de todos los lagos sudamericanos y cubre un área de aproximadamente 1213 Km2 [1]. El Lago está continuamente sometido a contaminación, producto de la entrada de las aguas salinas provenientes del Golfo de Venezuela y debido a las descargas residuales; domésticas e industriales, las cuales están gradualmente colaborando con el deterioro de las condiciones de vida de este gran reservorio de agua dulce; ya que tanto a los productos de la oxidación de la materia orgánica presente en las descargas domésticas como a los nutrientes descargados en los residuos industriales, se les atribuye a su deterioro.
Una de las especies presente en el Lago de Maracaibo, y que contribuye a su deterioro progresivo es el ion sulfato; el cual puede presentarse en el agua a partir de ciertos minerales, especialmente yeso, o también como producto final de la oxidación de sulfuros y sulfitos. La reducción anaeróbica del sulfato en aguas estratificadas contribuye a alterar las propiedades fisicoquímicas del agua, lo mismo que la productividad y la distribución de los organismos; y la presencia de sulfato en las aguas naturales generalmente disminuye a medida que estas son más profundas, por la disminución del oxígeno disuelto, con la consecuente producción de elevadas concentraciones de sulfuro [2, 3].
El sulfato también puede estar presente en el agua como subproducto de las refinerías de petróleo; descargas industriales de fábricas de celulosa y papel, textiles, tenerías, industrias químicas, operaciones de transformaciones de gas y las lavanderías como consecuencia del uso de detergentes [4].
La determinación de sulfato en aguas naturales es muy importante para estudios geoquímicos y ambientales, y se ha utilizado para ello diversas técnicas tales como: gravimetría [5], turbidimetría [6], espectroscopía de Laser Raman [7], cromatografía iónica [8], absorción atómica [9].
La técnica potenciométrica con electrodo selectivo para determinar SO=4 presenta algunas ventajas sobre las anteriormente nombradas; tales como: la rapidez y sencillez del análisis y en general, las muestras no necesitan pre-tratamiento complejo; requiere de instrumentos disponibles en la mayoría de los Laboratorios y resulta relativamente económico. Todas estas ventajas sugieren la posibilidad de utilizar los electrodos selectivos para la determinación de sulfato en agua, como método de análisis alternativo a los ya existentes.
En este trabajo, se optimizan variables de la titulación potenciométrica para determinar sulfato con un electrodo selectivo a plomo vs un electrodo de referencia de Ag/AgCl. Se analizan 14 muestras de la columna de agua del Lago de Maracaibo.
Procedimiento Experimental
Se comprobó el buen funcionamiento del electrodo selectivo a plomo (ORION 94-82), mediante el método potenciométrico directo (Potenciómetro Corning 125), con soluciones patrón de Pb (NO3)2, preparadas con agua destilada-desionizada y se utilizó el electrodo de referencia de Ag/AgCl de unión doble (ORION 90-02). Como solución reguladora de la fuerza iónica (ISA) se evaluó solución de NaClO4 y NaNO3, ambas 5 mol/L, y se midió el potencial correspondiente a cada solución patrón; verificando el tiempo de respuesta y la pendiente mediante la respectiva curva de calibración. Se establecieron los parámetros óptimos (ISA, uso de metanol, velocidad de titulación), para la titulación de SO=4 mediante la valoración de solución patrón de SO=4 y se analizó el contenido de sulfato en muestras (5,00 ± 0,01) mL de la columna de agua (Latitud N 09°5117", Longitud O 71°3141") del Lago de Maracaibo; por titulación potenciométrica automática (titrino, Metrohn 751GPD) con solución de Pb(NO3)2 4,83x10-3 mol/L (Titrisol Merck), utilizando los electrodos antes mencionados. Las titulaciones fueron por triplicado para reportar promedio de los resultados obtenidos, y todas las medidas de potencial se realizaron a la temperatura del laboratorio (24,3 ± 0,4°C).
Resultados y Discusión
Se calibró el electrodo selectivo a plomo por potenciometría directa, y se estudiaron los parámetros relacionados con la ecuación de Nernst a diferentes condiciones; los valores obtenidos se representaron mediante curvas de calibración, cuya pendiente debe acercarse al valor teórico dado por dicha ecuación para considerar el buen funcionamiento del electrodo. Los resultados obtenidos al investigar el efecto de diferentes soluciones para ajustar la fuerza iónica, necesidad de ajuste del pH y de adicionar metanol se muestran en la Tabla 1.
Dichas variables se estudiaron con el objeto de ampliar las condiciones experimentales para la determinación potenciométrica de SO4 =. Así por ejemplo, el NaNO3 podría utilizarse como alternativa al NaClO4 para regular la fuerza ionica y el Pb(NO3)2 como titulante en sustitución del Pb(ClO4)2, utilizado en la literatura [10, 11]. El ajuste del pH en las soluciones patrón y la presencia de metanol en las mismas, se espera que no alteren el comportamiento del electrodo selectivo de plomo a efectos de su calibración; ya que estas variables influyen al ocurrir la reacción, de formación de SO4Pb, durante la titulación. En consecuencia, solamente se realizó una prueba de calibración del electrodo selectivo modificando estas variables. En la Tabla 1 se observa que los valores de la pendiente, CMD e intervalo de linealidad están incluidos en los intervalos dados al repetir n veces las pruebas sin ajustar pH ni agregar metanol. Lo cual demuestra que el electrodo selectivo de plomo funcionará en condiciones óptimas en la titulación de SO4= en presencia de metanol y pH entre 4,0 y 4,5.
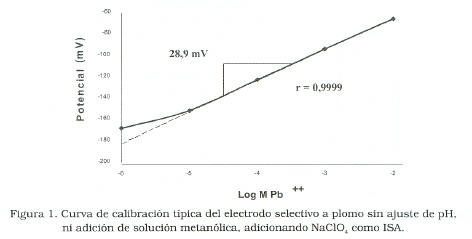
La CMD en todos los casos fue inferior a los niveles de concentración (10-3 mol/L) que pueden analizarse por titulación con un error de ± 0,2 a 0,5% [12], de allí que la poca precisión en la determinación de la CMD no es crítica y la misma obedece al método manual utilizado para estimarla. Además, para cualquiera de las condiciones estudiadas; el comportamiento del electrodo se ajustó a la ecuación de Nernst, ya que la pendiente resultó acorde a los valores teóricos esperados de 28 ± 2 mV/Log M Pb+2 [10].
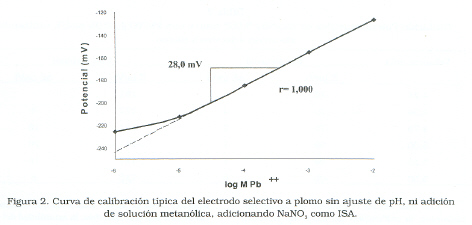
La Figura 1 muestra la respuesta típica del electrodo selectivo de plomo utilizando NaClO4, como regulador de fuerza iónica, sin ajuste de pH, ni adición de solución metanólica en la calibración; mientras que la Figura 2 representa la calibración del electrodo en igualdad de condiciones, pero usando NaNO3 como regulador de fuerza iónica.
En ambas figuras se puede observar buena linealidad con coeficientes de correlación de 0,9999 y 1,000 para las Figuras 1 y 2 respectivamente.
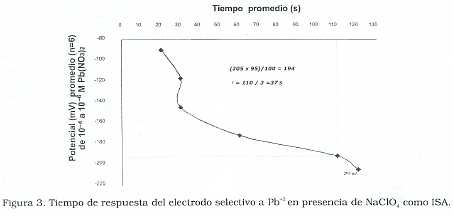
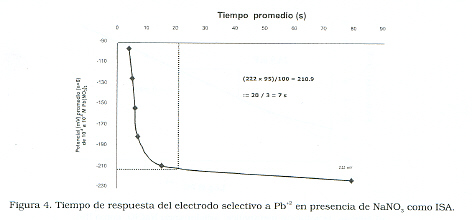
Al utilizar como regulador de fuerza iónica el NaNO3, se observó la estabilización del potencial entre 2 y 8 veces más rápido que con el Na- ClO4. El tiempo de respuesta (τ), tiempo necesario para alcanzar una diferencia de potencial estable, fue medido utilizando el método de inmersión [13]. El cual consiste en graficar el potencial promedio obtenido para cada concentración del ion vs el tiempo promedio medido para alcanzar la estabilidad del potencial. Se obtiene el 95% del potencial promedio correspondiente a la menor concentración del ion y con este valor se entra en la curva, se intercepta y se determina el tiempo promedio experimental. Este último es igual a 3 veces el tiempo de respuesta del sensor; para el NaClO4 de 37 s (Figura 3)y para el NaNO3 resultó ser 7 s (Figura 4) y , demostrando en el primer caso un tiempo de respuesta 5 veces menor, lo que le confiere ventajas al uso de NaNO3como solución reguladora de la fuerza iónica.
Con base en los resultados obtenidos inicialmente, la calibración del electrodo selectivo se realizó sin ajuste de pH, ni adición de solución metanólica y utilizando como regulador de fuerza iónica el NaNO3 ya que con este se obtuvo un menor tiempo de respuesta.
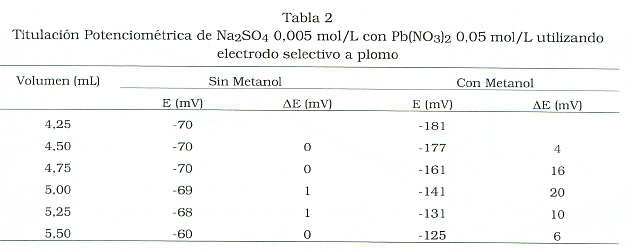
Antes de analizar la cantidad de SO4= en las muestras de agua del lago por titulación potenciométrica, se realizaron pruebas de validación con el objeto de lograr las condiciones óptimas para la titulación de SO=4 con Pb+2. Se tituló solución patrón de Na2SO4 con Pb(NO3)2 en presencia y ausencia de solución metanólica. Resultados típicos obtenidos para concentraciones 0,005 mol/L y 0,05 mol/L de Na2SO4 y Pb(NO3)2 respectivamente, se muestran en la Tabla 2. En presencia de solución metanólica se registraron saltos de potencial en la zona del punto final de titulación hasta de 20 mV más altos que en ausencia de este solvente, además, la estabilidad del potencial leído fue mayor. La adición de este solvente disminuye la solubilidad del sulfato de plomo y garantiza una mayor precipitación del mismo.
También se estudió el uso de regulador de fuerza iónica en la titulación potenciométrica. Se utilizaron soluciones de Na2SO4 a diferentes concentraciones, a las cuales se les adicionó solución metanólica e ISA (NaNO3) y se titularon con solución titrisol de Pb+2 1,93x10-3 mol/L; los resultados demostraron que en todos los casos hubo formación de precipitado y saltos de potencial entre 4 y 19 mV en la zona del punto final de titulación. Al repetirse las experiencias en ausencia de ISA, los saltos de potencial fueron entre 16 y 41 mV; con estos resultados se comprobó que en la titulación potenciométrica no es necesario utilizar regulador de fuerza iónica. Este comportamiento demuestra que al avanzar en la titulación se incrementa la fuerza iónica de la solución que se está titulando. El ajuste de pH en el intervalo 4,0-4,5 se consideró óptimo [14], para evitar tanto la precipitación de hidróxido de plomo, Pb(OH)2 a pHmás básicos, como el incremento de la solubilidad de la membrana del electrodo a Ph más ácidos.
Operando bajo las condiciones experimentales óptimas encontradas, se investigó el efecto de la velocidad de adición del titulante sobre el salto del potencial en el punto final de la titulación. Se realizaron ensayos adicionando diferentes volúmenes de solución titulante a la misma velocidad y se determinó la variación en la diferencia de potencial, los resultados obtenidos demostraron que con adiciones de 0,008 mL/s de solución titulante, los saltos de potencial en la zona del punto final de titulación fueron de 2 a 6 veces mayor que con adiciones de 0,003 mL/s, donde los saltos de potencial entre una adición y otra resultaron, en general, igual o menora1mV, los cuales son cambios insignificantes.
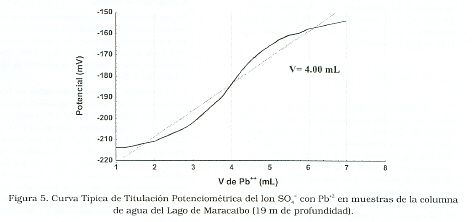
Con base en los resultados obtenidos en las pruebas preliminares se realizó la titulación potenciométrica de las 14 muestras de agua del Lago de Maracaibo, en presencia de solución metanólica al 50%, ajustando el pH entre 4,0 y 4,5; sin utilizar solución reguladora de fuerza iónica y adicionando la solución titulante en incrementos de 0.008 mL/s. Para cada titulación, se obtuvo una curva similar a la de la Figura 5. Como se puede observar la curva es simétrica y el punto de inflexión se obtuvo aplicando un análisis estadístico por medio del programa Statistic for Windows versión 4.3.
De acuerdo con la literatura [10], el ion nitrato se debe considerar como interferencia en la titulación potenciométrica de SO4=; siempre y cuando su concentración sea 50 veces mayor que la concentración de sulfato detectada. Posiblemente debido a la formación de Pb(NO3)2, la cual mantiene soluble el plomo y disminuye su precipitación como PbSO4. En el análisis de las muestras se encontró una concentración de SO4= de 1,79 × 10-3 mol/L (menor concentración detectada) y una de NO3 - de 4,5 × 10-3 mol/L, proporción inferior a la requerida para ser considerada como interferencia. Además, la concentración de nitrato en las muestras analizadas osciló entre 0,01 y 0,09 mg/L (1,6 × 10-7 y 1,5 × 10-6mol/L respectivamente), lo cual representa una relación NO3-/SO4 = máxima de 8 × 10-4 ; insignificante con respecto a la relación Pb(NO3)2 agregado como titulante / SO4 = = 2,5.Al titular algunas muestras con (NO3 -)2 Pb y con PbCLO4 se encontró similar el volumen del punto final, descartando asi la interferencia por nitrato.
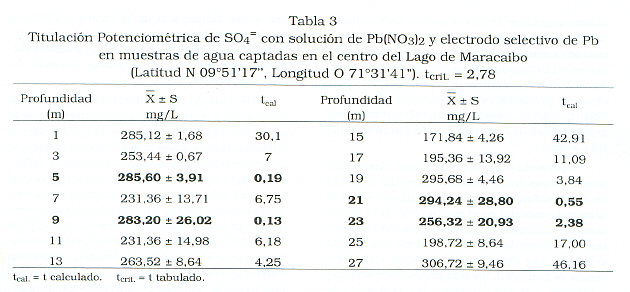
El análisis de sulfato, por titulación potenciométrica, se realizó en muestras captadas en la columna de agua del lago de Maracaibo, desde la profundidad de 1 m hasta 27 m con una diferencia de 2 m entre ellas. Al titular las 14 muestras con solución Pb(NO3)2 4,83x10-3Mse detectaron valores de SO4= en el intervalo de 171,84 ± 4,26 a 306,72 ± 9,46 mg/L (Tabla 3). Se esperaba que a medida que se incrementara la profundidad, la presencia de sulfato disminuyera, por la ausencia de oxígeno disuelto. Sin embargo en la zona de captación de las muestras (centro del lago) se ha reportado la presencia de una cuña salina [15] por entrada de agua del mar, a la cual se le podría atribuir la variabilidad de los resultados encontrados.
Un estudio estadístico de estos resultados, usando la varianza combinada (Sc2= [S12 (n1-1) + Sx2 (nx-1)] / (n1-1) + (nx-1) para las desviaciones estándar de los valores de SO4 = obtenidos por triplicado (nx = 3) para cada profundidad (x) con respecto a los de 1 m (n1 = 3) y calculando tcal [16], según la ecuación (1).
Se obtuvo los valores mostrados en la Tabla 3. para un 95% de probabilidad y 4 (n1+ nx-2) grados de libertad tcrit. = 2,78 [17]. En consecuencia, puede concluirse que en general hay diferencia significativa en los niveles de SO4 = encontrados, en función de la profundidad de captación de la muestra, con tendencia a ser menores a mayor profundidad. Los valores mostrados en negrilla en la Tabla 3, no son significativamente diferentes de la concentración superficial de SO4 =. Debido al agotamiento de las muestras no fue posible repetir los análisis sobre un mayor número de alícuotas y así incrementar n para aumentar los grados de libertad, con la consecuente aclaratoria de estos resultados.
Conclusiones
– La calibración del electrodo selectivo a plomo se realizó sin ajuste de pH, ni adición de solución metanólica y utilizando como regulador de fuerza iónica el NaNO3, con el cual se obtuvo tiempo de respuesta de 7 s; presentando buen comportamiento según la ecuación de Nernst.
– En las titulaciones potenciométricas con el electrodo selectivo a plomo se establecieron los parámetros óptimos de trabajo: solución de la muestra en metanol al 50%, sin adición de ISA y velocidad de adición de titulante de 0,008 mL / s.
– Los niveles de sulfato encontrados en las muestras de la columna de agua del Lago de Maracaibo (Latitud N 09°5117, Longitud O 71°3141") analizadas, fueron 171,84 ± 4,26 a 306,72 ± 9,46 mg/L, con tendencia general a disminuir con la profundidad; con un 95% de probabilidad al hacer el estudio estadístico con base al valor de sulfato encontrado en la superficie. La dispersión observada en los valores encontrados se atribuye a la turbulencia del medio en estudio.
Agradecimiento
Se agradece al CONDES el financiamiento para realizar el Proyecto N° 1652-2000, al Profesor Aquiles Materán por su apoyo en la parte estadística, al ICLAM por la captación y donación de las muestras y a Conicit por la donación de algunos equipos básicos del laboratorio.
Referencias Bibliográficas
1. Millán, R, Godoy, G and Montiel, M. Bacterias sulfato reductoras en muestras de sedimento del Lago de Maracaibo, Venezuela. CIENCIAS, 4 (1996), 9-16. [ Links ]
2. Waiser, M and Robarts, R. "Microbial Nutrient Limitation in praorie saline lakes with higth sulfate concentration". Limnol, Oceanog Vol 40, No 3 (1995), 566-574. [ Links ]
3. Murray, J; Codispoti L and Friedirich, G. "Oxidation-reduction Environment. The suboxic. Zone in the black sea". School of Oceanography, University of Washington. Aquatia Chemistry (1995), 158-175. [ Links ]
4. Nalco. "Manual del agua. Su naturaleza. Tratamiento y Aplicaciones". Tomo Nº 1. Mc GrawHill (1991), 358. [ Links ]
5. American Public Healt Association: "American Water Works Asociation and Water pollution Control Federation. Standard Methods for the Examination of Water and Wastewater". 14th edn., New York. American Public Health Association (1998), 540. [ Links ]
6. Santellí, R; Salgado, P. "Turbidimetric determination of sulphate in waters employing flow inyection and lead sulphate formation". Anal. Chim. Acta 300 (1995), 149-153. [ Links ]
7. Murata, K; Kawakam, K. "Determination of sulfate in brackish waters by laser raman spectroscopy". Anal. Chim. Acta 344 (1997), 153-155. [ Links ]
8. Oquendo, J; Prieto, H. "Determination of sulfate in alumina catalyst supports by ion Chromatography". Revista Técnica Intevep 5 (1985), 163-6. [ Links ]
9. Blodau, C., Hoffmann, S., Peine, A., and Peiffer, S. Iron and sulfate reduction in the sediments of acidic mine lake 116 (Brndeburg, Germany): Rates and geochemical evalvation Water, Air and Pollution, 108 (1998) 249- 270. [ Links ]
10. Orion Research Catalogue. "Instruction Manual Lead Electrode, Model 94-82" (1982). [ Links ]
11. Ledo de Medina, Hilda. "Optimización y comparación de métodos potenciométricos con electrodos selectivos para detectar iones sulfato". Universidad del Zulia. Facultad Experimental de Ciencias. Trabajo de Ascenso (1989), 75. [ Links ]
12. Karl Camman. "Working with ion-selective electrodes chemical laboratory practice. Soringer-verlag". Berlin heidelberg New York (1979), 127. [ Links ]
13. Camargo, Nurys. "Construcción de electrodos selectivos para ion cloruro". Universidad del Zulia. Facultad de Ingeniería. Tesis de Posgrado (1989), 15. [ Links ]
14. Vesely, J. "Titration of sulphates and lead using lead ion selective electrode". Collection of Czechoslovak chemical comunications. Vol 46 (1981). 368-76. [ Links ]
15. Herman de Bautista, S. "Proceso de salinización en el Lago de Maracaibo". ICLAM. Gracias Nerio Tip, C.A. (1997). [ Links ]
16. Meier, Peter C and Zünd, Richard. "Statistical Methods in analytical chemistry". A Wiley-Interscience Publication. John Wiley Sous, Inc (1997), 39. [ Links ]
17. Guide to the expression of uncertainty in measurement (Guia ISO) (2000), 66. [ Links ]