Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
versión impresa ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia v.30 n.3 Maracaibo dic. 2007
Chemical activation of sugar cane bagasse (Saccharum officinarum) on nickel (II) adsorption in industrial effluents
Sabrina Acevedo, Marinela Colina, Altamira Díaz, Nola Fernández, Elisabeth Behling, Julio Marín y Gilberto Colina*
Departamento de Ingeniería Sanitaria y Ambiental (DISA), Escuela de Ingeniería Civil, Facultad de Ingeniería, Universidad del Zulia, Apartado 526. Maracaibo 4001-A, Venezuela. *gjcolina@hotmail.com
Abstract
Sugarcane bagasse Saccharum officinarum was used as a precursor on nickel (II) adsorption present in coal mining effluents. The sample of bagasse was dried, smashed and sieved until obtaining an adequate granulometry, then it was activated with H3PO4 40%p/p during 14 hours, the materials were pyrolized for one hour at 400 and 500°C respectively, obtaining prepared activated coal (PAC-400 y PAC-500). The specific area was determined by using the conventional procedure of Brunauer-Emmen- Teller (BET). The areas (SBET) at CAP-400 and CAP-500 were of 994 and 1344 m2/g respectively. Solutions of nitrate of nickel Ni(NO3)2, at initial concentrations (Co) of 50,100 and 150 mg/L, had a treatment with the PAC, in a contact time of 1 hour and 25°C, the operational pH were 5,0; 5,5 and 6,0. The PAC at 500°C can remove 85,66% of nickel with an Co of 50 mg/L at pH 5,5. The essays at pH 5 and 6 presented a nickel removal of 83,87 and 83,65% respectively. For a Co of 100 and 150 mg/L of Ni(NO3)2 the removal percentage lows. This tendency was similar to the ones with the PAC at 400°C. For the industrial effluent the removal percentage was 96,03%.
Key words: Sacharum officinarum, adsorption, activated coal, Nickel, BET isotherms.
Activación química del bagazo de caña de azúcar (Saccharum officinarum) en la adsorción de níquel (II) en efluentes industriales
Resumen
Se utilizó el bagazo de caña de azúcar Saccharum officinarum como precursor en la adsorción de níquel presente en efluentes de una mina carbonífera. La muestra de bagazo fue secada, molida y tamizada hasta obtener una granulometría adecuada, luego se activó con H3PO4 40%p/p durante 14 horas; el tiempo de pirólisis fue de una hora a 400 y 500°C, obteniéndose el carbón activado preparado (CAP-400 y CAP-500). El área específica fue determinada usando el procedimiento convencional de Brunauer-Emmett-Teller (BET). Las áreas (SBET) de los CAP-400 y CAP-500 fueron de: 994 y 1344 m2/g respectivamente. Soluciones de nitrato de níquel Ni(NO3)2 a concentraciones iniciales (Co) de 50, 100 y 150 mg/L, fueron tratadas con los CAP preparados en un tiempo de contacto de 1 hora y 25°C, a diferentes pH de operación: 5,0; 5,5 y 6,0. El CAP-500 fue capaz de remover 85,66% de níquel con una Co de 50 mg/L a pH 5,5. Los ensayos a pH 5 y 6, presentaron una remoción de níquel 83,87 y 83,65% respectivamente. Para Co de 100 y 150 mg/L de Ni(NO3)2 el porcentaje de remoción disminuyó; esta tendencia fue similar con los CAP-400. El porcentaje de remoción promedio de níquel (II) en la muestra fue 96,03%.
Palabras clave: Saccharum officinarum, adsorción, carbón activado, níquel, isotermas BET.
Recibido el 04 de Octubre de 2006 En forma revisada el 10 de Septiembre de 2007
Introducción
El contenido de metales pesados de efluentes industriales es un problema a resolver, ya que su presencia y acumulación provoca efectos tóxicos sobre la biota y genera degradación de suelos y aguas. La adsorción ha demostrado ser un proceso eficiente para la eliminación de metales del agua cuando éstos se encuentran presentes a bajas concentraciones [1].
Aun cuando existen estrictas regulaciones ambientales, las industrias metalmecánicas, tales como, refinerías de plata, baterías, soldaduras, procesos de aleación, entre otros, descargan en sus efluentes grandes cantidades de cromo y níquel. Un alto grado de exposición a los compuestos solubles de níquel pueden desarrollar alteraciones renales, donde existe exposición a la inhalación del metal o aerosoles de compuestos solubles de níquel, se pueden desarrollar enfermedades crónicas de las vías respiratorias [2].
La producción de carbones activados, obtenidos a partir de diversos precursores carbonosos se ha incrementado notablemente en las dos últimas décadas. Se ha generado una creciente demanda internacional por estos adsorbentes, debido a la necesidad de utilizar nuevas fuentes de materia prima, con disponibilidad segura y de bajo costo, centrándose especialmente en la biomasa renovable, dentro de las que se destacan el aserrín, avellana, la cáscara de coco, el bagazo de la caña de azúcar entre otros.
Los desechos sólidos agroindustriales son sometidos a diferentes procesos de activación química y física, donde el precursor es impregnado con diversos agentes, tales como, el ZnCl2, H3PO4, KOH, CO2, etc., para la obtención de carbones activados [3-6]. La utilización del bagazo de la caña de azúcar para la preparación de estos carbones, resulta una opción de interés por su versatilidad para la remoción de contaminantes en fase líquida y gaseosa, además de eliminar impurezas coloreadas, pigmentos (naturales y formados durante el proceso) y constituyentes inorgánicos [7].
Los carbones activados exhiben una gran capacidad de adsorción, debido a su estructura porosa que les confiere elevadas áreas superficiales específicas y características de textura adecuadas para la adsorción de contaminantes [8].
Estos adsorbentes son útiles en el tratamiento de efluentes industriales, y han sido propuestos por la EPA (Agencia de Protección Ambiental) para alcanzar niveles sanitarios admisibles de distintos contaminantes presentes en el agua, incluyendo su aplicación en la remoción de iones metálicos [8]. Cantidades importantes de cadmio, níquel, plomo, mercurio, vanadio (entre otros) todavía se encuentran presentes en efluentes de diferentes industrias, tales como; refinerías, baterías, soldadura y aleaciones, a pesar de las regulaciones estrictas del ambiente. Las concentraciones de estos metales cuando exceden los límites permisibles, causan efectos dañinos al hombre y a los seres vivos [10, 11].
Una forma de evaluar la eficiencia de remoción de un carbón activado preparado (CAP) es mediante el estudio de las isotermas de Langmuir, Freundlich y Brunauer-Emmett-Teller (BET), las cuales permiten determinar la naturaleza del equilibrio sólido- liquido y en especial, los parámetros relacionados con el área superficial, la cual constituye un indicador de la capacidad de adsorción de los carbones obtenidos del bagazo de caña de azúcar [12].
El objetivo de este trabajo es evaluar la capacidad de adsorción de los CAP con níquel (II) y su aplicación en aguas de fosa de una mina carbonífera.
Parte Experimental
1. Recolección de muestras
El bagazo de la caña de azúcar se recolectó del desecho generado al extraer su jugo en un comercio de la localidad Santa Cruz de Mara, Estado Zulia. Inmediatamente después de la recolección se secó exponiéndola al sol por tres días. La muestra se procesó en un molino de la marca The Straub Company modelo 4E Grinding Mil1, posteriormente se secó a 105°C en una estufa Fisher Isotemp modelo Senior, finalmente se colocó en un tamiz eléctrico Siever Shaker, modelo J-1, hasta obtener un polvo de granulometría 80 Mesh retenidos (180 µm). Las muestras se caracterizaron por triplicado, mediante un análisis próximo, según el método estándar [13].
El efluente utilizado fue obtenido de una “fosa de almacenamiento” (hueco superficial originado luego de la extracción del carbón), donde se encuentran confinados los drenajes de la mina carbonífera (agua procedente de las lluvias y drenajes superficiales del proceso de extracción del carbón), ubicada en el municipio Mara, estado Zulia, Venezuela. Las muestras de agua de fosa, se captaron en envases de polietileno (4L), previamente lavados e inmediatamente se midió el pH. Posteriormente se trasladaron al laboratorio para su almacenamiento a 8°C. Las concentraciones de aluminio, cadmio, cobre, cromo, zinc, níquel y vanadio se determinaron utilizando un espectrofotómetro de absorción atómica por llama (EAA) Perkin Elmer modelo 3110. El límite de detección (LDD) se realizó siguiendo la metodología descrita por Millar-Miller [14].
2. Preparación del adsorbente
A fin de obtener el carbón activado preparado a 400°C (CAP-400), se pesaron 250 g del bagazo de caña de azúcar previamente secado, molido y tamizado, luego se impregnó con una solución de H3PO4 40% p/p (calidad reactivo) en un envase de vidrio pirex con tapa, dejándola reaccionar durante toda la noche (12 a 14 horas de contacto aproximadamente), posteriormente la muestra se sometió a pirólisis a 400°C en un reactor de acero inoxidable de longitud (150 x 50mm) de cierre hermético, el cual se calentó eléctricamente por un lapso de 1 hora. Una vez que el bagazo carbonizado estuvo a temperatura ambiente, se procedió a lavarlo varias veces con agua destilada y se ajustó el pH a 6,5 con una solución alcalina de NaOH 0,01N, luego se filtró utilizando un equipo Millipore Whatman Nº 40. Finalmente, el carbón activado se colocó en un desecador para las pruebas de adsorción con níquel (II). El mismo procedimiento se siguió para obtener el carbón activado sometido a pirólisis a 500°C (CAP-500).
Las muestras del carbón activado obtenido se analizaron para determinar las áreas específicas y el volumen de poros presentes utilizando el modelo convencional de Brunauer-Emmett-Teller (BET) para la obtención de las isotermas de nitrógeno a 77K mediante un equipo de fisisorción y quimisorción Micrometrics ASAP 2010 [15, 16].
3. Pruebas con soluciones de Ni(NO3)2
Para la preparación de las soluciones, se utilizó agua desionizada de alta pureza a 18 Wm.cm–1 y nitrato de níquel al 97% de pureza Riedel de Haên, obteniendo soluciones a: 50, 100 y 150 mg/L. Esta prueba se realizó por triplicado para cada tipo de carbón activado preparado por separado (CAP-400 y CAP-500), agregando, un gramo del carbón a cada una de las réplicas. El tiempo de contacto empleado en el proceso fue de 1 hora de agitación continua, para diferentes condiciones de pH (5,0; 5,5 y 6,0), ajustadas utilizando NaOH 0,1N. Para determinar la concentración final de Ni (Cf), utilizando un espectrofotómetro de absorción atómica por llama, las muestras se filtraron y se preservaron con HNO3 0,1N en una proporción de 1:100 [17]. Adicionalmente se realizó un ensayo utilizando carbón activado comercial (CAC) marca BDH chemicals charcoal como parámetros referenciales, bajo las mismas condiciones anteriores.
Para la curva de calibración se utilizó una solución de níquel certificada (Trinisol Merck) de 1000 mg/L, de la cual se prepararon diferentes concentraciones (3; 5; 7 y 9 mg/L). Los datos experimentales obtenidos, se ajustaron a los modelos de Langmuir y Freundlich, mediante las ecuaciones propuestas por cada uno de ellos.
4. Tratamiento del efluente
Se realizó un ensayo por triplicado, tomando volúmenes de 100 mL del efluente industrial por gramo de adsorbente activado cuyo valor de área superficial fue mayor (CAP-500), éstas se sometieron a las mismas condiciones experimentales aplicadas para las soluciones de Ni(NO3)2 estándares.
Resultados y Discusión
Los resultados del análisis próximo para el bagazo de caña crudo, carbón activado preparado y carbón activado comercial se presentan en la Tabla 1.
Tabla 1 Análisis próximo de los precursores empleados
| Precursor | %Humedad `x ± DS | %Cenizas `x ± DS | Densidad aparente (g/cm3) |
| BC | 9,4 ± 0,310 | 3,9 ± 0,101 | 0,158 |
| CAP | 2,7 ± 0,569 | 17,5 ± 1,060 | 0,307 |
| CAC | 4,2 ± 0,408 | 8,3 ± 0,346 | 0,357 |
BC: bagazo de caña crudo. CAC: carbón activado comercial. CAP: Carbón activado preparado. DS: desviación estándar. `c promedio.
El contenido de cenizas del bagazo crudo (BC) fue bajo, lo cual justifica su empleo para la producción de carbones activados. A pesar de que el CAP tuvo un mayor porcentaje de cenizas (17,5%), el porcentaje de humedad fue menor (2,7) si se compara con el CAC (4,2) y el bagazo crudo (9,4), lo que mejora las condiciones y garantiza la adsorción sobre los sitios activos disponibles presentes en la superficie del carbón activado [18].
Los valores de la densidad aparente permiten estimar algunas características del adsorbente tales como la resistencia mecánica de los carbones activados, donde se observó que tanto los carbones preparados, como el carbón comercial, presentan valores similares a los reportados en la literatura, esto representa una ventaja en el proceso de adsorción o separación de pequeños volúmenes de adsorbentes [19].
La Tabla 2 muestra los resultados de la aplicación del método convencional de Brunauer-Emmett-Teller (BET) de N2 a 77K de los carbones activados preparados a 400°C y 500°C y el carbón activado comercial.
Tabla 2 Volumen total de poros, microporos, mesoporos, radio y diámetro de poros de los carbones activados
| Tipo de carbones | Vtp (cm3/g) | V mic (cm3/g) | V mes (cm3/g) | d (nm) | r (nm) |
| CAP-400 | 0,586 | 0,235 | 0,50 | 2,35 | 1,178 |
| CAP-500 | 1,127 | 0,0923 | 1,035 | 3,35 | 1,678 |
| CAC | 0,952 | 0,0427 | 0,710 | 3,60 | 1,800 |
CAC: carbón activado comercial. CAP-400: carbón activado preparado a 400°C. CAP-500: carbón activado preparado a 500°C. Vtp: volumen total de poros. Vmic: volumen de microporos. Vmes: volumen de mesoporos. d: diámetro de poros. r: radio de poros.
El CAP-500 presentó condiciones superficiales favorables con respecto al CAP-400 en todos los parámetros medidos, por lo que la temperatura de pirólisis al igual que otros factores como el ácido utilizado, son determinantes en la activación de la superficie del precursor. El CAC utilizado en esta experimentación, presentó un área superficial de 1058 m2/g, valor que se encuentra entre el obtenido por el CAP-400 (994 m2/g) y el CAP-500 (1344 m2/g).
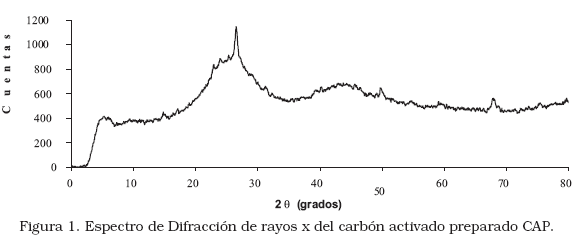
En la Figura 1 se muestra el espectro de difracción de rayos x del carbón activado preparado (CAP). Este espectro indica una forma de carbonos amorfos típicos donde muestra picos entre 2q ~ 25° y 2q ~ 45° que puede asignarse a formas de grafitos desordenados. Estos picos diferentes indican la presencia de estructuras porosas. Los grafitos de carbón desordenados fueron denominados como estructuras turboestáticas por Biscoe y col. [20]. Otros estudios realizados, mostraron espectros de carbones activados similares al obtenido por el bagazo de caña de azúcar, donde ellos determinan que son de origen carboníferos con estructuras de carbonos amorfos que tienen muchos poros en común [21].
La cantidad de metal adsorbido expresado en miligramos, por área de adsorbente (q), fue determinado mediante la siguiente ecuación:
![]()
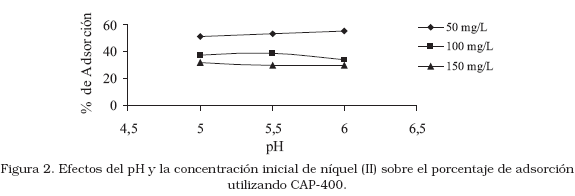
donde m es la cantidad del adsorbente (1 g), V es el volumen de solución de níquel (100 mL), Co es la concentración inicial de dicha solución (50, 100 y 150 mg/L) y Cf es la concentración final obtenida después del proceso de adsorción. Los resultados sobre el efecto del pH y la concentración inicial de níquel sobre su remoción usando CAP-400, se muestran en la Figura 2.
A una concentración inicial (Co) de 150 mg/L, para diferentes valores de pH (5,0; 5,5 y 6,0), se obtuvo un porcentaje de remoción de 32,03; 29,45 y 29,98% respectivamente. A concentración inicial de 100 mg/L la remoción fue de 37,50; 38,85 y 33,67%, mientras que a 50 mg/L la remoción fue de 51,55; 52,83 y 54,85% respectivamente. Ello evidencia que el equilibrio que rige el proceso de adsorción del níquel (II), es afectado por el pH y la concentración inicial del metal, alcanzándose las condiciones más óptimas a 100 mg/L y valores de pH de 5,5 y 6,0. A valores mayores de pH la curva de adsorción comenzó a descender, este comportamiento es similar a los presentados por otros investigadores [22].
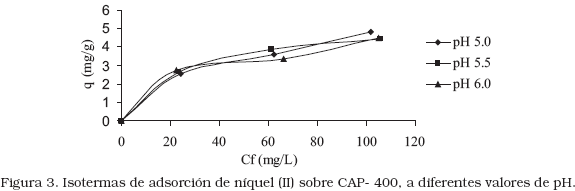
Según la clasificación de las isotermas establecidos por la IUPAC [18], la Figura 3 muestra una isoterma tipo I, característica de sólidos microporosos con superficies externas relativamente pequeña. Los CAP-400 son carbones microporosos, cuyo volumen es de 0,235 cm3/g.
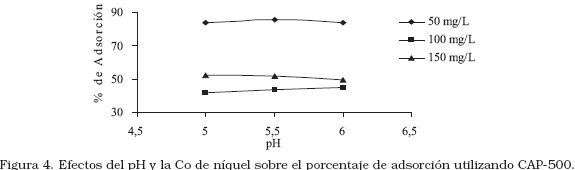
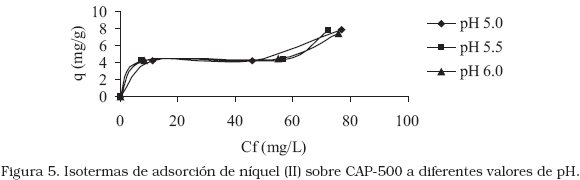
Los resultados de la remoción de níquel en soluciones diluidas, el efecto del pH y la concentración sobre la cantidad adsorbida de níquel (II) usando CAP-500, se muestran en la Figura 4. El comportamiento del proceso es similar al realizado con el CAP-400 en donde se observó un aumento del porcentaje de adsorción de níquel a concentración inicial de 50 mg/L, los valores de pH estudiados no presentaron diferencias significativas en la cantidad de níquel removido, sin embargo, valores de pH igual a 5,5 representan condiciones muy favorables para la adsorción.
A concentración inicial de 50 mg/L, el proceso respondió de mejor forma ya que se obtuvieron remociones de 83,84; 85,66 y 83,61% a pH de 5,0; 5,5 y 6,0 respectivamente. La pirólisis a 500°C obtuvo mejores resultados de remoción de níquel (II) a diferentes pH, sin embargo, se observó que un valor de pH de 5,5 y concentración inicial de 50 mg/L de níquel (II) constituye condiciones óptimas para la remoción del metal. La isoterma de níquel para el CAP-500 (Figura 5), muestra una tendencia similar a la obtenida por el CAP-400, es decir, corresponden a una clasificación de isoterma del tipo I, sin embargo, se observó un leve cambio al tipo de isoterma II según la clasificación IUPAC.
En el carbón activado (aún cuando es un material microporoso), se desarrollan cavidades mesoporosas que favorecen la difusión del níquel (II) hasta la zona de microporos en la superficie del carbón.
Es evidente que el equilibrio que rige el proceso de adsorción del níquel (II), fue afectado por el pH y la concentración, observando que a 100 mg/L el pH recomendado es de 5,5. Investigaciones anteriores demostraron la eficiencia del proceso en condiciones de pH similares [22]. Estudios realizados reportaron resultados similares para el proceso de adsorción de níquel, ellos concluyeron que las isotermas determinan en gran parte, el proceso de adsorción que está ocurriendo. Según estos investigadores el proceso es tanto físico como químico; la adsorción ocurre sobre los grupos funcionales oxigenados presentes en la superficie del carbón, generando una atracción electrostática por parte de los iones metálicos hacia la superficie del carbón [22, 23].
Los resultados obtenidos en esta investigación fueron ajustados a los modelos propuestos por Langmuir y Freundlich, tomando en cuenta las temperaturas a las cuales fueron pirolizados los CAP y el pH de óptima adsorción (pH 5,5). En las Tablas 3 y 4 se presentan los resultados del ajuste al modelo de Langmuir y Freundlich.
Tabla 3 Valores de las constantes de adsorción obtenidas de los datos experimentales y su correspondiente ecuación lineal para el modelo de Langmuir
| Tipo de carbón | Ajustes al Modelo de Langmuir | |
| Ecuación lineal | Constantes de adsorción | |
| CAP-400 | Cf/q=0,1833Cf + 4,581 | R2= 0,999 KL=24,99 L/mg aL= 0,218 L/mg |
| CAP-500 | Cf/q=0,1443Cf + 1,4597 | R2= 0,8466 KL=10,11 L/mg aL= 0,6850 L/mg |
Tabla 4 Valores de las constantes de adsorción obtenidas de los datos experimentales y su correspondiente ecuación lineal para el modelo de Freundlich
| Tipo de carbón | Ajustes al Modelo de Freundlich | |
| Ecuación lineal | Constantes de adsorción | |
| CAP-400 | Log q= 0,3423 logCf – 0,0409 | R2= 0,9893 KF=0,9101 L/g n= 2,92 |
| CAP-500 | Log q= 0,1606 LogCf + 0,4803 | R2= 0,5980 KF= 6,22 L/g n= 3,02 |
El modelo de Langmuir se ajustó satisfactoriamente al proceso cuando se utilizó el CAP-400, la adsorción del metal ocurre en una superficie homogénea a temperatura constante. Este modelo es útil cuando hay una interacción fuerte entre la especie adsorbida y la superficie del adsorbente [20]. El factor de correlación favorece el proceso llevado a cabo en el CAP-400 (R2 = 0,999), sin embargo, el valor de la constante que determina la capacidad de adsorción para Langmuir aL fue mayor para el CAP-500 (0,6850 L/mg) que para el CAP-400 (0,218 L/mg).
Para el ajuste del modelo propuesto por Freundlich de los carbones preparados (CAP-400 y CAP-500), los valores de las constantes n y KF son mayores a la unidad, lo que evidencia una buena afinidad entre el adsorbato y la superficie de los carbones [24].
El hecho de que las isotermas de Freundlich no expliquen del todo el proceso de adsorción se debe a que las concentraciones de partida son relativamente elevadas.
La Tabla 5 presenta los resultados del análisis de metales pesados presentes en una muestra de agua de fosa de una mina carbonífera. Las concentraciones de los metales estuvieron dentro de los límites permitidos de descarga a los cuerpos de agua según el decreto N° 883 [25].
Tabla 5 Análisis elemental de la muestra de agua de la fosa de una mina carbonífera
| Metal | Concentración (µg/L) | LDD (µg/L) |
| Aluminio | 70,3 ± 0,32 | 1,69 |
| Cadmio | 7,12 ± 0,54 | 0,10 |
| Cobre | 110,20 ± 2,04 | 1,47 |
| Cromo | 6,09 ± 0,246 | 1,05 |
| Zinc | 18,79 ± 0,02 | 0,86 |
| Níquel | 756,6 ± 0,57 | 23,98 |
| Vanadio | 70,23 ± 0,03 | 15,98 |
LDD: límite de detección [13].
La concentración final de níquel (II) sobre CAP-500, fue de 30,03 ± 1,69 µg/L, lo que representa un 96,03% de remoción del metal presente en la muestra de fosa, aun cuando las concentraciones de los metales fueron mínimas, el empleo de estos carbones remueven satisfactoriamente estos metales [26].
Conclusiones
El área superficial y el porcentaje de adsorción de níquel (II) sobre el CAP preparado a 500°C fueron de 1.344 cm2/g y 83,44% respectivamente. Estos valores estuvieron por encima a los obtenidos por el CAP-400 y el CAC. La adsorción fue favorecida para soluciones con una Co de 50 mg/L. La remoción de níquel (II) del efluente industrial fue de 96,03%. Los valores de las constantes que determinan la capacidad adsortiva estuvieron por encima de la unidad lo que indica una eficiente capacidad de adsorción, siendo el modelo de Langmuir el que mejor se ajustó al proceso de remoción del níquel (II).
Agradecimiento
Al Consejo de Desarrollo Científico y Humanístico (CONDES) de LUZ por el financiamiento al proyecto de investigación. A la Dra. María Josefina Pérez Zurita de Scout. Escuela de Química de la UCV por su valiosa colaboración en la investigación. Al Laboratorio de Espectroscopia Molecular y Atómica (LEMA) de la Facultad Experimental de Ciencias de LUZ.
Referencias Bibliográficas
1. Razvigorova, B.T., Petrov, N., Minkova V. Purification of water by activated carbons from apricot stones. Wat. Res. 32(7): (1999). 2135-2139. [ Links ]
2. Quen Brossa, S. Toxicología Industrial. Salvat, S.A (ed). (1994), México, 90-93, 101-102. [ Links ]
3. Ahmedna M., Clarke, S., Johns, M., Marshall, W., Rao, R. “Use of filtration and buffers in raw sugar colors measurements”. J. Sci. Food Agric 109: (1997). 117-124. [ Links ]
4. Blanco, J., Bonelli, P., Cerrella, E., Cukierman, A. “Phosphoric Acid Activation of Agricultural Residues and Bagasse from Sugar Cane: Influence of the Experimental Conditions on Adsorption Characteristics of Activated Carbons”. J. Ind. Eng. Chem. Res. 39: (2000). 4166-4172. [ Links ]
5. Heschel, W., Klose, E. “On the Suitability of Agricultural By-Products for the Manufacture of Granular Activated Carbon”. Fuel 74: (1995). 1786. [ Links ]
6. Khalil, L. “Adsorption Characteristics of Activated Carbon Obtained from Rice Husks by Treatment with Phosphoric Acid”. Sci. Technol 13: (1996). 317. [ Links ]
7. Ruiz, M., Rolz, C. “Activated carbons from sugar cane bagasse”. Ind. Eng. Chem. Prod. Res. 4(10): (1971). 429-432. [ Links ]
8. Toles, A., Marshall, M., Johns, H., Wartelle y Mcaloon, A. “Acid activated carbons from almond shells: physical, chemical and adsorptive properties and estimated cost of production”. Bioresourse Technology, 71: (2000). 87-92. [ Links ]
9. Blanco, J., Bonelli, P., Cerella, E., Cukierman, A. “Activación química de bagazo de caña de azúcar para la obtención de carbones activados”. Programa de investigación de fuentes alternativas de materias primas. Universidad de Buenos Aires. Facultad de Ciencias Exactas y Naturales. Buenos Aires. Argentina (2001). [ Links ]
10. Periasamy, K., Namasivayam, C. “Process Development for Removal and Recovery of Cadmium from Wastewater by a Low-Cost Adsorbent: Adsorption Rates and Equilibrium Studies”. Ind. Eng. Chem. Res 33: (1994). 317. [ Links ]
11. Periasamy, K., Namasivayam, C. “Removal of Nickel (II) from Aqueous Solution and Nickel Plating Industry Wastewater Using an Agricultural Waste: Peanut Hulls”. Waste Manage, 15: (1995). 63. [ Links ]
12. Ayyappan A., Carmalin, S., Swaminathan, K., Sandhya, S. Removal of Pb (II) from aqueous solution using carbon derived from agricultural wastes. Process Biochemistry, 40: (2005). 1293-1299. [ Links ]
13. APHA. “Standard methods for examination of water and wastewater”. 20th edition. American Public Health Association. 1015 Fifteenth Street, N.W. Washington, D.C. USA. (1998). [ Links ]
14. Miller J. Y Miller, J. Estadística para Química Analítica. Addisson-Wwesley. Iberoamericana. Estados Unidos. (1983) 100-101. [ Links ]
15. Daifullah A., Girgis, B., Gada, H. “A study of the factors affecting the removal of humic acid by activated carbon prepared from biomass material”. Colloids and Surfaces A: Physicochemical. Eng. Aspects 235: (2004). 1-10. [ Links ]
16. Girgis, B., Khalil, L.B., Tawfik, A. M. Activated Carbon from Sugar Cane Bagasse by Carbonisation in the Presence of Inorganic Acids. J. Chem. Tech. Biotechnol 61: (1994). 87-92. [ Links ]
17. Lenores, S., Clescari, A., Greenberg, A Standard Methods. American Public Health Asociation (ed). Washington. (1998) 319-320. [ Links ]
18. Blanco Castro, J., Bonelli, P.R., Cerella, E.G., Cukierman, A.L. Activación química del bagazo de caña de azúcar para la obtención de carbones activados. Avances en energía renovable y medio ambiente, 3(2): (1999). 41-44. [ Links ]
19. Bello G., R. Cid, R. García Y R. Arraigada. 1999. “Retention of Cr(VI) and Hg(II) in Eucalyptus globulus and Peach Stone-activated Carbons”. Journal of Chemical Technology and Biotechnology, 74: (1999). 9 904-910. [ Links ]
20. Biscoe, J., Warren, B. “An X-ray study of carbon black”. J. Appl. Phys 13: (1942). 364-371. [ Links ]
21. Jung, W., Ahn, K., Lee, Y., Kim, K., Rhee, J., Park, J., Paeng, K. “Adsorption characteristics of phenol and chlorophenols on granular activated carbons (GAC)”. Microchem. J. 70: (2001). 123-131. [ Links ]
22. Basso M., Cerella E. y Cukierman. A. Remoción de Cd (II) de soluciones acuosas mediante carbón activado preparado a partir de caña. Revista Argentina Avances en Energías Renovables y Medio Ambiente, (5): (2001). [ Links ]
23. Kadirvelu, K., Thamaraiselvi, K., Namasivayam, C. “Removal of heavy metals from industrial wastewaters by adsorption onto activated carbon prepared from an agricultural solid waste”. Bioresource Technology, 76: (2001). 63-65. [ Links ]
24. Aygün, A., Yenisoy-Karakas, S., Duman, I. “Production of granular activated carbon from fruit stones and nutshells and evaluation of their physical, chemical and adsorption properties”. Microporous and Mesoporous Materials, 66: (2003). 189-195. [ Links ]
25. Gaceta Oficial de la República de Venezuela Nº 5021. Extraordinario. Decreto 883: “Normas para la clasificación y el control de los cuerpos de agua y vertidos o efluentes líquidos” (1995). [ Links ]
26. Clair, N., Sawyer, P., Perkin, G. Química para Ingeniería Ambiental. McGraw-Hill (ed). México, (2000) 103-108. [ Links ]