Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
versión impresa ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia v.30 n.Especial Maracaibo nov. 2007
Anodic oxidation of NADH at surfactant-hydrotalcite-ferrocenedicarboxylic acid glassy carbon modified electrodes.
Isis Ledezma y Lenys Fernández*
Departamento de Química, Universidad Simón Bolívar. Apdo 89000, Caracas 1080-A, Venezuela. Tel.: +58-212-9063979; Fax: +58-212-9063961. *lfernandez@usb.ve
Abstract
We report on the electrochemical behavior of chemically modified glassy carbon (GC) electrodes by using surfactant/hydrotalcite (HT) films, incorporating ferrocenedicarboxylic acid (FDC) as redox mediators for NADH. The FDC retained in the films displayed two well-defined voltammetric peaks. They correspond to the redox process ferrocene/ferrocenium. The type of surfactants adsorbed have a pronounced effect on the FDC adsorption on the HT. The modified electrodes are found to give stable and reproducible electrocatalytic response to NADH and axhibit good stability.
Key words: Synthetic hydrotalcite-like clay, nicotinamide adenine-dinucleotide oxidation, clay-modified electrode.
Oxidación anódica de NADH sobre electrodos de carbón vítreo modificados con películas de surfactantes-hidrotalcita-ácido ferrocenodicarboxílico
Resumen
Se obtuvieron películas estables de ácido ferrocenodicarboxílico (FDC)-surfactantes-hidrotalcita (HT) sobre electrodos de carbón vítreo (CV), a partir de dispersiones acuosas de FDC y HT. El FDC retenido en las películas origina un par de ondas voltamétricas alrededor de 360 mV vs ECS, características del proceso redox ferroceno/ferroceniun. La adsorción del FDC sobre la HT esta influenciada por el tipo de surfactante utilizado: el SDBS favorece la solubilidad del FDC en las micelas en solución, cuando se utilizo TX100 se sugiere mayor solubilidad del FDC en las miscelas superficiales, mientras que en presencia de CPB la adsorción del FDC sobre el mineral se produce por atracción electrostática entre la carga negativa del FDC y la carga positiva del la HT, incrementada por la presencia del CPB en su estructura. Mediante análisis voltamétricos se encontró que estos electrodos son capaces de mediar la transferencia electrónica entre la coenzima nicotinamida adenín dinucleótido (NADH) y la superficie de CV, a través de una reacción catalítica entre esta coenzima y el FDC. Proceso a través del cual se diminuye el sobrepotencial de oxidación del NADH.
Palabras clave: Hidrotalcitas sintéticas, coenzima nicotinamida adenín dinucleótido, electrodo modificados con arcillas.
Recibido el 30 de Junio de 2006 En forma revisada el 30 de Julio de 2007
Introducción
Todas las reacciones químicas del metabolismo celular se realizan gracias a la acción de catalizadores o enzimas. Una enzima completa se denomina holoenzima, y está formada por una parte proteica (apoenzima) y un cofactor no proteico (coenzima): HOLOENZIMA = APOENZIMA + COENZIMA. Entre los cofactores que requieren las enzimas para su funcionamiento están las coenzimas: NADPH (nicotinamida adenina dinucleótido fosfato reducido), NAD (nicotinamida adenina dinucleótido), FAD (flavina adenina dinucleótido), piridoxal, biotina, tiamina, ácido tetra hidrofólico, cobalamina, etc. La NAD+ y la NADH son fundamentales para utilizar la energía metabólica de los alimentos. La regeneración electroquímica de este cofactor es extremadamente importante desde un punto de vista fundamental y de aplicaciones prácticas. Las aplicaciones tecnológicas de esta reacción incluye el desarrollo de biosensores para un gran numero de analitos y celdas biocombustibles [1, 2]. La oxidación electroquímica de esta coenzima ha sido objeto de mucho interés, debido a que su oxidación directa sobre electrodos convencionales solo es posible a altos sobrepontenciales, además de conducir a la desactivación de la superficie electródica. Así que es necesario el uso de mediadores redox entre el NADH y la superficie del electrodo, capaces de disminuir este sobrepotencial. La detección anódica de NADH se facilita vía mediadores electrocacatalíticos que en su actividad electrooxidante pierden un electrón, como por ejemplo el ferroceno y sus derivados [3-6], o dos electrones como fenoxacina, fenotiacina y nitrofluorenos [7-9]. Donde las ventajas del ferroceno y sus derivados como mediadores redox abarcan las siguientes características: sus reacciones redox no involucran intervención protónica así que no están influenciada por el pH, reacciones redox reversibles, se regenera a bajos sobrepotenciales, formas oxidadas y reducidas estables, no tóxicos e inertes al oxígeno, etc. Estas características los hacen muy adecuados para su incorporación en sistemas supramoleculares útiles como soportes sobre superficies electródicas. La bibliografía reporta una variedad de electrodos químicamente modificados, incluyendo polímetros conductores, que soportan mediadores redox para la oxidación de NADH, sin embargo recientemente el uso de materiales porosos [13] y silica [14, 15], se han vuelto increíblemente populares. En este estudio se reporta la electrooxidación del NADH utilizando un electrodo de carbón vítreo modificado con ácido ferrocenodicarboxílico, el cual previamente se coadsorbe junto con diferentes tipos de surfactantes, en la arcilla tipo hidrotalcita. En particular en nuestro laboratorio se ha demostrado [16-18] que la superficie de carbón vítreo puede ser ventajosamente modificada con suspensiones de surfactantes-hidrotalcita, formando películas con características útiles en el desarrollo de sensores para la detección de moléculas de interés biológico, tales como el ácido úrico y el ascórbico, y contaminantes orgánicos como los compuestos fenólicos. En la siguiente investigación hemos encontrado que este tipo de electrodo es capaz de incorporar de una forma muy estable el ácido ferrocenodicarboxílico, el cual media la trasferencia electrónica entre el NADH y la superficie del carbón vítreo.
Experimental
Reactivos
Los reactivos utilizados fueron: dodecilbencenosulfonato de sodio (SDBS) y el octilfenoxipolietoxietanol (TX100) marca Riedel-de Haëno; nitrato de aluminio nanohidratado (99%) y nitrato de cobalto hexahidratado de Hopkins & William; perclorato de sodio, hidróxido de litio y la sal disódica reducida hidratada de b-NADH de Sigma, bromuro de cetilpiridiniun (CPB), ácido clorhídrico, cloruro de sodio, sulfato de sodio, nitrato de sodio, ácido ferrocenodicarboxílico (96%) y fenol de Aldrich. Perclorato de tetrabutilamonio (TBAClO4) de Kodak. Todos los reactivos fueron utilizados como se recibieron. Las soluciones se prepararon usando agua desmineralizada filtrada a través de un filtro Milli-Q Reagent Water System a una resistencia mayor de 15 MW-cm.
Equipos
Los voltagramas fueron obtenidos en un potenciostato galvanostato de la EG&G Princeton Applied Research modelo 273A acoplado mediante una interface a una computadora con un sofware PAR-M270. Los experimentos fueron realizados en una celda de un compartimiento y tres electrodo, utilizando CV (0,28 cm2 y 3 cm2) como electrodo de trabajo, electrodo de calomel saturado (ECS) como referencia y platino como contraelectrodo. Las soluciones electrolíticas fueron purgadas con gas N2 antes de realizar los experimentos. Las medidas de pH se hicieron con un medidor de pH 26 RADIOMETER COPENHAGUE. Para los análisis de difracción de rayo-X se uso un difractometro de la Philip con una radiación Cu-la = 1.542 Å, 40 KV/20 mA a una velocidadde barrido de 30 min–1. Los espacios interlaminares fueron calculados usando la ecuación de Bragg, nl = 2d senq, donde n es un numero entero (1,2,3 ., n), l es la longitud de onda, d ladistancia entre los planos atómicos, y q el ángulode incidencia.
Procedimiento experimental
La arcilla HT fue sintetizada en el laboratorio siguiendo el método de coprecipitación. Una solución que contiene 25% de Al(NO3) y 75 % de Co(NO3) fue titulada con 1M de solución de NaOH para producir el precipitado de Co/Al-NO3. La solución fue purgada con gas N2 para desalojar el dióxido de carbono. El precipitado fue filtrado y secado por 24 h a 120°C. Se adicionó HT Co/Al-NO3 a soluciones de surfactantes, con una relación sólido/solución 1g por 50 mL (la cantidad de surfactante fue variada para obtener la isoterma de adsorción). Las suspensiones fueron sometidas a ultrasonido por 15 min para homogenizar las partículas, y agitadas a 40°C por 2 h. El nuevo material fue filtrado, enjuagado tres veces con agua destilada (5 mL de agua por gramo) y secado a 70°C por 45 min. La concentración de surfactante remanente en solución fue determinada por medidas de espectroscopia UV-Vis (a 223 nm, 364 nm y 276 nm, para el SDBS, CPB y TX100, respectivamente), basadas sobre una curvas de calibración estándar (adsortividades molares de 12,830; 18,56 y 32,87 L mol–1 para SDBS, CPB y TX100, respectivamente). La cantidad adsorbida de surfactante fue determinada por la siguiente ecuación: n= Vo(co– ceq)/m, donde n es la cantidad de surfactante adsorbida en mmol/g, ceq la concentración en equilibrio, co la concentración inicial en mmol/L, Vo volumen de la solución en L, y m es la cantidad de adsorbente en gramo. La desviación estándar de análisis por triplicado fue igual o menor a ± 3%. Por otro lado para la preparación de la hidrotalcita Co/Al-surfactante- FDC se siguió el mismo procedimiento anterior, diferenciándose en la presencia de FDC en la mezcla de solución. La concentración de surfactante remanente en solución fue determinada por medidas de espectroscopía UV-Vis (a 223 nm, 364 nm y 276 nm, para el SDBS, CPB y TX100, respectivamente), y la del FDC a 456 nm, basadas sobre una curvas de calibración estándar.
Los electrodos de CV fueron previamente pulidos, con suspensiones de alumina de diferente tamaño de grano (1,0 µm y 0,3 µm), sobre tela tipo mesa de billar, luego fueron sometido a ultrasonido, sumergiéndolos en solución 1:1 de metanol-agua por 5 min, para eliminar las partículas remanentes en la superficie. Las películas de surfactantes-HT fueron preparadas por goteo sobre la superficie del electrodo de CV de 20 µL de una dispersión acuosa de la sintetizadas organo- HT (preparadas mezclando Co/Al-NO3 HT + 0.9, 0.10, 0.15mMsolución de SOS, SDS, SDBS, CPB o TX100 respectivamente, con una relación de 1g por 50 mL de solución). Las suspensiones modificadoras fueron sometidas a ultrasonido inmediatamente antes de preparar las películas.
Resultados y discusión
Isotermas de adsorción
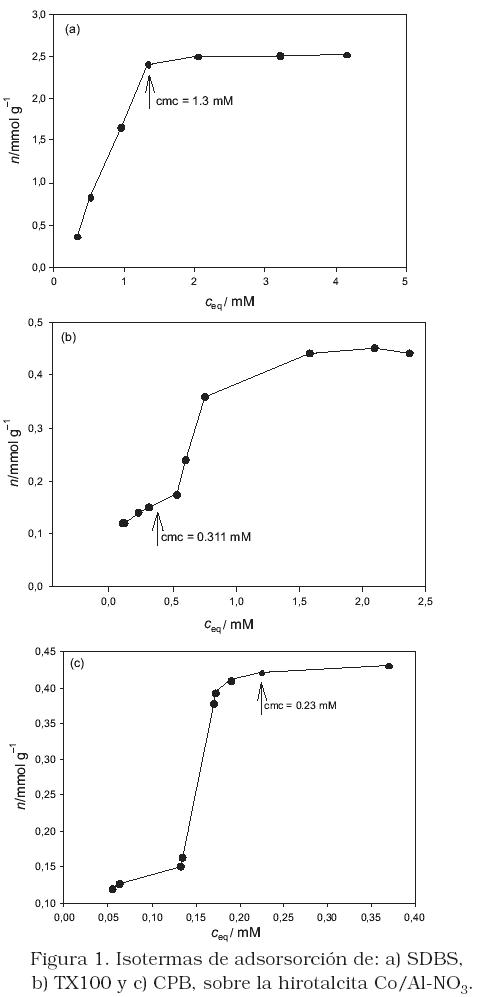
Las isotermas de adsorción para retención de los surfactantes por la HT se presentan en la Figura 1. De acuerdo a la clasificación de Giles y MacEwan [19], la isoterma para el SDBS es de forma "L", mientras que las isotermas para el TX10 y el CPB son de forma "S". Las isotermas en forma "L", son características cuando el adsorbato es fuertemente atraído por el adsorbente, generalmente por un mecanismo de intercambio iónico. El SDBS se adsorbe por intercambio de los aniones NO3– huésped en la HT por los aniones SDBS– en solución. Mientras que las isotermas de forma "S" (Figura1b-c), son indicativos de la formación de agregados miscelares en la interface. En el caso del TX100 (Figura1b), a bajas concentraciones de equilibrio, podría adsorberse por formación de puentes de hidrógeno entre los grupos éter de la cadena oxietilenica del surfactante y los grupos hidroxilos de la HT, para luego a altas concentraciones generar la formación de agregados superficiales por interacción entre las moléculas de surfactantes ya adsorbidas y las provenientes de la solución. En el caso del CPB (Figura 1c), la fuerza conductora de adsorción podría ser entre la superficie de la HT y la cadena hidrofóbica del surfactante, con disposición del grupo hidrofílico positivamente cargado hacia la superficie externa de la HT.
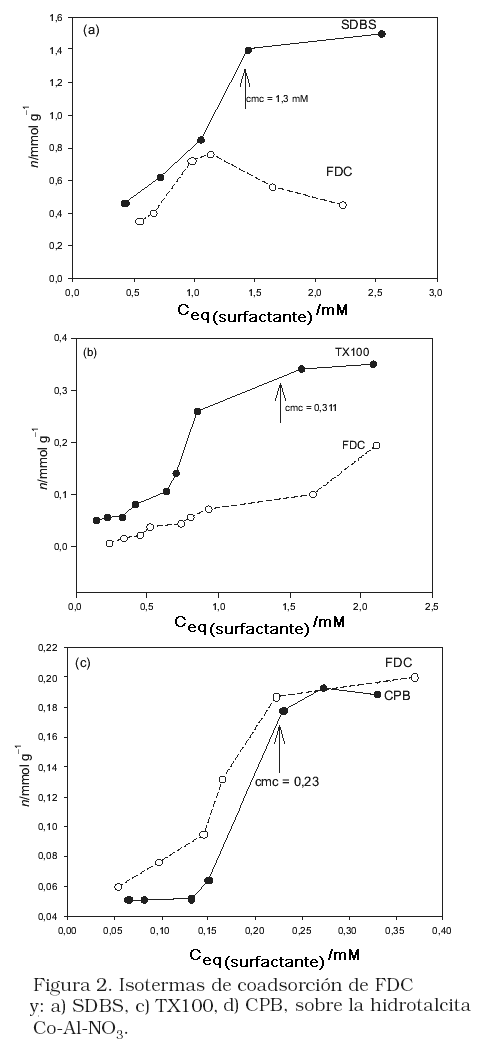
Las isotermas de coadsorción del SDBS y el FDC se muestran en la Figura 2a. A baja concentración de equilibrio del surfactante, se observa un aumento en la adsorción de ambas especies sobre la HT, lo que sugiere la coadsorción competitiva de FDC y SDBS por iguales sitios superficiales, ya que en esta región cuando el FDC esta presente se adsorbe menos cantidad de surfactante sobre la superficie de la HT. A valores mayores de la concentración micelar crítica (cmc), la cantidad adsorbida de surfactante alcaza un valor constante, mientras que la cantidad de FDC disminuye. Se conoce que después de la cmc, las miscelas crecen en solución, lo que produciría un incremento de la solubilidad del FDC en esa fase. De acuerdo a esto, la disminución de la cantidad adsorbida de FDC después del valor de cmc en esta isoterma, sugiere que esta especie es más afín a las micelas en solución que a las capas adsorbidas de surfactantes sobre la HT. Las isotermas de coadsorción del TX100 y el FDC se muestra en la Figura 2b, al inicio de la curva se observa un ligero aumento en la adsorción del surfactante con el aumento de la concentración de equilibrio, siendo la adsorción del FDC casi lineal en este rango de concentración. Como podemos observar, la forma de la curva de la isoterma del surfactante, no se ve afectada por la adición de FDC (Figuras 1b y 2b), lo que podría sugerir formación de agregados superficiales sobre el mineral. Por otro lado, la adsorción de FDC aumenta con el aumento de la concentración de equilibrio del surfactante, efecto que puede ser interpretado como la adsolubilización de las moléculas de FDC sobre los agregados superficiales. Debido a que pueden existir micelas tanto en solución como en la superficie del mineral, la coadsorción del FDC y el TX100 podría ser cinergética. La isoterma de coadsorción del CPB y el FDC se presenta en la Figura 2c. Al inicio de las curvas la adsorción del CPB se mantiene constante, mientras que aumenta la adsorción del FDC, lo que sugiere que en esta región el FDC se adsorbe preferiblemente sobre la HT, lo que era de esperar por la diferencia de carga. Con el incremento en la concentración de CPB en solución aumenta su adsorción en el mineral, lo que puede ser debido a la afinidad de las moléculas en solución con aquellas ya incorporadas en dicha superficie (las cuales tendrían una conformación que favorezca esta interacción). También se observa que la adsorción de FDC aumenta, pero comparando las curvas de las Figura 2b y Figura 2c, el aumento es mayor que en presencia de TX100. En este caso se puede ver favorecida la adsorción del FDC, debido a un mecanismo electrostático entre esta especie y la HT positivamente carga, cuya densidad de carga positiva ha aumentado por la incorporación del CPB en la HT.
Análisis por difracción de rayos-X
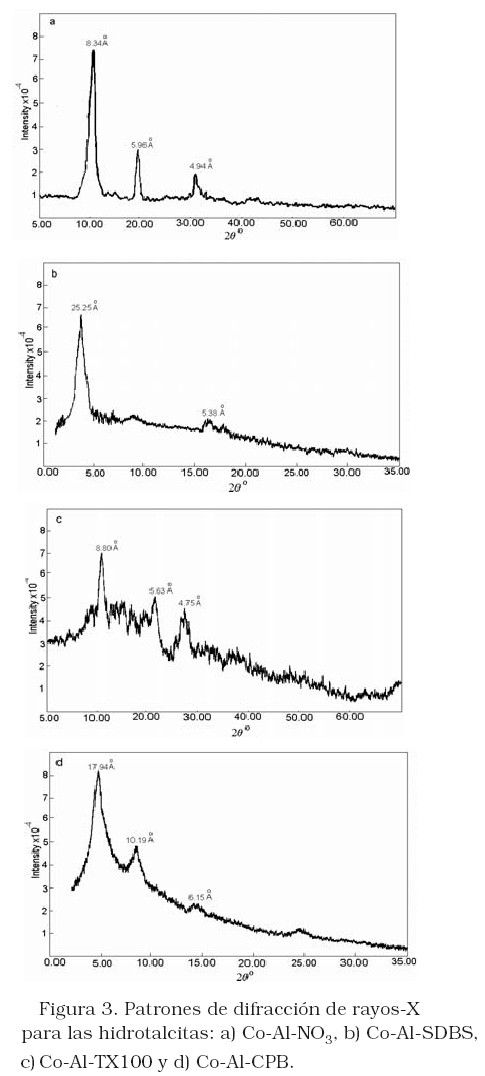
La Figura 3 muestra los patrones de difracción de rayos-X para los materiales Co/Al-NO3, Co/Al-SDBS, Co/Al-CPB y Co/Al-TX100, preparados utilizando cantidades de surfactantes cerca del valor de la cmc. El difractograma para el material precursor Co/Al-NO3 (Figura 3a), muestra el típico patrón de la HT [20], el cual consiste de tres líneas de reflexión a 2q = 10°, 25°, 85° y33°, 94° debido a la reflexión de los planos basales 003, 006 y 009, respectivamente. Se encontró que el valor para la distancia interplanar (dL) fue 8,34 Å (Figura 2a), valor que concuerda con resultados reportados en la literatura [21]. La presencia de SDBS en la HT expande la distancia interplanar a 25,25 Å (figura 3b), sugiriendo formación perpendicular de monocapas de aniones SDBS intercalados en la estructura de la HT [22]. No se encontró gran cambio en el valor experimental dL en presencia de TX100, 8,80 Å (Figura 3c), lo que sugiere que este surfactante no se intercambia por los iones nitratos en la estructura de la HT, así que únicamente la superficie externa de la arcilla es capas de adsorberlo. Mientras que en presencia de CPB el dL se expande a 17.94 Å (Figura 3d), sugiriendo que este surfactante también podría intercalarse en las intercapas de la HT.
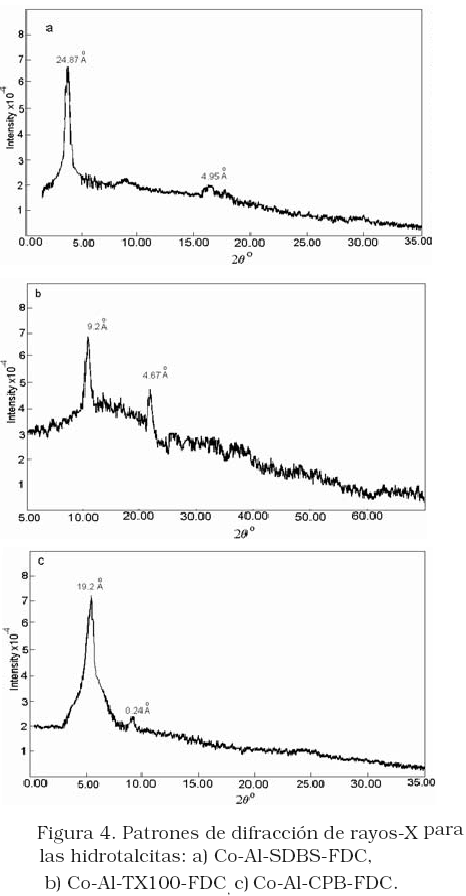
Los análisis por difracción de rayos-X para los materiales modificados, ahora en presencia FDC se muestran en la Figura 4. Los resultados indican que no hay un gran cambio en dL para el Co-Al-SDBS en presencia del FDC (Figura 4a), para el Co-Al-TX100 cambia de 8,88 Å a 9,2Å (Figura 4b), mientras que para el Co/Al-CPB dL se expande ligeramente de 17,94 a 19,2 Å (Figura 3c). Como se ha demostrado experimentalmente el valor del dL para el material precursor es de de 8,34 Å, el ferroceno tiene aproximadamente una forma cúbica de 4,1 Å, una distancia entre los anillos de 3,3 Å [23]. Lo que sugiere que el FDC no debería expandir el dL del material precursor. El hecho que no se expandan los dL de los materiales Co/Al-SDBS y Co/Al-CPB, en presencia del FDC no descarta la interacción de este último con las intercapas del HT, debido a que la expansión que producen estos surfactantes es mucho mayor que la que puede producir el FDC. Por otro lado, si la presencia de FDC no expande el dL del material modificado Co/Al-TX100, sugiere que efectivamente el TX100 no sustituye los aniones nitratos, y solo se adsorbe en la superficie externa.
Comportamiento electroquímico de los electrodos modificados
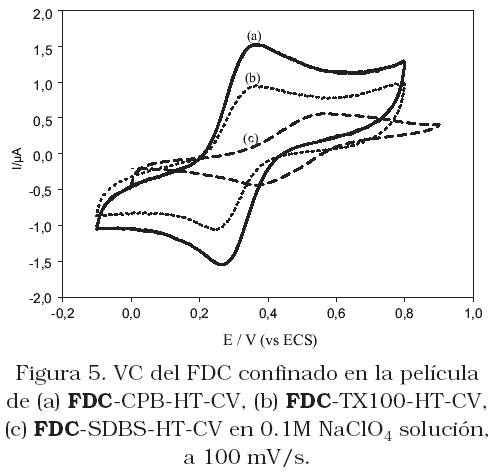
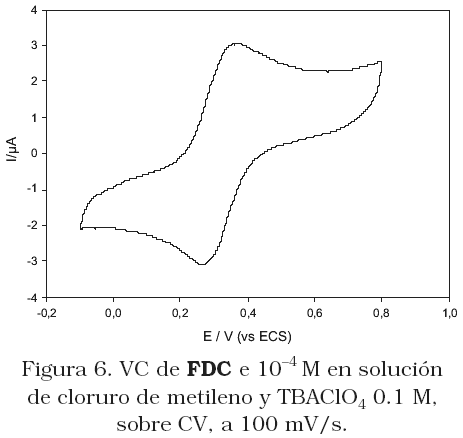
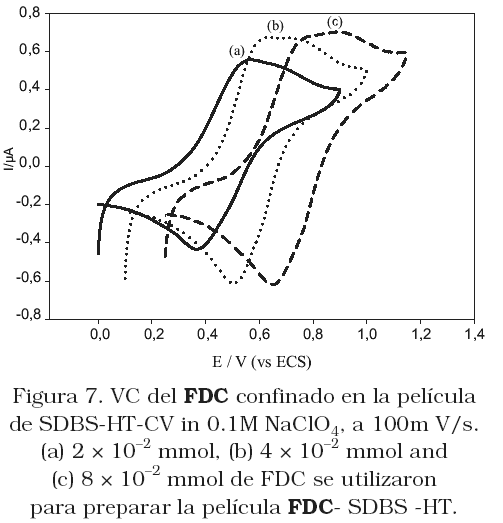
La Figura 5 muestra las voltametrías cíclicas (CVs) de los electrodos FDC-surfactantes- HT-CV en solución 0.1M de LiClO4, y la Figura 6 el comportamiento del FDC en solución de CH2Cl2/TBAClO4. Comparando estas dos figuras, observamos que en ambos casos las VCs muestran dos ondas de oxidación/reducción bien definidas, las cuales corresponden al proceso redox ferroceno/ferrocenium (Fc « Fc+ + 1e–). Considerando la baja solubilidad de los derivados del ferroceno en agua, las ondas voltamétricas observadas en la Figura 5, evidentemente corresponden al proceso redox del FDC, retenido en la película. La VC obtenida para el FDC retenido en la película de SDBS-HT-CV (Figura 5c) muestra corriente de pico de oxidación menor y potencial de pico a valores más positivos, comparado al comportamiento cuando el CPB esta presente en el electrodo (Figura 5a). Cuando el surfactante utilizado fue el TX100 (Figura 5b), se obtiene un valor de corriente entre los dos valores anteriores, y el valor de potencial de pico coincide con el obtenido sobre el electrodo CPB-HT-CV. Estos resultados conducen a pensar que los surfactantes catiónicos realmente incrementan la densidad de carga positiva de la arcilla, y como consecuencia la cantidad de FDC en la película, representada por el mayor valor de corriente que se obtuvo sobre este electrodo. Cuando el surfactantes en la película es el SDBS, el cual está cargado negativamente, este compite con el FDC por los sitios positivos de la HT. Lo que es evidente a partir de la isoterma de adsorción presentada en la Figura 1a. El cambio en potencial de pico a valores más positivos, podría relacionarse con las interacciones repulsivas de las dos especies cargadas negativamente lo que origina una lenta transferencia electrónica. Este resultado se sustenta por el hecho que sobre el electrodo modificado FDC-SDBS-HT-CV, el potencial de pico se desplaza a valores más positivos con el aumento en la cantidad de FDC para preparar la solución modificadora (Figura 7). A bajas concentraciones de FDC, las interacciones entre el FDC y el SDBS son débiles, originando que el potencial de pico se desplace a potenciales menos negativos, por el contrario cuando aumenta la cantidad de FDC en la película prevalecen las repulsiones electrostáticas entre las especies, y el potencial se desplaza a valores positivos. Si el surfactante en el interior de la película es no iónico, como es el caso de TX100, este no cambia la densidad de carga de la HT, ni compite con el FDC por los sitios positivos.
Los electrodos modificados mostraron buena estabilidad, ya que luego de 30 cíclos voltamétricos consecutivos, la respuesta no cambia, aun después de 800 cíclos de uso. Estos fueron almacenados por un mes en un desecador, y una vez probados nuevamente mantuvieron su respuesta voltamétrica.
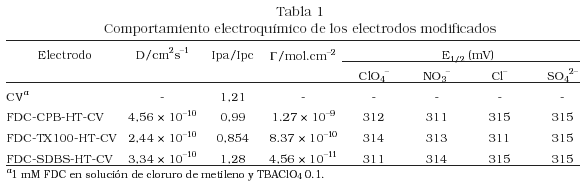
Las corrientes de pico (Ip), el coeficiente de difusión (D), el potencial de pico medio (E1/2 = Epa+Epc /2) y la concentración superficial de especie electroactiva, G, para el FDC retenido en los diferenteselectrodos, se reportan en la Tabla1. Las corrientes de pico fueron proporcionales a la raíz cuadrada de la velocidad de barrido, lo que indica que el proceso de oxidación del FDC dentro de estas películas está controlado por difusión (Gráficas no mostradas). El valor aparente del D, obtenido a través de la ecuación de Randles-Sevcik [24], fue mucho menor comparado con el obtenido en solución (10–6 cm2s–1), sugiriendo la difusión más lenta de la especie electroactiva en el interior de las películas comparada a cuando se encuentra en solución. Los cálculos de G muestran, que el valor de G para el FDC retenido en las películas deCPB-HT y TX100-HT, son mayores que el obtenido sobre la película SDBS-HT-CV, lo que confirma que sobre las primeras películas se retienen mayor cantidad de la especie electroactiva. Por otro lado, en la tabla se muestra que el E1/2 no dependen de la naturaleza del anión del electrolito soporte, sugiriendo que estos aniones pueden difundir libremente a través de la interfase electrodo/ solución y no interfieren con el proceso redox que se lleva a cabo dentro de la película.
Oxidación de NADH sobre los electrodos modificados
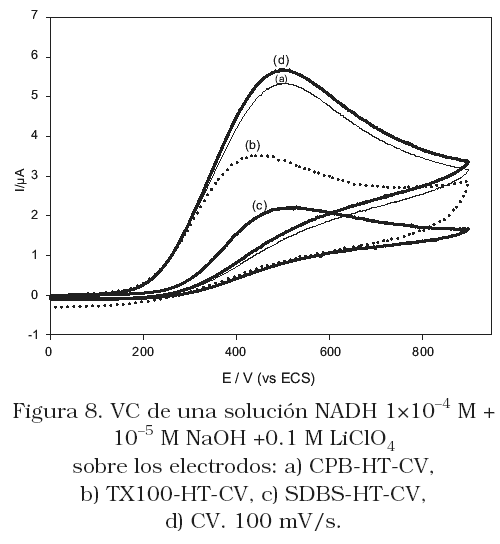
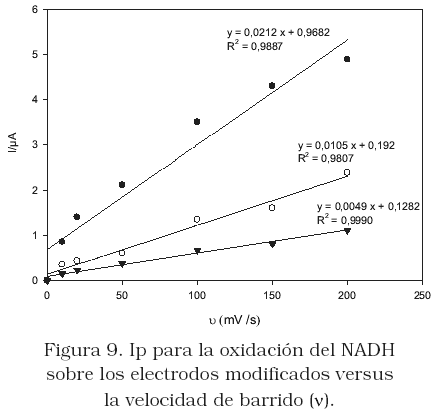
En la Figura 8, se muestra que la corriente de pico de oxidación del NADH sobre el electrodo CPB-HT-CV (Figura 8a), es aproximada a la obtenida sobre CV (Figura 8d), mientras sobre los electrodos TX100-HT-CV (Figura 8b) y SDBS-HT-CV (Figura 8c) la corriente es menor. Sobre los tres electrodos modificados se diagnostica un comportamiento de adsorción (Figura 9). La mayor corriente de oxidación sobre el electrodo CPB-HT-CV puede estar relacionada con el mayor carácter hidrofílico inducida sobre la superficie del electrodo por la presencia del CPB. El agua de hidratación de la película CPB-HT confiere a la superficie del electrodo un mayor contacto con la solución que contiene al NADH y como consecuencia se favorece la mayor interacción con la superficie del electrodo por polarización de los electrones P, lo que ocurre cuando eladsorbente contiene núcleos aromáticos con este tipo de electrones y el sustrato una alta densidad de sitios activos positivos. La menor corriente obtenida sobre el electrodo SDBS-HT-CV puede deberse a la hidrofobicidad inducida por estos surfactantes a la superficie del electrodo, mientras que el TX100 se adsorbe superficialmente sobre la arcilla, también confiriéndole cierta hidrofobicidad superficial. Por otro lado, sobre el electrodo TX100-HT-CV se observa además, un desplazamiento de potencial a valores menos positivo, por lo que podría pensarse que sobre este electrodo se ve favorecida la oxidación del NADH. Comportamiento para el cual no se tiene claro, hasta los momentos, una explicación.
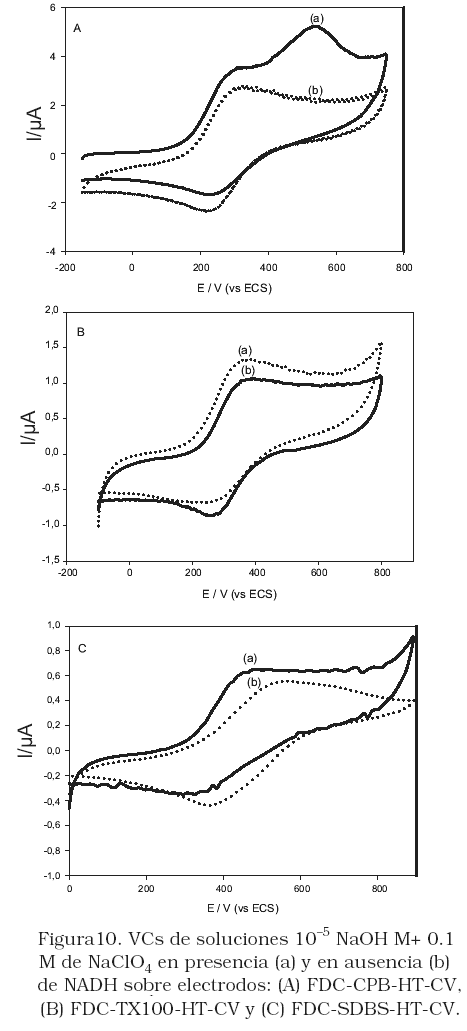
Se ha demostrado que la detección anódica del NADH se facilita por medio del ferroceno y sus derivados como mediadores electrocatalíticos [3]. La Figura 10, muestra las respuestas voltamétricas de los electrodos FDC-CPB-HT-CV (A), FDC-TX100-HT-CV (B) y FDC-SDBS-HT-CV(C) en soluciones 10–5 NaOH M+ 0.1 M de NaClO4 en presencia (a) y en ausencia (b) de NADH. Sobre el FDC-TX100-HT-CV (B) y FDC-SDBS-HT-CV (C), en presencia de NADH, la corriente de pico anódica correspondiente a la especie FDC en la película aumenta y el pico catódico disminuye, característica que corresponde al proceso catalítico que involucra la reacción entre la especie oxidada que se forma del FDC y el NADH proveniente de la solución. Se encontró que la eficiencia electrocatalítica, definida como el cociente entre la corriente de pico en presencia (Ic) y en ausencia (Ib) del NADH, es similar para ambos electrodo: 1,30; 1,25 y 1,20; sobre FDC-CPB-HT-CV, FDC- TX100-HTCV y FDC-SDBS-HT-CV, respectivamente.
Sobre el electrodo FDC-CPB-HT-CV (Figura 10A) la oxidación del NAHD muestra dos ondas, la primera a 324 mV corresponde a la oxidación del FDC en la película mientras que la segunda a 546 mV se relaciona a la oxidación del NAHD, ya que el potencial de pico de la ultima onda anódica concuerda con el obtenido en la misma solución sobre el electrodo CPB-HT-CV sin FDC en la estructura de la HT (Figura 8a). Sin embargo la corriente de pico anódica correspondiente al FDC en la película aumenta en presencia del NADH mientras que el pico catódico disminuye, lo que sugiere nuevamente la participación electrocatalítica del FDC sobre este tipo de electrodo para la oxidación del NAHD. Siendo la eficiencia electrocatalítica similar a los otros electrodos modificados. De acuerdo a este comportamiento voltamétrico, se puede asumir que el NAHD interactúa fuertemente con la densidad de carga positiva sobre la película de CPB-HT, y que en presencia del FDC dicha carga persiste, pero también interactúa con el FDC presente en este mismo electrodo, presentándose además el comportamiento electrocatalítico del FDC en la oxidación del NAHD.
Conclusión
Se obtuvieron películas estables de ácido ferrocenocarboxílico (FDC)-surfactantes-hidrotalcita (HT) sobre electrodos de carbón vítreo (CV), a partir de dispersiones acuosas de FDC y HT. El FDC en películas ejerce un poder catalítico que involucra la reacción entre la especie oxidada que se forma del FDC y el NADH proveniente de la solución. Aunque los derivados de ferroceno usualmente son considerados menos eficientes como mediadores redox en la oxidación de NADH, la combinación de sus propiedades catalíticas, con las características especiales de las películas surfactantes-HT, podría ofrecer una interesante y fácil alternativa para la fabricación de biosensores para este analito.
Agradecimientos
Se agradece a la Universidad Simón Bolívar (USB) a través del Decanato de Investigación y Desarrollo por el soporte financiero, y al Laboratorio de Electroquímica de la USB por valioso soporte técnico.
Referencias Bibliográficas
1. Bartlett P. N., Tebbutt P., Whitaker R. G.: "Kinetic aspects of the use of modified electrodes and mediators in bioelectrochemistry, Prog. React. Kinet. Vol. 16 (1991)55-155.
2. E. Simon, P.N. Bartlett, in: J.F. Rusling(Ed), Biomolecular Films: Design, Function and Applications, Marcel Dekker, New York.
3. Carlson B. W. and Miller L. L.:"Oxidation of NADH by ferrocenium salts. Rate-limiting one-electron transfer". J. Am.Chem. Soc., Vol. 105 (1983) 7453-7454.
4. Carlson B. W. and Miller L.L.: "Oxidation of NADH involving rate-limiting one-electron transfer ". J. Am. Chem. Soc., Vol. 106 (1984) 7233-7239.
5. Matsue T., Suda M., Uchida I., Kato T., Akiba U. and Osa T.: "Electrocatalytic oxidation of NADH by ferrocene derivatives and the influence of cyclodextrin complexation". J. Electroanal. Chem., Vol. 234 (1987) 163-173.
6. Pessoa C.A., Gushikem Y. and Kubota L. T.: "Ferrocenecarboxylic acid adsorbed on Nb2O5 film grafted on a SiO2 surface: NADH oxidation study". Electrochim. Acta, Vol. 46 (2001) 2499-2505.
7. Jaegfeldt H., Torstensson A.B.C., Gordon L. and Johansson G.: "Catalytic oxidation of reduced nicotinamide adenine dinucleotide by graphite electrodes modified with adsorbed aromatics containing catechol functionalities". Anal. Chem.,Vol.53 (1981) 1979-1982.
8. L. Gordon and L. Gardon: "Chemical modified electrodes for the electrocatalytic oxidation of nicotinamide coenzyme". J. Chem. Soc. Faraday Trans. 82(1986) 1245-1258.
9. C. Ramírez- Molina, M. Boujtita and N. El Murr: "A carbon paste electrode modified by entrapped toluidine blue-O for amperometric determination of L-lactate". Anal. Chim. 401(1996) 155-152.
10. Vijayakumar A. R., Csöregi E., Séller A. and Gordon L.: "Alcohol biosensors based on coupled oxidase-peroxidase systems". Anal. Chim. Acta, Vol. 327 (1996) 223-234.
11. Wang J. and Pamidi P.V.A.: "Sol-Gel-Derived Gold Composite Electrodes". Anal. Chem., Vol. 69 (1997) 4490-4494.
12. Wang, Pamidi J. P.V.A. and Jiang M.: "Lowpotential stable detection of b-NADH at solgel derived carbon composite electrodes". Anal Chim. Acta, Vol. 360 (1998) 171-178.
13. S. Serban and N. El Murr: "Use of ferricinium exchanged zeolite for mediator stabilization and analytical performance enhancement of oxidase-base carbon paste biosensor". Anal. Lett. Vol. 36 (2003) 1739-1753.
14. Kubota L. T. and Gushikem Y.:"Cyclic voltammetric study of [Fe(CN)6]3-/4- immobilized on silica gel surface coated with titanium( IV) oxide" Electrochim. Acta, Vol. 37 (1992) 2477-2480.
15. A.Walcarius:"Analytical applications of silicamodified electrodes-a comprehensive review". Electroanalysis, Vol. 10(1998) 1217-1235.
16. Carrero H. and León L.: "Electrochemically active films of negatively charged molecules, surfactant and synthetic clays". Electrochemical Communication, Vol. 3 (2001) 417-420.
17. Fernández L. and Carrero H.: "Electrochemical evaluation of ferrocene carboxylic acids confined on surfactant-clay modified glassy carbon electrodes: oxidation of ascorbic acid and uric acid". Electrochimica Acta, Vol. 50 (2005) 1233-1240.
18. Fernández L., Borrás C. and Carrero H.: "Electrochemical behavior of phenol in alkaline media at hydrotalcite-like clay/anionic surfactants/glassy carbon modified electrode". Electrochimica Acta, Vol. 52 (2006), 872-884.
19. Giles C.H., MacEwan T.H., Nakhwa S.N. and Smith D.: "Studies in adsorption:Part XI. A system of classification of solution adsorption isotherms, and its use in diagnosis of adsorption mechanisms and in measurement of specific surface area of solids". J. Chem. Soc. 111 (1960) 3973-3993.
20. Meyn M., Beneke K. and Lagaky G.: "Anion-exchange reactions of layered double hydroxides". Inorg. Chem., Vol. 29(1990) 5201-5207.
21. Itaya K., Chang H. C. and Uchida I.: "Anion- exchanged clay (hydrotalcite-like compounds) modified electrodes". Inorg. Chem., Vol. 26 (1987) 624-626.
22. You Y., Zhao H. and Vance G. F.: "Surfactant-enhanced adsorption of organic compounds by layered double hydroxides". Colloids and Surface A: Physicochem. Eng. Aspects, Vol. 205 (2002)161-172.
23. Swearingen C.,Wu J., Stucki J. and Fitch A.: "Use of ferrocenyl surfactants of varying chain lengths to study electron transfer reactions in native montmorillonite clay". Environ. Sci. Technol., Vol.38 (2004) 5598-5603.
24. Nicholson R. S.: "Theory and Application of Cyclic Voltammetry for Measurement of Electrode Reaction Kinetics". Anal. Chem. 37 (1965) 13451-1355.