Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
versión impresa ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia v.33 n.2 Maracaibo ago. 2010
Optimization of shrimp waste fermentation by Kocuria rosea to obtain a protein hydrolysate
Annalisse Bertsch1*, Isabel Díaz2, Nereida Coello1
1Laboratorio de Biotecnología Agroindustrial, Instituto de Química y Tecnología, Facultad de Agronomía, Universidad Central de Venezuela, Apdo. postal 4579. Maracay 2101A, Venezuela.
2Facultad de Ingeniería, Universidad Central de Venezuela, Núcleo Cagua. Venezuela. * bertscha@gmail.com . Telf.0243-5507304/Telf-Fax.0243-5507303- 2465360.
Abstract
This assay was carried out to obtain a protein hydrolysate by optimization of culture conditions (pH, substrate concentration and temperature) for degrading the shrimp waste by Kocuria rosea using response surface methodology (MSR). The results of regression analysis showed that optimal culture conditions were substrate 138g/L; pH 7.57 and 38°C in 24 hours. The comparison between the optimized and non optimized fermentation process evidenced an increasing in 71%, 64%, 43% and 60% the concentration of soluble protein (mg/100mL), proteolytic activity (U/mL), N-acetyl-glucosamine (g/L) and chitinolytic activity (U/mL), respectively. The optimized culture broth was dehydrated and grounded to obtain protein hydrolysate (HP). This was composed by true protein (62.5%) with 94% in vitro digestibility, fat, ash and reducing sugars from chitin degradation. True protein content was improved in 36% respect to shrimp waste unfermented (HDC). This biotechnological process is a harmonious way with the ambient to revalorization of shrimp waste like feedstock.
Key words: Shrimp waste, Kocuria rosea, fermentation, protein hydrolysate.
Optimización de la fermentación mediante Kocuria rosea de los desechos del procesamiento de camarones para la obtención de un hidrolizado proteico
Resumen
El presente trabajo tuvo por finalidad obtener un hidrolizado proteico al optimizar las condiciones de cultivo (pH, concentración sustrato y temperatura) para degradar los desechos de camarones con Kocuria rosea utilizando la metodología de Superficie de Respuesta. Los resultados del análisis de regresión en la Superficie de Respuesta mostraron que las condiciones óptimas de cultivo fueron pH: 7,57; 38°C y 139 g/L sustrato en 24 horas. La comparación entre los procesos de fermentación en condiciones optimizadas y sin optimizar, evidenció el incremento en 71%, 64%, 43% y 60% en la cantidad de proteína soluble, actividad proteolítica, N-acetilglucosamina y actividad quitinolítica, respectivamente. El caldo de fermentación así producido fue deshidratado y molido para obtener el hidrolizado proteico. Este principalmente contenía proteína verdadera (62,5%) la cual fue 36% superior a la materia prima original, con una digestibilidad “in vitro “de 94% además de grasa, sales minerales y azúcares reductores, estos últimos provenientes de la degradación de la quitina. Este proceso biotecnológico permite de manera armoniosa con el ambiente revalorizar los desechos de camarones para su uso en la alimentación animal.
Palabras clave: Desechos camarones, Kocuria rosea, Fermentación, hidrolizado proteico.
Recibido el 23 de Marzo de 2009
En forma revisada el 15 de Marzo de 2010
Introducción
Los sistemas de producción animal requieren la utilización de ingredientes alternativos disponibles, de bajo costo y con una adecuada calidad nutricional para la formulación de las dietas de los animales. Por ello, actualmente se lleva a cabo la evaluación de los subproductos y desechos originados por la agroindustria para obtener sustitutos de las fuentes convencionales de proteína (soya y harina de pescado, entre otras). El uso de tales residuos permitiría a escala mundial disminuir su acumulación, así como los problemas de manejo y disposición en beneficio de la calidad del ambiente [1, 2].
En Venezuela, es de gran importancia la industria camaronera ya que representa cerca del 55% de la acuicultura nacional. En dicha actividad entre el 40 y el 45% del peso del animal (cabezas, vísceras y exoesqueletos) es desechado durante su procesamiento [3]. Esto permite estimar que de 44.680 Tm de camarones producidos para el año 2006, la disponibilidad de tales residuos fue de 18.989 Tm [4]. Estos residuos están principalmente compuestos por proteína (40%-50%), quitina (10%-15%), sales minerales (15%-20%) y pigmentos carotenoides unidos íntimamente en un complejo insoluble donde la presencia de quitina (exoesqueletos) disminuye su valor nutricional [5-8]. Actualmente, el aprovechamiento de este desecho para la obtención de productos de mayor valor agregado se fundamenta en la separación de sus componentes mediante el uso de grandes cantidades de HCl y NaOH para su desmineralización y desproteinización. Este proceso es ambientalmente agresivo ya que conlleva problemas para la disposición de la gran cantidad de agua requerida para su remoción. En adición, el valor nutricional de la proteína es afectado por dicho tratamiento [9, 10].
La búsqueda de alternativas que permitan la utilización de estos residuos en resguardo del ambiente y el mejoramiento de sus propiedades nutricionales, ha conducido a la aplicación de métodos biotecnológicos. Se ha reportado el uso de enzimas proteolíticas comerciales para separar sus componentes, manteniendo en el proceso la desmineralización de la muestra con HC1 para obtener hidrolizados proteicos; así como el ensilado con bacterias ácido-lácticas [11-13].
La bacteria Kocuria rosea (LPB-3) ha sido aislada en Venezuela y estudiada por su capacidad de excretar enzimas proteolíticas que le permiten hidrolizar la queratina de las plumas para producir hidrolizados proteicos además de pigmentos carotenoides [15]. El estudio de la bioconversión por Kocuria rosea requiere el establecimiento y optimización de las condiciones de cultivo. En este orden de ideas, el presente trabajo plantea optimizar las condiciones de cultivo de la bacteria Kocuria rosea en fermentación sumergida, utilizando los desechos de camarones como fuente de carbono y energía para la obtención y caracterización preliminar de un bio-hidrolizado proteico destinado a la alimentación animal, como estrategia para revalorizar desechos agroindustriales.
Materiales y Métodos
Microorganismo y sustrato de fermentación
Se utilizó la cepa LPB-3 de Kocuria rosea aislada en el laboratorio de Procesos Biotecnológicos del Instituto de Biología Experimental de la UCV [15]. Los desechos de camarones (cabezas y caparazones) fueron donados por una empresa procesadora de camarones en Cumaná, Edo. Sucre. Estos desechos se utilizaron en forma de harina (HDC) al ser deshidratados en un secador de bandejas a 60°C y molidos en un molino de martillo.
Medio de fermentación y condiciones de cultivo
El medio usado en el precultivo y en los cultivos sin optimizar contenía por litro: 70 g de HDC, 0,5 g de NH4Cl (Riedel de Haën), 0,5 g de NaCl (Merck), 0,3 g de K2HPO4(Riedel de Haën), 0,4 g de KH2PO4(Riedel de Haën), 0,1 g de MgCl2.6H2O (Sigma) y 0,1 g de extracto de levadura (Difco-Bacto). Los precultivos se llevaron a cabo en fiolas con baffles con un volumen de 40 mL a 40°C, 90 rpm y pH 7,5 durante 24 horas [15].
Determinaciones analíticas
Durante las fermentaciones se tomaron muestras del caldo, las cuales fueron filtradas con el fin de eliminar los restos del sustrato que no habían sido degradados. El filtrado remanente fue centrifugado a 6.000 rpm en una centrífuga Beckman GS-15R a 5°C y el sobrenadante fue utilizado en los análisis siguientes:
a. Proteína soluble: se empleó el método de Bradford [16] usando el reactivo BioRad y la albúmina sérica de bovino como estándar.
b. N-acetil-glucosamina (N-AcGluc): mediante el método espectrofotométrico conocido como Somogyi y Nelson [17].
c. Actividad proteolítica: Se realizó por el método de Kunitz [18]. Se incubó el caldo con caseína (SIGMA®) al 4% (p/v) a pH 10 y 40°C por 20 minutos. Se adicionó 0,5 mL de ácido tricloroacético al 5% (p/v) y se centrifugó. Una unidad de actividad enzimática fue definida por el incremento de una unidad de Absorbancia a 280 nm en el sobrenadante (Shimadzu UV2101PC, Tokyo, Japón) a 20°C.
d. Actividad quitinolítica: Se incubó 0,15 mL de caldo con 0,1mL de quitina coloidal al 1% (p/v) (Monreal y Reese, 1969). Se adicionó 0,1 mL de NaOH al 1% (p/v) y la mezcla fue centrifugada. Se estimó la cantidad de N-AcGluc en el sobrenadante mediante el método de Somogyi-Nelson. Una unidad de actividad enzimática fue aquélla capaz de producir 1 micromol de N-AcGluc en 1 hora a 20°C [19, 20].
Optimización de las condiciones de cultivo
Se aplicó la metodología de Superficie de Respuesta (MSR). Se consideraron las variables independientes: pH (X1), concentración del sustrato (X2) y temperatura (X3). Como variable dependiente la concentración de proteína soluble (Y1) en el caldo, por representar un indicador de la degradación de la fracción proteica. Se planteó un modelo polinomial de segundo orden en tres variables para describir la respuesta de interés, cuya ecuación se representa por:
Y = bo + b1 x 1 + b2x2 + b3x3 + b12..x1 x2 + b13.x1x3+ b23.x2x3 + b11.x12+ b22.x22 +b33.x32 (1)
El análisis de regresión para estimar los coeficientes del polinomio planteado se realizó mediante la aplicación de un “Diseño Compuesto Central Ortogonal”. Este contempló 17 tratamientos distribuidos de la siguiente forma: 8 corresponden a un factorial (23) con niveles –1,1; 6 puntos estrellas con niveles de a ± 1,3531 y 3 replicaciones del punto central o condiciones sin optimizar (Tabla 1) [21].
Se utilizó el análisis Ridge para explorar la superficie en búsqueda de un mejoramiento de los resultados. Los datos a través del diseño seleccionado fueron analizados mediante regresión múltiple y el análisis de varianza (ANAVAR) utilizando el SYSTAT 7.0.
Obtención y caracterización del hidrolizado proteico
El hidrolizado proteico (HP) se obtuvo en forma de harina a partir del caldo de fermentación luego de filtrarlo, pasteurizarlo (90°C × 10 min) en un tanque de doble camisa y deshidratarlo en un secador de bandejas (60°C × 24 horas). El residuo sólido no degradado (HDCSD) retenido en el filtrado fue lavado, secado a 105°C por 12 horas y pesado. La diferencia entre el resultado anterior con respecto al total de sustrato usado en el cultivo, permitió obtener el porcentaje de sustrato degradado.
El HP, HDC y HDCSD fueron caracterizados en cuanto a su composición físico-química: humedad; proteína total, proteína verdadera, grasa, cenizas, calcio, fósforo, quitina y azúcares reductores [22, 12]. Al HP se le determinó la digestibilidad in vitro de sus proteínas y su contenido de lisina disponible [23, 24].
Resultados y discusión
Optimización de las condiciones de cultivo mediante la MSR
El análisis estadístico reveló que la concentración de desechos de camarones (X2) fue el factor de principal influencia sobre la cantidad de proteína presente en el caldo, luego de 30 horas de fermentación. Mientras que la influencia del pH (X1) y la temperatura (X3) resultaron de menor relevancia (Tabla 2).
Una vez obtenido el polinomio ajustado a los datos para la variable dependiente, se procedió a estudiar la superficie de respuesta con la finalidad de establecer las condiciones “óptimas” para solubilizar la proteína (Y1) durante la degradación. Las gráficas de superficies (Figura 1A y 1B) mostraron la tendencia a aumentar su concentración en el caldo, a medida que se incrementa la cantidad de desechos de camarones en el medio, lo cual puede estar relacionado con una mayor excreción de enzimas debido al efector inductor del sustrato.
El punto estacionario fue un punto de silla, tal como se puede observar por los distintos signos de los coeficientes de regresión (Tabla 2). La exploración de la superficie alrededor del punto central a través del análisis Ridge permitió estimar que el valor más elevado de la proteína dentro de los límites de la región estudiada consistió en 148 mg/100 mL a pH: 7,57 utilizando 139 g/L de sustrato en el medio de cultivo y 38,3°C de temperatura durante la fermentación [7].
Comparación de las cinéticas de fermentación optimizada y sin optimizar
Los cambios ocurridos en el proceso de fermentación optimizando y sin optimizar, permitieron evidenciar que los niveles de proteína soluble se incrementan en el caldo con el transcurso de los días. La cantidad de proteína en el caldo optimizado resultó ser un valor 71% superior respecto al encontrado en el caldo no optimizado al cabo de 24 horas (Figura 2A).
Tabla 1. Diseño del compuesto central ortogonal
| Factorial | X1 | X2 | X3 |
| 6,5 | 35 | 32,6 | |
| 6,5 | 105 | 32,6 | |
| 8,5 | 35 | 32,6 | |
| 8,5 | 105 | 32,6 | |
| 6,5 | 35 | 47,4 | |
| 6,5 | 105 | 47,4 | |
| 8,5 | 35 | 47,4 | |
| 8,5 | 105 | 47,4 | |
| Puntos Estrellas | 5,15 | 70 | 40 |
| 9,85 | 70 | 40 | |
| 7,5 | 70 | 40 | |
| 7,5 | 70 | 40 | |
| 7,5 | 70 | 30 | |
| 7,5 | 70 | 50 | |
| Puntos Centrales | 7,5 | 70 | 40 |
| 7,5 | 70 | 40 | |
| 7,5 | 70 | 40 |
X1= pH. X2= Desechos de camarón (g/L). X3=Temperatura (°C). Y1= Concentración de proteína soluble (mg/100mL).
Tabla 2. Coeficientes estimados del modelo polinómico determinado para la variable proteína soluble (R2=0,945)
| Factor | Coeficiente | Proteína soluble | |
| t | p | ||
| Constante | 1,852 | 4,581 | 0,003 |
| X1 | 0,113 | 0,495 | 0,636 |
| X2 | 1,932 | 8,458 | 0,000 |
| X3 | –0,402 | –1,760 | 0,122 |
| X1X1 | –0,315 | –1,045 | 0,331 |
| X2X2 | 0,498 | 1,650 | 0,143 |
| X3X3 | 1,063 | 3,522 | 0,010 |
| X1X2 | 0,081 | 0,295 | 0,777 |
| X1X3 | 0,234 | 0,847 | 0,425 |
| X2X3 | –0,362 | –1,312 | 0,231 |
Se observó una gran actividad enzimática desde el inicio con una fuerte tendencia hacia la degradación del sustrato proteico (aumento de actividad proteolítica y concentración de proteínas solubles). El estudio de la actividad proteolítica en el caldo de fermentación optimizado mostró que esta supera en 64% a la del caldo sin optimizar o control (Figura 2C). Estas características fueron similares a las de las reacciones hidrolíticas tipo Zipper. En estas, en forma subsecuente se presentó una desnaturalización rápida de la proteína en péptidos de gran tamaño y una degradación lenta de éstos en péptidos de menor tamaño y aminoácidos libres. Este mecanismo permite la existencia en el sistema de una gran cantidad de productos intermediarios y un residuo insoluble en el caldo de fermentación [25].
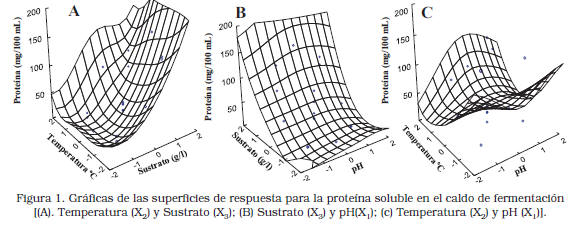
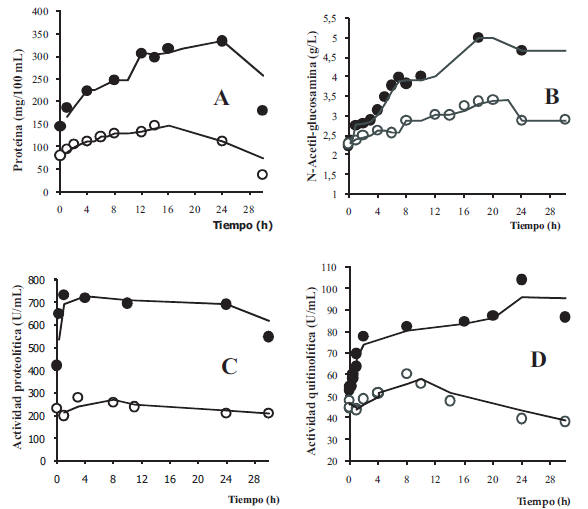
Figura 2. Comparación de la producción de proteína soluble (A), producción de N-acetil-glucosamina
(B), actividad proteolítica (C) y actividad quitinolítica (D) durante la fermentación con Kocuria rosea
LPB-3 de desechos de camarones en condiciones optimizadas ( ) y sin optimizar ( ).
La evaluación del efecto de la fermentación por Kocuria rosea sobre el complejo proteo-quitinoso del sustrato fue determinado a través de la medición de la concentración de N-acetil-glucosamina (N-AcGluc) y la actividad quitinolítica en el caldo de cultivo. Durante la fermentación ambos parámetros se incrementaron (Figura 2B), lo cual señaló la capacidad no reportada anteriormente de esta cepa de degradar sustratos quitinosos. La mayor disponibilidad de N-AcGluc (3,41 g/L) se observó en el caldo optimizado a las 20 horas de cultivo. Al cabo de 24-30 horas, la concentración del azúcar y la actividad quitinolítica fueron superiores a la del caldo no optimizado en 43% y 60%, respectivamente.
Caracterización del hidrolizado proteico obtenido a partir de los desechos de camarones fermentados
El secado del caldo de fermentación presentó un rendimiento de 79,5 g de harina por litro de caldo. El producto hidrolizado resultante principalmente estuvo compuesto por proteínas además de minerales y grasa (Tabla 3). El contenido de proteínas verdaderas de este producto (62,5% bs) fue 36% y 87% superior al de la HDC y al de HDCSD, respectivamente. La proteína proveniente del complejo proteo-quitinoso fue solubilizada en un 80% por la acción de enzimas proteasas excretadas por Kocuria durante la fermentación para la obtención del hidrolizado destinado a la alimentación animal. Adicionalmente, el 94% de la proteína fue digestible según ensayos realizados in vitro de acuerdo a la norma COVENIN [23], con un contenido de lisina en forma disponible en orden de 7,46 g/100g proteína, valor 67% superior al reportado por Nawna [1] en harina de desechos de camarones que fueron ensilados con bacterias ácido lácticas.
El contenido de sales minerales en HP fue inferior en 22% a la HDC, en 56% a la HDCSD y en 50% al hidrolizado reportado por Synowieck y Al-Khateeb [12]. Estos autores reportaron la desmineralización de los desechos de camarones antes de ser tratados con las proteasas comerciales, lo cual no fue necesario en el proceso biotecnológico desarrollado en el presente estudio. En este mismo orden de ideas, con la reducción del contenido de minerales en HP se observó una disminución en 52% del contenido de calcio respecto a HDC, no obstante el nivel es lo suficientemente importante para cubrir los requerimientos en la alimentación animal.
En cuanto a la fracción quitinosa, se logró su separación y purificación ya que en la HDCSD su contenido superó en 56,5% al de la HDC (Tabla 3), mientras que esta no se evidenció en el HP. Así mismo, este producto contiene oligosacáridos y posiblemente monómeros de N-AcGluc y glucosamina que conforman a los azúcares reductores, los cuales provienen de la degradación de la quitina durante la fermentación. Estos azúcares en el HP se encuentran en una cantidad superior en 27,5% y 66% respecto al contenido determinado en la HDC y HDCSD, respectivamente (Tabla 3). Este tipo de oligosacáridos son reportados como agentes promotores de la salud en animales, ya que presentan actividad antitumoral, antimicrobiana, realzan el sistema inmune y adicionalmente son muy usados en tratamientos contra la osteoartritis y gastritis [26].
Tabla 3. Composición bromatológica de las harinas de desechos de camarones (HDC),
de los residuos sin degradar en los cultivos (HDCSD) y la del hidrolizado proteico (HP)
| Análisis en base seca (%) | HDC | HDCSD | HP |
| Materia seca | 95 ± 0,31 | 94 ± 0,04 | 91,8 ± 0,20 |
| Proteína total | 58,8 ± 0,43 | 40 ± 0,57 | 68,1 ± 0,43 |
| Proteína verdadera | 40 ± 0,03 | 0,81 ± 0,09 | 62,5 ± 0,05 |
| Lisina disponible (g/100g proteína) | - | - | 7,46 |
| Grasa | 7,4 ± 0,27 | 6,5 ± 0,01 | 8,7 ± 0,29 |
| Cenizas | 16,8 ± 0,60 | 29,8 ± 0,27 | 13,1 ± 0,60 |
| Calcio | 6 ± 0,025 | 8,8 ± 5.10–3 | 2,9 ± 1.10–3 |
| Quitina | 13,7 ± 0,57 | 31,5 ± 0,02 | ND |
| Nitrógeno quitina | 2,2 ± 0,03 | 5,1 ± 0,04 | ND |
| Azúcares reductores (ppm) | 293 ± 0,1 | 139 ± 0,10 | 404 ± 0,10 |
Conclusiones
Las condiciones de pH (7,57), temperatura (38°C) y principalmente el incremento en la concentración del sustrato (139 g/L) determinadas mediante la MSR, influyeron en el mejoramiento en la tasa de degradación de las fracciones que componen los desechos del procesamiento de camarones durante la fermentación. Su aplicación induce positivamente al mecanismo de excreción de las proteasas y quitinasas, siendo estas últimas de importancia en los procesos industriales para la obtención de los bio-hidrolizados proteicos.
El hidrolizado proteico obtenido a partir de la fermentación en condiciones optimizadas principalmente proteína (62,5%) cuya digestibilidad in vitro fue de 94%.El conocimiento adquirido en el presente estudio acerca del hidrolizado proteico (HP) es una etapa preliminar en la determinación de su valor nutricional como fuente proteica alternativa para la alimentación animal.
Agradecimientos
Los autores agradecen el apoyo económico al CDCH/UCV mediante el proyecto PI-01-37-5268-2007 y a la TSU Hazel Román por su colaboración técnica.
Referencias
1. Nawna, L. Nutritional value and digestibility of fermented shrimp head waste by african catfish Clarias garepinus. Pakistan Journal of nutrition. Vol. 2 No 5. (2003) 339-345. [ Links ]
2. Bertsch, A., Coello, N. A biotechnological process for treatment and recycling poultry feathers as a feed ingredient. Bioresource Technology. Vol. 96 (2005) 1703-1708.
3. Andrade, R,, Chavez, M., Naar, V. Evaluación de las etapas de cocción y secado en la obtención de harina de cabezas de camarón de cultivo (Penaeus sp). Revista Dyna. Vol.74 No 153 (2007) 181-186.
4. Food and Agricultural Organization of the United Nations.2008.FAOSTAT. Disponible en: http://www.apps.fao.org. [ Links ]
5. Fanimo, A., Oduguwa, O, Onifade, A., Olutunde, T. Protein quality of shrimp-waste meal. Bioresource Tecnology. Vol. 72 (2000) 185-188.
6. Falini, G., Weiner, S., Addani, L. 2003. Chitin-silk fibroin interaction: Relevance to calcium carbonate formation in invertebrate. Calcified Tissue International. Disponible en: http://link.springer-ny.com . [ Links ]
7. Myers, R.Response Surface Methodology. Allyn and Bacon, INC. Boston, United States. 1971. [ Links ]
8. Gernat, A.G.The effects of using different levels of shrimp meal in laying hen diets. Poultry Science.Vol.80 (2001) 633-636.
9. Knorr, D. Recovery and utilization of chitin and chitosan in food processing waste management. Food Technology. January (1991) 114-122.
10. Armenta-López, R., Guerrero, I., Huerta,S. Astaxanthin extraction from shrimp waste by lactic fermentation and enzymatic hydrolysis of the carotenoprotein complex. Journal of Food Science. Vol. 67 No 3 (2002) 1002-1006.
11. Gildberg, A.,Stenberg,E; A new process for advanced utilization of shrimp waste. Process Biochemistry. Vol.36.No 8-9 (2001) 809-812.
12. Synowiecki J, Al-Khateeb N. The recovery of protein hydrolysate during enzymatic isolation of chitin from Crangon crangon processing discards. Food Chemistry. Vol.68 (2000) 147-152.
13. Nawani, N., Kapadnis, B. Optimization of chitinase production using statistics based experimental designs. Process Biochemistry. Vol. 40 (2005) 651-660.
14. Coello, N., Bernal, C.,Bertsch, A., Estrada, O., Mocco, Y., Hasegawa, M. Las plumas como residuo agroindustrial:su utilización biotecnológica para producir insumos de interés industrial. Rev. Facultad de Ingeniería de la UCV. Vol. 18 No 3 (2003)119-126.
15. Coello, N., Vidal, L. Kocuria rosea as a new feather degrading bacteria. In Applied Microbiology. Kluwer Academic Publishers. Durieux and Simon eds. Focus on Biotechnology. Netherlands. 2001. [ Links ]
16. Bradford,M. A rapid and sensitive method for the quantization of micrograms quantities of protein utilizing the principles of protein-dye binding. Anal. Biochem. Vol.72 (1976) 248-254.
17. Cosio,I., Fisher,R., Carroad,P. Bioconversion of shellfish chitin waste: waste pretreatment, enzyme production, process design and economic analysis. Journal of Food Science. Vol 47 No 2 (1982) 901-905.
18. Kunitz, M. Crystalline soybean trypsin inhibitor II. General properties. Journal of General Physiology.Vol. 30(1947)291-310.
19. Monreal J., Reese, ET. The chitinase of Serratia marcescens. Canadian Journal of Microbiology. Vol.15 (1969)689-696.
20. Carroad, P., Tom,R. Bioconversion of shellfish chitin wastes: process conception and selection of microorganisms. Journal of Food Science. Vol. 43 No 4 (1978) 1158-1161.
21. Dreyer, A., Montiel, E., Coello, N. Utilización de la superficie de respuesta en la optimización de un medio de cultivo para la producción de L-lisina por Corynebacterium glutamicum. Agronomía Tropical. Vol. 50 No 2 (2000)167-188.
22. AOAC.Official Methods of Analysis 15th edition. Washington D.C. 1990.
23. COVENIN. Alimentos para Animales. Determinación de digestibilidad de las proteínas de origen animal. Caracas. 1981.
24. Mejía de C., M. y Correa, N. Estandarización de métodos sencillos para la determinación de lisina disponible, triptófano y metionina. Revista del Instituto de Investigaciones Tecnológicas de Colombia. Vol. XXII (1980) 27-36.
25. Adler-Nilssen, J. Enzymatic Hydrolysis of proteins for increased solubility. Journal Agricultural Food Chemistry. Vol. 24 No 6 (1976) 1090-1093.
26. Wu, G.,Tsai, G. Cellulase degradation of shrimp chitosan for the preparation of a water-soluble hydrolysate with inmunoactivity. Fisheries Science.Vol.70 (2004) 113-1120.













