Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
versión impresa ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia vol.35 no.1 Maracaibo abr. 2012
Pilot scale superficial flow constructed wetlands for sulfide and phenol removals from oil field produced water
Uso de humedales construidos de tipo superficial a escala piloto para la remoción de sulfuros y fenoles de agua de producción de petróleo
Ninoska Paz1, Edith Blanco1, Edixon Gutiérrez1, Marisel Núñez2, Yaxcelys Caldera3
1Centro de Investigación del Agua (CIA), Facultad de Ingeniería, Universidad del Zulia. Apartado postal 526. Maracaibo 4011, Venezuela. Fax: 0261-7597181, Telf: 0261-7597184. nimapazpa@gmail.com, egutierr12@gmail.com
2Programa de Ingeniería y Tecnología. Universidad Nacional Experimental Rafael María Baralt (UNERMB). Cabimas, Zulia, Venezuela.
3Laboratorio de Investigaciones Ambientales del Núcleo Costa Oriental del Lago (LIANCOL). Universidad del Zulia. Cabimas, Zulia, Venezuela. yaxcelysc@hotmail.com
Abstract
During the oil extraction, a high amount of water is generated which disposal is of concern because they can become a pollutant agent causing a negative impact on the environment. In this study, the efficiency of free surface flow constructed wetlands (FSFCW) at pilot-scale for the removal of sulfides and phenols from oil field produced water (OPW) was evaluated. The experimental design consisted of two FSFCW (FSFCW I y FSFCW II) with gravel and soil (as media) and emergent aquatic plants. Cyperus luzulae and Cyperus ligularia were planted in FSFCW I while Cyperus feraz L, Paspalum sp. and Typha dominguensis were planted in FSFCW II. A control (C) without plants was also evaluated. The wetlands were fed with OPW from a continuous flow tank, the hydraulic retention time (HRT) was 7 days, and the effluent samples were collected weekly during 80 days. Removals of 69% for sulfides and 71% for phenols were observed in the control system. Lower removal percentages were achieved in planted systems (FSFCW I: 62% for sulfides and 64% for phenols; FSFCW II: 66% for sulfides and 61% for phenols). The aquatic plants did not play a fundamental role in the removal sulfur and phenols from oil field produced water.
Keywords: surface flow constructed wetland, oil field produced water, emergent aquatics plants, sulfide and phenol removal.
Resumen
Durante la extracción de petróleo se producen grandes cantidades de aguas o aguas de producción, cuyo destino definitivo es importante considerar ya que pueden convertirse en un agente contaminante que ocasionaría un impacto negativo sobre el medio ambiente. En esta investigación se evaluó la eficiencia de humedales construidos de flujo superficial libre (HFSL) a escala piloto en el tratamiento de agua de producción de petróleo (APP), para la remoción de sulfuros y fenoles. El diseño experimental consistió de dos humedales de tipo superficial (HFSL I y HFSL II), los cuales constaron de soporte (grava y suelo) y plantas acuáticas emergentes (Cyperus luzulae y Cyperus ligulari en el HSFL I y Cyperus feraz L, Paspalum sp. y Typha dominguensis en el HFSL II) y de un control (C) sin plantas. Los humedales se alimentaron con APP Rev. Téc. Ing. Univ. Zulia. Vol. 35, No. 1, 2012 desde un tanque a flujo continuo, el tiempo de retención fue de 7 días, las muestras del efluente fueron recolectadas semanalmente durante 80 días Se encontraron remociones de 69% de sulfuro y 71% de fenol en control, 62% de sulfuro y 64% de fenol para el HFSL II y 66% de sulfuro y 61% de fenol para el HFSL I. Las plantas no jugaron un papel fundamental en la remoción de sulfuros y fenoles presentes en las aguas de producción de petróleo.
Palabras clave: Humedales de flujo superficial libre, agua de producción de petróleo, plantas acuáticas emergentes, fenoles, sulfuros.
Introducción
En la industria petrolera venezolana del occidente del país, el agua que es utilizada en la inyección, principal método aplicado para la recuperación de petróleo de los yacimientos, es dispuesta en tanques de almacenamiento, donde se le aplica un tratamiento físico-químico que consta de separación y clarificación, y un tratamiento posterior con floculantes para eliminar partículas coloidales. Sin embargo, estos tratamientos no eliminan completamente los contaminantes, encontrándose que no cumplen con las normativas venezolanas vigentes [1-4].
Las aguas de producción de petróleo (APP) son difíciles de tratar debido al volumen generado (3 barriles por cada barril de crudo producido) y a su composición, consistente en una mezcla de materiales orgánicos e inorgánicos que varía en función de las características del yacimiento, localización de éste, tipo de crudo extraído y método empleado para la extracción [5]. Según Behling y col. [6] la cantidad de agua generada en el occidente de Venezuela sobrepasa los 305 mil barriles diarios para el 2005.
En la actualidad se ha planteado la inquietud con relación al destino final de las aguas de producción, ya que se espera que para un futuro los tanques de almacenamiento lleguen a su capacidad máxima, viéndose obligados a descargar estos efluentes a cuerpos de agua de la región, generando un impacto ambiental negativo tanto a la flora como a la fauna, además de problemas de salud en la población [1].
Las APP están en contacto con el petróleo in situ y generalmente separadas del petróleo crudo en la superficie del campo en un separador petróleo/ agua; una fracción del agua producida es reciclada y reusada para la producción adicional de petróleo [5]. Entre las opciones de reuso se incluyen: aumento de agua superficial, recarga de aguas subterráneas e irrigación de cosechas de alimentos o césped [7].
Muchos de los compuestos químicos presentes en las APP son hidrocarburos, aceites y grasas, metales pesados y cloruros, entre otros, cuyas concentraciones no pueden ser disminuidas hasta aquellas requeridas, por el Decreto 883 de la Gaceta Oficial 5021 [4]. Los métodos convencionales de tratamiento no garantizan la adecuación de las APP a los valores requeridos por la normativa venezolana vigente [4]; además, sus costos son altos y muchos de ellos son difíciles de aplicar en condiciones de campo, como lo son los reactores de manto de lodo de flujo ascendente (UASB siglas en inglés) y reactores por carga secuenciales (SBR siglas en inglés), los cuales necesitan de personal capacitado para su mantenimiento, control y operación [8, 9], lo que lleva a decir que los costos de operatividad, obras civiles y mantenimiento de humedales destinados a ser usados como sistemas de tratamientos de aguas, son significativamente más bajos que cualquier sistema de tratamiento convencional de efluentes líquidos [10].
Ante esta situación los humedales construidos representan una de las tecnologías naturales no convencionales, simple y de bajo costo que se ha planteado para el tratamiento de aguas residuales, constituyendo una de las opciones de mayor atractivo debido a su simplicidad de operación y mantenimiento, sencillez de construcción, bajo o nulo consumo de energía, baja producción de residuos e impacto ambiental y armonía con el medio ambiente, se les denomina tratamiento naturales de aguas residuales pues producen efluentes de buena calidad [8, 11].
Un humedal construido es un sistema complejo compuesto de agua, sustrato, plantas (vasculares y algas), restos vegetales, invertebrados (principalmente insectos de larvas y gusanos) y una variada comunidad microbiana (los más importantes son las bacterias) [8, 10]. Además, los humedales pueden remover efectivamente materia orgánica, sólidos suspendidos, metales, compuestos como fenoles, hidrocarburos, benceno y tolueno y exceso de nutrientes, como nitrógeno, fósforo, entre otros, a través de varios procesos físicos, químicos y biológicos tales como precipitación, filtración, sedimentación, adsorción a las partículas del suelo y/o acumulación biológica en los tejidos de las plantas y transformaciones microbiológica [10, 12, 13].
En esta investigación se evaluó la eficiencia de humedales de flujo superficial libre (HFSL) en la remoción de fenoles y sulfuros presentes en las APP.
Parte experimental
Área de estudio
El sistema HFSL consistió de tres bandejas de polietileno de 1,28 m de largo por 0,45 m de ancho y 0,45 m de alto, una que sirvió de control (sin plantas) y dos con plantas acuáticas emergentes (HFSL I y HFSL II). Las plantas fueron colectadas de cañadas y áreas adyacentes al Patio Tanque de Ulé, ubicado en el la Costa Oriental de Lago del estado Zulia en una etapa madura. Estas fueron podadas a una altura de 10 cm y plantadas en una fosa de tierra con un área de 4 m2 y una profundidad de de 20 cm sin controlar condiciones ambientales con un rango de temperatura de 37°C y 40°C para su reproducción, para luego ser sembradas en los humedales, previamente podadas a una altura de 10 cm de longitud, con una separación de 25 cm de distancia entre ellas. En HFSL I se ubicaron las especies Cyperus luzulae y Cyperus ligulari, y en el HFSL II la Cyperus feraz L.C, Paspalum sp. y Typha dominguensis, se colocaron 30 plantas por cada especie. La profundidad del soporte fue de 0,25 cm, conformado por un 7% de grava de diferente granulometría (0,2 a 6 cm) y un 93% suelo, y una capa de agua superficial de 0,05men cada sistema. La superficie total fue de 1,73 m2. Las paredes y fondo de las bandejas estuvieron cubiertas con papel de polietileno negro para evitar la entrada de la luz al interior, simulando la oscuridad de la fosa en el terreno. El caudal de entrada utilizado fue de 8 mL/min, con tiempo de retención hidráulico (TRH) de 7 días y una carga orgánica (CO) aproximada de 23,49 gDQO/m2d. Las APP fueron colectadas del Patio Tanque de Ulé en envases de 25 L cada 7 días durante el periodo de estudio de 80 días.
Determinación de parámetros
El tratamiento de APP en los humedales construidos tuvo una duración de 80 días. Las muestras del agua tratada en cada humedal, en el control y la de entrada fueron colectadas tres veces por semana en botellas de vidrio transparentes de 150 mL para la determinación de hidrocarburos, y en recipientes de polietileno de 1 litro para el análisis de pH, fenoles y sulfuros. Los ensayos se realizaron por triplicado.
Las APP fueron caracterizadas en términos de demanda química de oxígeno (DQO), pH, sulfuro, fenoles, sólidos suspendidos totales (SST), sólidos suspendidos volátiles (SSV) y oxígeno disuelto (OD). La eficiencia del tratamiento fue determinada a través de pH, sulfuros y fenoles, según lo descrito en el Standard Methods [14].
Análisis estadístico
El estudio no se realizó con replicas de los tratamientos por lo que se determinaron valores centrales (media y desviación estándar) para cada variable en cada tratamiento utilizando el paquete estadístico SPSS 11, y se compararon en función del tiempo para el mismo tratamiento, no se realizaron comparaciones entre tratamientos. Resultados y discusión
Caracterización del APP
La caracterización fisicoquímica del APP se presenta en la Tabla 1, en la cual se observa que los hidrocarburos totales, la DQO, los SST, sulfuros y fenoles no cumplen con los límites permisibles para descargas a cuerpos de aguas establecidos en la normativa venezolana vigente [4].

Variables fenológicas
En la Tabla 2 se presentan las variables fenológicas de las plantas en cada sistema al final del ensayo. En el HFSL I sobrevivieron 83 plantas en total, mientras que en el HFSL II 67 plantas en Rev. Téc. Ing. Univ. Zulia. Vol. 35, No. 1, 2012 Humedales de tipo superficial a escala piloto para remoción de sulfuros y fenoles 73 total; es decir 23 plantas nuevas en el HFSL I, mientras que en el HFSL II no se presentaron nuevas plantas, lo que indica que en el HFSL I hubo una mayor reproducción de biomasa vegetal. Las plantas utilizadas en los HFSL I y II, en su hábitat normal tienen un gran desarrollo en su altura de tallo, número de hojas, reproducción y un gran número de inflorescencia, pero debido a las condiciones del afluente en cuanto a salinidad (Na+ y Cl–), crudo de petróleo presente, fenoles y sulfuros, entre otros, pudieron inhibir el desarrollo normal de las mismas, presentando en general al final del tratamiento bajo desarrollo, baja reproducción, pocas presentaron inflorescencia y casi todas presentaron un color amarillento en sus hojas, además de resequedad y ciertas zonas quemadas lo que podría indicar síntomas de necrosis y clorosis.

pH
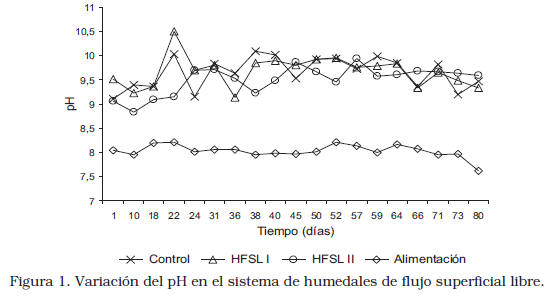
Los efluentes de los sistemas evaluados presentaron valores alcalinos de pH, fluctuando en un intervalo de 9,10 a 10,09 con una media de 9,60±0,02 para el control; de 9,13 a 10,50 y una media de 9,81±0,05 para el HFSLI, y de 8,84 a 9,93 con una media de 9,40 ±0,08 para el HFSL II (Figura 1).
El pH de la alimentación se mantuvo en un intervalo estable y relativamente bajo (7,62 a 8,21) con respecto a los valores de pH de los efluentes, lo que indica que, posiblemente, las actividades que se desarrollan en los sistemas HFSL como el crecimiento de microalgas, descomposición de la vegetación muerta, actividad microbiana, precipitaciones químicas y formación de complejos entre otros, afectan el pH. Según Murray y col. [15], en las zonas abiertas dentro de los humedales, pueden desarrollarse altos niveles de actividad microalgal, generando un ambiente con pH alto (pH>9). De igual manera, Lin y col. [16] encontraron que el valor de pH se incrementó a causa de las algas en HFSL durante el tratamiento de aguas de cultivo. Por el contrario, otros autores han encontrado valores de pH más bajos, Gessner y col. [17] hallaron fluctuaciones de pH entre 6,8 y 7,6 tratando aguas subterráneas. Ji y col. [18] reportaron valores de pH entre 7,63 y 7,77 durante el tratamiento de aguas de producción de crudo pesado en HSFL.
Por otra parte Hadad y col. [19] quienes trabajaron con aguas de desecho industrial en un sistema HFSL, reportaron una disminución del pH de la entrada de 9,9 a 7,9. Igualmente, Alvarez y Becares [20] observaron una disminución del pH de 9 a 8,1 en el efluente de agua residual del sistema de HFSL, debido posiblemente a la actividad heterótrofa de los microorganismos asociados a las plantas. Resulta claro que el comportamiento del pH en los trabajos mencionados anteriormente es opuesto al comportamiento observado en la presente investigación, debido probablemente a que las actividades de las plantas se vieron limitadas por la composición de las APP. Los valores de pH de los efluentes se encontraron un poco más elevados que el intervalo permitido (6-9) para descargas de efluentes [4].
Remoción de sulfuros
En la Figura 2 se observa el comportamiento del sulfuro en el sistema de humedales. La remoción de sulfuro al final de los 80 días fueron 68,61%; 66,11% y 62,18% para el control, el HFSL I y HFSL II respectivamente, lo que podría indicar que para la remoción de este compuesto la presencia de las plantas no jugó un papel fundamental y que dicha remoción fue debida principalmente a la presencia de microorganismos y a reacciones químicas como precipitación y formación de complejos, entre otras.
Debido a las condiciones complejas que se presentan en los humedales, puede presentarse la oxidación microbiana y abiótica, así como también los procesos de reducción, de manera simultánea [21]. En las zonas anaerobias, las bacterias sulfato reductoras (BSR) pueden producir sulfuros, y en las zonas óxicas, catalizadas por las bacterias como las Thiobacillus, o por la oxidación abiótica, el sulfuro puede oxidarse a formas de azufre como azufre elemental y sulfuros de valencia (–2) [22]. Por otra parte, se ha reportado que el azufre reducido es un inhibidor del crecimiento de ciertos microorganismos y afecta la fisiología de varios tipos de helofitas [21, 23, 24]; esto último contribuye al pobre desarrollo de las plantas en los humedales.
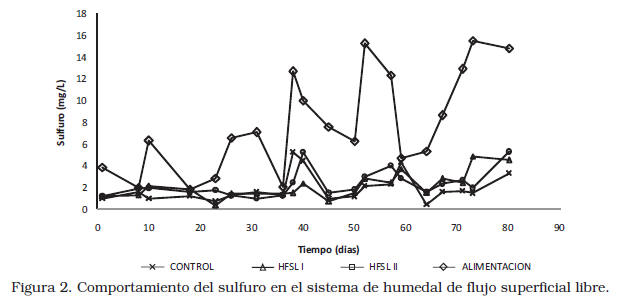
En los sistemas estudiados podría haberse dado la presencia de bacterias verdes y rojas reductoras del azufre, evidenciada por la formación de una gran capa de estos colores en la superficie del soporte del humedal. Además las condiciones eran propicias para su crecimiento y desarrollo: condiciones anóxicas (OD=0), pH elevado (pH>9), concentración de cloruros en el afluente y en efluente (795,52-3804,18; 842,35-3704,07; 860,35-3503,85 mg/L, para el control, HFSL I y HFSL II respectivamente) y altas concentraciones de sulfato, cerca de 10.000 mg/L al final del periodo de estudio, halladas a la salida de los sistemas, esto indica que parte o todo el azufre se redujo a sulfuro y posteriormente oxidado a sulfato. En este sentido Keith y col. [25], reportaron en su estudio con agua de desecho de una estación de comprensión de gas natural tratada con HFSL, una remoción del 75% de sulfuro, valor cercano a los encontrados en este estudio. Mientras que Quilice y col. [26] que trabajaron con agua de producción de la industria petrolera nacional, encontraron una remoción mayor (98%) del sulfuro, comparada a la obtenida en este estudio.
Cabe destacar que los humedales utilizados en este estudio tenían dimensiones mucho más pequeñas (0,58 m2 cada unidad) y un TRH mayor (7 días) que los utilizados por Quilice y col. [26], de 40 m2 y TRH de 1 a 5 días, lo que podría influir y contribuir con la remoción de este compuesto. La similar remoción de sulfuro en los sistemas evaluados, es un indicativo que las plantas no ejercieron un papel fundamental en la remoción de este compuesto, la cual se debe a la actividad microbiana (degradación biológica), además de la posible formación de complejos con metales presentes en el sistema. Cabe destacar que no se cuenta con datos suficientes para explicar las causas precisas que justifiquen esta evolución, indicando la necesidad de realizar estudios adicionales.
Por otra parte, las concentraciones de sulfuros en el efluente no están por encima de los valores establecidos en la normativa oficial para descargas a cuerpos de agua (0,5 mg/L) [4], en algunas muestras al final del estudio, la concentración de sulfato estuvo por encima de 1000 mg/L.
Remoción de fenoles
La remoción de fenoles se ilustra en la Figura 3. Se observa un comportamiento similar en los tres sistemas, con remociones promedios de fenol de 71,21±0,08%; 64,31±%0,07 y 61,37±0,08% para el control, el HFSL I y el HFSL II respectivamente. Se ha reportado que concentraciones de fenol en el intervalo de 1 a 1000 mg/L es tóxico para los seres humanos y las plantas [27]. Las concentraciones encontradas de fenol en el afluente de los sistemas evaluados estuvieron dentro de este intervalo lo que posiblemente contribuyó con la muerte progresiva de las plantas, las cuales presentaron poco crecimiento y reproducción, hojas quemadas y amarillentas, entre otros síntomas.
En la Figura 3, se puede observar que en los primeros días de funcionamiento de los sistemas evaluados las remociones de fenoles fueron diferentes, destacándose la mayor remoción en el control, seguido de HFSL I, debido a la menor cantidad de ellas sembradas al inicio, lo cual habría favorecido la foto oxidación y a la adsorción en el soporte. Al final del estudio, se puede observar un comportamiento análogo en los sistemas, encontrándose valores de remoción similares, indicando que al final del estudio la presencia de las plantas no fue determinante en la remoción del contaminante, ya que para esta última etapa se pudo apreciar la muerte progresiva de las plantas. La foto oxidación, la formación de complejos, la actividad microbiológica y la adsorción, entre otras, pudieron haber favorecido la remoción del fenol de las APP en los humedales. Por el comportamiento observado en la remoción de fenoles en los tres sistemas, se puede inferir que las plantas no tienen una influencia en dicha remoción, atribuido a los mecanismos de degradación biológica y a la foto oxidación del fenol. Sin embargo, la caída de la remoción del fenol en los tres sistemas para el día 80, podría deberse a otros fenómenos que requieren de otras investigaciones.
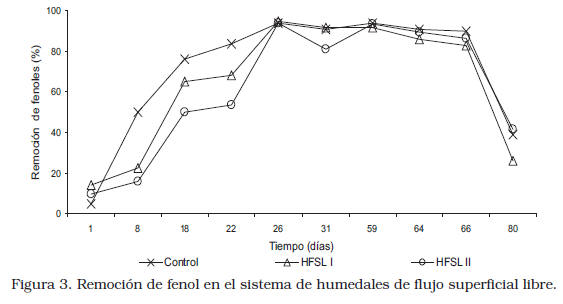
En el trabajo realizado por Gessner y col. [17], se reporta una remoción del 98% de fenoles, debida a la absorción experimentada por las raíces de las plantas, señalando los autores que la Typha dominguensis es eficiente en la reducción de este parámetro. Por el contrario, Quilice y col. [26] reportaron una remoción del 40% de fenoles, siendo esta remoción menor a la encontrada en el presente estudio, mientras que Keith y col. [25] y De León y col. [28], reportaron una remoción de un 98%, atribuyéndola a procesos tales como la volatilización, oxidación fotoquímica, sedimentación, sorción y degradación biológica (microbiana), valores que son mayores a los reportados en el presente estudio.
Conclusiones
Las condiciones del afluente en cuanto a salinidad, crudo presente, fenoles y sulfuros, entre otros, pudieron inhibir el desarrollo normal de las mismas, presentando en general al final del tratamiento bajo desarrollo, baja reproducción, pocas presentaron inflorescencia y casi todas presentaron un color amarillento en sus hojas, además de resequedad y ciertas zonas quemadas lo que podría indicar síntomas de necrosis y clorosis.
Las plantas no jugaron un papel fundamental en la remoción de sulfuros y fenoles presentes en aguas de producción de petróleo.
Agradecimiento
Este trabajo fue realizado gracias al financiamiento otorgado por el Consejo, de Desarrollo Científico y Humanístico de la Universidad del Zulia (CONDES).
Referencias bibliográficas
1. Gutiérrez E., Caldera Y., Fernández N., Blanco E., Paz N. y Mármol Z.: Biodegradabilidad anaerobia termofílica de aguas de producción de petróleo en reactores por carga. Rev. Téc. Ing. Univ. Zulia, Vol. 30, Nº 2 (2007) 111-117.
2. Gutiérrez E., Caldera Y., Perez F., Blanco E. y Paz N.: Comportamiento de metales presentes en aguas de producción de petróleo durante el tratamiento anaerobio termofílico. Boletin del Centro de Investigaciones Biológicas, Vol. 43, Nº 1 (2009) 145-160.
3. Gutiérrez E., Caldera Y., Contreras K., Blanco E. y Paz N.: Degradación anaerobia mesofílica y termofílica de aguas de producción de petróleo liviano. Boletin del Centro de Investigaciones Biológicas, Vol. 40, Nº 3 (2006) 242-256.
4. Gaceta Oficial 5021 de la República de Venezuela (1995). Caracas 18 de Diciembre de 1995. 5021, Extraordinaria. Decreto 883.: Normas para la clasificación y el control de las aguas de los cuerpos de agua y vertidos o efluentes líquidos.
5. Arnold R., Burnett D., Elphick J., Feeley T., Galbrun M., Jiang Z., Khan M., Lavery M., Luffey F. y Verbeek P.: Manejo de la producción de agua: de residuo a recurso. Oilfield Review (2004) 30-45.
6. Behling E., Weffer G., Marín J., Colina G., Rincón N., Díaz A. y Fernández N.: Tratamiento de un efluente sintético de glucosa y fenol en un reactor biológico rotativo de contacto. Boletín del Centro de Investigaciones Biológicas, Vol. 39, Nº 3 (2005) 277-292.
7. Lim P., Tay M., Mak K. y Mohamed N.: The effect of heavy metals on nitrogen and oxygen demand removal in constructed wetlands. The Science of the Total Environment, Vol. 301, (2003) 13-21.
8. Arias C. y Hans B.: Humedales artificiales para el tratamiento de aguas residuales. Revista Científica e Ingeniería Neogranadina, Vol. 13, (2003) 17-23.
9. Chen T., Kao C., Yeh T., Chien H. y Chao A.: Application of constructed wetland for industrial wastewater treatment: A pilot-scale study. Chesmosphere, Vol 64, Nº 3 (2006) 497-502.
10. Prado M.: Aprovechamiento de los humedales para la disposición y tratamiento de efluentes líquidos. Visión tecnológica. Publicación de INTEVEP S.A., Vol. 5, Nº1 (1997) 59-70.
11. Garcia J., Morato J. y Bayona J.: Depuración con sistemas: humedales construidos. Departamento de Química Ambiental, CSIC, Barcelona. (2002). Disponible en: http:// www.dicat.csic.es.
12. Jing S., Lin Y., Lee D. y Wang T.: Using constructed wetland systems to remove solids from highly polluted river water. Water Science and Technology: Water Supply, Vol. 1 (2001) 89-69.
13. Gessner T., Kadlec R. y Reaves R.: Wetland remediation of cyanide and hydrocarbons. Ecological Engineering, Vol. 25, Nº 4 (2005) 457-469.
14. APHA-AWWA-WEF.: Standard Methods for the Examination of Water and Wastewater. 20th Edition.Washington, DC, USA. (1998).
15. Murray C., Heatley J., Karanfil T., Rodgers Jr. y Myers J.: Performance of a hybrid reverse osmosis-constructed wetland treatment system for brackish oil field produced water. Water Research, Vol. 37, Nº 3 (2003) 705-713.
16. Lin, Y., Jing, S., Lee, S. y Wang, T.: Removal of solids and oxygen demand from aquaculture wastewater with a constructed wetland system in the start-up phase.Water Environment Research. Vol. 74, Nº 2 (2002) 113-216.
17. Gessner T., Kadlec R. y Reaves R.: Wetland remediation of cyanide and hydrocarbons. Ecological Engineering, Vol. 25, Nº 4 (2005) 457-469.
18. Ji G., Sun, T. y Ni, J.: Surface flow constructed wetland for heavy oil-produced water treatment. Bioresource Technology. Vol.98, Nº 2 (2007) 436-441.
19. Hadad H., Maine M. y Bonetto C.: Macrophyte growth in a pilot-scale constructed wetland for industrial wastewater treatment. Chemosphere, Vol. 63, Nº 10 (2006) 1744-1753.
20. Alvarez J. y Becares E.: El papel de la vegetación en humedales construidos para el tratamiento de aguas residuales. Encuentro Internacional en Fitodepuración. (2005). Disponible en: www.fundacionglobalnature. org/macrophytes/.../C-4%20Álvarez%20J.A. pdf
21. Wiessner A., Kappelmeyer U., Kuschk P. y Kästner M.: Sulphate reduction and the removal of carbon and ammonia in a labora- Rev. Téc. Ing. Univ. Zulia. Vol. 35, No. 1, 2012 78 Paz y col. tory-scale constructed wetland. Water Research, Vol. 39, Nº 19 (2005) 4643-4650.
22. Gonzalias A.E., Kuschk P.,Wiessner A., Jank M., Kästner M. y Köser H.: Treatment of an artificial sulphide containing wastewater in subsurface horizontal flow laboratory-scale constructed wetlands. Ecological Engineering, Vol. 31, Nº 4 (2007) 259-268.
23. Chambers R.M., Mozdzer T.J. y Ambrose J.C.: Effects of salinity and sulfide on the distribution of Phragmites australis and Spartina alterniflora in a tidal saltmarsh. Aquatic Botany, Vol. 62, Nº 3 (1998) 161-169
24. Wiessner A., Kuschk P., Jechorek M., Seidel H. y Kästner M.: Sulphur transformation and deposition in the rhizosphere of Juncus effuses in a laboratory-scale constructed wetland. Environmental Pollution, Vol. 155, Nº 1 (2008) 125-131.
25. Keith J., Craig M. y Travis D.: Treatment of wastewater effluent from a natural gas compressor station. Wat. Sci. Tech. Vol. 40, Nº 3 (1999) 51-56.
26. Quilice A., Camacho F., Urquiola A. y Mendoza J.: Evaluación piloto del proceso de humedales construidos para el tratamiento de aguas de producción. VI Congreso Venezolano de Ecología (memorias) (2005).
27. Fenol (2005). Disponible en: http://www. fenol.catalago.info/documentacion/Conferencias% 20y%20P%F3sters/P-9%20Torres %20L.A.pdf [ Links ]
28. De León N., Camacho F., Ceci N., Velazquez J. y Colombo P.: Wetlands as evaporation and treatment system for produced water. Memorias de Annual Technical Conference and Exhibition Held in Dallas, Texas. SPE (Society of Petroleum Engineer) 1-4 de Octubre (2000).
Recibido el 26 de Enero de 2010 En forma revisada el 28 de Noviembre de 2011
Rev. Téc. Ing. Univ. Zulia. Vol. 35, No. 1, 2012 Humedales de tipo superficial a escala piloto para remoción de sulfuros y fenoles 79













