Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
Print version ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia vol.35 no.1 Maracaibo Apr. 2012
Cu (II), Cd (II) and Zn (II) adsorption by the Cuare Mangrove Peat, Falcon State, in different degrees of artificial maturation
Adsorción de las especies Cu (II), Cd (II) y Zn (II) por la turba de manglar de Cuare, Edo. Falcón, en diferentes grados de maduración artificial
Virginia Martínez1, Manuel Martínez1*, Katya Reategui1, Marcos Escobar 2
1Centro de Geoquímica, Instituto de Ciencias de la Tierra, Facultad de Ciencias, Universidad Central de Venezuela. Caracas 1040, Venezuela. *manuel.martinez@ciens.ucv.ve
2 Postgrado en Geología Petrolera, Facultad de Ingeniería, Universidad del Zulia, Maracaibo, y CARBOZULIA, Av. 2, No. 55-185, Casa Mene Grande, Maracaibo 4002, Venezuela.
Abstract
The high adsorption capacity of peat for heavy metals constitutes a complex phenomenon of economic and environmental interest. Nevertheless, little is known about how this process is modified by enhancing the thermal maturity of the peat, as a consequence of the burial of the peat-bog. The aim of this study is the evaluation of the variability in the capacity of adsorption of the peat for the ions Cu++, Cd++ and Zn++ according with the thermal maturity increases, by means of artificial maturation in the laboratory. The adsorption isotherms were determined in both the original and artificial matured peat, from the peat-bogs of Cuare swamp (Falcon State, Venezuela). Notable decrease is observed in the matured peat for all studied ions, with respect to the original peat. The affinity order for metals towards the carbonaceous materials used was Cu2+> Zn2+> Cd2+.
Keywords: peat, artificial maturation, adsorption, heavy metals.
Resumen
La elevada capacidad de adsorción de la turba hacia los metales pesados, constituye un fenómeno complejo de interés económico y ambiental. Sin embargo, no se conoce con claridad cómo es modificado este proceso acorde incrementa la maduración de la turba, por efecto del soterramiento en las turberas. El propósito de este trabajo es evaluar la capacidad de adsorción de la turba hacia los iones Cu2+, Cd2+ y Zn2+ a medida que incrementa el proceso de maduración térmica, inducida por hidropirólisis en el laboratorio. Fueron determinadas las isotermas de adsorción de los iones citados en turba original proveniente de las turberas de manglar de Cuare (Estado Falcón, Venezuela), así como su producto madurado artificialmente. La turba madurada disminuye notablemente su capacidad de adsorción de todos los iones estudiados, con respecto al material original. El orden de afinidad de los metales hacia los materiales carbonáceos usados fue Cu2+> Zn2+> Cd2+.
Palabras clave: turba, maduración artificial, adsorción, metales pesados.
Introducción
Las turbas están constituidas por lignina, celulosa y sustancias húmicas, que comprenden a los ácidos fúlvicos, húmicos y huminas [1-3]. Estos ácidos están señalados como los responsables del proceso de adsorción de metales en la turba, debido a que los grupos funcionales presentes en ellos (particularmente, ácidos carboxílicos y fenólicos) le confieren un acentuado carácter polar y por lo tanto incrementan su capacidad de adsorción, aunado a su elevada área superficial (> 200 m2/g) y alta porosidad (80-90%) [3-7]. Debido a estas características, ha sido estudiada desde hace varios años como un material excelente para la purificación de aguas residuales y de consumo, teniendo además como ventaja su bajo costo frente a otros materiales como carbón activado, zeolitas, alúmina o sílice [8-11]. De esos trabajos previos destaca la alta afinidad de la turba por metales presentes en solución, tales como Pb, Cd, Zn, Cu y Ni, entre otros. La turba es por tanto muy importante en los sistemas naturales ya que limita la biodisponibilidad de estos metales tóxicos para los organismos vivos. Además han sido propuestos modelos o mecanismos en los que ocurriría la remoción de los metales que incluyen la adsorción física, quelatación y reacciones químicas [2, 12-15]. Sin embargo, a pesar de todas las investigaciones relacionadas con la turba y sus procesos de adsorción, no es conocido cómo afecta la maduración térmica de la turba (carbonificación) el proceso de adsorción de metales pesados.
El conocimiento de estos mecanismos es clave para entender, entre otras cosas, cómo tiene lugar el enriquecimiento de elementos trazas que experimentan los carbones minerales [16]. Es por ello que esta investigación contempla madurar artificialmente la turba mediante hidropirólisis y evaluar su efecto sobre la capacidad de adsorción de Cu, Cd y Zn, prestando especial interés por la afinidad de los metales hacia este material a medida que avanza el proceso de maduración artificial.
Materiales y métodos
Las muestras de turba fueron recolectadas en la localidad Boca del Zorro, en el Golfete de Cuare, Estado Falcón en una pequeña depresión con una significativa acumulación de materia orgánica derivada principalmente de mangle rojo (Rizophora mangle). Luego de remover los primeros 15 cm de material superficial, se colectó con ayuda de un barreno, la turba presente, hasta una profundidad de 1,20 m; el procedimiento fue realizado en tres puntos de muestreo de la depresión, separados entre sí aproximadamente 10 m. De cada punto se obtuvo aproximadamente 3 kg de material, que fueron mezclados y homogeneizados a fin de preparar una muestra compuesta. Una vez en el laboratorio, fue secada a temperatura ambiente durante 4 días y posteriormente llevada a la estufa a 50 °C durante 24 horas. La turba seca fue disgregada manualmente a un tamaño de 2 mm y homogeneizada.
Maduración artificial de la turba
Para la maduración artificial de la turba fue utilizada la técnica de hidropirólisis, que consistió en colocar dentro de un reactor de acero inoxidable de 500 mL de capacidad, aproximadamente 30 g de turba seca, pulverizada y cuarteada, cubierta con 70 mL de agua. El reactor fue cerrado y calentado a 250 °C en una camisa térmica durante 24 horas basados en estudios previos de maduración. El producto madurado bajo las condiciones antes descritas corresponde a un carbón bituminoso alto en volátiles, determinado tanto por la distribución de biomarcadores saturados y aromáticos como por reflectancia de la vitrinita [17-19].
Ensayos de adsorción sobre turba original y su producto de maduración
Para los ensayos de adsorción fue pesado 1 g de material carbonáceo (turba o producto madurado) y mezclado con 20 mL de una solución de nitrato del metal de interés en su forma bivalente, con concentraciones entre 0 y 300 μg/g para la turba y entre 0 y 72 μg/g para el producto madurado. El sólido se agitó con la solución durante 2 horas, dejando luego en reposo hasta completar un tiempo de 8 horas. Después de este lapso, la solución fue filtrada y medida la concentración resultante mediante espectrometría de emisión óptica inductivamente acoplado a plasma (ICP). Todos los ensayos fueron conducidos a una temperatura de 25 °C y pH entre 5 y 6.
Resultados y discusión
Ajuste de los datos experimentales de adsorción a la isoterma de Langmuir Ambos sistemas fueron ajustados al modelo de isoterma de Langmuir debido a que éste permite calcular la máxima capacidad de adsorción del adsorbente, a pesar de las limitaciones reales que pueda presentar. Los datos experimentales correlacionaron bien con el modelo teórico, ya que presentaron coeficientes de regresión cercanos a 1.
Al comparar los coeficientes de Langmuir para ambos sustratos (Tabla 1) hay evidencia de una gran diferencia entre los máximos de adsorción de los metales en la turba y su producto de maduración (Tabla 1). Estos máximos, junto con los porcentajes de adsorción promedio, indican que el ión Cu (II) es adsorbido en una mayor proporción sobre la turba estudiada, que las especies Zn (II) y Cd (II); esta última especie es adsorbida en menor proporción que las restantes, debido a que los dos primeros compiten favorablemente con este último, por los sitios de adsorción en la turba [20-21]. Los resultados a discutir a continuación, permiten reconocer que la turba y su producto de maduración, que alcanzó un rango equivalente a carbón bituminoso, exhibieron diferencias significativas en su capacidad de adsorción hacia los metales estudiados, en el intervalo de pH considerado.
La relación X X original madurada max max
mostrada en la Tabla1, permite establecer el número de veces que la turba supera a su producto de maduración con respecto a la adsorción de los cationes. De todos ellos, Cd2+ es el que presenta mayor valor de esta relación (29), lo cual indica que su afinidad por el producto de maduración es menor con relación a la turba original y en comparación con los otros cationes. Este resultado, junto a su menor adsorción respecto a los otros cationes, implica que el Cd es el más desfavorecido de los iones evaluados frente a su adsorción por la turba de estudio [20-21], y el más sensible ante las variaciones de madurez.
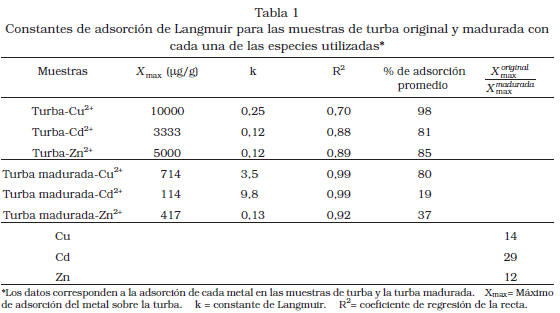
Por otra parte, los iones Cu (II) y Zn (II) poseen diferencias menos marcadas que Cd (II) al comparar los máximos de adsorción en la turba y el producto madurado. Sin embargo, son igualmente significativas al momento de evaluar la capacidad de adsorción de ambos materiales. De acuerdo a la ecuación de Langmuir, el orden de adsorción y de afinidad para los sustratos es Cu2+ > Zn2+ >Cd2+.
Isotermas de adsorción
A partir de los datos experimentales, fueron construidas las isotermas de adsorción para cada uno de los metales, mediante la representación gráfica de la concentración en el equilibrio de la especie contra la concentración adsorbida por kilogramo de adsorbente (Figura 1).
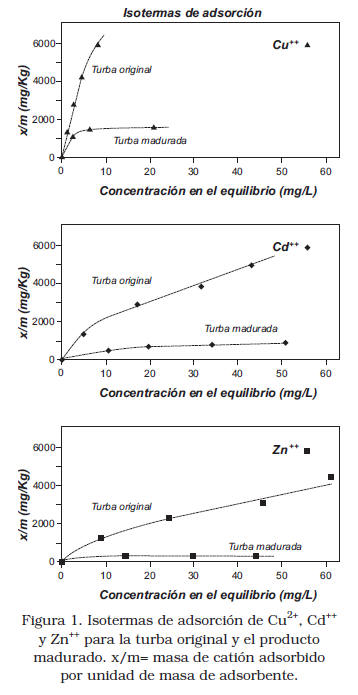
A primera vista, resalta el hecho de que la saturación de la turba madurada es alcanzada a concentraciones iniciales de adsorbato menores con respecto a la turba original; por lo tanto, esta última posee una mayor capacidad de adsorción con respecto al carbón producto de hidropirólisis para todo el grupo de metales ensayados. Estos resultados concuerdan con los reportados en la literatura, los cuales afirman que la turba es un material orgánico con una elevada capacidad para remover metales en solución [2, 9, 14, 16, 22].
Las isotermas de adsorción confirman el orden decreciente de afinidad determinado mediante el máximo de adsorción de Langmuir, indicando el siguiente orden: Cu2+ > Zn2+ >Cd2+, tanto para la turba original como para el producto madurado. Las diferencias de afinidad de los cationes estudiados por los sitios activos de ambos materiales están relacionadas con las propiedades químicas de cada uno de ellos tales como potencial iónico, configuración electrónica y la energía de estabilización del ligando.
El Cu2+ es el catión que posee mayor potencial iónico ( = Z/r = 2,9) [23], por tanto, la densidad de carga positiva es mayor, facilitándole formar complejos de esfera interna con los ligandos de la materia orgánica; es muy conocida la afinidad de este ión por ácidos húmicos, materia orgánica de suelos, turbas y carbón [16, 24-25]. Además, posee orbitales d parcialmente ocupados (el Cu (II) es un d9) lo que lo hace una especie bastante reactiva. En el caso de Cd2+ y Zn2+, ambos poseen menor potencial iónico que el Cu2+ ( = 2,1 y 2,7 respectivamente) y sus orbitales d están llenos, lo que limita su reactividad [26]. Se infiere, a partir de los resultados obtenidos, que la interacción entre la turba y el Cu (II) es más fuerte que con los otros iones estudiados, ocurriendo una quimisorción con posible formación de un enlace químico formal entre el metal y terminales oxigenados o nitrogenados de la materia orgánica de la turba. La notable diferencia en la extensión de la adsorción entre este metal y el cinc o el cadmio, posiblemente radique en su elevada capacidad de quelatación. Esta aseveración recibe apoyo adicional con la disminución del fenómeno de adsorción (entre 12 y 29 veces menor, Tabla 1) con el material madurado artificialmente. La maduración de la turba implica la remoción casi total de grupos funcionales heteroatómicos como carboxilos, fenoles, tioles, aminas, etc. La pérdida de estos grupos funcionales disminuye en consecuencia la capacidad de quelatación y por ende, la adsorción de las especies metálicas consideradas.
Significado geoquímico de la adsorción de iones por la turba original y madurada
Los resultados obtenidos permiten establecer que en un ambiente de turbera, las turbas superficiales, con alto contenido de grupos funcionales y con una gran área superficial, presentan una mayor capacidad de adsorción hacia los metales considerados, que las turbas más profundas que han empezado a sufrir un proceso de carbonificación, en el cual la compactación y la pérdida de grupos funcionales conducen a una disminución de la capacidad de adsorción.
El proceso descrito afecta también la forma en la que tiene lugar el fenómeno de adsorción: el mejor ajuste de las isotermas hacia el modelo de Langmuir para las turbas maduradas indica que con este sustrato tiene lugar la quimisorción con formación de monocapa, conforme al modelo teórico de la isoterma. En el caso de la turba, es probable que exista más de un mecanismo de sorción involucrado, y/o que se formen multicapas.
Es posible establecer entonces un modelo cualitativo de enriquecimiento de metales traza por las turbas y por ende los carbones. Suponiendo disponibilidad geoquímica de las especies, en una turbera, para un tiempo inicial de referencia (t=0), la turba superficial presente está adsorbiendo diferentes especies metálicas con gran eficiencia, y cargando consigo estos iones durante el soterramiento. Considerando una tasa de acumulación de 1 mm/ año, a un tiempo 1 (t1= 10.000 años) esa misma turba dopada en iones metálicos se encontrará aproximadamente a 10 mde profundidad, donde la maduración comienza a ser más activa y propicia la pérdida paulatina de grupos funcionales.
A medida que transcurre el tiempo (t2 =100.000 años) y el proceso de soterramiento sigue actuando, la turba puede hallarse a profundidades de hasta 100 m, y su madurez puede ser tal, que la capacidad de adsorción del sustrato sea significativamente menor que la turba superficial, provocando que los iones inicialmente adsorbidos comiencen a ser desorbidos y migren junto con el agua intersticial que asciende en búsqueda de menores presiones, siendo nuevamente asimilados por la turba más reciente o superficial, insaturada aún en los iones.
Este fenómeno puede explicar cualitativamente el enriquecimiento notable en metales traza por parte de las turberas. Éstas reciben y adsorben especies metálicas no sólo de las aguas superficiales con las que están en contacto, sino también de las turbas infrayacentes y que están liberando parte de los iones adsorbidos inicialmente. Sin embargo, la turba soterrada queda cargada con parte de los metales adsorbidos porque la desorción no es total. Estos metales constituyen la fracción inorgánica de los carbones, una vez alcanzado el rango de madurez; el modelo representa entonces un mecanismo plausible para el enriquecimiento en metales traza que experimentan los carbones [16, 27-28].
Significado ambiental
En general, en ecosistemas costeros o de formación de turbas, la elevada capacidad de adsorción resulta vital, ya que limita la exposición de los organismos vivos a metales pesados, cuya toxicidad los hace muy peligrosos. La peligrosidad de estos metales radica en que son bioacumulados y carecen de un mecanismo de degradación, lo que acentúa su efecto en la naturaleza. Así pues, las turberas resultan ser indispensables en la regulación composicional de especies potencialmente tóxicas disponibles en los ecosistemas en los que se depositan estos materiales (lagunas costeras, albuferas, líneas de costa, deltas, marismas, estuarios, etc.).
Los resultados muestran que la turba de manglar remueve metales tóxicos, y tal vez lo más importante, no los libera con facilidad. No obstante, es necesario extender estudios de esta naturaleza a otros iones, y a turbas provenientes de otro material parental, distinto a manglar, a fin de verificar el carácter general de los resultados obtenidos en este trabajo.
Conclusiones
El orden de adsorción de los metales hacia la turba original y al producto madurado en orden decreciente es Cu2+> Zn2+> Cd2+. El potencial iónico, junto a la presencia de orbitales d parcialmente llenos, pueden ser los responsables del orden de adsorción encontrado.
La turba madurada artificialmente (con un nivel de madurez térmica equivalente a un carbón bituminoso) presenta una menor capacidad de adsorción (14 veces menos para Cu++, 29 veces para Cd++ y 12 veces menos para Zn++) que la turba original. Este resultado es ocasionado por la disminución en el contenido de grupos funcionales con heteroátomos, capaces de enlazarse a los metales.Los resultados permiten establecer un modelo cualitativo que explica el enriquecimiento en metales traza que experimentan los carbones, como productos madurados naturalmente de la litificación de las turbas.
Estos resultados tienen una relevancia ambiental notable, porque determinan un papel primordial de los ambientes que permiten la acumulación de turbas, en la regulación y biodisponibilidad de metales potencialmente tóxicos en los ecosistemas en los que están presentes estos depósitos.
Agradecimientos
Los autores agradecen el financiamiento del Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela (CDCH-UCV) a través del proyecto PI 03-00- 5887-2005.
Referencias bibliográficas
1. Yonebayashi, K., Pechayapisit, J., Vijarnsorn, P., Zahari, A., Kyuma, K. Chemical alterations of tropical peat soils determined by Waksmans proximate analysis and properties of humic acids. Soil Science and Plant Nutrition, Vol. 40 (1994), 435-444.
2. Brown, P.A., Gill, S.A., Allen, S.J. Metal removal from wastewater using peat. Water Research, Vol. 34 (2000), 3907-3916.
3. Francioso, O., Sanchez-Cortes, S., Tugnoli, V., Marzadori, C., Ciavatta, C. Spectroscopic study (DRIFT, SERS and 1H NMR) of peat, leonardite and lignite humic substances. Journal of Molecular Structure, Vol. 565-566 (2001), 481-485.
4. Brown, P.A., Gill, S.A., Allen, S.J. Determination of optimal peat type to potentially capture copper and cadmium from solution. Water and Environmental Research, Vol. 73 (2001), 351-362.
5. Van Dijk, H. Cation binding of humic acids. Geoderma, Vol. 5 (1971), 53-66.
6. Aldrich, C., Feng, D. Removal of heavy metals from wastewater effluents by biosorptive flotation. Mineral Engineering, Vol. 13 (2000), 1129-1138.
7. Stevenson, F.J. Humus Chemistry: Genesis, Composition, Reactions, 2nd ed. Wiley, New York, 1994. [ Links ]
8. Brown, P., Gill, S., Allen, S. Metal removal from wastewater using peat. Water Research, Vol.34 (2000), 3907-3916.
9. Qin, F., Wen, B., Shan, X., Xie, Y., Liu, T., Zhang, S, Khan, S. Mechanism of competitive adsorption of Pb, Cu and Cd on peat. Environmental Pollution, Vol. 144 (2006), 669-680.
10. Volesky, B. Biosorption for the next century. Hydrometallurgy, Vol. 59 (2001), 203-216.
11. Dissanayake, C.B., Weerasooriya, S.V.R. "Peat as a metal-trapping material in the purification of industrial effluents." International Journal of Environmental Studies, Vol. 17 (1981), 233-238.
12. Gosset, T., Trancart, J., Thévenot D. Batch metal removal by peat: Kinetics and thermodynamics. Water Research, Vol. 20 (1986), 21-26.
13. Ma,W., Tobin, J. Determination and modelling of effects of pH on peat biosorption of chromium, copper and cadmium. Biochemical Engineering Journal, Vol.18 (2004), 33-40.
14. Kalmykova, Y., Strombal, A., Steenari, B. Adsorption of Cd, Cu, Ni, Pb and Zn, on Sphangnum peat from solutions with low concentrations. Journal of Hazardous Materials, Vol. 152 (2007), 885-891.
15. Sen Gupta, B., Curran, M., Hasan, S., Ghosh, T.K. Adsorption characteristics of Cu and Ni on Irish peat moss. Journal of Environmental Management, Vol. 90 (2009), 954-960.
16. Swaine, D. Trace Elements In Coal. Butterworth & Co. Publ., London, 1990. [ Links ]
17. Caccamo, J. Efecto del tiempo y la temperatura de maduración artificial de turbas sobre la composición y distribución de la fracción de hidrocarburos saturados Trabajo Especial de Grado, Universidad Central de Venezuela, Caracas, 2007. [ Links ]
18. Villalba, M. Efecto del tiempo y la temperatura de maduración artificial de turbas sobre la composición y distribución de la fracción de marcadores aromáticos. Trabajo Especial de Grado, Universidad Central de Venezuela, Caracas, 2007. [ Links ]
19. Reategui, K. Efecto de la maduración térmica de la turba sobre su capacidad de adsorción de metales pesados. Memorias del 11º Congreso Latinoamericano de Geoquímica Orgánica, Porlamar, Venezuela. 2008. 4 p. [ Links ]
20. Christensen, T.H. Cadmium soil sorption at low concentrations: V. Evidence of competition by other heavy metals. Water, Air, and Soil Pollution, Vol. 34 (1987), 293-303.
21. Kyzio -Komosi ska, J., Twardowska, I., Kocela, A. "Adsorption of cadmium(II) ions from industrial wastewater by low moor peat occurring in the overburden of Brown Coal deposits." Archives of Environmental Protection, Vol. 34 (2008), 83-94.
22. Couillard, D., The use of peat in wastewater treatment. Water Research, Vol. 28 (1994), 1261-1274.
23. Bernal, J., Railsback, L. Introducción a la Tabla Periódica de los Elementos y sus Iones para Ciencias de la Tierra. Revista Mexicana de Ciencias Geológicas, Vol. 25 (2008), 236-246.
24. Ong, H., Swanson, V. Adsorption of copper by peat, lignite and bituminous coal. Economic Geology, Vol. 61 (1966), 1214-1231.
25. Zubovic, P. Physicochemical properties of certain minor elements as controlling factors in their distribution in coal. American Chemical Society, Advances in Chemistry Series, Vol. 55 (1966), 221-231.
26. Huheey, J., Keiter, E., Keiter, R. Química Inorgánica: Principios de estructura y reactividad. Oxford, México, 1997. [ Links ]
27. Yudovich, Y., Korycheva, A., Obruchnikov, A., Stepanov, Y. Mean trace element contents in coals. Geochemistry International, Vol. 9, (1972), 712-720.
28. Bouska, V. Geochemistry of coal. Elsevier Scientific Publishing, Praga, 1985. [ Links ]
Recibido el 19 de Julio de 2010 En forma revisada el 26 de Septiembre de 2011













