Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Latinoamericana de Metalurgia y Materiales
versión impresa ISSN 0255-6952
Rev. LatinAm. Met. Mat. v.22 n.2 Caracas jun. 2002
A. Loaiza-Gil1*, M. Olivo1, R. Casanova2, J. Mendialdua2, F. Rueda2,
A. Rodriguez2, Y. Ng Lee3
1. Lab. de Cinética y Catálisis, Dep. de Química, Fac. de Ciencias, Universidad de Los Andes
2. Lab. de Física de Superficies, Dep. de Física, Fac. de Ciencias, Universidad de Los Andes
Mérida, 5101 Venezuela, Tel./Fax: 0058-274-24013171/2401286 c.e: loaizag@ciens.ula.ve
Resumen
El método del amonio modificado fue utilizado para preparar catalizadores del tipo filosilicatos de hierro. Los estudios de caracterización por reducción a temperatura programada (RTP) de los catalizadores, indican que en los sólidos sintetizados se encuentran presentes por lo menos dos fases. Una fase de baja temperatura correspondiente a óxidos ó hidróxidos del metal y una fase de alta temperatura (1054 °C) correspondiente a filosilicatos de hierro. La presencia de estas fases también fue observada por espectroscopia infrarroja con transformada de Fourier (IRFT) y difracción de rayos X (DRX). Estudios realizados por espectroscopia de fotoelectrones de rayos X de éstos sólidos indican que la relación O/Si entre la parte del pico O1s que no está enlazada al hierro y el pico Si2p es de 2.5 típica de los filosilicatos. La actividad y selectividad a la formación de alcoholes superiores de éstos catalizadores fue estudiada, en un sistema de reacción de alta presión, después de someter estos sólidos a un pretratamiento térmico reductivo a 450°C. Los resultados indican que los sólidos reducidos usando velocidades de calentamiento de 0.5°C/min mantienen una superficie hidroxilada estable en las condiciones de reacción y son muy selectivos a la formación de alcoholes superiores. En estas condiciones, los catalizadores presentan valores de actividad y selectividad superiores a aquella obtenida para catalizadores de mayor carga metálica.
Abstract
The modified ammonia method was used to prepare iron Phyllosilicates catalyst type. The temperature programmed reduction profiles studies (TPR) show at least two phases in such catalysts. One phase at lower temperature corresponding to one metal oxide or hydroxide and an iron Phyllosilicate phase at higher temperature (1054 °C). Such phases were observed by Fourier Transformed Infrared Spectroscopy (IRFT) and X-ray Diffraction (XRD). Studies by X-ray Photoelectron Spectroscopy (XPS) indicated that the O/Si ratio between the part of the O1s peak not bonded to iron, and the Si2p peak is about 2.5 typical of Phyllosilicates. The activity and selectivity to the synthesis of higher alcohols of these catalysts was studied in a high pressure reaction system after a thermal reductive pretreatment at 450°C. The results indicated that the solids pretreated using a heating rate of 0.5°C/min kept an stable hydroxide surface under the reaction conditions and are very selective to the higher alcohols formation. In such conditions, the activity and selectivity is higher than for the high loading catalysts.
1. Introducción
Las recientes regulaciones ambientales en materia de combustibles en los Estados Unidos y en Alaska limitan el uso del metil-ter-butil-eter (MTBE) como aditivo en la gasolina sin plomo, debido a que durante la combustión se producen sustancias nitrogenadas tipo NOx con graves consecuencias para el medio ambiente. El metanol, etanol o las mezclas de alcoholes superiores [1] han sido vistos como posibles sustitutos del MTBE pues poseen características similares a este último, con la ventaja que la combustión ocurre a temperaturas inferiores evitándose la formación de compuestos nitrogenados.
Las especies químicas formiato y formilo, como posibles intermediarios en los procesos de síntesis de alcoholes, han llevado a Klier y col.[2] a proponer que la síntesis de alcoholes superiores es favorecida por la presencia de superficies hidroxiladas estables en las condiciones de reacción. Por otra parte, los mayores inconvenientes en los procesos de hidrogenación del monóxido de carbono se deben a la presencia de limitaciones difusionales de los reactantes en los poros de los catalizadores. Una forma de superar este inconveniente es el de diseñar catalizadores que posean tamaño de partículas metálicas muy pequeñas ó estructuras que no sean porosas. El método del amonio [3,4], inicialmente propuesto para preparar catalizadores soportados de níquel y cobalto con partículas metálicas de dimensiones nanométricas fue empleado en este trabajo con algunas modificaciones para preparar catalizadores de base hierro que serán empleados en las reacciones de síntesis de alcoholes superiores. Estudios anteriores sobre los sólidos preparados con este método sugieren que el metal interacciona con el soporte para formar un filosilicato de hierro que se descompone a altas temperaturas liberando el metal en forma de partículas muy finas sobre el soporte [5]. En estas condiciones, los catalizadores de hierro son muy activos a las reacciones de hidrogenación del monóxido de carbono y selectivos a la formación de parafinas y olefinas.
La actividad y selectividad de los catalizadores en los procesos de hidrogenación del monóxido de carbono, se encuentra estrechamente relacionada con el método de preparación, la naturaleza de los precursores empleados [6-12] y la forma del pretratamiento térmico reductivo previo a las reacciones de hidrogenación.
En este trabajo se estudiará la composición química y estructural de los catalizadores frescos y la evolución de éstos en condiciones de pretratamiento térmico en ambiente de hidrógeno por debajo de la temperatura de descomposición de los filosilicatos de hierro con la finalidad de establecer la existencia de superficies metálicas hidroxiladas, estables térmicamente, que permitan orientar la selectividad de las reacciones a la formación de alcoholes. Los estudios serán realizados por temperatura de reducción programada (TRP), Difracción de rayos X (DRX), espectroscopia Infrarrojo con transformada de Fourier (IRFT), espectroscopia de fotoelectrones Rayos X (XPS) y pruebas catalíticas.
La síntesis de alcoholes superiores a partir de la hidrogenación del monóxido de carbono (materia prima obtenida del gas natural) puede ser una alternativa muy atractiva desde el punto de vista industrial si se logra diseñar un catalizador adecuado para el proceso que sea económico y muy selectivo a la formación de alcoholes superiores. Además, el proceso debe tener lugar a presiones de operación intermedias pues los costos de compresión de los reactantes son muy elevados y encarecen el proceso.
2. Métodos y Procedimientos
El método de preparación usado es similar al descrito por Barbier y Col. [3] a excepción de la atmósfera inerte durante el manejo y preparación de los catalizadores, puesto que el precursor es nitrato de hierro (III). Este método consiste en poner en contacto sílice aerosil 200 (200 m2/g, Degusa) con hidróxido de hierro en solución obtenido por la adición de unas gotas y después un exceso de solución amoniacal (25% NH3, Riedel de-Haën) a una solución de Fe(NO3)3.9H2O (J.T Baker, 100% pureza). El pH de la solución fue mantenido en 12. Después de dos horas de contacto la solución es llevada a sequedad en una estufa por 48 horas a 80°C.
Los perfiles de reducción a temperatura programada se realizaron en un reactor de cuarzo de un equipo marca Micromeritics, modelo TPR/TPD 2900, operado desde temperatura ambiente hasta 1200 °C con una velocidad de calentamiento de 10 °C/min., usando una mezcla al 10% de hidrógeno en argón. Las muestras, de 150 mg de peso promedio, fueron sometidas a un pre-tratamiento térmico en flujo de aire antes de las medidas de TPR.
Los espectros infrarrojo de los catalizadores frescos con concentración de hierro desde 1% al 20% fueron realizados en un espectrofotómetro Perkin Elmer 1725X con una resolución de 4 cm-1 previa dilución en KBr. El análisis de los espectros IR se realizó tomando como referencia los espectros de la sílice aerosil 200 y del nitrato de hierro (III) tratados con el método del amonio en forma separada. Los análisis de XPS fueron realizados en un espectrómetro VSW operado en el modo DE= const. Se tomó como referencia el pico C1s = 285 eV del carbono de contaminación a fin de tener en cuenta los posibles efectos de carga de la muestra en examen. La muestra analizada contiene el 10% de hierro y fué sometida a calentamiento en ultra alto vacío en el espectrómetro a las siguientes temperaturas:134°C, 174°C, 217°C, 334°C, 589°C, con una velocidad de calentamiento de 1°C/min. Después de la última temperatura la muestra se calentó en corriente de oxígeno ultra seco y después en hidrógeno a 500 °C.
Los análisis por difracción de rayos X (método de polvo) de los catalizadores se realizaron en un difractómetro Phillips PW1050/25 con radiación CuKa (l = 1.5406 Å).
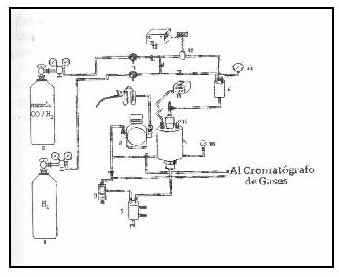
Las pruebas catalíticas fueron realizados en un sistema de reacción de lecho fijo y flujo continuo construido en acero inoxidable ( Figura 1) y conectado en línea a un cromatógrafo de gases Hewlett Packard 6890 Plus equipado con dos columnas empacadas Porapak Q (10x1/8, 80/100 mesh) y molecular sieve 13X (10x1/8, 80/100 mesh) conectadas en serie, para la determinación de los gases permanentes y los hidrocarburos ligeros. Una columna capilar HP1 de 100 m x 0.25 mm x 0.5 mm fue empleada para la identificación y cuantificación de los alcoholes superiores y los hidrocarburos líquidos y gaseosos. El catalizador fue reducido in situ en flujo de hidrógeno (10 ml/min.) a 450 °C por 55 horas. Esta temperatura fue alcanzada a una velocidad de calentamiento de 1°C/min para catalizadores con diferente concentración de metal y a 0.5°C/min, 1°C/min. y 2°C/min para catalizadores con igual concentración de metal. Las pruebas de actividad a la síntesis de alcoholes superiores se realizaron a una temperatura de 240°C y 34 atmósferas de presión usando una relación molar de alimentación de los gases reactantes (H2/CO) de 1:1 (AGA Gas, 99,9% pureza) y una velocidad
Fig. 1 Sisxtema de reacción de lecho fijo en flujo continuo. Reactor y horno (4), Condensador (5) , Mezclador (6), Válvulasde flujo (7), Válvula de presión (9) Microcontrolador de Temperatura (11).
3. Resultados y Discusión.
3.1.Caracterización
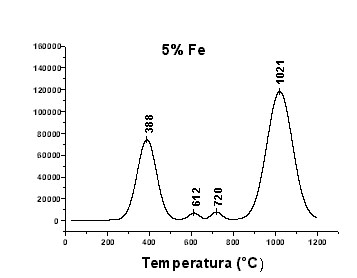
En las figuras 2 y 3 se presentan los perfiles de reducción a temperatura programada de dos catalizadores de base hierro al 5% y al 9% preparados con el método del amonio. En la Figura 1 se observa que el catalizador preparado con el 5% de hierro presenta dos importantes picos de reducción. El primero a 388°C correspondiente a especies de hierro másico del tipo Fe2O3 ó mas probablemente Fe(OH)3 debido al método de preparación. El segundo pico se presenta a 1021 °C correspondiente a especies hierro difícilmente reducibles, probablemente a filosilicatos de hierro del tipo FeO(OH)(Si2O5)2 ó Fe(OH)2(Si2O5)2.
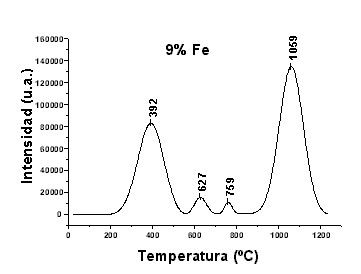
La relación de àreas entre los principales picos de reducción es 1:2. en la Figura 3 se observa que al aumentar la concentración de hierro aumenta la intensidad de los picos de reducción. La relación de áreas es de 1:1.5 indicativa del incremento de la fase másica. En este caso se definen mejor los picos de reducción a temperaturas intermedias de 617 °C y 761 °C correspondientes a hierro másico y probablemente a un hexacuocomplejo de hierro no incorporado a la red silícea del tipo Fe+3(H2O)6 derivado del método de preparación [3,4].
Un análisis previo de la sílice aerosil 200 usada como soporte tratada con el método del amonio en ausencia de metal indica que ésta no presenta picos de reducción.
Fig. 2. Perfil de Reducción a Temperatura Programada (RTP) de un catalizador al 5% Fe.
Fig. 3. Perfil de Reducción a Temperatura Programada (RTP) de un catalizador al 9% Fe.
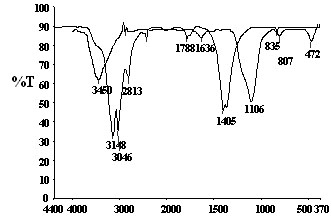
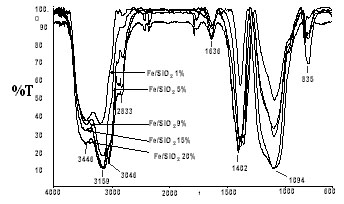
Los espectros infrarrojo FT de la sílice aerosil 200 y del nitrato de hierro (III) preparados en las mismas condiciones de los catalizadores se comparan en la figura 4. Se observa que la sílice tratada en agua y solución amoniacal ( Fig. 4a) presenta bandas de adsorción en 3450 cm-1 y 1640 cm-1, atribuibles a los modos de vibración de estiramiento del hidrógeno enlazado a los grupos OH de la sílice y a la vibración por flexión del hidrógeno en H-O-H del agua de cristalización. Las vibraciones de estiramiento simétricas de los grupos Si-O de la sílice se observan alrededor de 1100 cm-1, mientras que las vibraciones de estiramiento asimétricas y de flexión de estos grupos se observan alrededor de 810 y 470 cm-1 en ese orden. En la parte b ( Fig.4) se observan las bandas características de vibración del hidrógeno enlazado a grupos OH del hierro en forma de asociaciones poliméricas ó OH intermolecular (hidroxilos) en el rango 3148 cm-1 a 3046 cm-1. La banda de 1405 cm-1 corresponde a la vibración del NO3+ del ión nitrato [13]. Las bandas identificadas en los espectros usados como referencia se encuentran en los espectros de los catalizadores sintetizados con el método del amonio. En la Figura 5 se muestra la evolución de los espectros infrarrojo de los catalizadores de hierro por efecto del aumento de la carga metálica.
Fig.4. Espectros IRFT de referencia. El espectro a corresponde a la sílice aerosil 200 tratada con el método del amonio . El espectro b al nitrato de hierro (III) hexahidratado tratado con el mismo método.
En cada uno de los espectros infrarrojo de los catalizadores sintetizados se presentan dos bandas anchas en la región de alta frecuencia. La banda en 3446 cm-1 puede ser asignada a la fase filosilicato de hierro [14] mientras que la banda que aparece en 3159 cm-1 corresponde a una fase metálica hidroxilada probablemente un hidróxido de hierro (III). A medida que aumenta la carga metálica aumenta la intensidad de la banda asociada al hidróxido del metal. Para concentraciones de metal superiores al 9% en los catalizadores sintetizados se observa la aparición de una banda en 3046 cm-1 correspondiente probablemente a una fase metálica compleja del tipo Fe+3(H2O)6. Estudios anteriores indican que las bandas 3156 y 3046 cm-1 desaparecen progresivamente por efecto del tratamiento térmico reductivo en flujo de hidrógeno al aumentar la temperatura desde ambiente hasta 700 °C [15], indicativo de una fase reducible a relativamente baja temperatura y una fase de alta temperatura.
Fig. 5. Espectros infrarrojo de catalizadores de base hierro sintetizados con el método del amonio. Efecto del aumento de la carga metálica.
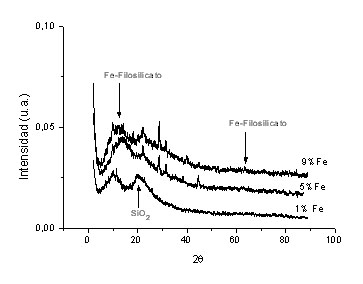
En la Figura 6 se presentan los patrones de difracción de los catalizadores de base hierro sintetizados con el método del amonio. El catalizador con el 1% de hierro presenta el patrón de difracción característico de la sílice (SiO2) a excepción de un pico en 2q = 17.8 ° asociado a las especies filosilicato (Si2O5) [16]. A medida que aumenta la carga de hierro en el catalizador se define mejor la fase filosilicato con una línea de difracción característica en 2q =61.3°.
Fig. 6. XRD de filosilicatos de hierro al 1, 5 y 9%.
Además, se observan líneas de difracción típicas del Fe(OH)3. Estos resultados indican que en los sólidos sintetizados con el método del amonio, se encuentran presentes por lo menos dos fases sólidas.
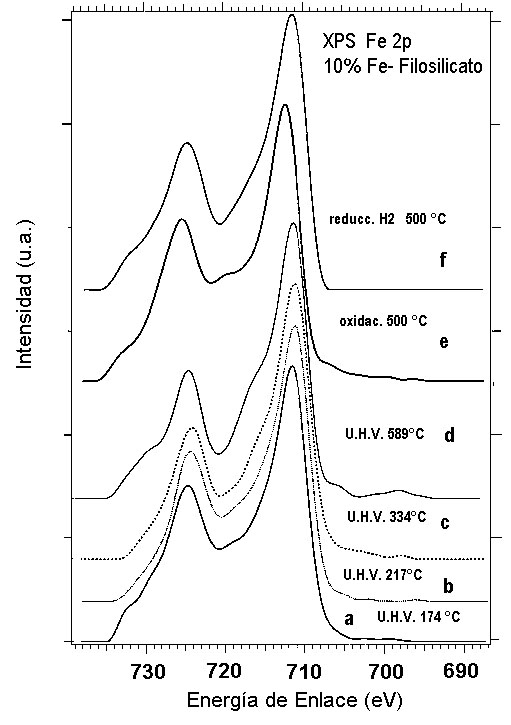
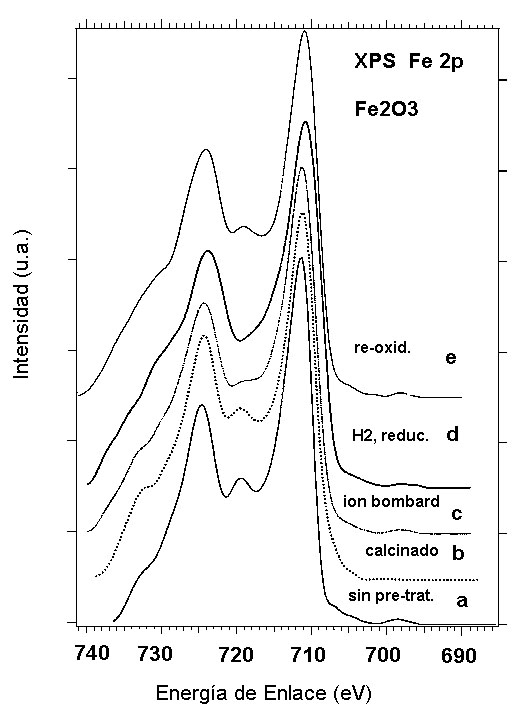
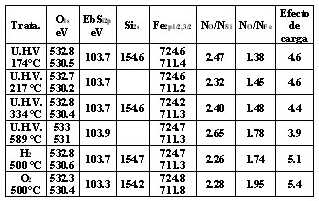
Una fase cristalina atribuible principalmente a hidróxido de hierro (III) que aumenta al aumentar la concentración del metal en el catalizador y una fase filo- silicato de hierro. Estos resultados concuerdan con auellos obtenidos por RTP y IRFT. En las Figuras 7 y 8 se presentan las regiones espectrales XPS del Fe2p de un catalizador al 10% Fe sintetizado con el método del amonio y sometido a los diferentes tratamientos antes mencionados. Los espectros XPS de la región Fe2p de un oxido de hierro (III) comercial sometido a tratamientos similares se presenta en la Figura 7 con fines comparativos. Las mayores diferencias que se observan entre los espectros de las Figuras 7 y 8 residen en la estructuras satélites tipo shake up que se encuentran situadas entre los picos 2p3/2 y 2p1/2 así como las que aparecen en la zona de alta energía de enlace a la izquierda de Fe2p1/2. Sin embargo las energías de enlace de ambas muestras (catalizador y Fe2O3 comercial) son muy similares como se puede observar en la Tabla 1. En el catalizador de hierro, para todos los tratamientos, la energía de enlace corresponde a Fe+3. Además, el tamaño del ancho del pico Fe2p3/2 medido a media altura es muy similar al presentado por las muestras de Fe2O3 sin tratamiento, calcinada y re oxidada.
Fig. 7. XPS de la región Fe 2p de un catalizador al 10% de hierro sintetizado con el método del amonio.
Fig. 8. XPS de la región Fe 2p de Fe2O3 comercial.
De la comparación de los espectros XPS de el catalizador de hierro y de la muestra comercial se deduce que la diferencia mas importante entre ellos estriba en las estructuras satélites. Estas estructuras están vinculadas a los niveles de valencia y sugieren que el entorno químico de los átomos de hierro presentes en las muestras del catalizador es diferente al que existe en la muestra de Fe2O3 e incluso en FeOOH. Esto es particularmente evidente en las muestras de catalizador sometidas a ultra alto vacío (U.H.V.) a 334 °C, a 589 °C y reducidas en hidrógeno a 500 °C. El tratamiento en oxígeno a 500 °C permite recuperar las estructuras satélites.
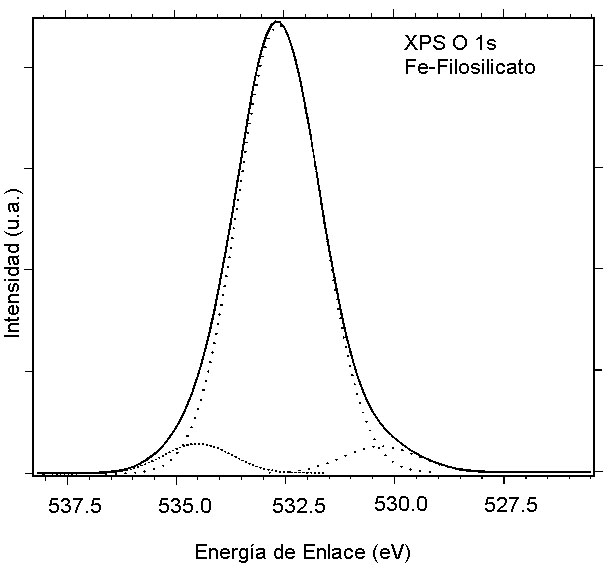
En la Figura 9 se presenta una descomposición típica del pico O1s del catalizador de hierro. En la Tabla 1 se presentan los valores obtenidos para las energías de enlace, así como la relación cuantitativa entre la concentración de oxígeno y silicio. Puede así mismo observarse el efecto de carga presentado por las muestras en cada tratamiento.
Fig. 9. Espectro XPS de la región O1s del catalizador al 10% Fe/SiO2 sintetizado con el método del amonio.
Tabla 1. Energías de Enlace del catalizador Fe-Filosilicato.
Se observa que los valores de la energía de enlace del nivel Si2p en las muestras de catalizador es similar al del SiO2; lo mismo puede decirse para la componente del pico O1s relativa al silicio. Por otra parte , la fracción del pico O1s relativa al hierro presenta un valor casi igual al del Fe2O3.
Los valores de energía de enlace del nivel Fe2p son ligeramente superiores a los obtenidos para ese nivel en Fe2O3 situándose entre los de este compuesto y el FeOOH [17]. La relación cuantitativa entre el oxígeno y el silicio, obtenida a partir de la relación de intensidades entre la parte del pico O1s que no está relacionada con el hierro y el pico Si2p arroja valores mas cercanos a 2.5 que a 2.0, lo cual corresponde a la relación esperada para los filosilicatos (Si2O5). Por otro lado, la relación de intensidades entre la parte del pico O1s relacionado con el hierro y el pico Fe2p arroja una relación cuantitativa cercana a 1.5 correspondiente a Fe2O3. Sin embargo la poca cantidad de hierro presente (relación de superficie NSi/NFe entre 14 y 15) hace que la parte del pico O1s relacionada al hierro sea muy pequeña por lo que los valores NO/NFe pueden estar afectados de gran error a diferencia de los valores NO/NSi cuyos resultados son enteramente confiables. Estudios detallados de la región Auger del oxígeno de estos catalizadores y de la sílice[18] indica que existe un mayor pronunciamiento de la estructura asociada a la transición KL2L2 en la muestra del catalizador
3.2 Pruebas catalíticas
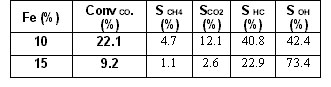
Todas las pruebas catalíticas de los catalizadores sintetizados con el método del amonio fueron realizadas en las mismas condiciones de operación a fin de establecer el efecto del incremento de la carga metálica y de la velocidad de calentamiento durante el proceso de pretratamiento sobre la selectividad a productos de reacción. En la Tabla 2 se presentan los resultados del efecto de la carga metálica sobre la actividad y selectividad. Estos valores fueron medidos en condiciones de estado estacionario que fue alcanzado después de 12 a 15 horas del inicio de la reacción.
Tabla 2. Efecto de la carga metálica sobre la conversión y selectividad a alcoholes superiores.
Se observa que la conversión disminuye al aumentar la carga metálica en el catalizador mientras que la selectividad a alcoholes superiores en el rango C1-C6 aumenta en forma marcada. Al mismo tiempo disminuye la selectividad a hidro carburos (C2-C4), a CO2 y a metano. Se ha observado que el área superficial y el área metálica disminuyen al aumentar la carga metálica [4] probablemente porque aumenta la fase másica respecto a la fase filosilicato. Los hexacuo-complejos de hierro del tipo Fe+3(H2O)6 no asociados a la red silícea es probable que también aumenten por efecto del incremento de la carga metálica. La presencia de estas especies podría explicar el aumento de la selectividad a alcoholes superiores.
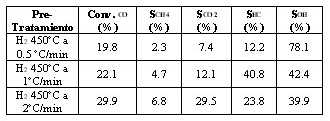
En la Tabla 3 se observa la influencia de la velocidad de calentamiento usada durante el pretratamiento térmico sobre la conversión y selectividad a productos de interés.
Tabla 3. Conversión y selectividad en las reacciones de hidrogenación del monóxido de carbono en función del pretratamiento térmico.
Se observa que a medida que aumenta la velocidad de calentamiento, aumenta la conversión, la selectividad a metano y a dióxido de carbono y disminuye la selectividad a alcoholes superiores. La selectividad a hidrocarburos inicialmente aumenta al pasar de 0.5 a 1°C/min pero al usar 2°C/min disminuye y se forma gran cantidad de dióxido de carbono. La distribución de los alcoholes superiores formados (C1-C6) no cambia en forma significativa produciéndose principalmente metanol (50%) seguido de etanol (38%), 1-propanol (8%), 1-butanol (2.5%), 1-pentanol (1%) y 1-hexanol (0.5%).
El empleo de bajas velocidades de calentamiento durante el pretratamiento térmico reductivo disminuye la ocurrencia de los procesos de sintéresis debido a que la reducción ocurre en condiciones de seudo-estabilidad térmica. Por otra parte, los estudios de caracterización indican que durante este proceso se reduce solo la fase metálica másica. La fase filosilicato de hierro debería sufrir solo un proceso de limpieza ofreciendo una superficie con una elevada concentración de grupos hidroxilos que favorecen las reacciones de síntesis de alcoholes superiores. El incremento de la velocidad de calentamiento favorece la perdida de grupos hidroxilos e incrementa la superficie metálica orientado la selectividad a la formación de hidrocarburos en vez de alcoholes superiores.
4. Conclusiones
Los catalizadores de base hierro sintetizados con el método del amonio presentan por los menos dos fases. Una fase metálica másica reducible a baja temperatura del tipo Fe(OH)3 o Fe2O3 y una fase reducible a alta temperatura probablemente un Filosilicato de hierro del tipo FeO(OH)2(Si2O5)2 ó Fe(OH)2(Si2O5)2.
Los estudios realizados por espectroscopia Infrarrojo FT, Temperatura de reducción programada y difracción de rayos X (DRX) indican que al aumentar la concentración de metal en el catalizador aumenta la fase másica y el carácter cristalino del catalizador.
Los estudios realizados por espectroscopia de fotoelectrones de rayos X (XPS) sugieren la presencia de la sílice bajo la forma Si2O5 (Filosilicato). En las condiciones de reducción usadas en este experimento el hierro no sufre modificaciones apreciables y se encuentra bajo la forma Fe+3.
La actividad catalítica de estos sólidos fue probada en las reacciones de síntesis de alcoholes superiores. La selectividad a estos productos sufre la influencia de la carga metálica y de las condiciones del pretratamiento térmico. En particular, la conversión del monóxido de carbono disminuye y la selectividad a alcoholes superiores aumenta al aumentar la carga metálica. Valores mayores de selectividad a alcoholes superiores a mayor conversión del monóxido de carbono fueron obtenidos usando catalizadores de menor carga metálica reducidos en hidrógeno a bajas velocidades de calentamiento (0.5°C/min), sugiriendo que en estas condiciones se mantiene una superficie hidroxilada, estable en las condiciones de reacción, que favorece la síntesis de alcoholes superiores.
Agradecimientos
Al FONACIT Proyecto S1- 2000000809 y al CDCHT-ULA Proyecto C-942-99-08-AA.
5. Referencias
1. Symposium on Future Fuels for Advanced Vehicles. INTEVEP, PDVSA, Caracas-Venezuela 21 Marzo 2001. [ Links ]
2. G.A. Vedage, R. Pitchai, R.G. Hermann, K. Klier. Proc. 8th Cong. Catalysis, Berlin, 2 (1984) 47. [ Links ]
3. G.A. Martín, B. Imelik, M. Prette, J. Chim. Phys.,66 (1969)1682. [ Links ]
4. A. Barbier, A. Hanif, J.A. Dalmon, G.A. Martin, Applied Cata., 168 (1998)333. [ Links ]
5. A. Loaiza-Gil, Memorias V Congreso Venezolano de Química.. Maracaibo-Venezuela (2001)1001. [ Links ]
6. M.E. Dry, in: The Fischer Tropsch Synthesis, Catalysis Science and Technology; J.R Anderson, M.Boudart, Eds.; Springer, Berlin, 1981; Vol. 1., p.160. [ Links ]
7. M.E Dry, Ind. Eng. Chem. Prod. Res. Dev., 15 (1976)282. [ Links ]
8. K. Takeuchi, T. Matsuzaki, T.A. Hanaoka, H. Arakaura, Y. Sugi., J. Mol. Catal. 55 (1989)361. [ Links ]
9. M.P. Rosynek, C.A. Polansky, Applied Catal. 73 (1991)97. [ Links ]
10. J.A. Dalmon, G.A. Martin, B. Imelik, J. Chim. Phys. 70 (1973)214. [ Links ]
11. R.J. Madon, W.F. Taylor, J. Catal., 69 (1981)32 [ Links ]
12. A.S. Lisitsyn, A.V. Golovin, V.L. Kuznetsov, Y.I. Yermakov, C1, Mol. Chem. 1 (1984) 115. [ Links ]
13. W.A.Deer, R.A. Howie, J. Zussman. An Introduction to the rock forming mineral. Ed. Longman, London, (1966),p.193. [ Links ]
14. K.Kiss-Erös. Comprehensive Analytical Chemistry. Wilson & Wilsons, Analytical Infrared Spectroscopy, Vol.6, G. Svehla Editor, Elsevier (1976) p.319 [ Links ]