Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Latinoamericana de Metalurgia y Materiales
versión impresa ISSN 0255-6952
Rev. LatinAm. Met. Mat. v.26 n.1-2 Caracas ene. 2006
Síntesis de nanopartículas de a-Al2O3 a partir de Al2(SO4)3.18H2O estudio de los mecanismos de formación de las partículas
Janeth Cobo Quezada1, Claudia F. Villaquiran 1, Alberto Scian 2, Jorge E. Rodríguez-Páez 1*
1.Grupo CYTEMAC, Universidad del Cauca, Popayán-Colombia.
2.CETMIT, LA Plata-Argentina.
* E-mail: jnpaez@unicauca.edu.co
Publicado On-Line: 11-Dic-2006
Disponible en: www.polimeros.labb.usb.ve/RLMM/home.html
Resumen
La alúmina se obtiene normalmente utilizando el proceso Bayer, ella se emplea industrialmente para obtener abrasivos, aisladores eléctricos, soporte para catalizadores, refractarios, material de relleno para polímeros, entre otros usos, y sus propiedades se pueden modificar variando la temperatura de calcinación y el tamaño de partícula. Actualmente, se analizan diversos métodos de síntesis para la obtención de a-Al2O3 con el fin de favorecer una u otra característica exigida para una aplicación en particular. Ellos presentan ventajas y desventajas y tienen en común una completa descripción del mismo pero no se hace mención de los posibles mecanismos de formación de las partículas. A continuación se hace un análisis del proceso de obtención de las partículas de alúmina a partir del Al2(SO4)3.18H2O utilizando el método de precipitación controlado (MPC), poniendo especial interés en la conformación de los complejos y compuestos intermedios de aluminio que se forman a medida que se desarrolla el proceso de síntesis. Los resultados obtenidos por microscopía óptica, FTIR, ATD, TG, DRX, y MET indican que factores tales como el pH, velocidad de agitación y la naturaleza del solvente de lavado inciden en la conformación de los distintos complejos intermedios de Alúmina y las propiedades finales de las partículas de a-Al2O3.
Palabras claves: Síntesis, Alúmina, Complejos de Al, Nanopartículas, Precipitación controlada.
Abstract
Alumina is normally obtained employing the Bayer process, it is employed industrially in order to obtain abrasives, electrical insulators, catalysts supports, refractory materials, filling material for polymers, among other uses, and its properties can be modified by varying its calcination temperature and particle size. Nowadays, several synthetic methods for a-Al2O3 are being analyzed in order to meet the demands of particular applications. These methods have advantages and disadvantages and they have in common a complete description of the method in question but they do not mention the possible formation mechanisms of the particles. In what follows an analysis is made of the Alumina particle production from Al2(SO4)3.18H2O by the use of the controlled precipitation method (CPM), placing special interest in the conformation of the complexes and intermediate compounds of Aluminum that are formed throughout the synthesis process. Results obtained by optical microscopy, FTIR, ATD, TG, XRD and TEM indicate that factors such as pH, stirring speed and the nature of the washing solvent influence the conformation of the different intermediate Alumina complexes and the final properties of the a-Al2O3 particles.
Keywords: Synthesis, Alumina, Al complexes, Nanoparticles, Controlled precipitation.
Recibido: 19-Oct-2006; Revisado: 05-Dic-2006; Aceptado: 06-Dic-2006
1. INTRODUCCIÓN
Las diferentes formas cristalinas del óxido e hidróxido de aluminio, presentan un gran interés científico y tecnológico debido a su alta dureza, área superficial, alto punto de fusión, poco carácter volátil, inercia química y buenas propiedades como aislador eléctrico que ellas presentan. La a-Al2O3 es la fase termodinámicamente más estable, los hidróxidos y oxi-hidróxidos que se forman generalmente, son: Gibbsita: (AlO(OH)3), Bayerita: (a-Al(OH)3), Bohemita: (?-AlOOH), y Diáspora: (a-AlOOH) [1].
Existen diversos métodos para obtener Alúmina. Algunos de estos métodos son complejos, pero todos presentan sus ventajas y desventajas, por lo que es necesario realizar estudios sistemáticos para determinar la conveniencia de los mismos. Para obtener alúmina, por el método de disoluciones, se han utilizado una gran variedad de precursores destacándose el Al2(SO4)3.xH2O (x = 18 ó menos). Uno de los métodos empleados es el de precipitación homogénea donde se utiliza la descomposición de la urea a temperaturas mayores de 70ºC [2]. Nagai y colaboradores [3] dan una detallada descripción de este proceso. Otros métodos son: secado por congelamiento [4], rocío pirolítico [5] o simplemente evaporando el líquido [6] La presencia de grupos OH en el precursor puede ayudar a disminuir la temperatura de cristalización y obtener partículas de alúmina de alta pureza. Henry y Nelly [7] hacen una adecuada descripción de la obtención de alúmina a partir de soluciones acuosas de NH4HCO3 y NH4Al(SO4)2.
Por otro lado, la técnica de emulsiones se ha utilizado para obtener aglomerados de alúmina con características controladas [8] una modificación de este método, denominada sol-emulsión-gel, ha permitido obtener esferas de a-Al2O3 a una temperatura de calcinación relativamente baja. Por último es necesario mencionar que la hidrólisis de alcóxidos, método sol-gel [9], ha permitido obtener partículas de alúmina esféricas aunque muy poco se ha publicado sobre la explicación de los fenómenos que ocurren durante este proceso [10-12].
El método que se utilizó en este trabajo, para sintetizar la alúmina Al2O3, fue el método de precipitación controlada (MPC). En el método de precipitación controlada se parte de una solución que contiene una sal soluble del catión de interés en un medio acuoso, después de obtener una solución homogénea se procede a la adición del agente precipitante de forma controlada, con el sistema en continua agitación. Durante la adición del agente precipitante, se registran los cambios de pH, conductividad, temperatura y las modificaciones físicas que el sistema experimenta [11,13]. Durante el desarrollo del MPC, las reacciones de hidrólisis y policondensación de los cationes son muy importantes y juegan un papel determinante en la formación de la fase sólida y transformación de las diferentes fases cristalinas.
En este trabajo se muestran los resultados al sintetizar a-Al2O3, de tamaño nanométrico, utilizando el método de precipitación controlada, tomando como precursor sulfato de aluminio. Se hace un análisis de las reacciones de hidrólisis y condensación que ocurren en el sistema Además se analiza el efecto del proceso de lavado y redispersión en etanol sobre los compuestos intermediarios durante los tratamientos térmicos que lleva a la formación de las partículas. El polvo cerámico obtenido se caracterizó con DRX, FTIR, ATD TG y microscopía.
2. PARTE EXPERIMENTAL
El método que se utilizó en este trabajo, para sintetizar a-Al2O3, fue MPC (Figura 1).
Figura 1: Diagrama de flujo del proceso de síntesis llevado acabo durante este estudio
Inicialmente se obtuvieron las curvas de valoración potenciométrica a temperatura ambiente para monitorear la evolución del sistema durante la adición de NH4OH a una velocidad de 0,03 cm3/seg en una solución de Al2(SO4)3.18H2O , (Carlo Erba Reagenti), con base a ellas se determinaron las diferentes etapas del proceso y se analizaron los diferentes procesos físico-químicos que pueden ocurrir en el sistema. El pH se midió utilizando un potenciómetro METROHM 744.}
2.1 Lavados y Redispersión en Etanol
n proceso de lavado y redispersión en Alcohol Etílico absoluto anhidro (etanol), marca Mallinckrodt, se realizó con el precipitado obtenido en el sistema con el fin de tratar de eliminar el sulfato (SO42-) dada la característica de polaridad del alcohol etílico [14].
La suspensión coloidal obtenida del proceso de precipitación controlada, se filtró utilizando una bomba de vacío BUCHI B-169, el sólido húmedo resultante se redispersó usando un agitador RW 20 JANKE y kunkel Kira-labotechik a una velocidad de 100 revoluciones por minuto (r.p.m) en un volumen definido de alcohol; se formó nuevamente un gel, el cual se dejó envejecer durante 24 horas para luego volver a repetir el proceso indicado. Este proceso se repitió 3 veces. El sólido húmedo, producto del filtrado de la solución obtenida de la tercera redispersión, se secó en una estufa a 70ºC durante un tiempo de 24 horas. Luego se molió para obtener un polvo que posteriormente se sometió a diferentes tratamientos en un horno programable durante una hora.
2.2 Caracterización del sistema
Para caracterizar la fase coloidal se utilizó un microscopio óptico de polarización NIKON MicrophoT Para ello se tomaron muestras en diferentes etapas del proceso, con base en las curvas de valoración potenciométrica obtenidas previamente; se tomaron fotografías a la suspensión a diferentes valores de pH: 4,1; 7,5 y 9,2. Se realizó un estudio con espectroscopia Infrarroja por Transformada de Fourier (FTIR) con el fin de determinar los grupos funcionales presentes en los sólidos y ver como se modifican al ser sometida las muestras a tratamientos químicos. Difracción de Rayos-X (DRX) se utilizó para determinar las fases cristalinas presentes en muestras sólidas obtenidas en diferentes etapas del proceso así como para conocer la evolución de las mismas cuando los sólidos se someten a tratamientos químicos y térmicos para ello se utilizó el difractómetro RICAKU RING 2200 con geometría Braga-Bietano y programa de operación DMAX. Las condiciones de medición fueron 40 KV y 19 kA, radiación Cu Ka1 (? = 1,54056 Å), velocidad de goniómetro de 5-2º /min empezando en 2º y terminando en 70º , los resultados fueron comparados superponiendo las líneas de la base sobre el difractograma (identificación por huella digital).
Se utilizaron los ensayos de análisis térmico ATD/TG para determinar las diversas reacciones, endotérmica y exotérmicas, que ocurren en las muestras sólidas obtenidas a diferentes valores de pH las curvas ATD/TG. Finalmente, en este trabajo se empleó Microscopia Electrónica de Transmisión (MET) para determinar el tamaño y la morfología de las partículas de a-Al2O3 obtenidas, en el proceso utilizando par ello el equipo JEOL 2000.
3. RESULTADOS Y DISCUSIÓN
3.1 Valoración Potenciométrica del Sistema Al2(SO4)3. 18H2O - H2O
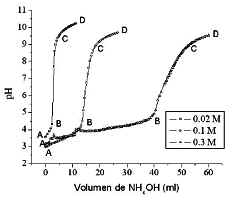
La curva de valoración potenciométrica de la Figura 2, obtenida para una solución 0,02 M; 0,1 M y 0,3 M de Al2(SO4)3, presenta 3 regiones muy bien definidas: dos regiones de poca variación del pH (AB y CD) y un salto (BC). La primera región, AB, corresponde a una zona con poca variación de pH, lo que indica un alto consumo de OH- por parte del sistema, además, desde el primer momento de adición de NH4OH se forma un precipitado que hace que la solución adquiera un color lechoso. La segunda región, BC, muestra una marcada variación de pH y la última, CD, representaría la saturación del sistema.
Figura 2: Curvas de valoración potenciométricas para diferentes concentraciones de sulfato de aluminio.
Al disolver el precursor de aluminio (Al2(SO4)3.18H2O ), en agua, se obtuvo una solución transparente y homogénea. El Al2(SO4)3.18H2O debería disociarse de acuerdo a la siguiente reacción:
Al2(SO4)3 (s) ® 2Al3+ (ac) + 3(SO4) 2- (ac) (1)
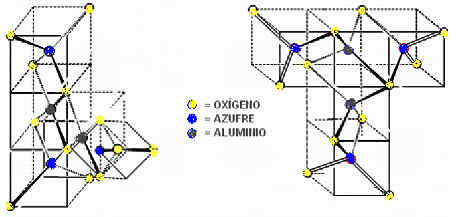
Pero debido a que el SO42- es un ligando fuerte, no debe presentarse una disociación completa del precursor generándose en el sistema complejos de Al+3 con iones sulfato bidentados y una estructura tetraédrica regular; a continuación en la Figura 3 se proponen las posibles estructuras que puede presentar el sulfato de aluminio, donde el ión sulfato está ligado al Aluminio por medio de 2 oxígenos acorde con un ligando bidentado
Considerando la formación de estos complejos, es posible que ocurra una hidrólisis parcial del precursor de acuerdo a la siguiente reacción:
Al2(SO4)3 (s) + 6H2O ®
[Al(SO4)2(H2O )2]- (ac) + [Al(SO4)(H2O )4]+(ac) (2)
Por lo tanto, el sulfato de aluminio se disociaría parcialmente dada la fortaleza del ión sulfato como lígate bidentado, formando especies acuo sulfatadas de aluminio tales, como las que se indican en la reacción 2. Posteriormente, cada una de las especies formadas a través de la reacción anterior experimentaría reacciones de hidrólisis. Por otro lado, dado el gran poder de solvatación de las moléculas de agua, es posible la formación de la especie (Al(OH2)6)3+ con seis (6) moléculas de agua como primeros vecinos, a través de las siguientes reacciones:
[Al(SO4)2(H2O )2]- (ac) + 2H2O ®
[Al(SO4)(H2O )4]+ (ac) + SO4 2- (ac) (3)
[Al(SO4)(H2O )4]+(ac) + 2H2O ®
(Al(OH2)6)3+ (ac) + SO4 2- (ac) (4)
Durante el desarrollo de las reacciones de hidrólisis, se podrían formar especies acuo hidroxo sulfatadas de aluminio del tipo: [Al(SO4)2(H2O )(OH)]-2(ac), [Al(SO4)2(OH)2]-2(ac), [Al(SO4)(OH)4]-3(ac).
La generación de estas especies también permitiría la producción de protones, H+ que incrementan la acidez del medio lo que explicaría en parte, el bajo valor de pH de la solución inicial al disolver el sulfato de aluminio en agua, Tabla 1 (ver punto A de la Figura 2).
Tabla 1: pH inicial de las soluciones de sulfato de aluminio a diferentes concentraciones.

Por otro lado hay que descartar la hidrólisis del catión hexaacuo y la hidrólisis extensiva del complejo acuo de acuerdo a las siguiente reacciones [15]:
(Al(OH2)6)3+ + hH2O ®
(Al(OH)h(OH2)6-h)(3-h)+ + hH3O+ (9)
hH3O+ + hOH- ®2hH2O (10)
En la región AB, la reacción entre las especies mononucleares hidrolizadas de aluminio y sulfato de aluminio da origen a especies pólinucleares a medida que se realiza la adición de NH4OH. Por las
Figura 3: Estructura propuesta para el sulfato de aluminio [14].
reacciones de olación (M-OH + M-OH2 ® M-OH-M + H2O ) y oxolación (M-OH + M-OH ® M-O-M + H2O ); estos complejos pólinucleares actuarían como precursores para la formación de los embriones [16]. Según la literatura, las especies pólinucleares (Al2(OH)2(OH2)8)4+, [Al13O4(OH)24(OH2)12]7+ y el (Al3(OH)4(OH2)9)5+ predominarían entre valores de pH 3,5 y 4,5. La primera especie polinuclear permitiría la formación de un sulfato básico de aluminio, [Al2(OH)2(H2O )8](SO4)2, en el sistema[17]; esta sal básica de aluminio se conformaría en la región AB de la curvas de valoración potenciométrica. Por otro lado, a partir de la especie polinuclear [Al13O4(OH)24(OH2)12]7+ se pueden conformar otros sulfatos básicos de aluminio, que además incorporarían amonio, y cuya fórmula típica podría expresarse como (NH4)7[Al13O4(OH)24(H2O )12](SO4)7xH2O [17] otro dímero que se podría formar por la presencia del amonio es el [Al2(OH)2(H2O )2(NH4)6]4+.
El salto de pH en la región BC, Figura 2, es muy abrupto y permite determinar de manera muy precisa el punto de equivalencia correspondiente a un valor de 5,45. Aproximadamente a un pH de 5,1 se observó un aumento de la viscosidad del sistema pues pese a la agitación constante a que fue sometido el sistema, este quedó inmóvil, por unos segundos, y recuperó su fluidez al adicionarle más NH4OH. En esta región BC debe presentarse una reducción de la eficacia del proceso de conformación de los complejos de aluminio, y por lo tanto de la formación de núcleos de la fase sólida.
En la región CD, de la Figura 2, se mantuvo la textura homogénea del sistema, su color lechoso que indica la presencia de precipitado en el sistema sin que ocurra un proceso de redisolución irreversible [18] y el olor a amoniaco se hace evidente; en esta región predominan los procesos de saturación y muy poco el de redisolución de la suspensión coloidal. A valores altos de pH, la especie predominante de aluminio es el AlO2- [13,17].
En la Figura 2 también se puede observar como se modifican las curvas de valoración potenciométrica al variar la concentración de Al2(SO4)3 en el sistema. La extensión de la región AB se incrementa a medida que aumenta la concentración inicial del precursor. Dado que las reacciones de policondensación y la formación de núcleos son los procesos más importantes en esta región, es de esperar que la cantidad de núcleos que se forman sea mayor para el sistema con mayor concentración de Al2(SO4)3, Observando las curvas de valoración potenciométrica se eligió para trabajar la de concentración 0,1M, ya que es la que presenta mejor comportamiento (Figura 2).
El salto de pH en la región BC de la Figura 2 es de aproximadamente 5,0 unidades independiente de la concentración inicial de Al2(SO4)3. Al incrementar la concentración inicial de Al2(SO4)3, la formación de complejos polinucleares es el proceso más importante [17,19,20]. Desafortunadamente no existe un consenso general sobre la identidad exacta y la cantidad de tales especies poliméricas en disolución [7,11,15]; se considera que en el sistema existe una combinación de monómeros, dímeros y trímeros además de especies poliméricas del tipo [Al13O4(OH)24(OH2)12]7+ o Al14(OH)348+.
3.2 Análisis de la Suspensión Coloidal con Microscopia Óptica
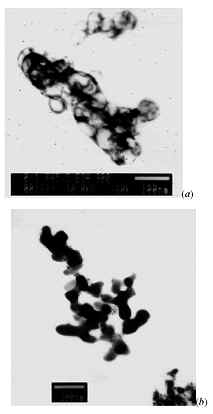
La Figura 4 muestra las fotografías obtenidas por microscopia de polarización (4X) del sistema en estudio a diferentes valores de pH, se escogieron estos puntos para determinar la evolución de las partículas en solución teniendo en cuenta las regiones que presentan la curva de valoración potenciométrica (Figura 2).
La Figura 4(a) muestra el gel que se forma a pH 4,1. Dado que este gel de forma "esponjosa" es estable a este valor de pH, él debe estar constituido principalmente por núcleos en crecimiento que se unen para formar "clusters". Estos aglomerados tienen un tamaño micrométrico como se observa.
Por otro lado, la Figura 4(b) es una fotografía obtenida de la suspensión a un pH 7,5 En esta fotografía se evidencia el avance en el proceso de aglomeración de los núcleos dando origen a "clusters" muy bien definidos; la estructura tipo esponja de los aglomerados es la que predomina.
La Figura 4(c) corresponde a la fotografía de la suspensión a pH 9,2, En esta fotografía se observan aglomerados "duros" agregados, que dan origen a partículas con bordes muy bien definidos; el aglomerado que se observa tiene un tamaño de ~500µm.
3.3 Espectroscopía FTIR de Muestras Sólidas
En la Figura 5 se muestran los espectros FTIR de muestras sólidas tanto del precursor de aluminio, en su estado puro, como de muestras obtenidas al filtrar el sistema Al2(SO4)3-NH4OH-H2O con una concentración 0,1 M de Al2(SO4)3 , se tomaron dichos valores de pH con el fin de determinar la variación de los grupos funcionales o complejos intermedios que se forman, teniendo en cuenta las regiones que presentan las curvas de valoración potenciométrica (Figura 2).
La banda más intensa entre ~3053 cm-1 y 3564 cm-1 corresponde a las vibraciones de tensión del O-H del agua (modo simétrico n1 y antisimétrico n3), mientras que la banda a ~1647 cm-1 se asocia al modo de flexión del H-O-H [21].
Figura 4: Fotografías obtenidas con microscopia de polarización de la estructura de una solución 0,1 M de Al2(SO4)3 durante la adición de NH4OH, a los siguientes valores de pH: (a) pH 4,1, (b) pH 7,5 y (c) pH 9,2.
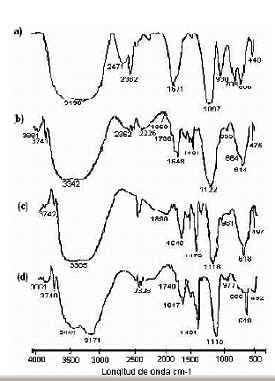
Figura 5: Espectros FTIR de muestras sólidas del Al2(SO4)3 puro (a), y del Al2(SO4)3 0,1 M precipitado con NH4OH y llevada hasta un pH final de: (b) 3,2, (c) 5,45, y (d) 10
Considerando la ubicación de las bandas que se asocian al SO42-, y la presencia o no de las mismas en el espectro, es posible obtener información sobre la naturaleza del complejo del cual forma parte el ión sulfato. En el espectro de la muestra sólida del precursor de aluminio, Figura 5(a), el complejo sulfato presenta las bandas a 1097 cm-1 y 990-930 cm-1 (banda ancha) indicando que hay dos átomos de oxigeno coordinados al metal haciendo que la simetría se reduzca a C2v. El efecto ambiental, debido a las interacciones no enlazantes del SO42- con sus vecinos en el cristal, perturba la simetría Td haciendo que la banda n3 sea ancha como se observa en el espectro [22]. En cuanto a las bandas relacionadas con el agua de coordinación, como es de esperar debido a la formula Al2(SO4)3.18H2O , estas están ubicadas a 707 cm-1 y 605 cm-1 [22].
Para la muestra sólida obtenida a pH 3,2, Figura 5(b), el complejo de sulfato presenta bandas a ~1122 cm-1 y ~1015 cm-1 (n3), ~614 cm-1 y ~664 cm-1(n4), así como un pequeño hombro a, ~989 cm-1(n1); de acuerdo a la bibliografía [22] esta muestra contendría complejos bidentados de SO42-. La presencia de estas bandas evidencia la existencia de sulfatos básicos de aluminio en el sistema.
Las bandas intensas que hay entre 1402 cm-1 y 1465 cm-1 ponen en evidencia la presencia del sulfato de amonio (NH4)2SO4 [22]. La existencia en el sistema del grupo funcional NH3 se confirma por la presencia de las bandas ubicadas a 1515-1550 cm-1, y 855 cm-1. En el espectro FTIR de la muestra sólida obtenida a pH 5, Figura 5(c), es evidente la formación de una especie monodentada del ión SO42- a la que se le pueden asignar las bandas ubicadas a 982 cm-1(n1), 1032-1044 cm-1 y 1117-1143 cm-1 (n3), y 645-604 cm-1 (n1). Se sigue evidenciando la presencia en la muestra de (NH4)2SO4 a la que se le asociaría la banda a 1479 cm-1. La banda a 1326 cm-1, y otra solapada a 857 cm-1, justificaría la existencia de un enlace M-NH3 que corroboraría la formación de compuestos derivados del complejo (Al2(OH)2(OH2)2(NH3)6) [21]. La banda a 1558 cm-1 se asigna al modo vibracional dd (NH3 ) y las bandas a ~ 560 cm-1 y ~ 450 cm-1 se podían asociar a modos vibracionales del Al2O3.
El espectro infrarrojo de la muestra a pH 10, Figura 5(d), presenta bandas a ~976 cm-1 (n1), ~1115 cm-1 (n3) y 619 cm-1 (n4) indicando que los complejos de SO42-, que predominan a altos valores de pH, son sulfatos libres. No se puede descartar completamente la presencia de sulfatos unidentados ya que dado el ancho de las bandas es posible que las ubicadas a 1032-1043 cm-1, 1117-1143 cm-1 (n3), 645 cm-1 y 604 cm-1 (n4) estuvieran solapadas. Las bandas a ~3040 cm-1 (n1), ~1679 cm-1 (n2), ~1401 cm-1 (n4) corresponden a la molécula tetraedral NH4+ [22]. Las bandas del espectro que se encuentran a más alta frecuencia se pueden asociar a iones hidróxilos aislados que se encuentran en la superficie de las partículas; la banda a ~3862 cm-1 correspondería a un hidróxilo con cuatro oxígenos primeros vecinos y la banda ubicada a ~3742 cm-1al hidróxilo con dos oxígenos primeros vecinos [22]. Observando cuidadosamente el espectro correspondiente a la muestra sólida obtenida a pH 10, cerca a la banda de ~915 cm-1 se encuentran dos hombros pequeños, a ~960 cm-1 y a ~760 cm-1, que son bandas características de la gibbsita (Al(OH)3) lo que lleva a considerar su posible presencia en la muestra. Estas bandas, más otra que estaría solapada por la de ~1115 cm-1, corresponderían a las cuatro vibraciones de deformación del OH del Al(OH)3 [22]; la banda a ~960 cm-1 se asigna a la vibración Al-OH-Al y la banda a ~760 cm-1 a la vibración Al-OH. En esta muestra coexistirían compuestos de sulfato básico de aluminio con hidróxido de aluminio, lo que posibilitaría la transformación de la especie básica de aluminio en hidróxido de aluminio, a valores altos del pH, por la acción del catión amonio [13,14].
3.4 Análisis Térmico Diferencial (ATD)
Las muestras estudiadas con ATD/TG fueron los siguientes:
· 0,1 M de Al2(SO4)3 a pH 5,5, tercer lavado en etanol y secado en rotaevaporador (M1).
· 0,1 M de Al2(SO4)3 a pH 9,63, tercer lavado en etanol (M2).
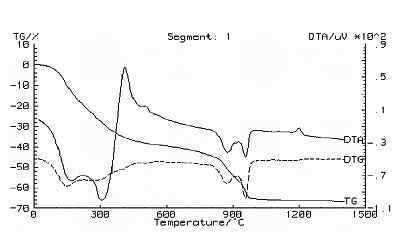
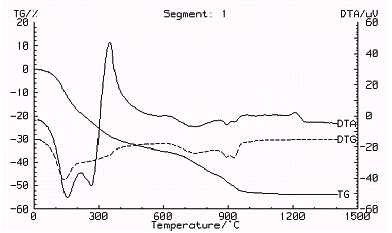
En la Figura 6 se muestran las curvas de ATD/TG correspondientes a la muestra M1. El primer pico endotérmico a 167,9º C, que involucra pérdida de masa, corresponde al desprendimiento del agua adsorbida por el sólido [23]. El segundo pico endotérmico a 304ºC, que también involucra pérdida de masa, da información sobre la liberación del agua de hidratación y la eliminación de una cierta cantidad de NH3 correspondiente a las sales de amonio presentes en el sólido. El primer pico exotérmico a 408ºC, con imperceptible pérdida de masa, corresponde a la formación del Al(NH4)(SO4)2 como resultado de la reacción del aluminio, el NH4+ y el SO42-, con desprendimiento de NH3. El pico a 500,7ºC, asociado a un proceso exotérmico, debe dar información sobre la formación de un compuesto de aluminio como consecuencia de la descomposición de los compuestos de amonio; el compuesto obtenido corresponde a un sulfato básico de aluminio o a un sulfato de aluminio.
Los picos endotérmicos a 875,8º C y a 957,2º C, que involucran pérdida de masa, corresponden a la descomposición del sulfato básico de aluminio. Por último, el pico exotérmico a 1199º C, sin pérdida de masa, corresponde a la transformación g-Al2O3 Ò a-Al2O3.
Para dar soporte a lo afirmado en el párrafo anterior se utilizó DRX como técnica complementaría al ATD/TG. En la Figura 7 se muestran los DRX correspondientes a las muestras M1 sometidas a
Figura 6: Curvas de ATD/TG correspondientes a la muestra sólida obtenida del sistema Al2(SO4)3-NH4OH-H2O , pH 5,53 y que fue sometida a tres lavados con etanol.
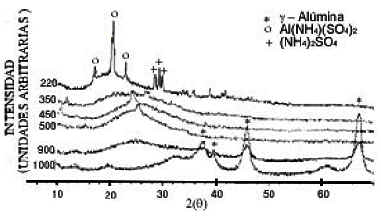
Figura 7: Difractogramas de la muestra sólida M1 sometidas a diferentes tratamientos térmicos.
tratamientos térmicos a diferentes temperaturas. En el DRX de la muestra tratada a 220ºC, son evidentes los picos correspondientes al Al2(SO4)3.12H2O y al (NH4)2SO4. En la muestra a 350ºC aparecen pequeños picos de (NH4)3Al(SO4)3. En el DRX de la muestra tratada a 450º C se evidencia la presencia del compuesto de Al(NH4)(SO4)2 que surge por la transformación del sulfato amoniacal de aluminio por reacomodación de los iones Al3+ - NH4+ - SO42-. A 550ºC aparecen Algunos picos de sulfato básico de aluminio y a 900ºC se observan los correspondientes a la g-Al2O3.
En la Figura 8 se muestran los resultados ATD/TG de la muestra M2. El primer pico endotérmico a 153,4ºC, que involucra pérdida de masa, corresponde a la liberación de agua adsorbida. El pico endotérmico a 264,9º C con pérdida de masa, indica la descomposición de los hidratos de un amorfo.
El pico exotérmico a 352,2º C con imperceptible pérdida de masa, puede indicar un reacomodamiento de los iones Al, NH4+ y SO42- modificando las distancias interatómicas promedio entre ellos y favoreciendo la conformación de una estructura más ordenada. El cuarto pico a 740,3º C, corresponde a un proceso endotérmico, que indica como se verá más adelante con el estudio DRX, la formación de g-Al2O3. Los siguiente picos endotérmicos a 896,0 oC y 929,5º C, corresponden a la liberación de SO4-2 y por lo tanto a la descomposición de los sulfatos aún presentes en la muestra. El último pico es exotérmico, a 1220º C, da información sobre la transformación de g-Al2O3 en a-Al2O3.
En la Figura 9 se muestran los DRX correspondientes a la muestra M2 tratadas a diferentes temperaturas durante 1 hora. En el difractograma de la muestra tratada a 210ºC los picos anchos que hacen prever la existencia de pseudoestructuras de tri y mono hidratos de
Figura 8: Curvas de ATD/TG correspondientes a la muestra sólida obtenida del sistema Al2(SO4)3-NH4OH-H2O , pH 9.63 y que fue sometida a tres lavados con etanol.
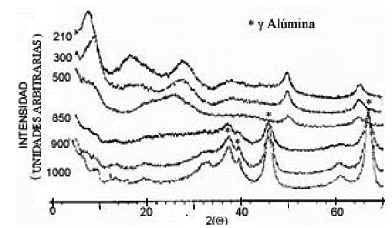
Figura 9: Difractogramas de la muestra sólida M2 sometidas a diferentes tratamientos térmicos.
aluminio; no se observan picos de compuestos de sulfato. A 300°C, luego del segundo pico endotérmico, comienza la descomposición de los hidratos del gel amorfo.
Se observa, además, el corrimiento a mayor ángulo de la banda centrada en aproximadamente 2q = 7,8° la cual se ubica al final a 2q = 9°, indicando que la pérdida de agua acerca los planos pseudocristalinos. A 500°C luego del pico exotérmico, aparecen bandas más anchas y menos intensas que se desplazan con relación a las que estaban. Por ejemplo, la banda ancha que estaba en 2q = 28° a 210°C parece desplazada a 2q = 26o y la que estaba en 2q = 17o pasa a 2q = 21o, indicando un reacomodamiento de las distancias interatómicas promedio. A 850°C, comienza la aparición de g-Al2O3, la cual cristaliza completamente a 900°C.
3.5 Análisis con Microscopía de los Polvos Cerámicos
A continuación se muestran las imágenes obtenidas con microscopía electrónica de transmisión, donde se analiza el efectos del, pH del sistema, etapa de lavado y redispersión en etanol sobre la morfología y tamaño de partícula del sólido (polvo) final, después de haber hecho los tratamientos térmicos a 900 y 1100°C;
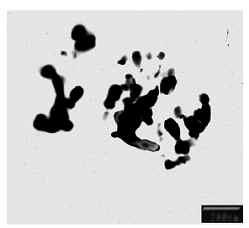
Figura 10: Morfología y distribución de tamaño de los polvos cerámicos obtenidos a partir de una solución Al2(SO4)3.18H2O , 0,1M, precipitada con NH4OH, llevada a un pH final de 9,6, lavadas con etanol tratadas térmicamente a 900ºC
En la Figura 10 se observa una muestra obtenida de una solución 0,1 M de Al2(SO4)3.18H2O , precipitada con NH4OH, llevada a un pH final de 9,6, lavada con alcohol etílico y posteriormente tratada a 900°C durante 1 hora; el difractograma de esta muestra indica que la única fase presente es la g-Al2O3. La morfología de las partículas no está bien definida y su distribución de tamaño no es uniforme.
Para el caso de las muestras sólidas obtenidas de una solución 0,1 M de Al2(SO4)3.18H2O , precipitada con NH4OH, a un pH final de 5,5 lavada en etanol, tratada térmicamente a 900°C durante 1 hora (Figura 11(a)), se observa un tamaño de partícula nanométrico, El DRX de esta muestra indica que la única fase presente es la g-Al2O3. En la Figura 11(b) se indica el tamaño y la morfología de partícula de esta muestra sometida a un tratamiento térmico a 1100ºC durante 1 hora, DRX indica que coexisten las fases g-alúmina y a-alúmina.
Figura 11: Muestras sólidas obtenidas de una solución de Al2(SO4)3.18H2O . 0,1M, precipitada con NH4OH, a un pH final de 5.5 lavada en etanol tratadas térmicamente (a) 900ºC, (b) 1100ºC.
4. CONCLUSIONES
· Observando los resultados indicados se puede concluir que al ir incrementando el pH del sistema, el SO42- forma complejos monodentados, C3v, y a valores mayores de pH Sulfatos libres, Td.
· La presencia de (NH4)2SO4 en el sistema es evidente a pH 3 y pH 5, y a pH 10 la existencia de enlaces Al-OH-Al es mayor a pH 10.
· Durante la disolución de la sal de sulfato de Aluminio se da una disociación parcial formándose las especies hidroxo sulfato y acuo hidroxo sulfato o nitrato de aluminio y acuo hidroxo nitrato de aluminio, las cuales dan origen a especies hexa-acuo de aluminio ([Al(OH2)6] 3+ en gran cantidad, y estas se hidrolizan de manera espontánea.
· Las curvas de valoración potenciométrica del sistema Al2(SO4)3-NH4OH-H2O presentan tres regiones bien definidas. En la primera región, que comienza a pH ácido y presenta pequeñas variaciones de este parámetro se da un alto consumo de OH- lo que indica la formación de especies mono y polinucleares, entre los que se destacan los sulfatos básicos de aluminio, los cuales actuarían como precursores en la formación de los embriones de la fase sólida y por lo tanto de los núcleos. En la segunda región se presentaría la transformación del sulfato básico de aluminio en un aluminato y en la última región se puede favorecer la formación de Al(OH)3. Estas transformaciones se ven fortalecidas por los altos valores de pH que hace que el ión SO42- sea fácilmente intercambiable con los iones hidroxilos.
· Los resultados de espectroscopia Infrarroja para la suspensión 0,1 M de Al2(SO4)3 muestran que a bajos valores de pH la fase sólida del sistema contiene compuestos de sulfato básico de aluminio bidentados. Estos compuestos modificarían su estructura a monodentados a medida que se adiciona el NH4OH, favoreciéndose la formación de oxihidróxidos e hidróxidos de aluminio a altos valores de pH; el espectro de la muestra tomada a pH 10 indica la presencia de Al(OH4) en la fase sólida del sistema justificando lo mencionado anteriormente.
· Los resultados de DRX, correspondientes a sólidos de los dos sistemas y obtenidos a diferentes valores de pH, muestran la presencia principalmente de sulfatos básicos de aluminio, y sulfato de amonio, para el sistema Al2(SO4)3-NH4OH-H2O .
· Para el sistema con sulfato, Independiente del valor de pH de la suspensión coloidal de la cual se obtiene el sólido, al someter el polvo cerámico a un tratamiento a 900ºC siempre se obtiene g-Al2O3.
· En todas las muestras tratadas térmicamente independiente de pH de la suspensión y lavadas con agua, la transformación de g®a-Al2O3 se da de manera directa sin que se presente otras fases intermedias. Esta transformación, se presenta un cambio de una estructura ccp a una estructura hcp lo que involucra un cambio en la secuencia de apilamiento de las capas de empaquetamiento.
· Comparando los resultados obtenidos de las caracterizaciones de los polvos cerámicos tratados térmicamente por ATD/TG, DRX y FTIR, para los sistemas, corroboro la fortaleza del ión SO4- como ligando ya que sólo fue posible eliminarlo totalmente del sistema con un tratamiento térmico hasta 950ºC.
· En general el tamaño de partícula que muestran los polvos cerámicos, tratados térmicamente a alta temperatura entre 900ºC y 1100ºC son de tamaño nanométrico (entre ~10 y 240 nm) independiente del, pH de la suspensión, y naturaleza del lavado.
5. AGRADECIMIENTOS
Por su incondicional atención y valiosas enseñanzas agradecimientos a la bióloga Patricia Mosquera de la Unidad de Microscopia de la UNIVERSIDAD DEL CAUCA, quien hizo posible la realización de una de las etapas de esta investigación. A COLCIENCIAS por el apoyo financiero a la joven investigadora J. Cobo-Quezada.
6. REFERENCIAS
1. Gitzen WH, Alumina as a Ceramic Material 4th Ed. New York (EE.UU): American Ceramic Society/John Wiley & Sons. Inc., 1970. [ Links ]
2. Brace R, Matijevic E, J. Inorg. Nucl. Chem. 1973; 35 (11): 3691-3694. [ Links ]
3. Nagai H, Oshima Y, Hirano K, Kato A, Brit. Ceram. Trans. 1993; 92 (3): 114-119[ [ Links ]STANDARDIZEDENDPARAG]
4. Wang L, Lloyd IK, J. Am. Ceram. Soc. 1991; 74 (11): 2934-2936. [ Links ]
5. Okada K, Tanaka A, Hayashi S, Otsuka N, J. Mater. Sci. Lett. 1993; 12 (11): 854-857. [ Links ]
6. Jaeger RE, Millar TJ, Am. Ceram. Soc. Bul.l 1974; 53: 885-859[ [ Links ]STANDARDIZEDENDPARAG]
7. Henry JL, Kelly HJ, J. Am. Ceram. Soc. 1965; 48 (4): 217-218. [ Links ]
8. SarikayaY, Akinc M, Ceram. Int. 1988; 14 (4): 239-244. [ Links ]
9. Ray J, Chatterjee M, Ganguli D, J. Mater. Sci. Lett. 1993 ; 12 (22): 1755-1757 . [ Links ]
10. Ogihara T, Nakajima H, Yanagawa T, Ogata N, Yoshida K, Matsushita N, J. Am. Ceram. Soc. 1991; 74 (9): 2263-2269. [ Links ]
11. Fanelli AJ, Burlew JV, J. Am. Ceram. Soc, 1986; 69 (8); C174-175. [ Links ]
12. Chang H-L, Lloyd IK, J. Am. Ceram. Soc. 1993; 76 (5): 1357-1360. [ Links ]
13.. Burriel Martí F, Arribas Jimeno S, Hernández Mendez J, Lucena Conde F, Química Analítica Cualitativa, 15° Ed. Madreid (España): Paraninfo S.A, 1994, p 691-694. [ Links ]
14. Cobo-Quesada J, Estudio de la Síntesis de Alúmina por el Método de Precipitación Controlada (MPC), Tesis de grado. Popayán (Colombia): Universidad del Cauca, 2005. [ Links ]
15. Baes CF, Mesmer RE, The Hydrolysis of Cations, 5th Ed. New York/London (EE.UU./Great Britain): John Wiley & Sons, 1976, p 57-87. [ Links ]
16. Matievic E, Chem. Mater 1993; 5 (4): 412-426. [ Links ]
17. Johansson G, Acta Chem. Scand. 1960; 14 (3): 771-773. [ Links ]
18. Rodríguez-Páez JE, Bol. Soc. Esp. Cerám. V. 2001; 40 (3): 173-184. [ Links ]
19. Matijevic E, Mathai KG, Ottewill RH, Kerker M, J. Phys. Chem. 1961; 65 (5): 826-830. [ Links ]
20. Vermeulen AC, Geus JW, Stol RJ, de Bruyn PL, J. Colloid Interf. Sci. 1975; 51 (3): 449-458. [ Links ]
21. Nakamoto K, Infrared and Raman Spectra of Inorganic and Coordination Compounds, Vol. II. New york (EE:UU): John Wiley & Sons. Inc., 1997, p 79-82. [ Links ]
22. Farmer VC, The Infrared Spectra of Minerals, Mineralogical Society Monograph, Number 4. London (Great Britain): Mineralogical Society, 1974, p 188-190, 447. [ Links ]
23. Mackenzie RC, Differential Thermal Analysis, 3er Ed. London (Great Britain): Academic Press, 1970, p 346-349. [ Links ]