Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Latinoamericana de Metalurgia y Materiales
Print version ISSN 0255-6952
Rev. LatinAm. Metal. Mater. vol.29 no.2 Caracas Dec. 2009
Efecto de la perlita en aceros bandeados sobre la resistencia a la corrosión por co2
Rosdely Quiroz
1*, Adalberto Rosales 1, Evaristo Barón 21 Universidad Simón Bolívar. Departamento de Ciencia de los Materiales. Caracas. Venezuela E-mail: rosdelyq@yahoo.com.mx
2 Consultor Independiente. Caracas. Venezuela.
Disponible en: www.rlmm.mt.usb.ve
Resumen
En este trabajo se estudió la influencia de la microestructura de dos aceros ferríticos- perlíticos bandeados, API 5L B grado X/42, sobre la resistencia a la corrosión por CO2. Se realizaron ensayos de pérdida de peso y de resistencia a la polarización en solución de NaCl 3,5% en peso, saturada con CO2, pH 3,5 y termostatizada a 45 ± 1oC. Las muestras se evaluaron por medio de microscopía óptica y electrónica de barrido con análisis químico por EDS. Las diferencias microestructurales principales entre estos dos aceros fueron la distancia entre bandas de perlita y su separación interlaminar, lo que demostró tener un efecto significativo sobre la resistencia a la corrosión por CO2. Inicialmente, la precipitación de FeCO3, como principal producto de corrosión, se localizó sobre las colonias de perlita en ambos materiales. Por otro lado, tanto la distancia entre bandas de perlita como el espaciamiento interlaminar dentro de la perlita, afectaron la disolución de la ferrita entre bandas. Al estar las bandas de perlita más cercanas entre si y al mismo tiempo más compactas en uno de los materiales, se convierten en regiones catódicas mejor definidas y más eficientes. Esto produjo una mayor -disolución de la ferrita entre bandas para ese acero y en consecuencia, su velocidad de corrosión también aumentó.
Palabras claves: Corrosión por CO2, Acero ferrítico – Perlítico bandeado, Cementita.
Abstract
The effect of the microstructure on CO2 corrosion resistance of two API 5L B X/42 ferritic-pearlitic steel was investigated. Weight lost and Linear Polarization Resistance tests were carried out in NaCl 3,5 wt% solution saturated with CO2, at pH 3,5 and 45 ± 1oC. Samples were evaluated by means of optical and scanning electron microscopy coupled to EDS, for chemical analysis. The distance between pearlite bands and the separation of carbide lamellae within the pearlite colonies were found to be the principal microestructural difference. These features had a significant effect on the CO2 corrosion process. Initially, FeCO3 deposits were located at pearlite colonies, on both materials. On the other hand, the distance between pearlite bands and the interlamellar spacing within the pearlite colonies affected the dissolution of the ferrite phase between bands. When pearlite bands and Fe3C lamellas were closer to each other, they became more defined and efficient cathodic regions. This produced a greater dissolution rate of the ferrite bands in this steel and, as a consequence, an increase in the overall corrosion rate of the steel.
Keywords: CO2 Corrosion, Ferrite – Pearlite banded steel, Cementite.
Recibido: 12-Ago-2008; Revisado: 25-Jun-2009; Aceptado: 20-Jul-2009 Publicado On-Line: 21-Dic-2009
1. INTRODUCCIÓN
La complejidad de los sistemas en los que se presenta la corrosión por CO2, ha motivado la realización de muchas investigaciones y se han planteado diversos mecanismos que describen este proceso corrosivo, definiendo los factores que lo favorecen [1-5].
Entre los mecanismos más aceptados para la corrosión generada por la presencia de CO2, se considera la disolución de este gas, para formar ácido carbónico (reacción 1). El H2CO3 puede disociarse en medio acuoso (reacciones 2 y 3), generando protones, los cuales pueden reducirse sobre el acero formando hidrógeno molecular (reacción 4). Sin embargo, por ser el ácido carbónico un ácido débil (pKa1 = 3,77; pKa2 = 10,3), su disociación proporcionaría una baja concentración de protones y en consecuencia se espera una baja contribución a la cinética catódica. Estas reacciones de disociación, no explican entonces las altas velocidades de corrosión encontradas en medios acuosos que contienen CO2 [4]. De Ward y Milliams [1], propusieron un mecanismo de corrosión ampliamente aceptado en la mayoría de las investigaciones sobre corrosión por CO2 [1-3]. Este mecanismo considera, como la principal responsable de la cinética catódica, a la reacción de reducción directa del ácido carbónico (reacción 5 y 6) para generar hidrógeno adsorbido. Esta especie puede recombinarse en la superficie del metal para formar H2 (reacción 6). Por otra parte, la cinética anódica está determinada por la disolución del metal en medio ácido (reacción 7). La generación de los iones producto de las reacciones 2, 3 y 5, junto a la baja solubilidad del carbonato de hierro (pKps = 10,54 a 25ºC), propician la precipitación de esta especie, de acuerdo a la reacción (8).
CO
2 + H2O H2CO3 (1)H2CO3 HCO3 - + H+ (pKa1) (2)
HCO3 - CO3 2- + H+ (pKa2) (3)
2H+ + 2e- H2 (4)
H2CO3 + e- HCO3 - + Hads (5)
2Hads H2 (6)
Fe Fe2+ + 2e- (7)
Fe2+ + CO3 2- FeCO3 (8)
Este mecanismo se ve influenciado por diversos factores, entre ellos la presión parcial de CO2, la temperatura [1,4,5], el pH de la solución [4,6], la hidrodinámica [7-9] y el tipo de acero [10-12].
En cuanto a los tipos de aceros, se han incorporado al estudio de la corrosión por CO2, factores relacionados con la composición y la microestructura. Con respecto a la composición, se han realizado estudios de aleaciones adicionando cantidades variables de cromo, en las que se ha encontrado que concentraciones de Cr por encima de 5% tienen efecto beneficioso sobre el control de la corrosión [13]. Para aleaciones con contenidos de Cr entre 1 y 5 % el efecto es dependiente del pH de la solución [14].
En cuanto a la microestructura, aun cuando ha sido considerado desde hace varios años como uno de los factores que afectan la corrosión por CO2, no se ha determinado con claridad cómo y por qué influye. Los estudios realizados comparan la resistencia a la corrosión por CO2 de microestructuras diferentes, sin relacionar las diferencias encontradas con factores microestructurales tales como: tamaño de grano, proporción de fases, su morfología y distribución espacial [10,11,15,16].
Las investigaciones registradas en la literatura, muestran que el tipo de microestructura predominante en un acero tiene un efecto sobre las velocidades de corrosión por CO2. Se han comparado las microestructuras obtenidas con diferentes tratamientos térmicos [10,16,17], en donde se obtiene que la mejor resistencia a la corrosión la presentan aceros tratados mediante templado y revenido en comparación con aquellos recocidos. Estos tratamientos térmicos producen microestructuras ferrítica-perlítica del tipo bandeado para los aceros recocidos, con ferrita-cementita globular homogeneizada para recocidos sub-críticos y martensita en los templados y revenidos, dependiendo de la composición del acero.
Adicionalmente, se han planteado diferentes hipótesis para explicar el efecto de la microestructura en la corrosión por CO2. Por un lado, para los aceros con microestructuras bandeadas se ha propuesto el establecimiento de pares galvánicos entre la ferrita y la perlita, siendo esta última la estructura más catódica, debido a la presencia de la Fe3C [16]. La disolución de la ferrita hace que se incremente en el tiempo el área catódica al exponer la perlita circundante. Por el contrario, en una microestructura homogeneizada de cementita globular, puede mantenerse el área catódica aproximadamente constante, ya que la disolución de la ferrita en los alrededores de la cementita globular, produce su desprendimiento de la superficie del metal, exponiendo nuevas partículas de cementita a la solución [17].
También se considera que en la estructura laminar de la perlita, ocurre inicialmente la disolución de la ferrita, y los espacios entre láminas de cementita se saturan en iones Fe2+, teniendo lugar la precipitación de FeCO3 [11]. De esta manera la formación de carbonato de hierro en la superficie del metal se inicia sobre la perlita, sirviendo de anclaje para estos productos de corrosión. En consecuencia, en aceros donde no se dispone de cementita laminar, no hay estos sitios de anclaje para mantener los productos de corrosión en la superficie del metal, y por lo tanto no se favorecería la disminución de la velocidad del proceso corrosivo.
En este trabajo se compara el comportamiento frente a la corrosión por CO2 de dos aceros de microestructura ferrítica-perlítica bandeada, de igual grado, B/X42 de acuerdo a la norma API 5L. Estos aceros presentaron, en servicio, comportamientos muy diferentes frente a la corrosión por CO2 [18]. El objetivo de este trabajo es analizar las diferencias microestructurales en términos de proporción de fase y su distribución, que pueden existir entre estos dos materiales, para explicar las desigualdades observadas, en cuanto a su comportamiento frente a la corrosión por CO2.
2. PARTE EXPERIMENTAL
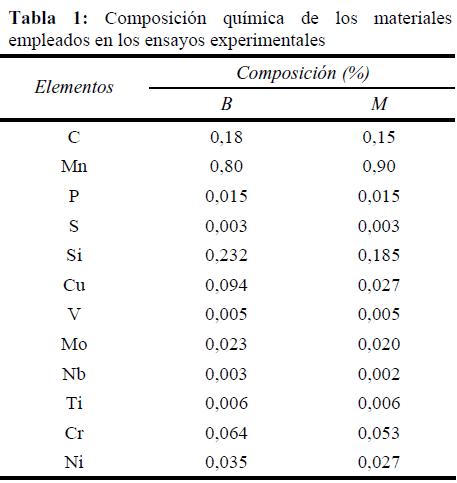
El presente estudio se realizó mediante ensayos electroquímicos de resistencia a la polarización lineal, pruebas de pérdida de peso y análisis con microscopía electrónica de barrido y espectroscopía de dispersión de energía de rayos X (MEB-EDS). El material empleado en estos ensayos corresponde a dos aceros API 5L B/X42, los cuales, a los efectos del presente estudio se identifican como B y M. Los materiales se emplearon en las condiciones de recepción, sin someterlos a tratamientos térmicos. Para verificar su composición química se analizaron muestras mediante emisión atómica por chispa eléctrica (ver Tabla 1).
El medio corrosivo en el cual se ensayaron las muestras B y M, fue una solución salina de NaCl al 3,5% en peso, previamente desaireada con N2 y luego saturada con CO2 durante una hora, con lo cual se obtuvo una presión de CO2 igual a la presión atmosférica (88,5 ± 0,5 kPa; 12,84 ± 0,07 psi). El pH alcanzado fue de 3,5 ± 0,1 y la temperatura se ajustó a 45 ± 1°C. El flujo de gas CO2 se mantuvo durante el tiempo de duración de los experimentos.
Los experimentos de polarización lineal, para obtener los valores de resistencia a la polarización (Rp), se realizaron empleando una celda de vidrio con arreglo de tres electrodos: como electrodo de trabajo se utilizó una muestra del acero de interés, con un área de 1 cm2, embutida en resina epóxica; el electrodo de referencia fue de calomel saturado y se usó una barra de grafito como contraelectrodo. La preparación superficial se realizó mediante el desbaste con papel de SiC hasta 600 grit y desengrase con acetona. Se empleó un potenciostato/galvanostato PRINCETON 173, y se realizaron barridos en sentido anódico de potencial de ± 10 mV respecto al potencial de corrosión, a una velocidad de 10 mV/min. Los ensayos de polarización lineal se iniciaron al transcurrir un tiempo de 60 minutos, luego de sumergir el electrodo de trabajo en el medio corrosivo, alcanzándose un potencial estable. Estos experimentos se realizaron por triplicado. A partir de los valores de Rp obtenidos de estos ensayos se calcularon las velocidades de corrosión (icorr) mediante la conocida ecuación de Stern-Geary [1]:
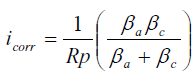 (9)
(9)
Donde, Rp es la pendiente de la línea recta que se obtiene de los barridos potencial-corriente, antes mencionados; βa y βa son las pendientes de Tafel, anódicas y catódicas, respectivamente. Los valores de las pendientes de Tafel empleadas, se obtuvieron previamente de ensayos de polarización potenciodinámica [20], coincidiendo con lo encontrado por otros investigadores [1-3]: βa = 40 mV/dec y βc = 120 mV/dec.
Los ensayos de inmersión consistieron en sumergir las muestras de los aceros en el medio corrosivo, descrito previamente, durante diferentes periodos de tiempo 24, 48, 144, 312 y 480 horas. Los valores de de velocidades de corrosión a partir de 24 horas se determinaron por el método convencional de pérdida de peso [21]. Se emplearon celdas de inmersión construidas en vidrio, de 300 mL de capacidad, con puertos para el acceso y salida de gases. Las muestras de acero se cortaron en cubos de aproximadamente 1 cm2 de sección transversal y se prepararon mediante desbaste con papel de SiC hasta 600 grit. Estas muestras se analizaron mediante MEB – EDS.
El análisis microestructural de las muestras de acero se realizó mediante microscopía óptica (MO) y microscopía electrónica de barrido (MEB). Las muestras se embutieron en resina epóxica, se prepararon metalográficamente mediante desbaste hasta 1200 grit, luego se pulieron con alúmina de 0,3 μm y se atacaron con Nital 2%, para revelar la microestructura. La medición del espaciamiento entre bandas e interlaminar se realizó mediante el método del intercepto, sobre las bandas de perlita y sobre las láminas de cementita, respectivamente.
3. RESULTADOS Y DISCUSIÓN
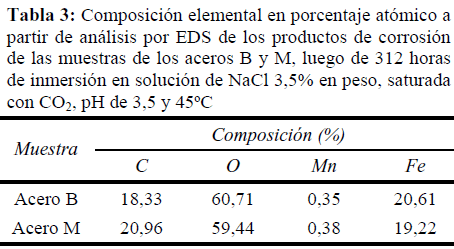
La Figura 1 muestra la microestructura de los aceros API 5L B/X42 empleados en este estudio, en la que se observa una morfología ferrítica–perlítica bandeada. La composición química, dada en la 0, fue muy similar; sin embargo, hay pequeñas diferencias en ciertos elementos. El contenido de carbono en la muestra B fue mayor, lo cual es compensado en el acero M con un incremento en la concentración de Mn, para mantener resistencia mecánica. También se presentaron diferencias en el contenido de cobre, cromo y níquel, los cuales fueron mayores en el acero B. El Cu, Cr y Ni son elementos que se adiciona a los aceros en proporciones próximas a 0,1%, a fin de mejorar su resistencia a la corrosión atmosférica [22]. Esta pequeña diferencia en composición pudiera sugerir una mejor resistencia a la corrosión del acero B, pero quizás las concentraciones son muy bajas para otorgarla. En este sentido, no se espera y no se encontró una diferencia en el comportamiento frente a la corrosión por CO2 entre los dos aceros debido exclusivamente a la variación en el contenido de Cu, Cr y Ni.
En cuanto a la proporción de fases, se analizaron diferentes cortes de las muestras mediante microscopía óptica y un programa para análisis de imágenes (Image Tool 3.0 [23]), obteniéndose tal como se indica en la Figura 1, una proporción de perlita ligeramente mayor en el acero B (27 ± 4 % acero B, 23 ± 5 % acero M).
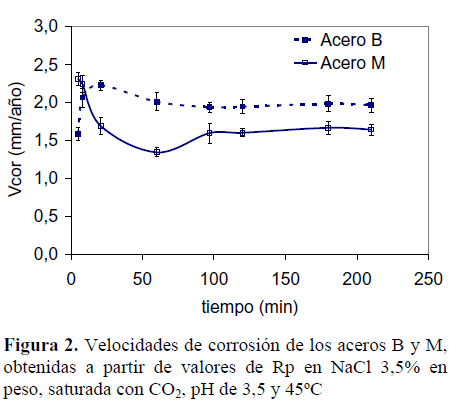
Debido a las pequeñas diferencias en composición química de ambos aceros (B y M), se asoció el comportamiento obtenido frente a la corrosión por CO2 a la microestructura de los mismos. En la Figura 2 pueden observarse las velocidades de corrosión de ambos aceros, derivadas de los ensayos electroquímicos de polarización lineal. Se puede apreciar un comportamiento claramente distinto para cada acero. Al inicio del ensayo el acero B mostró una menor velocidad de corrosión en comparación con el acero M. Al transcurrir el tiempo, el acero B aumentó su velocidad de corrosión mientras que el acero M la disminuyó. Luego de 3,5 h de ensayo (210 min) la velocidad de corrosión de ambos acero se estabilizó, alcanzando 1,95 mm/año para el acero B y 1,65 mm/año para el acero M, diferencia que resulta significativa. Este comportamiento indica que en la muestra de acero B, el Cu, Cr y Ni no le proporcionan resistencia a la corrosión por CO2 al metal, porque la cantidad en la que se encuentra no son suficientes. De manera que el comportamiento de cada material frente a la corrosión por CO2, debe estar asociado a la microestructura.
Ambos aceros tienen una microestructura de ferritaperlita bandeada, pero las reacciones asociadas al proceso corrosivo se desarrollan de manera distinta sobre cada material. A fin de encontrar aspectos que pudieran diferenciar los aceros en estudio, se realizó un análisis microestructural detallado, a partir de imágenes de MEB de cada acero. Se estudiaron las imágenes obtenidas de diversos cortes en las muestras para determinar la distancia de separación entre bandas de perlita y distancia entre las láminas de cementita que forman la perlita. Estos valores se muestran en Tabla 2. El acero B presentó una distancia entre bandas menor; adicionalmente, se observó una mayor diferencia en la distancia interlaminar en la perlita, la cual también es menor para éste acero, tal como se puede apreciar en la Figura 3, donde se muestran imágenes de MEB representativas de las colonias de perlita presentes en cada acero. En el acero B, la distancia interlaminar es prácticamente la mitad de la distancia interlaminar del acero M.
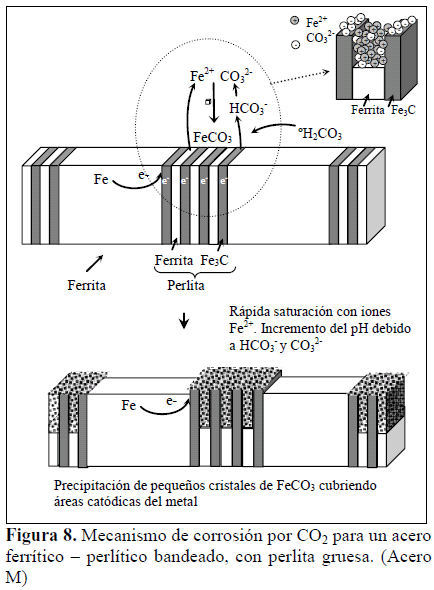
Se conoce que la perlita, o más específicamente la cementita, presenta un comportamiento catódico frente a la ferrita, soportando a las reacciones de reducción (reacciones 4 y 5) [1,2,4]. De esta manera, frente a la disolución de la ferrita circundante, la cementita va a quedar sin ser atacada, sobresaliendo cada vez más de la superficie, lo cual implica un incremento en el área catódica y en consecuencia, con el tiempo aumentará la disolución del metal (ferrita). Sin embargo, cambios locales de pH, debido a la generación de iones HCO3- y CO3 2- (reacciones 2 y 3), o saturación con iones Fe2+ en las cercanías a la cementita, darán lugar a la precipitación de FeCO3, el cual es aislante (resistencia específica de 7,2 109 Ω.m) y de acuerdo a su morfología pudiera ser protector.
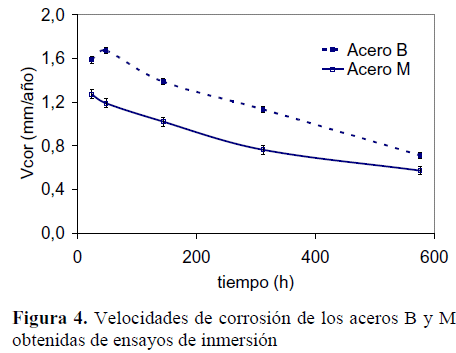
Para poder diferenciar el comportamiento frente a la corrosión por CO2, en función del tiempo, para cada material, se llevaron a cabo ensayos de inmersión en condiciones de estancamiento, para así lograr la saturación en la interfase con los iones CO3 2- y Fe2+, y formar capas de productos de corrosión [5,15,24]. Los valores de velocidades de corrosión obtenidos de los ensayos de pérdida de masa se muestran en la Figura 4. Nuevamente, los valores de velocidad de corrosión para el acero B fueron mayores en comparación con el acero M. Para las primeras 24 horas de inmersión se obtuvo una velocidad de corrosión de 1,59 mm/año para el acero B y de 1,27 mm/año para el acero M. Ambos aceros disminuyeron la velocidad de corrosión en el tiempo, como era de esperarse por las condiciones de estancamiento y formación de FeCO3. Luego de 576 horas de inmersión el acero B presentó una velocidad de corrosión de 0,70 mm/año, mientras el acero M alcanzó 0,55 mm/año.
Esta clara diferencia en el comportamiento de los acero B y M frente a la corrosión por CO2, puede explicarse considerando las superficies de las probetas luego de ser expuestas al medio corrosivo. En la Figura 5 se muestran las superficies de los aceros luego de 312 horas de exposición. Se pueden observar diferencias en la morfología de la superficie corroída y los productos de corrosión, que en ambos casos podrían corresponder a carbonatos de hierro (20% Fe, 20% C y 60% O), de acuerdo a los análisis químicos por EDS, mostrados en la 0. El acero B presentó una superficie cubierta con una gran cantidad de cristales grandes de FeCO3, sin orientación específica y formando una capa poco compacta, mientras que en el acero M se pueden ver zonas con material desnudo y zonas con productos de corrosión que parecen haberse depositado sobre lo que corresponde, por su orientación y espaciamiento, a las bandas de perlita.
Al eliminar los productos de corrosión, mediante una limpieza química de la superficie de las muestras de aceros sometidas a inmersión hasta 312 horas, se apreció en ambos materiales que la corrosión disolvió la ferrita dejando las colonias de perlita en relieve (Figura 6). En este sentido, aun cuando la superficie del acero B se cubrió con FeCO3 (0a), se corroboran las características catódicas de la perlita, al no disolverse, permaneciendo en la superficie del material. En el acero M, se aprecia que efectivamente, la orientación de los productos de corrosión se corresponde con la de las colonias de perlita.
A partir de los resultados obtenidos, se puede concluir que las mayores diferencias microestructurales que ejercieron una influencia en el comportamiento frente a la corrosión por CO2, de los acero bajo estudio, fueron la separación entre las bandas de perlita y su espaciamiento interlaminar. El acero denominado B, presentó una menor distancia entre bandas y entre láminas de cementita, produciendo una mayor velocidad de corrosión. Por el contrario, el acero M presentó una mayor separación entre bandas y entre láminas, manifestando una menor velocidad de corrosión.
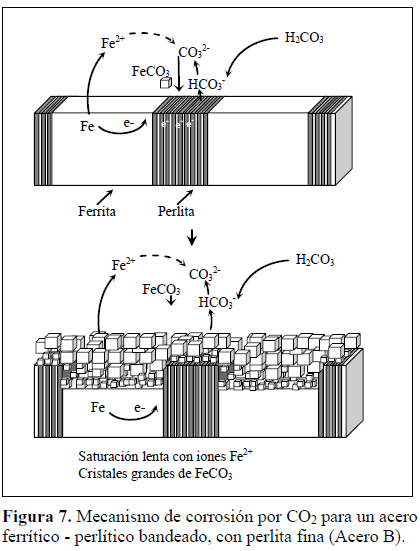
Este comportamiento puede explicarse considerando que en el acero B, la menor separación entre láminas, es decir, una perlita más fina, localizó una mayor área catódica sobre las bandas de perlita, capaz de propiciar en forma más eficiente la disolución de las bandas de ferrita. En consecuencia, se produjo una mayor pérdida de material. El espacio entre las bandas de perlita (banda de ferrita) debe saturarse con iones Fe2+ y las especies de la reacción catódica (reacción 1 y 2) deben difundir desde las bandas de perlita hacia esta zona, para alcanzar y sobrepasar el producto de solubilidad del FeCO3 y lograr su precipitación. Esta situación permitió mayor disolución de la ferrita entre bandas. La capa formada fue porosa, permitiendo el intercambio iónico con la solución, dando oportunidad al progreso del proceso corrosivo. Este mecanismo se esquematiza en la Figura 7. Adicionalmente, en el acero B, la distancia entre bandas es menor, produciendo un acople galvánico más eficiente entre las bandas de ferrita y perlita, generando una mayor corrosión de este material en comparación con el acero M.
El mecanismo propuesto para explicar el comportamiento del acero M se muestra esquemáticamente en la Figura 8. Al disponer este material de una mayor separación entre láminas, se facilitó la disolución de la ferrita que conforma la colonia de perlita, en forma preferencial a las bandas de ferrita cercanas. Esta disolución generó espacios confinados entre láminas de cementita, donde se alcanzó la saturación con los iones Fe2+ y rápidamente se logró el incremento del pH debido a las reacciones de reducción (reacciones 1 y 2), lo que produjo la precipitación de FeCO3 entre láminas. Este proceso cubrió la perlita del acero, es decir, cubrió las áreas catódicas, con lo cual se retrasó el proceso corrosivo.
4. CONCLUSIONES
Los dos aceros bajo estudio presentaron una microestructura muy similar en cuanto a sus constituyentes, compuesta por perlita bandeada en una matriz ferrítica. El acero B mostró una perlita muy fina con menor distancia entre bandas en comparación con el acero M. La distancia interlaminar (entre láminas de Fe3C) fue 50 % más pequeña que aquella observada en el acero M. Estos factores afectaron al comportamiento frente a la corrosión por CO2.
En ensayos electroquímicos de Rp, el acero B presentó inicialmente una menor velocidad de corrosión que el acero M; sin embargo, luego de los primeros 120 minutos de ensayo, se invirtió la tendencia y el acero B mostró una mayor velocidad de corrosión, comportamiento que se observó también en ensayos de inmersión (pérdida de masa).
Se observó una diferencia en la morfología y distribución de los productos de corrosión formados sobre cada material, durante los ensayos de inmersión. El acero B mostró cristales de FeCO3, cubriendo toda la superficie, distribuidos en forma dispersa y sin orientación específica (capa poco compacta). Por otra parte, el acero M presentó una distribución de productos de corrosión más compactos cubriendo las bandas de perlita y mostrando zonas de ferrita sin productos de corrosión.
En ambos materiales la corrosión disolvió ferrita, dejando bandas de perlita en sobre relieve.
La menor separación entre láminas de Fe3C, en el acero B, localizó una mayor área catódica sobre las colonias de perlita de este material, en comparación con el acero M, efecto que propició una mayor eficiencia en la disolución de la ferrita y como consecuencia una mayor corrosión en el acero B.
El acero M, con una mayor separación entre las láminas de Fe3C, facilitó la disolución de la ferrita que conforma la colonia de perlita, en forma preferencial a las bandas de ferrita cercanas. En los espacios interlaminares, se alcanzó la saturación de iones Fe2+, dando lugar a la precipitación localizada de FeCO3, proceso que cubrió las bandas de perlita, con lo cual se retardó el proceso corrosivo, porque se bloquearon los sitios catódicos.
5. AGRADECIMIENTOS
Los autores agradecen al Decanato de Estudio de Postgrado de la UNIVERSIDAD SIMÓN BOLÍVAR, Caracas, Venezuela, por el apoyo proporcionado.
6. REFERENCIAS
1. De Waard C, Milliams D. Corrosion 1975; 31 (5): 177-181. [ Links ]
2. Neić S. Prediction of Transport Processes in CO2 Corrosion. En: European Federation of Corrosion Publications. London (UK): The Institute of Materials, 1994; (13): 120-133. [ Links ]
3. Neić S, Pots B, Postlethwaite J, Thevenot N. J. Corros. Sci. Eng. 1995; 1, paper 3. [ Links ]
4. De Waard C, Lotz U, Prediction of CO2 Corrosion of Carbon Steel. En: European Federation of Corrosion Publications. London (UK): The Institute of Materials, 1994; (13): 30-49. [ Links ]
5. Lin G, Zheng M, Bai Z, Zhao X. Corrosion 2006; 62 (6): 501-507. [ Links ]
6. Zhang G, Lu M, Chai C, Wu Y. J. Univ. Sci. Technol. B 2006; 13 (1): 44-49. [ Links ]
7. Ruzic V, Veidt M, Neić S. Corrosion 2006; 62 (5): 419-432. [ Links ]
8. Chen Y, Chen H, Jepson P, Effects of Multiphase Flow on Corrosion Inhibitor. En: Proceeding del The NACE International Annual Conference and Exposition, CORROSION99. Houston (EE.UU.): NACE International, 1999, No. 12. [ Links ]
9. Villareal J, Laverde D, Fuentes C. Corros. Sci. 2006; 48 (9): 2363-2379. [ Links ]
10. Clover D, Kinsella B, Pejcic B, De Marco R. J. Appl. Electrochem. 2005; 35 (2): 139-149. [ Links ]
11. Ueda M, Takabe H, Effect of Environmental Factor and Microstructure on Morphology of Corrosion Products in CO2 Environments. En: Proceeding del The NACE International Annual Conference and Exposition, CORROSION99. Houston (EE.UU.): NACE International, 1999, No. 13. [ Links ]
12. Hashizume S, Minami Y, Ishizawa Y. Corrosion 1998; 54 (12): 1003-1011. [ Links ]
13. Ikeda A, Ueda M, CO2 Corrosion Behaviour of Cr - Containing Steels. En: European Federation of Corrosion Publications. London (UK): The Institute of Materials, 1994; (13): 59-93. [ Links ]
14. Carvalho DS, Joia CJB, Mattos OR. Corros. Sci. 2005; 47 (12): 2974-2986. [ Links ]
15. Crolet J, Thevenot N, Neić S. Corrosion 1998; 54 (3): 194-203. [ Links ]
16. Al-Hassan S, Mishra B, Olson D, Salama M. Corrosion 1998; 54 (6): 480-491. [ Links ]
17. López DA, Simison SN, de Sánchez SR. Electrochim. Acta 2003; 48 (7): 845-854. [ Links ]
18. Barón E, Rincón P, Tarazón C, González F, Marcano A, Influencia de los Patrones de Flujo y Otros Factores en la Corrosión de un Oleoducto de Transporta Fluido Multifásico En: Proceeding del Congreso Internacional de Corrosión. Puerto La Cruz (Venezuela): Asociación Venezolana de Corrosión ASVENCOR, 2005. [ Links ]
19. Stern Mm, Geary A. J. Electrochem. Soc. 1957; 104 (1): 56-59. [ Links ]
20. Quiroz R, Rosales A, Barón E. Rev. Tec. Ing. Univ. Zulia 2007; 30 (Número especial): 261- 271. [ Links ]
21. Norma ASTM G1-03: Standard Practice for Preparing, Cleaning and Evaluating Corrosion Test Specimens, vol. 03.02. West Conshohocken (EE.UU.): ASTM International, 2003. [ Links ]
22. Choi Y, Shim J, Kim J. J. Alloys Compd. 2005; 391 (30): 162-169. [ Links ]
23. Wilcox DC, Dove SB, McDavid WD, Greer B D, UTHSCSA ImageTool, ver. 3.0. San Antonio (EE.UU.): Department of Dental Diagnostic Science, The University of Texas, Health Science Center. [en línea] 22-Feb-2002 [citado 19-Dic-2009]. Disponible en la web: <http://ddsdx.uthscsa.edu/dig/itdesc.html>. [ Links ]
24. Kinsella B, Tan Y, Bailey S. Corrosion 1998; 54 (10): 835-842. [ Links ]