Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Latinoamericana de Metalurgia y Materiales
versión impresa ISSN 0255-6952
Rev. LatinAm. Metal. Mater. v.31 n.2 Caracas dic. 2011
Estudio termodinámico del proceso de adsorción de iones de ni y v por parte de ligninas precipitadas del licor negro kraft
Narciso Pérez*, Jean González, Luisa A. Delgado
Dpto. de Procesos y Sistemas-Sección de Procesos Químicos, Universidad Simón Bolívar. Caracas, Venezuela * e-mail: naperez@usb.ve
RESUMEN
En el presente estudio se efectuó un análisis del proceso de adsorción de Ni y V con ligninas provenientes de licores negros nacionales, usando principios termodinámicos. Para ello se compararon dos ligninas precipitadas con una lignina comercial de grado analítico. Luego, se procedió a evaluar la capacidad adsortiva de ambas ligninas por medio de la construcción de isotermas, a cuyos datos se les aplicaron los modelos de adsorción de: Freundlich, Langmuir y Redlich – Peterson. De estos modelos, el que mejor ajustó para los casos en estudio fue el de Langmuir. Se calcularon, además, los parámetros termodinámicos DGº, DHº y DSº para cada caso. La entalpía de adsorción arroja valores menores a 40 KJ/mol lo cual no permite dilucidar que tipo de adsorción (física o química) se llevan a cabo, ya que ambos tipos de adsorción pueden estar presentes. Con relación a la energía libre de Gibbs, se obtuvieron valores negativos para la adsorción del Ni sugiriendo un proceso espontáneo, mientras que para el V se obtuvieron valores positivos, lo cual sugiere un proceso no espontáneo. En cuanto a la entropía se obtuvo un valor negativo para la adsorción de níquel, que es indicativo del proceso de adsorción, en cambio para el vanadio, de forma contraria, se obtuvo un valor positivo y bajo, que debido a la baja adsorción que se obtuvo no se pudo interpretar de forma precisa este resultado.
Palabras Claves: adsorción metales pesados, ligninas, isotermas de adsorción
THERMODYNAMIC EVALUATION OF THE NI AND V ADSORPTION PROCESS BY PRECIPITATED LIGNINS FROM KRAFT BLACK LIQUOR.
ABSTRACT
In the present study an analysis of the adsorption of Ni and V on lignin from national black liquor was carried out using thermodynamic principles. A comparison was established between both the precipitated lignins and one commercial analytical grade lignin. The adsorptive capacity of both materials was evaluated through the construction of isotherms whose data was fitted to the following models: Freundlich, Langmuir and Redlich - Peterson. For all these models, the best fit for the obtained data was the one of Langmuirs. For the adsorption process, the thermodynamic parameters DGº, DHº y DSº, were also calculated. The adsorption enthalpy yielded values of less than 40 KJ / mol, which can not clarify what type of adsorption (physical or chemical) is ocurring, since both types of adsorption may be present. With respect to the Gibbs free energy, negative values were obtained for the adsorption of Ni, suggesting a spontaneous process, while for V values were positive, suggesting a not spontaneous process. In the case of the calculated entropy, a negative value was obtained for the adsorption of nickel, which is indicative of the adsorption process. On the other hand, for V this value was small and positive, which combined with the low adsorption obtained, does not permit to accurately interpret the results.
Keywords: adsorption of heavy metals, lignin, isotherm of adsorption
Recibido: 20-10-2010 ; Revisado: 14-12-2010 Aceptado: 09-03-2011 ; Publicado: 28-03-2011
1. INTRODUCCIÓN
Venezuela cuenta con una de las reservas de crudos pesados y extrapesados más grandes del mundo [1]. Estos crudos se caracterizan por contener elevadas concentraciones de azufre, vanadio y níquel, al punto que el crudo Venezolano es el de mayor contenido de vanadio en el mundo (687 ppm), le sigue Estados Unidos (334 ppm) e Irán (323 ppm) [1].
La recuperación del vanadio ha pasado a tener un peso importante como fuente de este metal, ya que al ser el crudo Venezolano el de mayor contenido de vanadio en el mundo, se estima que el potencial de producción de vanadio a partir de flexicoque alcanzaría a cubrir el 70% de la demanda internacional [1]. Además, este proceso es de vital importancia para el resto de las aplicaciones industriales del coque las cuales se ven afectadas y limitadas en su implementación principalmente debido a las impurezas metálicas presentes en este material [1].
En un proceso que permite la desmetalización tanto de crudos como de coque de petróleo mediante digestión ácida asistida por microondas se logra la remoción eficiente principalmente de vanadio y níquel, con porcentajes de extracción que varían dependiendo del tipo de coque utilizado y de variables como la granulometría del material de partida, la relación masa/ácido y el tiempo de irradiación [2].
Sin embargo, estos metales, una vez removidos del hidrocarburo, quedan disueltos en soluciones fuertemente ácidas que se obtienen como residuo del proceso.
Estudios previos [3] han demostrado la efectividad de las ligninas, provenientes del licor negro residual de la industria papelera (una de las mas importantes del país, y con mayores dificultades para el tratamiento de sus desechos), en la remoción de níquel y vanadio presentes en soluciones acidas. Más aún, se ha encontrado que dependiendo de las condiciones de obtención de las ligninas, éstas varían su capacidad adsortiva. Desde hace más de un siglo se ha podido caracterizar el proceso de adsorción por medio del desarrollo de modelos termodinámicos que parten de conjuntos de suposiciones que de ajustarse a los datos experimentales permiten suponer cual es el mecanismo de interacción adsorbente-adsorbato.
Entre las suposiciones más usadas en la construcción de cada modelo se encuentran: la formación de una monocapa o de múltiples capas o una combinación de las dos anteriores, así como la posibilidad de interactuar entre los centros activos. En el presente trabajo se plantea estudiar el proceso con que pueden ser adsorbidos el Ni y el V por las ligninas, mediante el ajuste a los distintos modelos de equilibrio de adsorción de Langmuir, Freundlich y Redlich-Peterson.
2. PARTE EXPERIMENTAL
2.1 Obtención de las ligninas
De estudios previos se verificó que el proceso de precipitación de las ligninas afecta su estructura molecular y en consecuencia su poder adsortivo de tanto de Ni(II) como de V(V) [4,5]. Además se comprobó que los mecanismos de adsorción de Ni(II) y V(V) son distintos dado, que el primero en solución es un catión y el segundo se comporta como anión por lo que habrá cierta selectividad en la adsorción dependiendo de los grupos presentes en las ligninas usadas como adsorbentes, ya sea por su condiciones de obtención o adsorción [4]. Por lo cual se seleccionaron 2 ligninas obtenidas, a diferentes condiciones de precipitación, a partir del licor negro Kraft (LNK), proveniente de la industria papelera venezolana, cada tipo de lignina responde a una buena capacidad adsorbente por separado tanto de Ni como de V respectivamente y que fue evaluada en trabajos previos [6]. Las condiciones para la precipitación de las ligninas se muestran en la tabla 1. Para separar el precipitado del licor se procedió a filtrar por gravedad el sólido obtenido, sobre un embudo Büchner con papel de filtro Whatman #4. La pasta obtenida se secó utilizando una lámpara a una temperatura cercana a los 100°C por espacio de 90 minutos aproximadamente. Una vez seca se procedió a homogenizar con un mortero el sólido obtenido, pasando nuevamente a secarla durante algunos minutos sobre la lámpara. Las ligninas obtenidas fueron comparadas con la lignina comercial identificada como INDULIN AT.
Tabla 1. Condiciones para la precipitación de las ligninas.
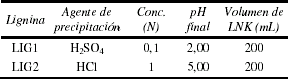
2.2 Caracterización de las ligninas
La caracterización se llevó a cabo en dos instancias diferentes: análisis espectroscópico para la elucidación estructural y de grupos funcionales, y análisis elemental para obtener la proporción de algunos elementos claves en la lignina.
2.2.1 Análisis espectroscópico
Se utilizaron dos técnicas espectroscópicas; la espectroscopía de infrarrojo (IR) y la espectroscopía del ultravioleta (UV). La primera con la finalidad de determinar los grupos funcionales presentes en las ligninas precipitadas, mientras que la segunda fue utilizada para estimar su grado de pureza, al ser comparado con la INDULIN AT.
ESPECTROSCOPÍA DEL INFRARROJO
El método de IR empleado fue el de Pastilla de KBr con un porcentaje de muestra de 5% por gramo de KBr, en un equipo marca TENSOR 27 de 8 ciclos, una resolución de 4 cm-1 y un rango de trabajo: 4000-400 cm-1.
ESPECTROSCOPÍA ULTRAVIOLETA
Se realizó una curva de calibración con el INDULIN AT, y posteriormente se determinó cuantitativamente la cantidad de lignina presente en cada adsorbente obtenido en el laboratorio. Para ello se disolvió 0,01 g. de lignina en una solución 9:1 de agua etanol respectivamente. El espectro de ultravioleta (UV) se obtuvo empleando un espectrómetro modelo 50Conc de la Varian Carey.
2.2.2 Análisis elemental
Los elementos determinados mediante estos análisis fueron: carbono, hidrógeno, azufre, sodio, potasio y calcio. Los tres primeros por tratarse de materia orgánica, los últimos debido a que el proceso por el cual el licor negro es obtenido (método Kraft) conlleva el uso de bases fuertes como KOH y NaOH. La determinación de los anteriores elementos fueron realizados empleando las siguientes normas:
Carbono e Hidrógeno: Norma AFNOR M03 032.
Azufre: Norma AFNOR M03-038 y M07-025.
Sodio, Potasio y Calcio: Método 3030-G [7], con la posterior detección vía ICP.
2.3 Evaluación de la capacidad adsortiva
Se prepararon dos soluciones de concentración 20 mg/L de Ni y de V por separado a partir de sus soluciones patrones de concentración 1000 mg/L.
En dicho caso, se tomaron 20mL de cada solución madre y se aforaron a 1000 mL. Cada solución se llevó a pH 4 previamente. Luego, se agregó 0,400g de cada una de las ligninas precipitadas en 100mL de solución de concentración 20 mg/L de Ni y V por separado, las mezclas resultantes fueron sometidas a un proceso de agitación por espacio de 2 horas, tiempo óptimo para la adsorción de Ni según Pérez et al. [3] que se realizó sobre ligninas con características superficiales equivalentes a las empleadas en este trabajo (durante el proceso de adsorción no se ajustó pH). Finalmente, se procedió a filtrar cada mezcla al vacío mediante filtro de vidrio poroso, el filtrado fue posteriormente analizado por absorción atómica mediante la técnica de plasma acoplado inductivamente (ICP), con la finalidad de medir la concentración final de cada uno de los metales.
2.4 Isotermas de adsorción
Para la construcción de las isotermas se realizaron pruebas de adsorción variando las concentraciones iniciales, de cada metal por separado, desde 5 mg/L hasta 50 mg/L. manteniendo constantes el volumen del adsorbato y la cantidad de adsorbente. Luego que las soluciones fueron filtradas se determinaron las concentraciones finales de cada metal por ICP. Partiendo de estos datos, con la finalidad de estudiar la naturaleza de la adsorción, se realizaron los ajustes a los diversos parámetros de los modelos: Langmuir, Freundlich y Redlich–Peterson.
Modelo de Langmuir: Isoterma de equilibrio que relaciona la cantidad de soluto adsorbido sobre la superficie con la concentración del soluto [8]. Esta ecuación es derivada al suponer la no existencia (o despreciable) interacción entre las moléculas adsorbidas y de que, una vez que una molécula ocupa un sitio no existe adsorción posterior. Puede ser reducida a la ley de Henry para concentraciones iniciales bajas. Alternativamente a concentraciones altas, predice una capacidad adsortiva de una monocapa. Esta última se denomina capacidad adsortiva de la monocapa saturada.
Modelo de Freundlich: Isoterma de adsorción empírica para adsorción no ideal sobre superficies heterogéneas así como adsorción sobre varias capas. La isoterma de Freundlich ha sido obtenida al asumir un decaimiento exponencial en la distribución energética de los sitios de adsorción. Esta ecuación tiene la limitación de no seguir la base fundamental de la termodinámica, al no poder ser reducida a la ley de Henry a concentraciones bajas[8].
Modelo de Redlich – Peterson: Este modelo combina elementos de Langmuir y Freunlich, por lo que el mecanismo de adsorción es un híbrido que no sigue el postulado ideal de adsorción por monocapas. Dicho modelo es ampliamente usado y visto como un intermedio entre el sistema tipo Freundlich y el sistema tipo Langmuir.
2.5 Determinación de los parámetros termodinámicos
El análisis de estos parámetros permitieron estimar la factibilidad del proceso de adsorción, así como el efecto de la temperatura sobre los mismos, en el caso de este trabajo se estimaron: El cambio en la energía libre estándar de Gibbs (DG°), la entalpía estándar (DH°) y entropía estándar (DS°) [5,9].
Energía libre de Gibbs: Permite discernir si un proceso es espontáneo o no. Valores negativos de DG° implican un proceso espontáneo, mientras que valores positivos significan que es necesario aportar energía al sistema ya que el sistema no es capaz de evolucionar por sí solo. Se calcula a partir de la ecuación:
![]()
Esta ecuación se utiliza en primera instancia a nivel de sistemas de gases ideales, pero su uso puede ser extendido a adsorción en interfases sólido líquido muy diluido, ya que ello implica que la distancia intermolecular es lo suficientemente grande para garantizar un comportamiento del tipo gas ideal.
La ecuación de Vant Hoff permite obtener de manera gráfica los valores DH° y DS° [5]. Esta ecuación nace de la ecuación de la energía libre de Gibbs de la siguiente manera:
![]()
Donde R es la constante universal de los gases, T la temperatura en Kelvin y KC es la constante de equilibrio. Al igualar (1) y (2) se obtiene:
![]()
Despejando ln KC se obtiene la ecuación de Vant Hoff
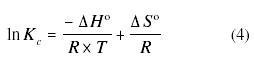
Un gráfico de ln Kc en el eje de las abscisas y T-1 en el eje de las ordenadas debería ser lineal y el intercepto equivaldría a DS°/R mientras que la pendiente sería numéricamente igual a DH°/R. Por su parte KC se determina de la siguiente manera [1]:

CAe es la concentración del adsorbato en el equilibrio contenido en la superficie del adsorbente y CSe es la concentración en solución en el equilibrio.
Entalpía de adsorción: Aporta información acerca del carácter exotérmico o endotérmico del proceso, se puede también estimar la energía de activación y además permite diferenciar si se trata de un proceso que ocurre vía adsorción física (valores bajos) o química (valores altos). Se calcula a partir de:
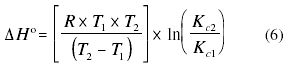
Donde R es la constante de los gases ideales, KC1 y KC2 son las constantes de equilibrio a las temperaturas T1 y T2 respectivamente [5,7].
Entropía de adsorción: Permite predecir la magnitud de los cambios sobre la superficie del adsorbente, ya que si los cambios son muy profundos en la misma se afecta la reversibilidad con lo que se obtendría un valor negativo de la entropía de adsorción, en caso contrario es indicativo de alta posibilidad de reversibilidad. Se calcula partiendo de la ecuación 7.
Empleando las suposiciones de Vant Hoff es posible estimar el rango de las propiedades termodinámicas tales como entalpía, entropía y energía libre de Gibbs de los procesos de adsorción estudiados. Para ello se realizaron pruebas de capacidad adsortiva de las muestras a tres temperaturas (25, 50 y 75 ºC) en consonancia con los trabajos de otros autores [5,9] donde también se barrieron tres temperaturas las cuales le resultaron suficientes para la interpretación del proceso de adsorción a partir de una aproximación a la termodinámica del mismo, ya que la diferencia entre los valores que se obtendrían entre ambos tipos de adsorción (física o química) son lo suficientemente amplios para que con las estimaciones obtenidas poder identificar el comportamiento del proceso. La concentración inicial de cada metal se fijó a 20 mg/L. Luego se determinó la concentración final de cada metal luego de la adsorción y con ello se estimó la cantidad de metal removido, con esta información se procedió a realizar un gráfico lnKc contra T-1 y se calcularon los parámetros termodinámicos requeridos.
3. RESULTADOS Y DISCUSIÓN
3.1 Obtención de las ligninas
Las cantidades de ligninas obtenidas en cada caso varían de acuerdo al pH final precipitación como se puede observar en la tabla 2. En el caso del licor acidificado a pH=2,00 con H2SO4 (LIG1) la cantidad es sensiblemente mayor, debido a que las condiciones finales son más ácidas si se les compara con el caso del mismo licor acidificado hasta pH=5,00 con HCl (LIG2).
Tabla 2. Rendimientos de ligninas precipitadas

Experimentalmente se observó que al entrar en contacto el HCl con el licor negro se crea una capa de precipitado en la superficie de éste más rápidamente que con el H2SO4, por lo que para evitar esto se aumentó la velocidad de agitación.
3.2 Caracterización de las Ligninas
En esta sección, el análisis espectroscópico de IR aporta información cualitativa en torno a los grupos funcionales presentes en las ligninas estudiadas. A su vez el análisis elemental y UV se utilizaron para comparar las ligninas precipitadas con la INDULIN AT.
3.2.1 Espectroscopía Infrarroja
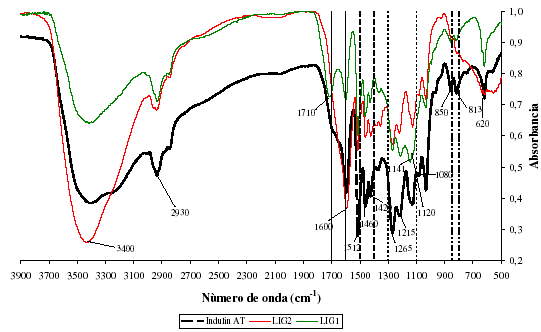
Se obtuvo una serie de cinco (5) espectros. El primero de ellos correspondió a la lignina comercial INDULIN AT. Por otro lado, A cada lignina se le realizó un análisis de IR antes y después de utilizarla como adsorbente. Esto fue hecho con la finalidad de comparar si existen diferencias apreciables a nivel estructural, permitiendo determinar los grupos funcionales más propensos interactuar con el níquel o vanadio según sea el caso. En la figura 1 se presentan los espectros de las ligninas antes de adsorber los metales junto con el de la lignina INDULIN AT. Observándose la existencia de una similitud entre las ligninas obtenidas por medio de precipitación ácida y la INDULIN AT, las cuales si bien difieren en el tipo de madera a partir de la cual son obtenidas, son esencialmente producidas utilizando un proceso similar (acidificación de un licor negro).
Figura 1. Espectros infrarrojos para INDULIN AT y las 2 ligninas precipitadas en el laboratorio
Al evaluar los espectros IR de la figura 1, los mismos albergan todas las bandas características de la lignina [10]. Alrededor de los 3400 cm-1 se nota una diferencia marcada en la intensidad de la banda correspondiente al grupo hidroxi (OH), esto puede deberse a la diferencia en el porcentaje de humedad de las muestras. El siguiente rasgo característico son las bandas sobre 2930 cm-1 correspondientes al alargamiento de los enlaces carbono hidrógeno para los grupos metil y metileno, los cuales se encuentran presentes en los tres espectros. La presencia de un pico en 620 cm-1 es sinónimo de la presencia de azufre en la muestra, y está presente en el patrón y en la lignina utilizada para adsorber vanadio (LIG1), mas no en la lignina utilizada para adsorber níquel (LIG2). Esto se debe al método de precipitación, por un lado se utilizó H2SO4 y por otro HCl
Como consecuencia del proceso de precipitación con cada ácido, la lignina precipitada con HCl presenta una diferencia mayor con el patrón, en comparación con su contraparte precipitada con H2SO4. Estudios anteriores [8,11] demuestran una estrecha relación entre la estructura química y las características adsortivas de las ligninas. Las diferencias estructurales a su vez se reflejan en los espectros, como es el caso de la vibración del esqueleto aromático a 1600 cm-1 y la deformación en el plano del enlace C-H en el anillo aromático a 1030 cm-1 donde las unidades, dependiendo de su naturaleza serán más o menos activas a dichas frecuencias de vibración, lo cual se aprecia directamente en la intensidad del pico.
Alrededor de 1512 cm-1 se presentan vibraciones del esqueleto aromático asociadas a las unidades siringil y guayacil [12,13], las cuales se aprecian claramente en el espectro de los tres adsorbentes. A 1460 cm-1 se tienen la deformación de los enlaces CH, mientras que a 1420 cm-1 vibraciones del esqueleto aromático, combinadas con deformación en el plano de enlaces C-H [12,13]. A 1080 cm-1 se representan deformaciones en el plano de enlaces CO en alcoholes secundarios y éteres alifáticos. Alrededor de 1265 cm-1 se presentan el estiramiento del enlace carbonilo en los anillos de las unidades guayacil más la vibración de enlaces C-O [10]. En la INDULIN AT y LIG2 se presentan dos picos, 1141 y 1120 cm-1 correspondientes a la deformación en el plano de enlaces C-H típico de unidades guayacil y el correspondiente de unidades siringil respectivamente, así como de alcoholes secundarios y grupos carbonilos. El espectro de INDULIN AT reporta un máximo en 1124 cm-1 que representa la vibración de la unidad éter (enlaces C-O) [13].
Finalmente 1213 cm-1 se debe a vibraciones enlaces de tipo C=O, C-O y C-C en unidades guayacil, teniendo una mayor contribución la forma condensada que la esterificada [13]. Todos los adsorbentes presentan ambos picos en valores alrededor de 850 y 813 cm-1, los cuales representan vibraciones de los enlaces C-H fuera del plano en las posiciones 2 y 6 de los anillos aromáticos, para unidades guayacil y siringil respectivamente[12,13].
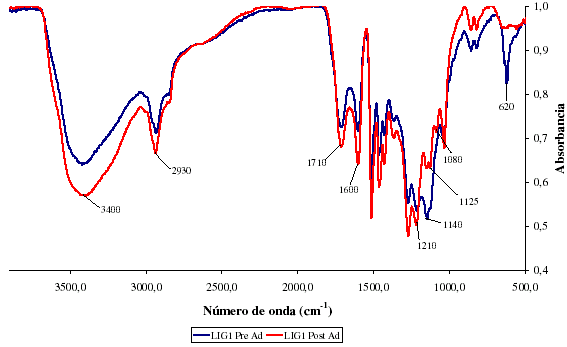
Siguiendo con los estudios mediante IR, se procedió a comparar los adsorbentes obtenidos antes y después del proceso de adsorción. Esto con la finalidad de determinar cuales grupos son los más propensos a adsorber los metales en solución y dar un paso más hacia la elucidación del mecanismo de adsorción. En la figura 2, se aprecian los espectros de la lignina que adsorbió vanadio, antes y después del proceso de adsorción. Como se puede observar en esta figura, se aprecia una disminución general en la intensidad de los picos, los cuales pueden estar relacionada con diferencias en la proporción KBr- Lignina al momento de realizar el estudio de IR, sin embargo, es posible observar diferencias en la intensidad relativa de algunos picos tal como se muestra en la tabla 3, donde la intensidad relativa de los grupos carbonilos C=O, enlaces C-O en unidades guayacil (1213 cm-1) diminuye además de aquellas de las deformaciones C-H de las mismas unidades, que puede indicar que posiblemente grupos con configuraciones especificas sean los responsables de la adsorción de V.
Figura 2. Comparación de espectros IR para adsorción de vanadio
Tabla 3. Asignación de los cambios, lignina para vanadio.

Los cambios en la intensidad relativa sugieren un cambio estructural que se indican en la tabla 3.
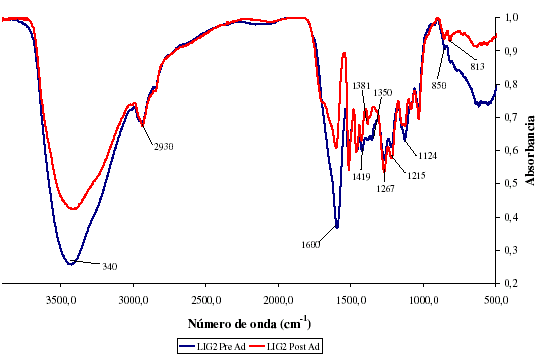
De igual manera, la lignina utilizada para adsorber níquel fue comparada antes y después de adsorber el metal. En la figura 3 se aprecia los dos espectros del adsorbente. A primera vista se ve una disminución de algunos picos, mas no como en el caso del vanadio. En esta oportunidad se ve una disminución en la tensión de los grupos OH (banda alrededor de 3400 cm-1), esta no está acompañada de la disminución similar en 2930 cm-1, efecto que si se aprecia en la comparación realizada con el adsorbente de vanadio. Absorbancia
Figura 3. Comparación de espectros IR para adsorción de níquel
Al comparar los espectros de la figura 3, se ve una variación en otros grupos, los cuales se encuentran resumidos en la tabla 4.
Tabla 4. Asignación de los cambios, lignina para níquel.
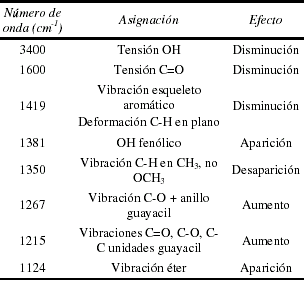
De la tabla 4, se aprecia una afinidad entre los oxígenos y el níquel presente, evidenciada por los picos en 3400 y 1600 cm-1, lo cual corrobora el mecanismo propuesto por Parajuli et al. [14], en el cual contempla la posibilidad de formación de quelatos debido a la coordinación de los grupos metoxi con el metal.
Bajo esta hipótesis es posible pensar que la interacción del níquel con los oxígenos presentes en el adsorbente sigue un mecanismo diferente al vanadio, ya que los grupos carbonilo y metoxilo son bastante abundantes en ambos adsorbentes, sin embargo sólo en el caso del níquel existe una marcada tendencia que sugiere la interacción metaloxígeno. Se aprecia además la aparición de una banda ancha en la región de huella dactilar (900-500 cm-1), la cual puede deberse al níquel presente en la lignina luego de la adsorción.
3.2.2 Espectroscopía Ultravioleta
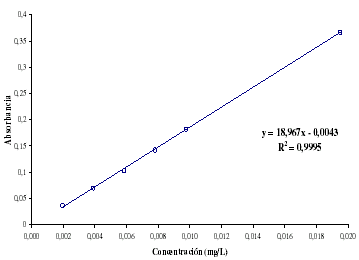
Para este estudio se utilizó nuevamente la lignina comercial INDULIN AT como patrón. Luego de las sucesivas diluciones, se obtuvo una curva de calibración, tomando en cuenta la absorbancia de las diluciones a un valor de 276,1 nm. El cual se encuentra dentro del intervalo reportado en la literatura alrededor de 280 nm [15]. Se realizó una curva con 6 puntos, y utilizando la función de regresión lineal, se determinaron los valores de pendiente e intercepto para la curva de calibración. En la figura 4 se observan los valores tanto para la pendiente como para el intercepto, así como el coeficiente de correlación entre los datos. Esta recta permite determinar el contenido de lignina presente en cualquier muestra que tenga una estructura similar a la del patrón.
Figura 4. Curva de calibración, análisis UV.
Luego con los valores de absorbancia obtenidos a partir de las soluciones preparadas con los adsorbentes obtenidos en el laboratorio como soluto, se calculó el porcentaje de similitud de la lignina precipitada con respecto a la INDULIN AT. En la tabla 5 se presentan los valores de absorbancia registrados, la concentración y el porcentaje obtenido.
Tabla 5. Absorbancia, concentración y porcentajes para las ligninas obtenidas

Se puede apreciar que el porcentaje de ligninas presentes en los precipitados con respecto a la INDULIN AT son bajos. El bajo valor en general se debe a la presencia de impurezas como sodio, potasio, calcio, celulosa, hemicelulosa contenidas en el licor negro del que se parte y que disminuyen sensiblemente la pureza del adsorbente. Se nota además que las diferencias en los porcentajes son superiores al 10% entre las ligninas precipitadas.
Éstas diferencias, representan por un lado la forma en la que la lignina es obtenida (H2SO4 y HCl) y por otro lado la falta de purificación. Se debe recordar que esto no se llevó a cabo ya que lo que se quiere es un producto con poco tratamiento que pueda ser utilizado como un adsorbente de bajo costo. Muy probablemente el valor más bajo de la lignina obtenida a partir de H2SO4 sea debido a la presencia de sales de azufre (sulfatos y sulfitos, posiblemente de calcio, sodio y potasio) las cuales no han sido separadas del adsorbente. En contraparte existe la posibilidad de encontrar cloruros en la lignina precipitada con HCl.
Inicialmente cuando la lignina se precipitó del licor negro, las condiciones de precipitación fueron diferentes en cuanto al pH final y concentración del ácido, la diferencia en los porcentajes es también un reflejo de estas condiciones ya que el porcentaje más alto está relacionado con el pH final más alto. Finalmente se debe considerar que las estructuras del patrón y los adsorbentes difieren debido a la madera a partir de la cual se obtienen los adsorbentes.
3.2.3 Análisis elemental
El análisis elemental determina los porcentajes de elementos presentes en la muestra. En la tabla 6 se pueden ver los valores obtenidos para los elementos estudiados.
Tabla 6. Análisis elemental de las ligninas estudiadas y aquellas reportadas en la literatura.
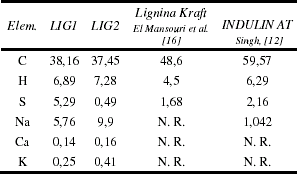
El contenido de carbono elemental se muestra bajo en comparación con los otros reportados mostrados en la tabla 6. Se podría pensar inicialmente que los relativamente altos valores de sodio, los cuales son sinónimo de impurezas (inherentes del proceso industrial del cual se deriva el licor negro, precursor de las ligninas estudiadas), podrían ser los causantes de esta baja cantidad de carbono. Pero se ve que la misma tendencia no se observa para los porcentajes de hidrógeno los cuales se encuentran en un rango esperado, 4,5-6,5% [12]. Si existiese la necesidad de aumentar el contenido de estos elementos en futuros estudios se podría utilizar algún proceso de purificación como lavar el sólido resultante con agua destilada [17] o con solución de etanol agua [12].
Por otro lado, existe una diferencia muy notoria en los porcentajes de azufre, en el caso de la lignina utilizada para adsorber vanadio es de esperarse ya que fue obtenida mediante precipitación con H2SO4. Sin embargo no es posible afirmar que todo ese azufre se encuentra a nivel estructural debido a que no se ha sometido al adsorbente a un proceso de purificación, con la finalidad de eliminar las sales de azufre que posiblemente estén presentes en el adsorbente. Sin embargo los espectros IR arrojan un pico en un valor característicos en la región de huella dactilar entre 1100 y 1150 cm-1 correspondientes a los sulfatos iónicos (SO4) [15], señal que está presente también en el patrón pero no en la lignina precipitada con HCl.
El alto porcentaje de sodio se debe al proceso de elaboración del papel. El método Kraft o del sulfito emplea grandes cantidades de reactivos alcalinos como hidróxido de sodio y potasio con la finalidad de separar la celulosa de la madera.
3.3 Isotermas de Adsorción
Luego de terminado el proceso de caracterización se procedió a la construcción de las isotermas de adsorción. En un estudio realizado por Guo et al. [17] se revela que un aspecto fundamental para la obtención de isotermas de adsorción reproducibles es mantener el pH constante durante todo el proceso de adsorción. Ya que en el caso de las ligninas este factor influye marcadamente en el fenómeno de adsorción ya que una variación de 0,5 en la unidad de pH puede cambiar fácilmente entre un 10% (caso vanadio) y un 40% (caso níquel) la cantidad de metal adsorbido. Por otro lado también se tiene que la cantidad de lignina inicial varía el pH de la solución como lo reporta Lalvani et al. [18]. Este comportamiento se apreció durante las experiencias, teniendo comportamientos marcadamente diferentes. Mientras que LIG1 aumenta el pH de la solución en la que se encuentra, LIG2 lo disminuye. Este comportamiento está directamente relacionado con los grupos presentes en la lignina y su capacidad de solubilización.
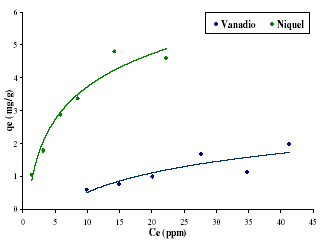
La figura 5 muestra las dos isotermas obtenidas. En primera aproximación, ambas isotermas presentan una forma tipo clásica. La tendencia del níquel es más pronunciada y con un cambio mas acentuado en la forma de la isoterma. Esto es indicativo de que ambos procesos de adsorción son diferentes, lo cual se viene evidenciando desde la obtención de los espectros de IR. Con los datos obtenidos de la figura 5 fue posible simular las isotermas de Langmuir, Freundlich y Redlich-Peterson.
Figura 5. Isotermas de adsorción para níquel y vanadio
Partiendo de la pendiente y el intercepto del modelo de Langmuir, es posible calcular los valores característicos KL y qm, donde el primero es la constante de equilibrio del sistema definido como el cociente de la constante de adsorción y la constante de desorción (Kads/Kdes) y qm es la cantidad máxima de adsorbato en el adsorbente o en términos teóricos volumen de la monocapa. Estos se presentan en la tabla 7.
Tabla 7. Parámetros de ajuste del modelo Langmuir para níquel y vanadio

3.3.1 Isoterma de Langmuir
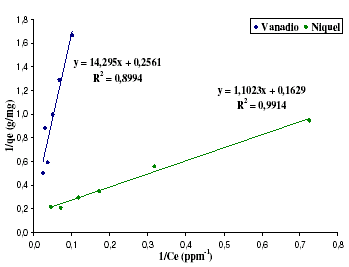
Las rectas obtenidas en cada caso se muestran a continuación en la figura 6.
Figura 6. Modelo de Langmuir para níquel y vanadio
Los coeficientes de correlación de los datos, sugieren que el modelo de Langmuir sólo explica el proceso de adsorción para el níquel, donde se obtuvo un valor para el coeficiente de correlación mucho más cercano a la unidad. Además el valor de saturación se acerca a los reportados por Guo et al. [17] para el mismo metal. En este caso se obtuvo un qm de 0,104 mmol/g mientras que el grupo de Guo et al. [17] obtuvo un valor de 0,102 mmol/g. Comparado con Pérez et al. [3], este valor es mayor (0,00928 mmol/g), lo cual es sinónimo de un adsorbente con una capacidad adsortiva mayor. Por su parte el vanadio presenta un valor de qm de 0,0767 mmol/g que comparado con el estudio de Pérez et al 2007 está en el mismo orden de magnitud (0,00895 mmol/g).
A su vez, un aspecto importante del modelo de Langmuir es el parámetro de equilibrio expresado en la ecuación (2). La concentración inicial utilizada fue la más alta como lo hace Gode y Pehlivan, [19]. El valor obtenido fue de RL=0,1299 para el caso del níquel, lo cual es indicativo de un proceso espontáneo [5,19]. Para el caso del vanadio, el valor de RL=0,5211 que indica un proceso menos espontáneo [19].
3.3.2 Isoterma de Freundlich
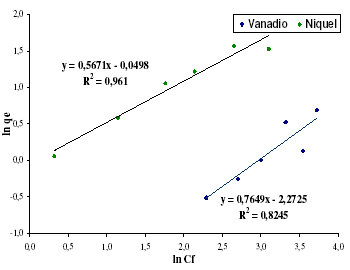
De manera análoga al modelo de Langmuir, se presentan a continuación las rectas obtenidas mediante la linealización usando el modelo Freundlich.
Figura 7. Modelo de Freundlich para níquel y vanadio
Finalmente los valores característicos para el modelo de Freundlich son calculados. KF es la constante de Freundlich y al igual que 1/n que es un factor adimensional no tienen un significado físico. Estos valores corresponden a los expresados en la tabla 8.
Tabla 8. Parámetros de ajuste del modelo Freundlich para níquel y vanadio

Comparado con el modelo de Langmuir este modelo, estadísticamente no es mejor, prueba de ello es el coeficiente de correlación de la regresión lineal aplicada a los datos, los cuales son sensiblemente menores en este caso. Esto se debe a que el modelo de Freundlich es utilizado usualmente para procesos en los que el fenómeno de adsorción es físico, mientras que Langmuir es utilizado para procesos con adsorción química. Debido a la naturaleza de la lignina con la gran cantidad de grupos funcionales, se puede afirmar que el proceso de adsorción en las ligninas es predominantemente químico [3] y debido a ello Langmuir ajusta mejor.
En ambos casos, los coeficientes calculados son mayores a los obtenidos por Pérez et al. [3], lo cual implica que la cantidad de metal removido del seno de la solución es mayor para el adsorbente estudiados en este trabajo.
3.3.3 Isoterma de Redlich – Peterson
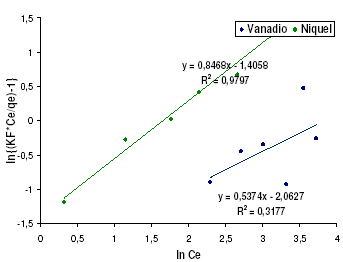
Siguiendo la metodología anterior las rectas obtenidas para este modelo de adsorción se muestran en la figura 8:
Figura 8. Modelo de Redlich - Peterson para níquel y vanadio
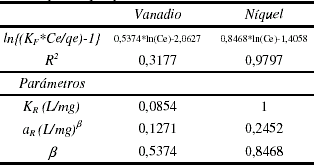
Es de notar que para el caso del vanadio, el modelo no ajusta tan bien como si lo hace para el caso del Níquel, indicativo de esto es el valor del coeficiente de correlación de datos (R2). En la tabla 9 se muestran los resultados del análisis del modelo para los sistemas en estudio, de los resultados mostrados en esta tabla es importante resaltar el hecho de la existencia de valores de b diferentes en ambos casos muestran un comportamiento diferente en el proceso de adsorción. Por un lado el vanadio arroja un valor cercano a cero lo cual sugiere un proceso que sigue la ley de Henry, sin embargo, no es un valor confiable debido a que como fue señalado previamente, el coeficiente de correlación sugiere que el modelo no explica el fenómeno de adsorción. Por su parte el níquel presenta un valor relativamente cercano a la unidad, lo cual sugiere un proceso de adsorción similar a Langmuir, que como se puede ver es el modelo que mejor se ajusta a la serie de datos que fue obtenida, siendo esto otra confirmación de que el proceso de adsorción es llevado a cabo mediante una interacción química entre el metal en solución y los grupos funcionales de la lignina.
Tabla 9. Parámetros de ajuste del modelo Redlich - Peterson para níquel y vanadio
3.4 Obtención de los parámetros termodinámicos
Los parámetros termodinámicos se calcularon en ambos casos de manera gráfica, utilizando la ecuación 9. Para el caso del níquel se muestra en la figura 9.
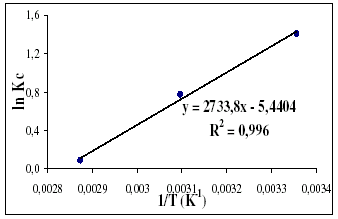
Figura 9. Modelo de la ecuación de Vant Hoff para el níquel
Los parámetros característicos de la recta presentada previamente con su respectivo error se presentan en la tabla 10.
Tabla 10. Regresión lineal gráfico Vant Hoff para níquel

Directamente de los valores de la pendiente y el intercepto del gráfico y tomando en cuenta la constante de los gases ideales R, es posible determinar DHº de adsorción y DSº de adsorción. Posteriormente, se calculó DGº. A continuación se presentan los valores obtenidos.
Los valores negativos de DGº indican la espontaneidad del proceso de adsorción. La entalpía asociada al proceso se encuentra por debajo de 40 KJ/mol lo cual sugiere la coexistencia de adsorciones físicas y químicas [5]. Este valor es contradictorio con el modelo de isoterma para el caso del níquel, sin embargo esta contradicción es usual [20] y es debido en parte a que ambos tipos de adsorción toman lugar, y en parte a que los modelos no interpretan exactamente el proceso. Igualmente se corresponde con valores encontrados en la literatura para procesos de adsorción similares [5,7]. Adicionalmente el valor negativo de este parámetro es un indicativo directo de la exotermicidad del proceso.
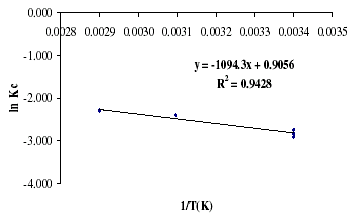
El mismo procedimiento fue aplicado a las adsorciones de vanadio obteniéndose la figura 10.
Figura 10. Modelo de la ecuación de Vant Hoff para el vanadio
Lamentablemente el ajuste obtenido en la figura 10, repercute en una baja confianza de los resultados de la tabla 12, que se pueden usar únicamente con fines referenciales para futuros estudios.
Tabla 11. Parámetros termodinámicos calculados para adsorción de níquel

Tabla 12. Parámetros termodinámicos calculados para la adsorción de vanadio
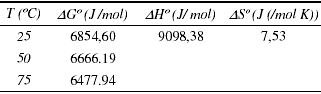
Los valores positivos de DGº indican la no espontaneidad del proceso de adsorción para esta lignina, y justificaría porque la adsorción aumenta ligeramente con la temperatura. La entalpía asociada al proceso se encuentra por debajo de 10 KJ/mol lo que indicaría una mayor importancia de los procesos de adsorción física que en el caso del níquel, pero su valor es positivo indicaría la existencia de un proceso endotérmico.
DSº por su parte resultó de baja magnitud y positiva, concordante para la baja adsorción obtenida para esta lignina en este estudio, indicando que este proceso es reversible.
4. CONCLUSIONES
De los ajustes a los distintos modelos de adsorción estudiados, se encontró, que el que mejor representa los dos casos en estudio, es decir, la adsorción de níquel y vanadio, dados los mayores coeficientes de correlación obtenidos, es el modelo de Langmuir, que es indicativo de los fenómenos asociados a la adsorción química. Para el caso de la adsorción de vanadio se recomienda realizar un mayor número de estudios, dado que la baja adsorción obtenida podría ser un factor que genera distorsiones al inferir que clase de adsorción se está llevando a cabo.
Los parámetros termodinámicos fueron estimados para la adsorción de los sistemas níquel-lignina y vanadio-lignina. En el caso de la adsorción de níquel, los valores obtenidos permiten interpretar el proceso como un fenómeno espontáneo, exotérmico y el valor negativo de la variación de la entropía es característico de los fenómenos que van a un mayor grado de ordenamiento, como lo es la adsorción. En el caso de la adsorción de vanadio, se obtuvo que el proceso se comporta de forma no espontánea, endotérmica y el valor positivo de la variación de la entropía es un indicio que la adsorción del vanadio a las condiciones de operación que se trabajaron no se está dando, lo cual concuerda con la baja adsorción obtenida.
5. AGRADECIMIENTOS
Los autores agradecen al FONACIT-Venezuela por el financiamiento de la siguiente investigación a través del proyecto G-2005000432. Así como al CESMA-USB por el desarrollo del diseño experimental usado en el proyecto y a la UGA-USB por la determinación de la concentración de los metales en las soluciones generadas.
6. REFERENCIAS
1. Gonzáles N, Pérez NA, Rincón G, Delgado L. Adsorption. 2006; 12: 279-286. [ Links ]
2. De Chamorro, M. and Romano, M. Simultaneous demetallization and desulphuration of carbonaceous materials via microwaves. United States Patent. 6,068,737 (2000). [ Links ]
3. Pérez N, Sánchez M, Rincón G, Delgado L. Lat. Am. Appl. Res.. 2007; 37 (2): 157-162. [ Links ]
4. González J. Caracterización de ligninas nacionales precipitadas por diferentes vías. Trabajo de Grado en licenciatura Química, Universidad Simón Bolívar., 2008. [ Links ]
5. Acemioglu B. Bioresour. Technol. 2004, 93: 99- 102. [ Links ]
6. Hernández A. Precipitación de lignina a partir de licores negros nacionales. Trabajo de grado de Licenciatura en Química, Universidad Simón Bolívar. 2007. [ Links ]
7. Standard Methods for the Examination of Water and Wastewater, 21st Edition American Public Health Association (APHA), American Water Works Association (AWWA) & Water Environment Federation (WEF) 2005. [ Links ]
8. Vasanth, K, Sivanesan S. J. Hazard. Mater. 2006, 134 (1-3): 237-244. [ Links ]9. Acemioglu B, Alma M.H. J. Colloid Interface Sci. 2001, 243: 81-84. [ Links ]
10. Pearl IA, The Chemistry of Lignin. New York(EE.UU): Marcel Dekker Inc. 1967. [ Links ]
11. Fernández J, Evaluación de la calidad adsortiva para Ni y V de lignina Kraft precipitada a diferentes condiciones. Trabajo de grado de Ingeniería Química, Universidad Simón Bolívar. 2007. [ Links ]
12. Singh R, Singh S, Trimukhe K D, Pandare KV, Bastawade KB, Gokhale DV, Varma A J. Carbohydr. Polym. 2005, 62: 57-66. [ Links ]
13. Sarwar M, Nasima DA, Islam, M, Iqbal SM. Bioresour. Technol. 2007, 98:465-469. [ Links ]
14. Parajuli D, Inoue K, Ohto K, Oshima T, Murota A, Funaoka M., Makino K. Reactive & Functional Polymers. 2005, 62: 129-139. [ Links ]
15. Wallberg O, Jönsson A, Wimmerstedt R. Desalination. 2003, 154: 187-199. [ Links ]
16. El Mansouri N, Salvadó J. Industrial Crops. 2006, 24: 8-16. [ Links ]
17. Guo X, Zhang S, Shan X. J. Hazard. Mater. 2008, 151: 134-142. [ Links ]
18. Lalvani SB, Hübner A, Wiltowski TS. Energy Sources. 2000, 22: 45-56. [ Links ]
19. Gode F, Pehlivan. E. J. Hazard. Mater. 2006, 136 (2): 330-337. [ Links ]
20. Wan Ngah WS, Hanafiah M. Biochemical Engineering Journal. 2007, 39 (3): 521-530. [ Links ]