Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Latinoamericana de Metalurgia y Materiales
Print version ISSN 0255-6952
Rev. LatinAm. Metal. Mater. vol.35 no.2 Caracas Dec. 2015
El efecto de los tratamientos: Radiación microondas y co-precipitación sobre las propiedades cristalinas en hidrotalcitas de Co-Al y Ni-Al
Viky-C Mujica-F1,2,*, Carlos F. Linares1,2, Ingrid Velásquez3
1: Departamento de Ingeniería Química. Facultad de Ingeniería. Universidad de Carabobo. Av. Universidad. Municipio Naguanagua Edo. Carabobo. Venezuela.
2: Unidad de Síntesis de Materiales y Metales de Transición, Departamento de Química, Facultad de Ciencias y Tecnología (FACYT), Universidad de Carabobo. Bárbula. Municipio Naguanagua. Edo. Carabobo. Venezuela.
3: Departamento de Física. Facultad de Ingeniería. Universidad de Carabobo. Av. Universidad Municipio Naguanagua Edo. Carabobo. Venezuela.
*e-mail: vcmujica@gmail.com
RESUMEN
Se analiza el efecto de las variables en la síntesis de compuestos tipo hidrotalcitas (HDLs) de composición Co,Al-CO3 y Ni,Al-CO3, por métodos de radiación microondas y co-precipitación, aplicando un diseño experimental factorial fraccionado 24-1. Las propiedades de HDLs obtenidas se comparan utilizando el Factor de Fisher, siendo éste un aspecto innovador en la síntesis para sólidos inorgánicos. El valor de Fisher permitió establecer la influencia de las variables: relación metálica o molar, pH, temperatura de precipitación y tiempo de cristalización o radiación. Los compuestos obtenidos fueron caracterizados mediante difracción de rayos X (DRX). Se estimaron los parámetros de red a y c, porcentaje de cristalinidad relativa (%CR) y tamaño del cristal (ε) por aplicación de la ecuación de Scherrer corregida por Warren. En todos los casos, se obtuvieron compuestos tipo hidrotalcitas con el anión carbonato situado paralelo a las láminas de brucita, independiente del método utilizado. La radiación microondas conduce a la formación de sólidos de satisfactoria cristalinidad aunque con menor tamaño de cristal cuando se comparan con los obtenidos por el método de co-precipitación. Desde el punto de vista estadístico en la síntesis de HDLs Co-Al y Ni-Al obtenidos por el método de co-precipitación, las variables estudiadas afectan significativamente el tamaño del cristal, porcentaje de cristalinidad relativa y parámetros de red para cada serie. Con el método de radiación por microondas se obtiene más versatilidad en las condiciones de síntesis, no se afectan significativamente ninguna de las características evaluadas. No se encontró mediante un análisis de varianza diferencias significativas entre los métodos utilizados para la obtención de las hidrotalcitas de Co-Al y Ni-Al, considerando cada una de las características estructurales estudiadas.
Palabras Claves: Microondas, co-precipitación, hidrotalcitas, factor de Fisher
The effect of treatment: Microwave radiation and co-precipitation on Co-Al and Ni-Al hydrotalcites crystal properties
ABSTRACT
The effect of the variables in the synthesis of hydrotalcite-like compounds (HDLs) of composition Co, Al-CO3 and Ni, Al-CO3, by microwave radiation and co-precipitation methods, using a 24-1 fractional factorial experimental design were analyzed. The properties of HDLs obtained were compared by using the Fisher factor. This is an innovative aspect in the inorganic solids synthesis. Fisher value allowed determining the influence of the variables such as: metal or molar ratio, pH, precipitation temperature, crystallization time or radiation. The obtained compounds were characterized by X-ray diffraction (XRD). Lattice parameters a and c, percent relative crystallinity (%CR) and crystal size (ε) by application of the Scherrer equation was estimated corrected by Warren. For all cases, hydrotalcite-type compounds were obtained with carbonate anion placed parallel to brucite sheets for the used methods. The microwave radiation leads to the formation of crystalline solids but a less satisfactory crystal size is obtained, when it is compared with those obtained by the coprecipitation method. From the statistical point of view, the synthesis of HDLs Co-Al and Ni-Al by co-precipitation method, the above mentioned parameters affect significantly studied variables for each series. The microwave radiation method was more versatility in the synthesis conditions, and the studied parameters did not significantly affect any of the evaluated characteristics. It was not found by analysis of variance significant differences between the methods used for producing hydrotalcites of Co-Al and Ni-Al, considering each of the structural characteristics studied.
Keywords: Microwave, co-precipitation, hydrotalcites, Fisher value
Recibido: 01-11-2014; Revisado: 18-01-2015
Aceptado: 09-04-2015; Publicado: 21-05-2015
1. INTRODUCCIÓN
Las hidrotalcitas son hidróxidos dobles laminares (HDLs) tipo brucita Mg (OH)2, pertenecen al grupo de las arcillas aniónicas de estructura laminar con polihidroxicationes bidimensionales y exceso de carga positiva compensada por aniones hidratados situados en el espacio interlaminar [1]. La estructura de las hidrotalcitas está basada en unidades de octaedros M(OH)6 unidas por los vértices para formar las láminas de brucita. Estas unidades octaédricas contienen tanto cationes metálicos divalentes como trivalentes; se pueden representar mediante la fórmula química [M2+1-x M3+x(OH)2]x+ [Am-]x/m·nH2O, donde: A es un anión de carga negativa m-, M+2 es el metal de carga bivalente, M+3 es el metal trivalente, x es la relación M3+/(M2++M3+) y m representa la máxima cantidad de agua [2].
Los metales con las cargas bivalentes y trivalentes, pueden acomodarse en los sitios cercanos a los grupos OH- de las capas de la estructura de la brucita [3]. La naturaleza del anión entre las láminas puede ser de tipo inorgánico, heteropoliácido, ácidos orgánicos y compuestos laminares; mientras que los aniones inorgánicos más utilizados son: CO32-, SO42-, Cl-, NO3- entre otros [3,4].
Ambrogi, et al [5] indican que los HDLs han recibido considerable atención en las últimas décadas debido a sus potenciales aplicaciones en diferentes campos, tales como intercambiadores de iones, adsorbentes, la ciencia médica y catalizadores. Según las investigaciones realizadas por Khan y OHare [6] y, Rives y Srinivasan [7], la amplia gama de aplicaciones provienen de las características especiales de su estructura relacionadas con la posibilidad de alojamiento de cationes de diferentes naturalezas en las láminas, intercalación de varios tipos de aniones (inorgánicos, orgánicos, organometálicos, polioxometalatos) y la formación de óxidos mixtos bajo tratamiento térmico.
Los HDLs también exhiben el denominado efecto memoria donde algunos de sus productos obtenidos por descomposición térmica, cuando se ponen en contacto con un medio acuoso, espontáneamente, reconstruyen su estructura [8]. Esta propiedad los hace materiales adecuados para ser empleados en procesos de adsorción-desorción de compuestos aniónicos en solución acuosa, aumentando así su durabilidad y la reducción de costos [9].
La síntesis de estos materiales se lleva a cabo utilizando diferentes técnicas, a través de reacciones de precipitación tales como: sal-óxido, sal-base y sal-hidróxido. El método sal-base es el más utilizado para la preparación de HDLs. Este método es llamado síntesis de co-precipitación (CP) de las sales metálicas que van a formar parte de las láminas en la capa de brucita. La facilidad de este proceso ha propiciado que se hayan preparado gran cantidad de compuestos donde se varía la composición de las láminas y la región inter-laminar [3,10].
Una de las áreas de investigación de interés actual son los métodos no convencionales para la síntesis de los materiales antes citados, a fin de acelerar y promover el curso de las reacciones. Entre ellos, se encuentra el uso del calor controlado por microondas (M) con el fin de acelerar las reacciones. Una microonda es una forma de energía electromagnética que se ubica en la zona de bajas frecuencias en el espectro electromagnético, localizada en la región de longitud de onda entre 1mm -1m y en frecuencias de 0,3-300 GHz [11].
En las investigaciones realizadas por Benito et al [12], la aplicación de nuevas tecnologías a la síntesis de materiales es un tema de gran actualidad por las perspectivas de mejora que suponen. La naturaleza de las microondas se produce un calentamiento volumétrico, que permite mejorar las propiedades físicas, preparar nuevos materiales que no se pueden obtener por otros métodos, disminuir el tiempo de síntesis, ahorro energético, mayor rendimiento, procedimiento económico y ser respetuoso con el medio ambiente, entre otros. El calentamiento se produce debido a que el campo eléctrico de las microondas es alterno, provocando un rápido movimiento de las especies polares que tratan de alinearse con el campo, la resistencia a dicho movimiento genera calor [13].
En esta investigación se utiliza un diseño de experimento de tipo factorial fraccionado para evidenciar el efecto de la variables: relación molar o metálica, pH, tiempo de cristalización o radiación y temperatura de precipitación en la síntesis de hidrotalcitas binarias de Co-Al y Ni-Al sobre las propiedades cristalinas de los HDLs empleando los métodos de radiación microondas y coprecipitación. Entre las propiedades cristalinas analizadas se encuentra el porcentaje de cristalinidad relativa, tamaño del cristal y los parámetros de red cristalina a y c.
El diseño estadístico factorial permitirá establecer las variables significativas durante la síntesis a través del Factor de Fisher. Por otra parte, se realizará una comparación entre ambos métodos de síntesis mediante la estimación de varianza. Vale destacar, que existe una variada información sobre síntesis de este tipo de materiales sin considerar herramientas estadísticas (diseño de experimentos), por tanto se hace novedosa la aplicación de este tipo de herramientas, a fin de definir las variables que son realmente importantes durante la síntesis de HDLs y poder alcanzar características estructurales y químicas en este tipo de materiales acorde con las exigencias relacionadas al destino o uso requerido.
2. PARTE EXPERIMENTAL
2.1 Síntesis de las hidrotalcitas (HDLs) bajo un diseño de experimento fraccionado 2k-p.
Para cada una de las hidrotalcitas binarias a sintetizar, se llevó a cabo una revisión bibliográfica exhaustiva sobre los métodos, procedimientos y condiciones para realizarlas [11-13]. Las propiedades cristalográficas objeto de estudio en la investigación se ven afectadas por: relación molar o metálica (A), pH (B), tiempo de cristalización o radiación (C), y temperatura de precipitación (D). Estas variables son consideradas de interés porque ofrecen un control sobre la estructura de este tipo de materiales reflejado en la cristalinidad, tamaño del cristal y parámetros de red. Los intervalos de estudio para cada variable se ajustaron en función del equipamiento y recursos disponibles.
Esta selección de variables se realizó a fin de estudiar los efectos sobre las características estructurales tales como: tamaño del cristal, parámetros de red cristalina a y c; así como también, el porcentaje de cristalinidad relativa. Para evidenciar los efectos de las variables sobre las características antes citadas se estableció un conjunto de experimentos regidos por un Diseño Factorial de tipo fraccionado 2k-p que es una fracción 1/2p de un diseño factorial completo 2k. La k representa el número de factores o variables para el diseño experimental, p el número de fracciones a considerar y el 2 indica el número de niveles que toman los factores.
Este tipo de experimentos fraccionados tienen por objetivo determinar la significación de los efectos principales y de las interacciones de 2, 3 y más factores de manera adecuada, evitando de esta forma, la presencia de interacciones dobles o triples que dificultan el análisis de resultados y la correlación entre las variables en estudio. Se tomó una resolución tipo III donde ningún efecto principal se confunde con otro principal. En este tipo de diseño, los efectos principales no son alias entre ellos, pero existen efectos principales que son alias de alguna interacción doble [14].
En general, empleando el método de coprecipitación, se prepararon 50 mL de las soluciones constituidas por los nitratos de las sales metálicas en estudio, considerando la relación metálica (x) o molar especificada en cada experimento (Tabla 1 y 2). También, se prepararon 50 mL de las soluciones de los agentes precipitantes Na2CO3 y NaOH a las concentraciones correspondientes manteniendo una relación [CO32-]/[M3+] =0,5.
Se procedió a la adición de las sales metálicas sobre el agente precipitante bajo agitación vigorosa ajustando el pH de la reacción según sea el caso y se controló la temperatura y el tiempo de agitación durante los experimentos. Luego, la mezcla de reacción se filtró, se lavó con agua destilada hasta pH = 7 y finalmente se secó a 60 ºC por 24 horas.
Para el caso de las síntesis en microondas la mezcla de reacción preparada bajo las mismas condiciones utilizadas por el método de co-precipitación, se colocó en envases plásticos de 25 mL de capacidad y sellados con teflón, para luego ser expuestos a la radiación en microondas, se dejan enfriar y se realiza el filtrado, lavado y secado. El horno microondas utilizado es de tipo doméstico modelo The Genius Sensor 1250 W marca Panasonic, el equipo no permite tener un registro y control de la temperatura durante la digestión; sin embargo, se controla la potencia aplicada en un rango de 10 niveles, para la investigación se utilizó el primer nivel.
2.1.1 Síntesis de hidrotalcitas de Co-Al.
La síntesis de la hidrotalcita Co-Al se realizó mediante el método de co-precipitación utilizando Al(NO3)3·9H2O y Co(Cl)2 con 98% y 98,4% de pureza respectivamente, empleando las metodologías descritas por Gabrovska et al [15], Thompson et al [16], Armor et al [17], Pérez- Ramírez et al [18], Pérez-Ramírez et al [19], Kannan y Swany [20] y Thaylor [21]. Para la síntesis utilizado microondas se consideraron los trabajos de Benito et al [22] y Negrón et al [23] que permitieron establecer los intervalos de las variables dependientes especificadas en la Tabla 1 para ambos métodos.
2.1.2 Síntesis de hidrotalcitas de Ni-Al.
En el caso de las hidrotalcitas Ni-Al se utilizó Al(NO3)3·9H2O y Ni(NO3)2·6H2O con 98 % y 97 % de pureza respectivamente, siguiendo lo establecido en las investigaciones de Armor et al [17], Parthasarathi et al [24], Pérez-Ramírez et al [19], Thaylor [21] y Sánchez-Cantu et al [25]. En microondas se revisaron los trabajos desarrollados por Benito et al [22], Benito et al [26] y Negrón Negrón et al [23]. Para ambos métodos las condiciones están especificadas en la Tabla 2.
En la Tabla 3 se presenta el arreglo factorial que considera la combinación de variables y niveles a ensayar para cada método.
2.2 Caracterización de los polvos de las hidrotalcitas sintetizadas.
Las hidrotalcitas de Co-Al y Ni-Al sintetizadas por ambos métodos se caracterizaron mediante la técnica de difracción en polvo de rayos X (DRX). Los estudios de DRX se realizaron en un difractómetro Siemens (D500S) operando con tubo de descarga con ánodo de cobre con radiación CuKα (1,54060 Å) a 40 kV y 40 mA, con un intervalo de barrido del ángulo de difracción para la detección de la fase cristalina (2θ) comprendido entre 5 y 90º y un tiempo de conteo de 0,4 segundos por paso.
Los parámetros de celda fueron estimados a partir de los datos de DRX considerando un polimorfismo 3R [28], el parámetro a representa la distancia promedio entre los cationes en las capas de brucita y d(110) es la distancia inter-planar para el plano (110) en Å [3], éste se calculó utilizando la siguiente ecuación.
a = 2×d(110) (1)
Mientras que el valor del parámetro c, que representa la distancia entre las láminas de brucita, fue calculado utilizando la ecuación 2 [29], es una consecuencia del contenido de agua, del tamaño, orientación y carga del anión utilizado, d(003) representa la distancia inter-planar para el plano (003) en Å.
2.2.2 Estimación del tamaño del cristal, ε.
El tamaño del cristal fue calculado con la ecuación de Scherrer a partir de los datos del ancho máximo a la altura media del pico de interés (Full Width at Half Maximum, FWHM) para el plano (003) utilizando la corrección de Warren [27], con un patrón de difracción de cuarzo.
![]()
Donde ε es el tamaño promedio del cristal, λ es la longitud de onda de la radiación, κ es una función de forma la cual tiene un valor de ( 0,9), FWHM determinado por el ancho medio del pico experimental en radianes y θ es el ángulo de incidencia en radianes.
2.2.3 Estimación del porcentaje de cristalinidad relativa (%CR).
Para el porcentaje de cristalinidad se realizó la estimación, considerando los picos máximos de intensidad para los planos cristalinos observados en los difractogramas de DRX [30].
3. RESULTADOS Y DISCUSIÓN
3.1 Caracterización de las hidrotalcitas.
3.1.1 DRX hidrotalcitas de Co-Al y Ni-Al.
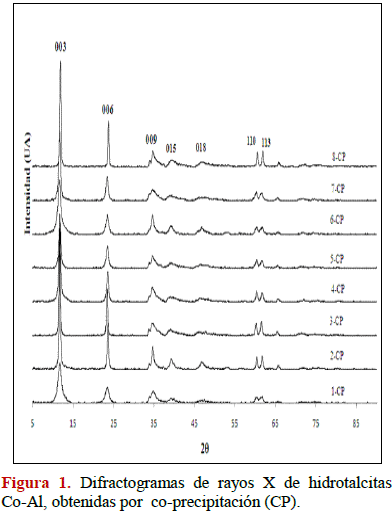
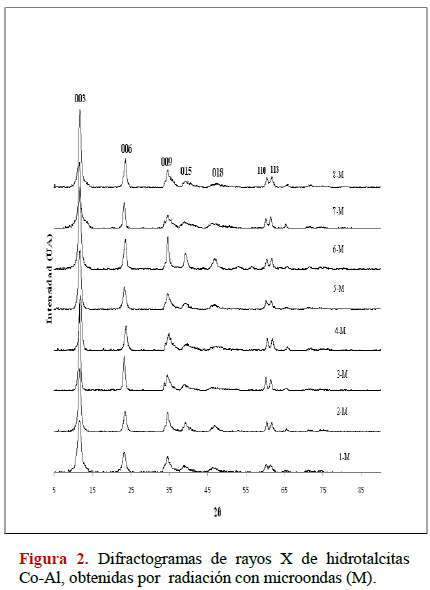
En las Figuras 1-4 se muestran los patrones de difracción de rayos X para las muestras sintetizadas por co-precipitación y radiación de microondas. En las hidrotalcitas obtenidas se observan picos finos y simétricos para los planos (003), (006), (110) y (113) y, picos anchos y asimétricos para los planos (009), (015) y (018) característicos de arcillas minerales con estructura laminar (JCPDS 22-700). Al comparar los difractrogramas (Figuras 2 y 3) se evidencia una ligera diferencia en las intensidades de las reflexiones que presentan los sólidos sintetizados por co-precipitación, lo que se traduce en compuestos ligeramente más cristalinos (reflexiones más intensas) que aquellos obtenidos por radiación microondas. En los compuestos HDLs de Ni-Al se puede observar en los difractogramas que a medida que se progresa en los experimentos para ambos métodos, se mejora la cristalinidad obteniéndose picos finos y simétricos para los planos (003), (006), (110) y (113). También se observan picos anchos y asimétricos para los planos (009), (015) respectivamente, intensidades sólo un poco ligeramente mayores se obtienen para los compuestos sintetizados por co-precipitación.
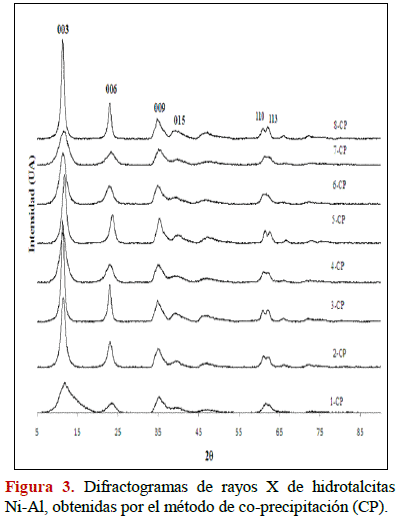
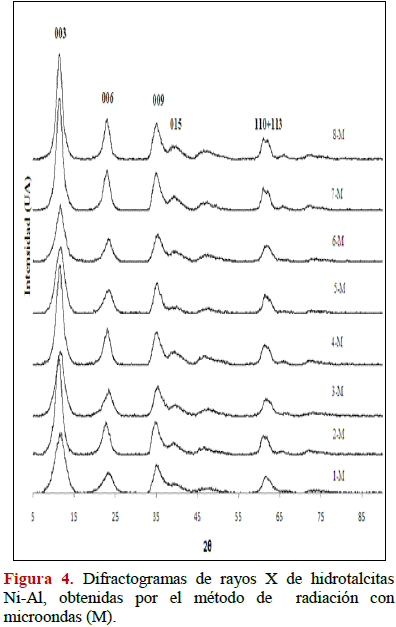
3.1.2 Parámetros de la red cristalina a y c para las hidrotalcitas Co-Al y Ni-Al.
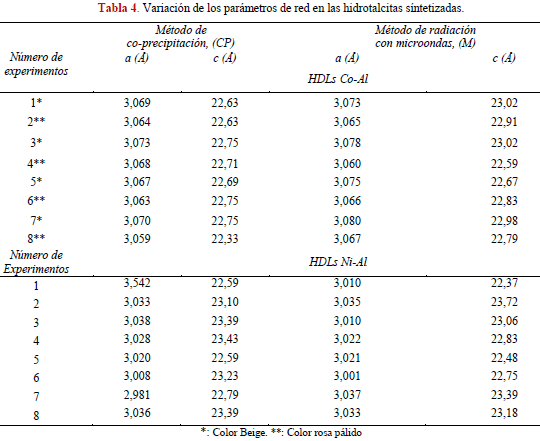
En la Tabla 4 se presentan los resultados asociados a los parámetros de red a y c obtenidos a partir de las reflexiones en los planos (110) y (003) respectivamente para las hidrotalcitas Co-Al y Ni-Al sintetizadas por ambos métodos. Los parámetros de red estimados son característicos de compuestos tipo hidrotalcita con el anión carbonato situado paralelo a las láminas de brucita y corresponden a lo reportado en la literatura [12, 15, 16, 18, 20, 22, 25, 26, 31-35].
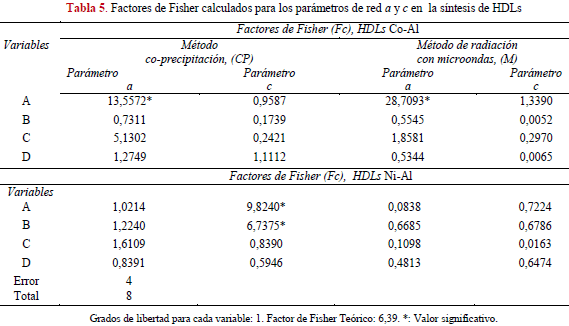
En la Tabla 5 se presentan los valores de Fisher calculados para cada variable durante la síntesis de HLDs Co-Al y Ni-Al, a fin de medir su efecto sobre los parámetros de la red. Se evidencia que para ambos métodos sólo el parámetro a presenta un grado de significancia al obtenerse valores del factor de Fisher mayores al teórico de 6,39 para la variable A asociada a la relación metálica x= M3+/(M2++M3+). Por ser el parámetro que representa la distancia entre los cationes presentes, entonces el cambio en la relación metálica estudiada afecta significativamente este valor. Se observa además, para ambos métodos, que al aumentar el contenido de Co (x= 0,25) se tienen valores mayores del parámetro a en los experimentos 1, 3, 5 y 7 respectivamente (Tabla 4), debido a las diferencias entre los radios iónicos entre los cationes Co+2 (0,74 Å) y Al+3 (0,53Å) [3,15, 18, 33].
Por otra parte, al comparar los valores de a en función del método, los resultados sugieren que la radiación por microondas aumenta ligeramente este parámetro en casi todos los experimentos: 1, 2, 3, 5, 6, 7 y 8, posiblemente atribuido a fuertes interacciones entre los cationes por efecto de la radiación [22]. Para las demás variables en estudio a saber: B, C, D los resultados estadísticos muestran que no existe una dependencia significativa en los parámetros de red.
Para la serie Co-Al aunque los cambios en el valor del parámetro c no son significativos desde el punto de vista estadístico a lo largo de los experimentos para cada método aplicado independientemente de las variaciones en A, B, C, D, es importante destacar que estos valores se incrementan en función del aumento del contenido de Co+2. Esto puede ser interpretado por un efecto parcial de oxidación de Co+2 a Co+3 favorecido termodinámicamente especialmente a condiciones básicas [36], asociado con la salida de cationes Al+3 del dominio intralaminar [37]. Esta suposición del cambio en la oxidación del Co+2 a Co+3 es soportada por el color beige obtenido en las hidrotalcitas con mayor contenido de Co, que ha sido también observada por otros investigadores [37,38].
El aumento de Co promueve la sustitución parcial Al+3 por Co+2 que trae como consecuencia la disminución de la densidad de carga positiva en las capas de brucita, disminuyendo a su vez la interacción entre las láminas y por tanto, aumentando el parámetro c. En consecuencia, se requiriere mayor cantidad de iones carbonatos en el espacio inter-laminar, a fin de compensar la carga y mayor cantidad de agua para prevenir la repulsión inter-aniónica. La presencia de catión Co+3 en las láminas hace que también los valores de a aumenten por poseer un radio iónico de 0,63 Å [15,36-40].
Los resultados obtenidos del factor de Fisher para los HDLs de Ni-Al, muestran que sólo en el método de síntesis por co-precipitación el parámetro c es sensible a la relación molar (A) y pH (B); los valores del factor Fisher son mayores al teórico.
Durante el método de co-precipitación (Tabla 4) para los experimentos 3 y 7 manteniendo la relación molar de Ni/Al en 2, los valores de c se incrementan con el pH. El mismo comportamiento se tiene en el caso de la relación molar de 2 experimentos 4 y 8. Este hecho puede ser explicado por efecto del pH, a valores mayores de 10,5 se mantiene mayormente el ión Al+3 en solución [41], lo que trae como consecuencia que disminuya la densidad de carga en la capas de brucita tal como se explicó anteriormente, haciendo que el valor de c aumente.
El efecto por la cantidad de níquel presente en los experimentos con relaciones molares de 3 a pH =11, incrementa el valor de c cuando se compara con los valores obtenidos con las mismas relaciones molares a pH= 9 (experimentos 2 y 6). A bajos pH entre 9 y 10, el porcentaje de níquel precipitado es menor con la consecuente deficiencia de densidad de carga en la lámina, hecho también observado por otros investigadores [41-43].
En general, al comparar los resultados del parámetro a en las series Co-Al y Ni-Al (Tabla 4) independiente del método aplicado, se tienen valores mayores para las hidrotalcitas de Co-Al debido al mayor radio iónico del Co+2 (0,74 Å) en comparación con el Ni+2 (0,72 Å) [3,18, 33,44]. Los valores obtenidos del parámetro c en las series estudiadas son muy similares y las diferencias encontradas no poseen una tendencia clara, por tal motivo no pueden ser fácilmente relacionadas en función de la fuerzas de atracción de Coulomb entre las cargas positivas en las capas de brucita y el anión localizado en la región inter-laminar Ni+2 =1,8 y Co+2=1.7 [25].
3.1.3 Tamaño del cristal (ε) en las hidrotalcitas Co-Al y Ni-Al.
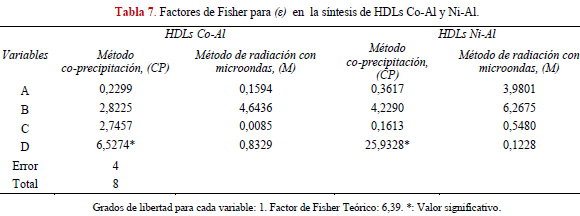
En la Tabla 6 se muestran los resultados del tamaño del cristal para las HDLs en estudio, existe una correspondencia de los valores obtenidos en la presente investigación y los reportados por otros investigadores [4, 12, 15, 22, 26, 45]. Al comparar los valores de ε por radiación de microondas con los valores obtenidos por el método de coprecipitación, sugiere que se producen sólidos de menor tamaño en el método de radiación con microondas.
La causa de este hecho está en la naturaleza del calentamiento, las microondas producen un calentamiento rápido de toda la suspensión, que favorece la nucleación simultánea de todos los cristales. Mientras que en el método de coprecipitación para los experimentos 2,3,5,8 donde existe una transferencia de calor por conducción y convección desde el exterior del recipiente hacia el interior del sólido se favorece el crecimiento de los cristales frente a la nucleación para aquellas síntesis realizadas a temperatura ambiente [12,13,46,47]. Los diferentes gradientes térmicos durante la síntesis por el método de co-precipitación, poseen una influencia que se ve reflejada en los valores del factor de Fisher (Tabla 7), mientras que el método por radiación de microondas no sugiere ningún efecto a causa de la temperatura.
3.1.4 Porcentaje de cristalinidad relativa (% CR) en las hidrotalcitas Co-Al y Ni-Al.
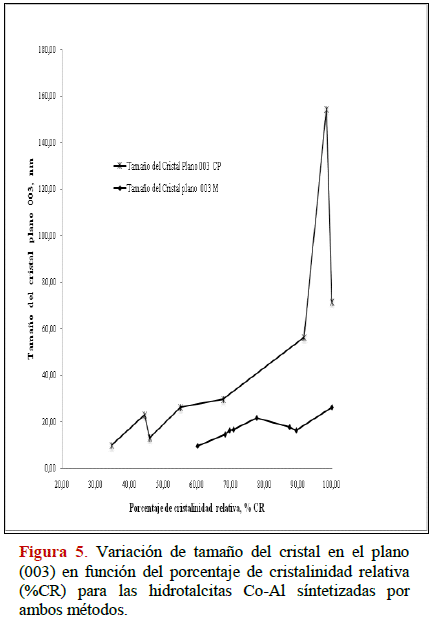
En las Figuras 5 y 6 se muestra la variación del porcentaje de cristalinidad relativa (% CR) en función del tamaño del cristal para cada serie. A medida que aumenta el % CR aumenta el tamaño del cristal independientemente del método aplicado; mientras más cristalino sea el HDLs mayor tamaño de cristal es obtenido, este comportamiento corresponde con lo reportado en varios trabajos [22, 25, 26, 31, 35, 47-49].
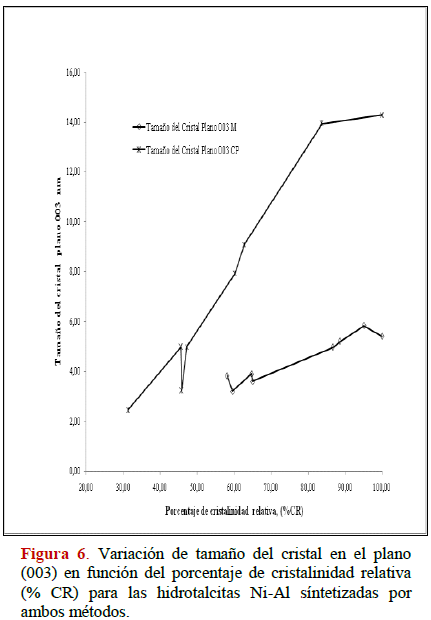
Por otra parte, los resultados sugieren que el intervalo de % CR son mayores para los compuestos tratados bajo el método de radiación por microondas, en la serie Co-Al, el rango va desde 60 % al 100 % mientras que para Ni-Al va desde 57 % a 100 %. El intervalo encontrado por el método de co-precipitación va desde 35 % -100 % y 30 % - 100 % para las series Co-Al y Ni-Al respectivamente. Estos resultados para el método de microondas son porque la suma de las intensidades en los planos: (003), (006), (009), (110), (113) son mayores a las obtenidas por el método de co-precipitación.
En la Tabla 8 se presentan los valores de Fisher para el % CR. La variable significativa es la temperatura (D), para el método de co-precipitación en ambas series, aunque el valor para el caso de Co-Al se encuentra en el valor límite (6,3748). Este comportamiento es lógico, ya que a medida que se aumenta la temperatura desde ambiente hasta 60 ºC en los experimentos 2, 3, 5, 8 (Tabla 6) se observa un crecimiento en el tamaño del cristal en proporción con el aumento del % CR que corresponde con lo señalado por Herrero et al [38] y Cepaldi y Valim [50] entre otros. Aún cuando existen variaciones en el % CR por los cambios de nivel en las demás variables estudiadas, no tienen un efecto significativo sobre el % CR independientemente del método y serie según los resultados encontrados.
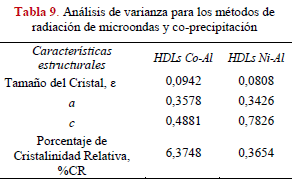
Finalmente al comparar ambos métodos de síntesis mediante la aplicación de un análisis de varianza (ver Tabla 9) no se encontró una diferencia significativa para la obtención de los HDLs, considerando cada una de las características estructurales en estudio porcentaje de cristalinidad, tamaño del cristal y los parámetros de red a y c. Estos resultados nos permiten ser optimistas en la utilización como método de síntesis la radiación por microondas, porque además de obtener HDLs de características estructurales satisfactorias, se contribuye en la preservación del medio ambiente y al uso adecuado de los recursos energéticos a un bajo costo.
4. CONCLUSIONES
La radiación microondas, como fuente de energía térmica aplicada a la síntesis de materiales laminares tipo hidrotalcita, conduce a la formación de sólidos de satisfactoria cristalinidad al compararlos con los obtenidos por el método de co-precipitación, aunque la aplicación de cada tratamiento induzca cambios interesantes en la cristalinidad de todos los sólidos obtenidos independientemente del método y serie analizada. La radiación microondas conduce a la formación de cristales más pequeños que los obtenidos por el método de co-precipitación para las series de Co-Al y Ni-Al.
Los efectos de las condiciones de síntesis fueron investigadas, lográndose dilucidar que la temperatura afecta significativamente el tamaño del cristal y el porcentaje de cristalinidad relativa para las series estudiadas sólo para el método de síntesis de co-precipitación, lográndose un aumento en proporción al aumento de la temperatura. Para el método de microondas no existen cambios significativos en el tamaño del cristal y porcentaje de cristalinidad, asociados a la temperatura durante la síntesis de ambas series. Este hecho permite concluir que al utilizar radiación microondas no existen cambios significativos por la variación en el nivel de las variables estudiadas para ε y % CR; así como, para los parámetros a y c excepto para la serie Co-Al en el parámetro a donde la relación metálica tiene una marcada influencia.
En las síntesis utilizando el método de coprecipitación el cambio en la variable A afecta el parámetro a para la serie Co-Al y c en la serie Ni- Al. El valor de c en HDLs Ni-Al también se ve afectado por los cambios en la variable B. En consecuencia, al utilizar el método de coprecipitación se debe ser cuidadoso al seleccionar las condiciones de síntesis en función de las características del HDLs que desee obtenerse, mientras que al utilizar radiación de microondas se obtiene mas versatilidad en las condiciones de síntesis porque no se afectan significativamente casi ninguna de las características de calidad (a, c, ε y % CR) sólo las antes descritas.
No se encontró una diferencia significativa entre los métodos utilizados para la obtención de las hidrotalcitas de Co-Al y Ni-Al analizadas, considerando cada una de las características estructurales estudiadas. En tal sentido, se tiene que el empleo de radiación de microondas como método alternativo de síntesis, supone un ahorro de tiempo y de energía comparado con el método convencional sin afectar significativamente las características de los HDLs obtenidos durante la investigación. Todo ello válido sólo en el intervalo de variación en los niveles de las variables estudiada en este estudio.
Por último, al emplear el diseño de experimentos de tipo factorial fraccionado se logró una adecuada correlación entre las variables en estudio y las propiedades cristalinas de los HDLs obtenidos, además de permitir una interpretación de los efectos principales asociados con cada variable. Por tanto, es una herramienta efectiva en estudios de tipo exploratorios cuando se desea mejorar las características estructurales de este tipo de materiales en función de una aplicación en particular.
5. AGRADECIMIENTOS
Este estudio fue apoyado por una subvención del Proyecto Estratégico Valorización de Corrientes LCO, aprobado por el Ministerio del Poder Popular para Ciencia Tecnología e Innovación (MPPCTI) bajo el proyecto Valorización de corrientes de LCO (201100379). Adicionalmente, los autores agradecen a la Unidad de Biología Celular y Biotecnología del Departamento de Biología- FACYT de la Universidad de Carabobo, por permitirnos realizar las síntesis por el método de radiación microondas en sus instalaciones, y a la Prof. Gema González por su invaluable discusión a los resultados obtenidos.
6. REFERENCIAS
1. Courson C, Khalfi A, Mahzoul H, Hodjati S, Moral N, Kiennemann A, Gilot P. Catal. Commun. 2002; 3 (10): 471-477. [ Links ]
2. Costantino U, Curini M, Montanari F, Nocchetti M, Rosati, O. J. Mol. Catal A: Chem. 2003; 195: 245–252. [ Links ]
3. Cavaní F, Trifiro F, Vaccari A. Catal Today. 1991; 11: 171-301. [ Links ]
4. Benito P, Labajos M, Rives V. Pure. Appl .Chem. 2009; 81:1459-1471. [ Links ]
5. Ambrogi V, Fardella G, Grandolini G, Perioli L, Tiralti M. C. AAPS PharmSciTech. 2002; 3 (3): 1- 6. [ Links ]
6. Khan A, OHare D. J. Mater. Chem. 2002; 12: 3191–3198. [ Links ]
7. Rives V, Srinivasan K. J. Mater. Chem. 2000; 10: 489-495. [ Links ]
8. Ferreira O, Álves O, Gouveia D, Souza A, De Paiva J, Mendes J. J. Solid State Chem. 2004; 177: 3058-3062. [ Links ]
9. Ulibarri M, Pavlovic I, Barriga C, Hermosin M, Cornejo J. Appl. Clay Sci. 1995; 10 (1):131-145. [ Links ]
10. Vaccari A. Appl. Clay Sci. 1999; 14: 161-198. [ Links ]
11. Martínez G. Análisis de parámetros microestructurales: Tamaño de cristalita y microdeformación de compuestos tipo hidrotalcita de cobalto, Tesis Maestro en Ciencias. México D.F: Instituto Politécnico Nacional, 2007. [ Links ]
12. Benito P, Labajos F, Rives V. Bol. Soc. Esp. Ceram y Vidrio. 2004; 43 (1): 56-58. [ Links ]
13. Prado-Gonjal J, Morán E. An. Quím. 2011; 107 (2): 129–136. [ Links ]
14. Gutiérrez H, De la Vara R. Análisis y Diseño de Experimentos, 1era. Ed. (México): McGrawHill Interamericana. Ed., 2005, Cap. 8. [ Links ]
15. Gabrovska M, Edreva-Kardjieva R, Tenchev K, Tzvetkov P. Appl. Catal A: General. 2011; 399: 242-251. [ Links ]
16. Thompson H, Parks G, Brown G. Clays Clay Miner. 1999; 47 (4): 425-238. [ Links ]
17. Armor J, Braymer T, Farris T, Li Y, Petrocelli F, Weist E. Appl. Catal B: Environ. 1996; 7: 397- 406. [ Links ]
18. Pérez-Ramírez J, Overeijnder J, Kapteinj F, Moulijn J. (1999). Appl. Catal B: Environ. 1999; 23: 59-73. [ Links ]
19. Pérez-Ramírez J, Mul G, Moulijn J. Vib. Spectrosc. 2001; 27: 75-88. [ Links ]
20. Kannan S, Swany C. Catal Today. 1999; 53: 725- 737. [ Links ]
21. Thaylor R. Clay Miner. 1984; 19: 591-603. [ Links ]
22. Benito P, Guínea I, Herrero M, Labajos M, Rives V. Z. Amorg. Allg. Chem. 2007; 11-12: 1815- 1819. [ Links ]
23. Negrón G, Soto L, Guerra A, Lomas L, Méndez J. Rev. Soc. Quím. Méx. 2000; 44 (4): 251-256. [ Links ]
24. Parthasarathi B, Rajamathi M, Hegde M, Kamath V. Bull Mater Sci. 2002; 23 (2): 141-145. [ Links ]
25. Sánchez-Cantu M, Pérez-Díaz L, Maubert A, Valente J. Catal Today. 2010; 150: 332-339. [ Links ]
26. Benito P, Guínea I, Herrero M, Labajos M, Rives V. J. Solid State Chem. 2008; 181: 987-996. [ Links ]
27. Langford J, Wilson A. J. Appl. Cryst. Crystallogr. 1978; 11: 102-113. [ Links ]
28. Bookin A, Cherkashin V, Drits A. Clays Clay Miner. 1993; 41: 558-564. [ Links ]
29. Bookin A, Drits A. Clays Clay Miner. 1993; 41 (5): 551-557. [ Links ]
30. Costantino U, Marmottini F, Sisani M, Montanari T, Ramis G, Busca G. Solid State Ionics. 2005; 176: 2917-2922. [ Links ]
31. Kovanda F, Kolousek D, Cílová Z, Hulínský V. Appl. Clay Sci. 2005; 28:101-109. [ Links ]
32. Dias A, Cunha L, Vieira A. Mater. Res. Bull. 2011; 46:1346-1351. [ Links ]
33. Kloprogge J, Frost R. Appl. Catal A: General. 1999; 18: 61-71. [ Links ]
34. Mills S, Whitfield P, Kampf A, Wilson S, Dipple G, Raudsepp M. J. Geosc. 2012; (57): 273-279. [ Links ]
35. Kayano M, Ogawa M. Clays Clay Miner. 2006; 54 (3):382-38. [ Links ]
36. Del Arco M, Trujillano R, Rives V. J. Mater. Chem. 1998; 8: 761-767. [ Links ]
37. Leroux F, El Moujahid C, Taviot-Guého J, Jean- Pierre B. J. Solid State Sci. 2001; 3: 81-92. [ Links ]
38. Herrero M, Benito P, Labajos F, Rives V. J. Solid State Chem. 2007; 180: 873-884. [ Links ]
39. Scavetta E, Ballarin B, Gazzano M, Tonelli D. Electrochim. Acta. 2009; 54:1027-1033. [ Links ]
40. Narita E, Yamagishi T, Aizu K, Han K. Int. J. Miner. Process. 1999; 29: 267-278. [ Links ]
41. Tamura H, Chiba J, Ito M, Takeda T, Kikkawa S, Mawatari Y. J. Coll. Int. Sci. 2006; 300: 648-654. [ Links ]
42. Brown G, Gastuche M, Mortland M. Clay Miner. 1967;7: 177. [ Links ]
43. Han K, Narita E, Lawson F. Hidrometallurgy. 1982; 8: 365-377. [ Links ]
44. Brindley G, Kikkawa S. Amer. Mineral. 1979; 64: 836-843. [ Links ]
45. Kannan S, Velu S, Ramkumar V, Swamy C. J. Mater Sci. 1995; 30:1462-1468. [ Links ]
46. Ruiyu Z, Changlong Y, Huiji Z, Chenguang L. Fuel Process Technol. 2000; 81:201-209. [ Links ]
47. Oh J, Hwang S, Choy J. Solid State Ionics. 2002; 151: 285-291. [ Links ]
48. Sharma S, Kushwaha P, Srivastava V, Bhatt S, Jasra R. Ind. Eng. Chem. Res. 2007; 46: 4856- 4865. [ Links ]
49. Kayano M, Ogawa M. Bull. Chem. Soc. Jpn. 2006; 79 (12): 1988-1990. [ Links ]
50. Crepaldi E, Valim J. Quím. Nova. 1998; 21 (3):300-311. [ Links ]