Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Veterinarias
versión impresa ISSN 0258-6576
Rev. Fac. Cienc. Vet. v.48 n.2 Maracay dic. 2007
Estudio Serológico e Histopatológico de la Infección por Toxoplasma gondii en Cerdos del estado Aragua-Venezuela.
Serological and Histopathological Study of Toxoplasma gondii Infection in Pigs of Aragua State –Venezuela
José A. Romero P.*1, Elias Sogbe M.** y Carmen Díaz**
*Instituto de Altos Estudios Dr. Arnoldo Gabaldon.
**Facultad de Ciencias Veterinarias. Universidad Central de Venezuela. Apartado 4563. Maracay 2101. Estado Aragua, Venezuela Correo-E: jromero114@gmail.com
Resumen
El cerdo, al igual que otras especies de interés zootécnico como los bovinos y caprinos, se considera factor de riesgo epidemiológico en la diseminación del Toxoplasma gondii al humano. El consumo de carne fresca o subproductos porcinos insuficientemente cocidos o la contaminación del agua o alimento con formas infectivas del parásito es la forma de infección más común. Esta investigación se planteó como objetivo determinar la seroprevalencia y el estudio histopatológico de los casos seropositivos a Toxoplasma gondii en cerdos destinados al consumo humano en el estado Aragua, Venezuela. Se realizó un estudio de cohorte transversal tomando 425 muestras sanguíneas de cerdos previos al beneficio; Posterior al sacrificio, se tomaron muestras de tejido músculo-esquelético (n=425). Se utilizó la prueba de hemoaglutinación indirecta (HAl) para el análisis serológico y para el estudio histopatológico de los casos seropositivos, se realizaron coloraciones de rutina y especiales. La tasa de seroprevalencia general fue 9,41%, no evidenciándose diferencias estadísticas significativas entre hembras y machos. La titulación de anticuerpos fue de 1/64 hasta 1/1024 sin la utilización de 2- Mercaptoetanol (2-ME), indicando la exposición al protozoario, el curso de una posible infección. Bajo la titulación con 2-ME, se obtuvo 12,5% de seroreaccionantes que presentaron IgM característica de la infección aguda, sin evidencia clínica de enfermedad, indicando que el contacto con el parásito se adquirió en las etapas finales del ciclo productivo. No se evidenciaron formas parasitarias libres ni intracelulares u organizaciones quisticas o pseudoquisticas. Los cambios histológicos más frecuentes fueron degeneración miofibrilar, fragmentación miofibrilar, fibrosis perivascular e infiltrado inflamatorio linfocítico en músculo del diafragma, semitendinoso, recto adbominal e intercostal; con grado de lesión de leve a moderado. La titulación de anticuerpos no expresa la evidencia de formas parasitarias en tejidos, lo cual podría depender del grado de infestación o exposición/dosis parasitarias; epizootiología del agente; higiene de la producción y método de muestreo. Es fundamental establecer un programa integral de control epidemiológico, basado en medidas básicas de bioseguridad, control de gatos y roedores, monitoreo serológico en granjas y medidas higiénico-sanitarias.
(Palabras clave: Toxoplasma gondii, histopatologia, inmunodiagnostico, morbosidad, Aragua, Venezuela)
Abstract
Pigs, as well as cattle and sheep are considered at epidemiological risk in the dissemination of Toxoplasma gondii to humans. The consumption of raw meat and pork by-products insufficiently cooked, or the contamination of water or food with the infective forms of the parasite are the means of infection. The aims of this investigation were two-fold: to determine the seroprevalence and to study the histopathology of Toxoplasma gondii in pigs for human consumption in the Aragua State, Venezuela. A cross-sectional study was undertaken. A total of 425 blood samples from pigs prior to slaughter were collected. Post mortem samples (n = 450) of skeletal muscle were also taken. For the serological analysis of positive cases, the indirect haemoagglutination test (IHA) was used. Hematoxilin-Eosin (H-E) and Periodic Acid of Schiff (PAS) stains were used for the histopathology study of seropositive cases. The results show an overall seroprevalence rate of 9.41%. No significant differences by gender were found. Antibody titration ranged from 1/64 to 1/1024 in samples non-treated with 2-mercaptoethanol (2-ME), indicating a potential exposure of the host to the protozoan infestation. Five (12.5%) of the serum samples treated with 2-ME, evidenced the presence of IgM, typical of an acute infection without clinical evidence of the disease. This finding suggests that the infection was acquired during the final stages of the parasites reproductive cycle. There was no histopathological confirmation of free parasites, intracellular forms, cystic or pseudocystic organizations. The most frequent histological changes were: myofibrilar degeneration, myofibrilar fragmentation, perivascular fibrosis, and lymphocytic inflammatory infiltration of the diaphragm, semitendinous, abdominal rectus, and intercostal muscles, with mild to moderate degrees of lesions. The antibodies titration does not necessarily reveal the presence of parasitic forms in a particular organ or tissue, which could depend on several factors such as: the degree of infestation, exposure to a parasite load, epizooty of the agent, health measures in the farm, epidemiologic conditions, and sampling methods. In conclusion, it is fundamental to establish a complete epidemiologic control program, based on biosecurity measures, pest (cats and rodents) control, and both serological screening and health measures of farms.
(Key words: Swine, Toxoplasma gondii, histopathology, immunodiagnosis, morbidity, Aragua, Venezuela)
Recibido: 02/07/07 - Aprobado: 21/01/08
Introducción
La toxoplasmosis es una zoonosis parasitaria de distribución cosmopolita que afecta a gran variedad de mamíferos incluyendo al hombre y aves. En diversas partes del mundo como los Estados Unidos de Norteámerica (EEUU), Costa Rica, Argentina y Japón, entre otras, se ha considerado al cerdo, (productos y carne fresca) como fuentes importantes de infección de Toxoplasma gondii para el humano; es decir, esta especie es factor de riesgo epidemiológico en la transmisión de esta zoonosis parasitaria, cuyo modo de transmisión es la contaminación del agua o alimentos con ooquistes infectivos, e ingestión de quistes en carne u otros tejidos derivados de la canal porcina (Weigel et al., 1995). Al respecto, Damriyasa y Bauer (2005) y Hill et al. (2005) indican que la manipulación de carne fresca y consumo de carne insuficientemente cocida son factores de riesgo epidemiológico en el ámbito de la salud pública. Anteriormente, Dubey et al. (1995) reportaron que entre el 40-50% de los casos de toxoplasmosis en humanos son provocados por la ingestión de carne fresca, o productos cárnicos que contengan quistes tisulares. Gajadhar et al. (1998) reportaron un porcentaje mayor (50-75%).
Las formas parasitarias se diseminan en diversos tejidos del hospedador y se ha demostrado que se presentan con intervalos cinéticos regulares como lo señalan Zenner et al. (1998). Durante la fase aguda de la toxoplasmosis, el parásito se puede alojar en nódulos linfáticos mesentéricos, bazo, hígado, músculo del diafragma, corazón, pulmón, cerebro, y vasos sanguíneos, con una cinética de dos días, cuyo orden de aparición es sistema nervioso central (SNC), corazón, nódulos linfáticos mesentéricos y músculo estriado esquelético (Zenner et al., 1998). Al respecto Rubin y Farber (1990) reportan que los quistes tisulares se presentan en SNC, corazón, ganglio linfático, pulmón, capa muscular del intestino delgado, páncreas, hígado, útero y placenta, y Gajadhar et al. (1998) reportan la presencia de quistes en SNC, corazón, diafragma y músculo estriado esquelético, durante la fase crónica de la enfermedad. Diversos estudios han evidenciado las formas parasitarias del T. gondii en diferentes tejidos; al respecto, Dubey et al. (1998) señalan que este protozoario puede permanecer viable y se observan formas parasitarias en corazón, amígdalas, hígado, riñón, bazo y músculo subcutáneo con tejido graso de muslo, hombro, cuello, costilla, diafragma.
Esta situación contribuye al hecho de que la toxoplasmosis representa una apreciable causa de natimortalidad y morbilidad neonatal en el humano, caracterizada principalmente por lesiones en el SNC, y a nivel ocular, de intensidad variable (Frenkel, 1973); por otro lado, en los últimos años el panorama se tornó más severo con el advenimiento del Síndrome de inmunodeficiencia adquirida (SIDA), condición que permite que la enfermedad cause graves daños, principalmente en el sistema nervioso central (Suárez et al., 1999).
En Venezuela, desde los años sesenta, se ha venido estudiado la epidemiología de T. gondii, fundamentalmente en humanos del sexo femenino e individuos inmunocomprometidos (Maekelt, 1990). Este agente causal se ha diseminado por casi todo el territorio nacional como lo reportan Bonfante et al. (1984) quienes evidenciaron títulos de anticuerpos anti-T. gondii en 14 estados, siendo las poblaciones de mayor riesgo epidemiológico las mujeres en edad reproductiva desde los 15 a los 45 años de edad.
En porcinos, la cadena epidemiológica está influenciada por factores demográficos, de producción y biológicos, incidiendo en las altas tasas de prevalencia de T. gondii reportadas, de hasta un 40% en EEUU. (Dubey y Beattie, 1988); de 43,8% en Costa Rica (Arias et al., 1994); mientras Dubey et al. (1995) señalan una prevalencia promedio de 23,9% para cerdos a la edad de beneficio (180 días de edad ó 90 Kg PV).
Al igual que para otras especies de animales de producción en el país, en cerdos, hasta donde se conoce, no existen reportes oficiales de la infección a T. gondii; sin embargo, por revestir el problema interés en salud pública, actualmente se está evaluando la reacción de la cadena de la polimerasa (PCR) como herramienta diagnóstica para la detección de formas infectantes de T. gondii en carne de cerdo (Rodríguez, comunicación personal.). Por otra parte, en ovinos de las zonas áridas del estado Lara, se determinó un 6,3% de títulos de anticuerpos contra este protozoario intracelular (Nieto y Meléndez, 1998) y se reportó un hallazgo accidental (Morillo y Bonfante, 1994) de formas parasitarias en el músculo diafragmático de un bovino clínicamente sano, beneficiado para el consumo humano. Al respecto, Solarte et al. (1991) señalan que T. gondii está diseminado entre las poblaciones de animales de Venezuela, cuyas cepas tienen la incapacidad para producir quistes, en ese estudio no enfatizan las especies de animales domésticos involucradas.
El diagnóstico del T. gondii en los animales no es sencillo, debido a que la enfermedad es mayormente subclínica; de allí la importancia de los monitoreos serológicos a nivel de plantas beneficiadoras para estimar la frecuencia de infección toxoplásmica en cerdos y otras especies productoras de carne para consumo humano, con el fin de evaluar el riesgo de infección a que está expuesta la población. Por lo tanto, en esta investigación se planteó como objetivo determinar la seroprevalencia y el estudio histopatológico de los casos que resultaran seropositivos a Toxoplasma gondii en cerdos destinados al beneficio en el estado Aragua, Venezuela.
Materiales y Métodos
Bajo un estudio de cohorte transversal con un muestreo completamente aleatorizado, se evaluaron 425 cerdos pre y post beneficio, en el estado Aragua.
Fase de campo
Previo al beneficio, se tomaron muestras de sangre para la obtención del suero sanguíneo y luego del beneficio se tomaron tejidos para el estudio histopatológico.
Muestras sanguíneas
Mediante venopunción auricular, se extrajeron aproximadamente 3 ml de sangre, para la posterior obtención del suero sanguíneo en el laboratorio (Straw y Wilson, 1989).
Muestras de tejidos
Posteriormente al sacrificio, se extrajeron muestras de músculo esquelético (recto abdominal, intercostal y semitendinoso) como lo señalan Gajadhar et al. (1998) para el estudio histopatológico. La toma de muestras se realizó según la técnica descrita por García Del Moral (1993) que consiste en la extracción de muestras de tejidos de un grosor no mayor de 0,5 cm por 2 cm de ancho, para luego preservarlos en una solución buferada de formalina al 10%, en relación fragmento de tejido-volumen 1:10 y colocados en recipientes adecuadamente identificados (Aluja, 2002). Posteriormente, las muestras fueron transportadas al Laboratorio de Anatomía Patológica de la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela, ubicado en Maracay, estado Aragua.
Fase experimental
Obtención del suero sanguíneo.
Una vez en el laboratorio, las muestras permanecieron por un período de 8 a 12 horas bajo temperaturas entre 22 y 27 ºC para favorecer la retracción del coágulo. Posteriormente, se centrifugaron a 10000 r.p.m. por 10 min para la obtención del suero y se mantuvieron a -20ºC hasta ser procesados.
Inmunodiagnóstico anti T. gondii.
Los niveles de anticuerpos anti T. gondii se determinaron mediante la prueba de hemoaglutinación indirecta (HAI). Se utilizó el kit comercial TOXOTEST HAI (Wiener Lab, 2000) cuyo fundamento metodológico se basa en la propiedad de los anticuerpos anti T. gondii de producir aglutinación en presencia de glóbulos rojos (GR) sensibilizados con antígenos citoplasmáticos y de membrana del parásito. El empleo de ambos tipos de antígenos incrementa la sensibilidad del método permitiendo la detección precoz de la infección. Tanto la presencia de anticuerpos heterófilos como la aparición de IgM, características del período agudo de la parasitosis, se investigan empleando tratamiento con 2-Mercaptoetanol (2-ME) y eritrocitos no sensibilizados para el control y absorción de heterofília (Wiener Lab, 2000).
Wiener Lab (2000) señala que los anticuerpos heterófilos que se absorben con eritrocitos no sensibilizados y sueros de pacientes con infección aguda tratados con 2-ME, presentan una caída del título, en por lo menos dos diluciones, comparado con los mismos sueros sin tratar con 2-ME.
Procedimiento:
Se seleccionó una policubeta con pocillos sin usar de fondo en U. Se pasó una toalla húmeda por la base antes de usar y disponer de hisopos.
Titulación sin 2-ME
1) Se colocaron 25 µl de diluyente de suero HAI en todos los pocillos a usar de la policubeta.
2) Se tomó una alícuota de cada suero o controles a ensayar con microdilutores de 25 µl. (Uno para cada muestra) y se colocaron en los pocillos de la columna 1. Se utilizaron tantas hileras horizontales como sueros o controles debían procesarse.
3) Se realizaron diluciones a partir de la columna 1 (dilución ½), pasando los microdilutores a la columna 2 (dilución ¼) y así sucesivamente hasta la columna 6 (dilución 1/64 titulación indicativa de positividad) y hasta la columna 12 (dilución 1/4096) para estimar los niveles de anticuerpos.
4) Se colocaron 25 µl en las columnas 1 y 2 (diluciones ½ y ¼ de GR no sensibilizados, para control de heterofília. Se hizo lo mismo en las columnas 7 y 8 en caso de ser empleadas.
5) En el resto de los pocillos, se agregaron 25 µl de antígeno HAI
6) Se agitó la policubeta golpeando con los dedos en las paredes laterales, durante 30 segundos por lo menos.
7) Se dejó en reposo, al resguardo de vibraciones, durante 90 min.
8) A partir de los 90 min, se procedió a leer.
Se puede aumentar la nitidez de la imagen, leyendo sobre un espejo, iluminado la placa desde arriba e interponiendo un papel blanco y traslúcido entre la policubeta y la fuente de luz.
Titulación con 2-ME
1) Se colocaron 25 µl de suero o controles en cada uno de los pocillos de la columna 1 (y 7 si es necesario), empleando pipetas descartables (una por cada suero) en posición vertical.
2) Se agregaron 25 µl 2-ME al 1% a los mismos pocillos utilizando una pipeta descartable.
3) Se sellaron los pocillos con cinta adhesiva y se agitó la policubeta golpeando con los dedos en las paredes laterales.
4) Se incubó 30-60 min a 37ºC ó 90 min a temperatura ambiente.
5) Se retiró la cinta adhesiva, se pasó una toalla húmeda por la base de la policubeta y, con microgotero de 25 µl se colocó una gota de diluyente de suero HAI en los pocillos restantes de las hileras utilizadas.
6) Se realizaron los pasos 3 al 8 anteriormente descritos en la titulación I.
Absorción sobre glóbulos rojos no sensibilizados.
En sueros que presenten heterofilia, los anticuerpos heterófilos pueden absorberse sobre GR no sensibilizados de la siguiente forma: en un tubo de hemólisis con tapón se colocan 50 ml de GR no sensibilizados + 50 mL de suero de ensayo. Se dejó la suspensión durante 30 min a 37 °C, agitando de tanto en tanto. Luego se centrifugó a 2000 r.p.m. durante 5 min. Del sobrenadante se tomó 50 ml y se empleó como dilución ½, colocándola en la primera columna. Si se empleó titulación con 2-ME esta columna correspondió a dilución ¼.
Interpretación de los resultados
Titulación sin 2-Mercaptoetanol
Títulos mayores o igual 1/64 significan mayor probabilidad de infección toxoplásmica. A fin de determinar una primoinfección reciente, deben procesarse 2 muestras tomadas con un intervalo de 2-3 semanas. Un aumento de título mayor de 2 diluciones entre la primera y segunda muestra indican infección reciente adquirida.
Titulación con 2-Mercaptoetanol
La aparición de títulos bajos en la titulación sin 2-ME y reactividad con glóbulos rojos no sensibilizados que desaparecen al efectuar la titulación con 2-ME y/o absorción con GR no sensibilizados, serían indicativos de la existencia de heterofilia. Por el contrario, títulos elevados sin el empleo de 2-ME que disminuyen considerablemente al utilizar 2-ME indicarían la presencia de IgM, característica de infección aguda. Los controles de heterofilia en este caso deben dar reacción negativa en el suero sin tratar o tras absorción con GR no sensibilizados.
Diagnóstico histopatológico
Las muestras tisulares correspondientes a animales seropositivos a T. gondii, se procesaron mediante deshidrataciones progresivas con soluciones alcohólicas crecientes (60-70-90 y 100%), se clarificaron con xilol y se impregnaron en parafina hasta enfriar. Después de solidificada la parafina se obtuvieron secciones histológicas de 4 a 7% y se procedió a teñirlas según la técnicas histotecnológicas de Hematoxilina–Eosina y Acido Periódico de Schiff (PAS) según técnicas de Stevens y Lowe (1998). Las secciones histopatológicas fueron examinadas en un microscopio óptico modelo Labophot y a los casos mas significativos se les practicaron micrografías.
Análisis e interpretación de los resultados
Se utilizaron indicadores epidemiológicos para determinar el comportamiento del T. gondii en cerdos destinados al beneficio en el estado Aragua, como lo citan Thrusfield (1990). Dichos indicadores fueron: tasa de prevalencia (TP), que es la estimación directa de la probabilidad de la frecuencia esperada del agente etiológico, en tiempo y espacio específico, pudiéndose categorizar por grupo.
Análisis estadístico
La significancia de la prevalencia del T. gondii según los grupos, se determinó utilizando tablas de contingencia bidimensional, con la aplicación del estadístico Chi Cuadrado (c2) y estadística descriptiva para el estudio histopatológico (Steel y Torrie, 1989).
Resultados y Discusión
La determinación de anticuerpos a T. gondii en cerdos destinados al beneficio en el estado Aragua, confirma que esta especie es un factor de alto riesgo epidemiológico como fuente de infección al humano, como lo demuestra la tasa de prevalencia general de 9,41%, con 40 animales seroreaccionantes de 425 muestreados; ésta es similar a las reportadas por Weigel et al. (1995) (10,3%) en cerdos de 6 a 11 meses y Hove y Dubey (1999) en 9,3% en rebaños porcinos destinados al beneficio en Zimbabwe.
En la Tabla 1, se reporta el numero de cerdos con anticuerpos a T. gondii según la procedencia, evidenciándose diferencias estadísticas significativas (P<0,01) entre los municipios (c2=31 ; 56; gl=5) con la mayor frecuencia de T. gondii (24,14%) en el Municipio José Félix Ribas.
Tabla 1. Seroprevalencia del Toxoplasma gondii según el sexo en cerdos destinados al beneficio en el estado Aragua
| Municipio | Nº de Granjas muestreadas | Nº de Animales Muestreados | Seroprevalencia |
| Nº (%) | |||
| Santiago Mariño | 8 | 88 | 9 (10,23) |
| Zamora | 16 | 156 | 7 (4,49) |
| José Félix Ribas | 7 | 87 | 21 (24,14) |
| San Casimiro | 3 | 25 | 0 (0) |
| José Ángel Lamas | 2 | 37 | 1 (2,70) |
| Sucre | 1 | 32 | 2 (6,25) |
| Total | 37 | 425 | 40 (9,41) |
c2 = 31;56; gl =5
Por otro lado, a pesar de que en todas las granjas se contemplan planes operativos que incluyen medidas profilácticas, control de la procedencia de los animales y medidas higiénico-sanitarias, a través de encuestas realizadas se pudo detectar que en la totalidad de los sistemas de producción de esas granjas de cerdos (n=37), existían pobres condiciones higiénico-sanitarias e indebidas condiciones de bioseguridad; con presencia de felinos domésticos dentro de las áreas de producción y de roedores y aves en los sistemas de alimentación de las explotaciones. Al evaluarlas se observó que la tasa de prevalencia fue significativamente más elevada en granjas del Municipio José Félix Ribas, pudiéndose deber a mayor deficiencia en las prácticas básicas de salud animal.
La evidencia serológica de la infección en cerdos destinados al beneficio sugiere la existencia de gatos domésticos o felinos salvajes de los géneros Felis y Lynx, como hospedadores definitivos, dentro o alrededor del sistema de producción; también de fuentes y reservorios como pájaros, roedores y otros animales silvestres, que se comportan como hospedadores intermediarios, favoreciendo la transmisión y diseminación del protozoario al cerdo. Aunado a ello, los factores climáticos permiten la sobrevivencia prolongada de las formas infestantes, y el fecalismo, que explica la gran magnitud de la transmisión del protozoario en las explotaciones porcinas poco especializadas o con precarias condiciones higiénico-sanitarias, donde la infección estaría mediada por la contaminación del suelo, alimentos y la presencia de artrópodos coprofílicos, como lo mencionan Dreseen et al. (1989) y Arias et al. (1994).
No hubo diferencias estadísticas significativas de la presencia de anticuerpos al protozoario entre hembras y machos (Tabla 2), con 9,43% y 9,39% de animales positivos, respectivamente (c2=0.00013; g.l.=1).
Tabla 2. Seroprevalencia del Toxoplasma gondii según el sexo en cerdos destinados al beneficio en el estado Aragua
| Sexo | Nº | Positivos | Negativos | ||
| Nº (%) | Nº (%) | ||||
| Hembras | 244 | 23 | (9,43) | 221 | (90,57) |
| Machos | 181 | 17 | (9,39) | 164 | (90,61) |
| Total | 425 | 40 | (9,41) | 385 | (90,59) |
c2 = 0.00013; g.l. = 1
La no significancia de la distribución de la infección en cerdos según el sexo, sugiere que tanto hembras como machos se encuentran expuestos a los mismos factores de riesgo para contraer la infección durante el ciclo de producción. Sin embargo, Assadi-Rad et al. (1995) señalan que las hembras en etapas reproductivas son el grupo de mayor riesgo en la diseminación de T. gondii, esto podría deberse al estrés post parto y a la lactancia, convirtiéndose en el principal factor de diseminación para lechones lactantes, lo que perpetúa la infección en las granjas porcinas. En este último grupo de edad, se observan las consecuencias más graves de la infección clínica, sin diferencias en la susceptibilidad al agente (Dubey, 1986).
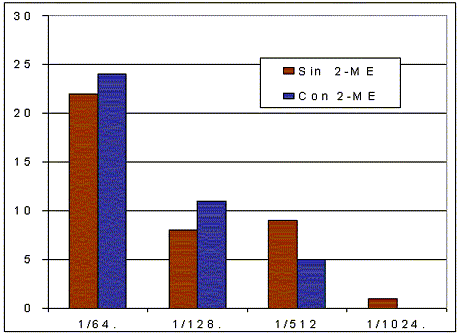
En la Figura 1 se representan los niveles de anticuerpos a T. gondii utilizando la prueba HAI sin titulación y con titulación con 2-ME aplicada simultáneamente en cerdos destinados al beneficio. De los 40 animales reactivos, 22 presentaron títulos 1/64; 8 de 1/128; 9 de 1/512 y 1 en 1/1024 sin titulación con 2-ME. Esta prueba indica el contacto del individuo con el agente etiológico, e indirectamente, la intensidad de la infección, pero sin discriminar si la infección es aguda ó crónica. Simultáneamente, se determinaron los niveles de IgM característicos de las infecciones agudas, bajo titulación con 2-ME, obteniendo el descenso de los niveles de anticuerpos en 5 (12,5%) animales en un mínimo de dos títulos, de la siguiente manera: 1 de 1/1024 descendió a 1/128; 2 de 1/ 512 declinaron a 1/128 y 2 de 1/512 redujeron los niveles a 1/64. Este descenso de los niveles de anticuerpos corresponde a la eliminación de IgM, lo que indica que el 87,5% de los seroreaccionantes estaban crónicamente infestados.
Figura 1. Niveles de anticuerpos a T. gondii utilizando la prueba HAI sin titulación y con titulación con 2-Mercaptoetanol (2-ME) en cerdos en el estado Aragua
La determinación de IgM característica de la infección aguda e IgG de la crónica, confirman que la evolución de la infección toxoplásmica en cerdos no es uniforme, ni constante; el dinamismo del proceso infeccioso depende de factores del hospedero y del parásito; en el primero la susceptibilidad a la infección y la capacidad defensiva inespecífica y específica, y en el segundo, la capacidad quistogénica y virulencia para desencadenar un proceso fisiopatológico, como lo reportan Dubey (1986) y Atias y Thiermann (1994). El Toxoplasma gondii durante las infecciones agudas cursa con aumento progresivo de las defensas inmunitarias, las cuales se detectaron en 12,5% de los seroreaccionantes bajo la titulación con 2-ME, sin evidencia clínica de la enfermedad. Estos resultados fueron de menor magnitud que los reportados por Omata et al. (1994), quienes señalan que en Costa Rica aproximadamente el 40% de los cerdos estaban infectados con niveles de IgM contra protozoario, sin discriminar la edad, y sólo el 15,7% de los animales destinados al beneficio correspondía a infecciones latentes o crónicas.
La evidencia serológica de cronicidad o latencia de la infección (87,5%) en los animales reaccionantes, se debe al tiempo de exposición del semoviente porcino al agente parasitario, lo cual favorece la aparición y aumento progresivo de las defensas inmunitarias, con predominio de IgM. Ésto puede provocar la desaparición de las formas extracelulares de la sangre y de los tejidos, al mismo tiempo que detiene la multiplicación intracelular (Dubey, 1986 y Atias y Thiermann, 1994). Sin embargo, estos autores reportan la persistencia de formas intracelulares, pudiéndose desarrollar formaciones quísticas, sin respuesta antigénica, lo que impide la estimación del riesgo epidemiológico por consumo de carne de cerdo.
Los cambios histológicos en músculos esqueléticos, se muestran en la Tabla 3. Se evidenciaron hallazgos atribuibles a la infestación por T. gondii; sin embargo, no son específicos del protozoario, similarmente lo señalan Jones y Duncan (1983); Dubey et al. (1998); Gajadhar et al. (1998); Zenner et al. (1998) y Fan et al. (2004). Se observaron diferentes cuadros de lesiones, dependientes del tejido afectado como lo indica Jones y Duncan (1983). No se evidenciaron formas parasitarias ni quísticas de T. gondii, en las diferentes secciones tisulares, concordando esto con Omata et al. (1994) y Cotran et al. (1995) que reportan que el hallazgo de las formas parasitarias en los cortes histológicos rutinarios de H-E es de bajo índice de determinación. Pero difieren de los reportes de Jones y Duncan (1983) y Zenner et al. (1998) que indican la presencia de formas libres intracitoplasmáticas PAS positivas u organizadas en quistes sin membrana definida, en las infecciones agudas; y en las crónicas, formaciones quísticas con membrana definida, principalmente en el SNC, músculo estriado cardiaco y esquelético.
Tabla 3. Cambios histopatológicos en músculo esquelético de cerdos seropositivos mediante la prueba de hemoaglutinación indirecta (HAI) anti T. gondii.
| Músculo Esquelético | N° de Muestras | % de Presentación | Lesiones | Grado lesional |
| Semitendinoso Rectoabdominal Intercostal | 40 | 7,5 | Degeneración miofibrilar | + |
| 5 | Ruptura fibrilar | + | ||
| 40 | 2,5 | Degeneración miofibrilar | + | |
| 7,5 | Ruptura miofibrilar | + | ||
| 7,5 | Fibrosis perivascular | + | ||
| 24 | 8,3 | Degeneración miofibrilar | + | |
| 8,3 | Fragmentación fibrilar | + | ||
| 16,7 | Fibrosis perivascular | + | ||
| 4,2 | Infiltrado linfocítico | + |
+ Leve, ++ Moderado, +++ Severo
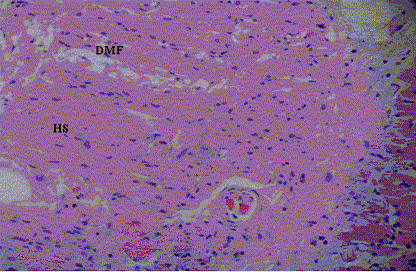
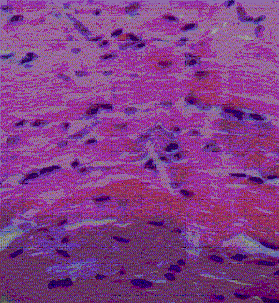
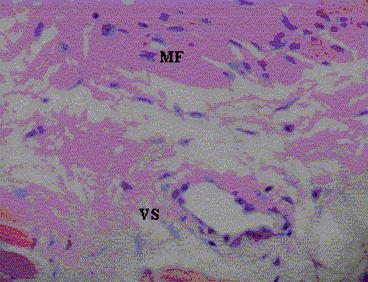
Se observaron lesiones musculares leves que han sido atribuidas a T. gondii y que no son específicas, que pueden ser multifactoriales. Éstas están caracterizadas por degeneración miofibrilar, ruptura celular, fibrosis perivascular e infiltrado inflamatorio linfocítico, en músculos del diafragma, semitendinoso, rectoadbominal e intercostal (Figura 2), en comparación con las Figuras 3 y 4, donde se observa una fotomicrografía del músculo control (serología negativa), el cual muestra un vaso sanguíneo sin alteraciones y ausencia de fibrosis perivascular.
Figura 2. Micrografía de músculo estriado intercostal (serología positiva): muestra degeneración miofibrilar (DMF) y homogenización del sarcoplasma (HS) H.E. 280x
Figura 3. Músculo estriado control (serología negativa) muestra integridad de las fibras musculares. H.E. 320x
Figura 4. Músculo control (serología negativa) muestra estriaciones sin alteraciones (MF), y vaso sanguíneo íntegro (VS) H.E. 320x
La ausencia de formas parasitarias libres e intracelulares, sin estructuras quísticas en los cortes de tejidos evaluados, difiere de los reportes de Jones y Duncan (1983); Fergunson et al. (1989); Atias y Thiermann (1994) y Pinckey et al. (1994), que señalan la predilección del protozoario por el músculo estriado esquelético durante la fase toxoplásmica aguda, evidenciándose las formas libres del parásito. En la fase crónica, ocurre la formación quística en los tejidos musculares, difiriendo también con Pinckey et al. (1994) que reportan la predilección del parásito por los músculos semitendinoso, semimembranoso y diafragma.
Los bajos porcentajes de presentación de daño en células musculares (≤16,7%), coinciden con Zenner et al. (1998) quienes señalan la infrecuencia de daños musculares por T. gondii. Los cambios distróficos en células de la musculatura esquelética concuerdan con los reportes Schratter et al. (1987), pero no son totalmente coincidentes, ya que reportan la presencia de formas parasitarias intramiocíticas en diversos modelos animales. El porcentaje de presentación de cambios degenerativos (2,5 a 8,3%), coincide con los reportes de Smales y Obendorford (1996) quienes señalan que el T. gondii, provoca hasta 9% de daños degenerativos en músculos somáticos.
La ausencia de formas parasitarias en tejidos, se puede atribuir al desarrollo de inmunidad mediada por células T y la activación de macrófagos por el factor de necrósis tumoral (TNF-2a) y otras linfocinas que destruyen las formas intracelulares del parásito, como lo reporta Frenkel (1988) y Cotran et al. (1995). Por otra parte, esta ausencia puede deberse a la capacidad letal de este protozoario de inhibir la actividad enzimática de las células linforreticulares, como lo señalan Tackey y Kassim (1999). También, puede atribuirse a la actividad de las enzimas líticas de neutrófilos y eosinófilos, como lo indican Parker et al. (1981), o al incremento en la liberación de hidrolasas y otras enzimas que favorecen la actividad fagocítica de macrófagos, como lo indican Tackey y Kassim (1999). También, se puede inferir que se debe a la producción de antígenos anti- taquizoitos solubles, IL-4 e ITNg por los esplenocitos. Estos antígenos son sustancias biológicas responsables de inhibir la proliferación de las formas parasitarias en las células linforreticulares, además estimulan las citocinas que inhiben los pro inflamatorios parasitarios, como lo reportan Roberts et al. (1996). Aunado a lo anteriormente expuesto, Solarte et al. (1991) describen cepas del parásito con incapacidad de producir quistes.
Por la gravedad de esta enfermedad, los resultados obtenidos en este estudio cobran particular importancia, ya que confirman al cerdo como una fuente de infección de T. gondii al hombre en Venezuela, donde el consumo de la carne de porcino es elevado.
Conclusiones
En las explotaciones porcinas venezolanas se cumple la cadena epidemiológica del T. gondii, evidenciado por los niveles de anticuerpos-HAI en cerdos destinados al beneficio en el estado Aragua.
El desarrollo de la infección en las poblaciones porcinas, convierte al cerdo en factor de alto riesgo epidemiológico en la transmisión al humano.
La evidencia serológica en cerdos a la edad de beneficio, establece que se comportan como hospedadores intermediarios, fuentes y reservorios del agente; y potencial factor de riesgo epidemiológico en la transmisión al humano.
El 9,41% de porcinos al momento del beneficio, presentaron títulos de anticuerpos a T. gondii, por lo tanto, estos individuos se infectaron en alguna etapa del ciclo productivo.
No hubo diferencias estadísticas significativas de la presencia de anticuerpos al protozoario entre hembras y machos, ni con lesiones histológicas observadas.
La titulación de los anticuerpos mediante la prueba de HAI arrojó niveles desde 1/64 hasta 1/1024 sin la utilización del 2-ME, indicando que los cerdos estuvieron expuestos a este protozoario, sin diferenciar si el curso de la enfermedad es agudo ó crónico.
El 12,5% (5) de los seroreaccionantes presentaron IgM característica de infección aguda, sin evidencia clínica de enfermedad, bajo la titulación con 2-ME, indicando que la infección se adquirió en las etapas finales del ciclo productivo.
La determinación de IgM e IgG, establecen que el curso de enfermedad en cerdos no es uniforme y constante.
En infecciones toxoplásmicas se producen cambios histológicos en diversos tejidos del hospedador porcino, como ocurre en músculo estriado esquelético.
No se observaron formas parasitarias libres ni intracelulares, en grupos u organizadas en formaciones quísticas o pseudoquísticas.
En los músculos semitendinoso, rectoabdominal e intercostal en el curso de la infección toxoplásmica, se desarrollan cambios histológicos con diferentes porcentajes de presentación de daño, basados principalmente en degeneración miofibrilar (2,5 a 8,3%), ruptura celular (5 a 8,3%), fibrosis perivascular (7,5 a 16,7%) e infiltrado inflamatorio linfocítico (2,5 a 4,2%); con un grado de lesión leve.
La titulación de anticuerpos no garantiza la evidencia de formas parasitarias en secciones tisulares, dependiendo del grado de infección, epizootiología del agente, higiene de la producción y método de muestreo.
Se sugiere por lo tanto una mayor vigilancia epidemiológica a nivel de las granjas a través del control de roedores y de gatos, reservorios primarios de la enfermedad y mayor énfasis en la educación para la salud a nivel de la población en aspectos preventivos, como una buena cocción de esta fuente de alimento.
Referencias
1. Aluja de, A.S. 2002. Necropsias en Animales Domésticos. Compañía Editorial Continental S. A. México, D. F. pp. 69-84. [ Links ]
2. Arias, M.; Reyes, L.; Chinchilla, M.; Linder, E. 1994. Seroepidemiology of Toxoplasma gondii (Apicomplexa) in meat producing animals in Costa Rica. Rev. Biol. Trop., 42: 15-20. [ Links ]
3. Assadi-Rad, A.; New, J.; Patton, S. 1995. Risk factors associated with transmission of Toxoplasma gondii to sows kept in different management systems in Tennessee. Vet. Parasitol., 57: 289-297. [ Links ]
4. Atias, A.; Thiermann, E. 1994. Toxoplasma En: Parasitología Clínica (Publicaciones Mediterráneo) 3a ed. Santiago de Chile, Chile. pp. 269-282. [ Links ]
5. Bonfante, R.; De Alvárez, N.; De Anzola, N.; De Crespo, L.; De Peñaloza, S. 1984. Toxoplasmosis en pacientes de 14 estados de Venezuela. Bol. Ofic. Sanit. Panam., 96:502-510. [ Links ]
6. Cotran, R. S.; Kumar, V.; Robbins, S. L. 1995. Robbins patología estructural y funcional. 5 e. Interamericana Mc Graw-Hill. Nueva York. 1533 p. [ Links ]
7. Damriyasa, I.; Bauer, C. 2005. Seroprevalence of Toxoplasma gondii infection in sows in Munsterland, Germany. Dutch Tierarztl Wochenschr., 112:223-224. [ Links ]
8. Dreesen, D. W.; Zimmennan, J. J.; Owen, W. L.; Cruz De La, A. 1989. Toxoplasma gondii in pork products. Healthy animals safe foods healthy man Proceeding of the World Association of Veterinary Food Hygienists International Symposium. Stockholm Sweden. 340-342. [ Links ]
9. Dubey, J. P. 1986. A review of Toxoplasma in pigs. Vet. Parasitol., 19:181-223. [ Links ]
10. Dubey, J. P.; Beattie C. 1988. Toxoplasmosis of animals and man. CRC Press, Boca Ratón, Florida. USA. 220 p. [ Links ]
11. Dubey, J. P.; Thuelliiez, P.; Powell, E. 1995. Toxoplasma gondii in low a sows: Comparison of antibody titers to isolation of T. gondii bioassays in mice and cats. J. Parasitol., 81:48-53. [ Links ]
12. Dubey, J.; Lunney, S.S.; Kwok, O.1998. Inmunity to Toxoplasmosis in pigs fed irradiated Toxoplasma gondii occysts. J. Parasitol., 84:749-752. [ Links ]
13. Fan, C. K.; Su, K. E.; Tsai, Y. J. 2004. Serological survey of Toxoplasma gondii infection among slaughtered pigs in northwestern. Taiwan. Parasitol., 90:653-654. [ Links ]
14. Fergunson, D. J.; Hutchison, W. M.; Pettersen, E. 1989. Tissue cyst rupture in mice chronically infected with Toxoplasma gondii. An inminocytochemical and ultrastructural study. Parasitol. Res., 75:599-603. [ Links ]
15. Frenkel, J. K. 1973. Toxoplasmosis in and around us. Bioscience., 23:343-352. [ Links ]
16. Frenkel, J. K. 1988. Parasitology today. J. Japan Vet. Medical., 41:251-254. [ Links ]
17. Gajadhar, A.; Aramini, J.; Tiffin, G.; Bisailon, I. 1998. Prevalence of Toxoplasma gondii in Canadian market-age pigs. J. Parasitol., 84:759-763. 1998. [ Links ]
18. Garcia Del Moral, R. 1993. Laboratorio de anatomía patológica. Interamericano Mc. Graw-Hill, Madrid. 676 p. [ Links ]
19. Hill, D.E.; Chirukandoth, S.; Dubey J. P. 2005. Biology and epidemiology of Toxoplasma gondii in man and animals. Anim. Health Res. Rev., 6:41-61. [ Links ]
20. Hove, T.; Dubey J. P. 1999. Prevalence of Toxoplasma gondii antibodies in feral of domestic pigs and so me wild game species from Zimbabwe. J. Parasitol., 85:372-373. [ Links ]
21. Jones, T. C.; Duncan, R. 1983. Veterinary pathology. 5 e. Lea & febiger. Philadelphia. 1792 p. [ Links ]
22. Maekelt, G. 1990. La toxoplasmosis en Venezuela. Rev. Fac. Med. UCV., 22:82-88. [ Links ]
23. Morillo, N.; Bonfante, G. 1994. Primer halIazgo de Toxoplasmosis gondii en un bovino del estado Yaracuy, Venezuela. Kasmera, 22:71-78. [ Links ]
24. Nieto, S. O.; Meléndez R. 1998. Seroprevalence of Toxoplasma gondii in goats from arid zones of Venezuela. J. Parasitolol., 84:190-191. [ Links ]
25. Omata, Y.; Dilorenzo, C.; Venturini, C.; Venturini, L.; Igarashi, I.; Saito, A. 1994. Correlation between antibody levels in Toxoplama gondii infected pigs and pathogenicity of the isolate parasite. Vet. Parasitol., 51:205-210. [ Links ]
26. Parker, G. A.; Langloss, J. M.; Dubey, J. P.; Hoover, E. A. 1981. Pathogenesis of acute toxoplasmosis in specific-pathogen-free cats. Vet. Pathol., 18:786-803. [ Links ]
27. Pinckey, R.; Lindsay, D.; Byron, L.; Blagbuen, L.; Boosinger, T.; Mclaghlin, S.; Dubey, J. 1994. Evaluation of the safety and efficacy of vaccination of nursing pigs with living tachyzoites of two strains of Toxoplasma gondii. J. Parasitol., 80:438-448. [ Links ]
28. Roberts, C. W.; Fergunson, D. J.; Jebbari, H.; Satoskar, A.; Bluethmann, H.; Alexander, J. 1996. Different roles for interleukin-4 during the course of Toxoplasma gondii infection. Infect. Imm., 64:897-904. [ Links ]
29. Rubin, E., Farber , J. L. 1990. Patología. Editorial medica panamericana. México, D.F. 1420 p. [ Links ]
30. Schratter, H. M.; Sarnat, H. B.; Matheson, D. S.; Seland, T. P. 1987. Juvenile dermatomiositis induced by toxoplasmosis. J. Child. Neurol., 2:101-104. [ Links ]
31. Smales, L. R.; Obendorford, D. L. 1996. Protozoan parasites and pathological finding in Hydromys chrysogaster (Muridae: Hydromyinae) from Queensland. J. Wildlife Diseases, 32:344-347. [ Links ]
32. Steel, R. G.; Torrie, I. H. 1989. Bioestadistica. Principios y procedimientos. 2e. Mc Graw-Hill. 622 p. [ Links ]
33. Stevens, A.; Lowe, J. 1998. Histología Humana 2a. Edit. Harcourt Brace. España, pp.1-8. [ Links ]
34. Straw, B. and Wilson, H. 1989. Diagnosis de enfermedades porcinas. 2e. Pig wold Inc. ST. Paul, MN. 80 p. [ Links ]
35. Solarte, Y.; Moreno E.; Scorza J. V. 1991. Incapacidad de una cepa de Toxoplasma gondii para producir quistes y ooquistes. Bol. DÍ/: Mal. San. Amb., 31:53-54. [ Links ]
36. Suárez, F.; Andrade, H.; Galisteo, A. 1999. Evaluación serológica del Toxoplasma gondii en suinos mediante la prueba de ELlSA. Rev. Inv. Vet. Perú, 10:11-17. [ Links ]
37. Tackey, R. N.; Kassim, O. O. 1999. Macrophage responses to Toxoplasma antigens in vitro: a possible role in inflammatory lesions in toxoplasmosis. Am. J. Trop. Med. Hyg., 61:272-279. [ Links ]
38. Thrusfield, M. 1990. Epidemiología Veterinaria Acribia. Zaragoza-España. 339 p. [ Links ]
39. Wiener Lab. 2000. Toxotest HAI. Prueba de hemoaglutinación indirecta. Winner Group Lab. Buenos Aires, Argentina. 8 p. [ Links ]
40. Weigel, R.; Dubey, J.; Siegel, A.; Kitron, U.; Mannelli, A.; Nitchell, M.; Mateus-Pinilla, N.; Thulliez, P.; Shen, S.; Kwok, O.; Todd, K. 1995. Risk factors for transmission of Toxoplasma gondii in swine farms in Illinois . J. Parasitol., 81:736-741. [ Links ]
41. Zenner, L.; Darcy, F.; Capron, A.; Cesbron-Delauw, M. 1998. Toxoplasma gondii kinects of the dissemination in the host tissues during the acute phase of infection of mice and rats. Exp. Parasitol., 90:86-94. [ Links ]