Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Veterinarias
versión impresa ISSN 0258-6576
Rev. Fac. Cienc. Vet. vol.55 no.1 Maracay jun. 2014
Morfometría Comparativa de Cinco Aislados Venezolanos Trypanosoma vivax.
Comparative Morfometric of five Venezuelan Trypanosoma vivax isolates
Ely Gómez-Piñeres*, Alpidio Boada-Sucre**, Antonio Bretaña**, Marisol Contreras-Bretaña**, Francisco García*** y Armando Reyna-Bello****,1
*Departamento de Biología y Sanidad Animal, Escuela de Zootecnia, Núcleo Monagas, Universidad de Oriente. Apdo. Postal 6201, Maturín, Estado Monagas, Venezuela. **Laboratorio de Microscopía Electrónica, Instituto de Estudios Científicos y Tecnológicos, Universidad Nacional Experimental Simón Rodríguez, Caracas, Venezuela. ***Cátedra de Parasitología, Facultad de Ciencias Veterinarias, Universidad Central de Venezuela, Maracay, Estado Aragua, Venezuela. ****Grupo de Inmunobiología, Centro de Estudios Biomédicos y Veterinarios, Universidad Nacional Experimental Simón Rodríguez-IDECYT, Caracas, Venezuela. Departamento de Ciencias de la Vida y de la Agricultura, Universidad de las Fuerzas Armadas-ESPE, Quito, Ecuador
1 A quien debe dirigirse la correspondencia (To whom correspondence should be addressed)
Correo-E:areyna@inmunobiologia.net.ve
Resumen
La tripanosomosis causada por Trypanosoma vivax, se encuentra distribuida en las regiones tropicales y subtropicales de África, América Latina y Asia, causando grandes pérdidas económicas. Los análisis biométricos previos reportan que T. vivax mide entre 18 y 31 µm; sin embargo, pocos estudios de este tipo se han realizado en Venezuela. El objetivo del presente estudio fue describir y comparar la morfometría de cinco aislados de T. vivax, con el propósito de demostrar la variabilidad en el tamaño de los protozoarios obtenidos a partir de bovinos con infecciones activas en diferentes zonas geográficas del país. Para ello, se realizaron infecciones experimentales en ovinos y se tomaron muestras de sangre en el primer pico de parasitemia. Se registraron microfotografías de los estadios hematozoicos (20 micrografías de microscopia electrónica de barrido) de cada aislado para estudios morfológicos. Los resultados revelaron diferencias significativas (p<0,05); (p<0,01) en la longitud entre los aislados. Los valores totales promedios fueron: 20,99 ± 2,10 µm, con variaciones medias entre 18,12 ± 4,42 µm en los de menor tamaño y 24,35 ± 5,55 µm en la mayor longitud, respectivamente. Por lo tanto, se demostró la existencia de variabilidad en el tamaño de estos hemoparásitos de Venezuela.
(Palabras clave: Trypanosoma vivax; ganado bovino; microscopia de barrido; tripanosomosis; Venezuela)
Abstract
Trypanosomosis caused by Trypanosoma vivax (T. vivax), is distributed in tropical and subtropical regions of Africa, Latin America and Asia, causing great economic losses. Previous biometric analysis report that T. vivax measures between 18 and 31 µm; but few such studies have been conducted in Venezuela. The aim of this study was to describe and compare the morphometry of five isolates of T. vivax, to demonstrate the variability in size of the protozoa obtained from naturally-infected cattle in different geographical areas of Venezuela. To accomplish this, experimental infections were induced in sheep and blood samples were taken at the first peak of parasitemia. Micrographs of stages of hematozoa (20 micrographs of each specimen using scanning electron microscopy) were recorded for morphological studies. The results of this research revealed significant (p<0.05); (p<0.01) statistical differences in length among them. The total average length was 20.99 ± 2.10 µm, with variations which ranged from 18.12 ± 4.42 µm, for smaller lengths, and 24.35 ± 5.55 µm, for greater lengths, respectively. Therefore, the existence of variability in the size of these hemoparasites in Venezuela was demonstrated.
(Key words: Trypanosoma vivax; cattle; scanning microscopy; trypanosomosis; Venezuela)
Recibido: 26/07/12 - Aprobado: 03/07/14
Introducción
Trypanosoma (Duttonella) vivax infecta principalmente rumiantes domésticos tales como: bovinos, ovinos, caprinos, bufalinos y silvestres como cérvidos y antílopes e incluso existen reportes en equinos y jirafas. Este parásito tiene una amplia distribución mundial especialmente en las zonas tropicales y subtropicales de América Latina y África. Este hemoflagelado ocasiona en los animales afectados fiebre recurrente, pérdida progresiva de peso, deterioro de condición física general, anorexia, letargia, efectos negativos sobre la fertilidad, reproducción y pérdidas en la producción de leche y carne en especies de interés comercial. Las alteraciones hematológicas observadas en las infecciones naturales y experimentales incluyen el desarrollo de leucopenia, simultáneamente linfopenia y neutropenia, además de variaciones en la concentración de las proteínas séricas totales [1-3]. La transmisión de T. vivax en África principalmente involucra a vectores biológicos del género Glossina sp.; mientras que en Suramérica es trasmitida en forma mecánica mediante insectos hematófagos, pertenecientes a las familias Tabanidae y Stomoxydae. La tripanosomosis bovina es una enfermedad crónica comúnmente llamada en Venezuela secadera, cachera, huequera o cacho hueco la cual se presenta en forma epizoótica [4-11].
Tradicionalmente la identificación de los tripanosomas se ha basado en las observaciones microscópicas (morfología, morfometría y motilidad), así como por el establecimiento del rango de hospedadores, área geográfica que ocupa, su localización en órganos específicos de los vectores y la capacidad de los parásitos de desarrollarse in vivo (roedores o vectores específicos) o in vitro (cultivos). No obstante, para los miembros del género Trypanosoma, el número de caracteres morfológicos comparativos son muy limitados, reduciendo la utilidad de los métodos convencionales como herramientas para la caracterización y la diferenciación específica de este grupo [12].
En este sentido, los análisis morfométricos de los aislados de T. vivax, han determinado una longitud total del cuerpo entre 18 a 31 µm (incluyendo 3 a 6 µm del flagelo libre), con un rango de longitud promedio entre 21 a 25,4 µm [12]. Muchos tripanosomas de esta especie (aproximadamente el 90%), miden entre 20 a 26 µm de longitud. No obstante, algunos aislados suramericanos, han resultado morfológicamente similares a las formas alargadas de los aislados del oeste de África y diferentes a aquellos con forma rechoncha, procedentes de las regiones ubicadas en el este del continente africano [2].
Los trabajos reportados en Suramérica y revisados por Osório et al. [2] señalan que en Santa Cruz, Bolivia, los T. vivax resultaron con promedio en longitud de 15,86 µm, mientras que los de Brasil en Poconé y Pará midieron 18,73 µm y 22,77 µm, respectivamente. Al comparar estos tres estudios se revela una diferencia significativa entre los referidos aislados indicando la posible heterogenicidad morfométrica existente para este parásito. Debido al impacto de T. vivax sobre la salud de los hospedadores susceptibles y a la poca información acerca de las medidas del cuerpo de este protozoario en Venezuela, se planteó como objetivo realizar un estudio morfométrico comparativo de T. vivax en cuatro zonas endémicas y representativas de gran impacto ganadero. Esto permitirá establecer características específicas de los aislados en estudio, que en un futuro cercano podrán ser utilizados como marcadores morfométricos de identificación, virulencia o patogenicidad. Además de esto, hasta el presente, los estudios realizados en los diferentes países, se basan en la evaluación de un solo aislado; sin embargo, en este trabajo se realizó la comparación entre de cinco aislados parasitarios.
Materiales y Métodos
Muestreos y Obtención de los Aislados en Campo de Trypanosoma vivax
Para el desarrollo del presente trabajo, se tomaron todas las zonas más productivas de ganadería bovina doble propósito (GDP) de Venezuela. Por ello, se establecieron los muestreos en un eje rectangular que recorre el país desde los estados Zulia-Apure hasta Monagas-Bolívar, con la finalidad de lograr obtener muestras de parásitos representativos, distribuidos en las zonas de GDP del país.
Se tomaron muestras de sangre a partir de la vena yugular o coccígea en 434 bovinos mestizos (Bos taurus y Bos indicus) con la ayuda de tubos Vacutainer®, en presencia de EDTA como anticoagulante. Las muestras sanguíneas fueron examinadas en un período de tiempo no mayor a seis h post-recolección mediante la técnica de Woo [13]. Adicionalmente, se emplearon frotis teñidos con Hemacolor® con el propósito de seleccionar aquellas muestras que presentaban los parásitos.
En estos muestreos realizados, se lograron obtener cinco aislados, los cuales se identificaron como: TvAA1: Apure-Aramendi-1; TvGP1: Guárico-Parmana-1; TvGZ1: Guárico-Zaraza-1; TvMT1: Monagas-Temblador-1 y TvLIEM176: Trujillo, aislado donado por las Dra. Laura Morón y Glenda Moreno y obtenido en la zona aledaña al lago de Maracaibo del estado Trujillo. En esta descripción, las dos primeras letras se refieren al género y especie (en este caso, Trypanosoma vivax), la tercera al estado donde fue diagnosticado el aislado, la cuarta a la localidad y el número indica la cepa evaluada en ese muestreo. La nomenclatura del aislado TvLIEM176 corresponde a una identificación interna del laboratorio (ULA-Trujillo).
Criopreservación de Trypanosoma vivax
Para todos los aislados caracterizados en este trabajo, se empleó el protocolo de criopreservación propuesto por Gómez-Piñeres et al. [14]. Para ello, se preparó una solución de glicerol al 20% diluido en PBS-G 0,02 M y 150 mM NaCl, pH 7,2 conteniendo 1% de glucosa, la cual fue mezclada en partes iguales con sangre infectada con tripanosomas y posteriormente almacenados en fase gaseosa en un tanque con nitrógeno líquido.
Infecciones Experimentales
Para las infecciones experimentales, se utilizaron ovinos machos mestizos de 6 a 9 meses de edad, inmunosuprimidos mediante administración interdiaria de dexametasona a dosis de 2 mg/kg pv. Asimismo, con la cuarta dosis de la droga, se les inoculó aproximadamente 1x106 tripanosomas de sangre criopreservada con los diferentes aislados de T. vivax (TvAA1, TvGP1, TvGZ1, TvMT1 y TvLIEM176). Luego del transcurso de cinco días, se comenzaron a realizar pruebas diarias para determinar la presencia del parásito en sangre y tomar las muestras respectivas al momento de máxima parasitemia.
Procesamiento para Microscopía Electrónica de Barrido (MEB)
Se tomaron alícuotas de 0,5 mL de muestras sanguíneas infectadas con T. vivax y se procesaron usando modificación del método descrito por Bretaña et al. [15], las muestras se fijaron en 2,5% de glutaraldehído, con buffer fosfato salino 0,1M, pH 7,2 por 1 hora a temperatura ambiente (TA). Los sedimentos celulares fueron lavados en PBS, fijados en tetraóxido de Osmio al 1%, en agua destilada, por 2 h a TA y posteriormente se lavaron con agua destilada. Alícuotas diluidas de cada muestra fueron colocadas sobre cubreobjetos circulares de 1 cm de diámetro, recubiertos de una capa de poli-L-lisina (0,01% p/v) y se dejaron reposar en capsula húmeda por 1 h. Se eliminó el exceso de líquido en las muestras y se deshidrataron por inmersión en gradientes crecientes de etanol (70, 80, 90, 95 y 100%). Luego, fueron sometidas a inmersión en acetato de amilo y secadas por el método de punto crítico con un secador Hitachi HCP-2. Los cubreobjetos con la muestra deshidratada se montaron en tacos de aluminio, los cuales se recubrieron con una monocapa de 20 nm de platino. Las muestras fueron observadas y se tomaron micrografías en un FESEM®, Hitachi S-4500, con un voltaje acelerador entre 4 a 10 KV.
Análisis Estadístico
Para el análisis morfométrico de T. vivax, se utilizaron micrografías de los parásitos obtenidas por MEB. Se determinó la longitud del flagelo libre (Fl), la longitud del cuerpo incluyendo la parte del flagelo libre (L+Fl), el diámetro medio del cuerpo del parásito (D), siguiendo las especificaciones indicadas por Hoare [12].
Para establecer los valores promedios y Desviación Estándar (DE), se seleccionaron al menos 20 micrografías de los parásitos con ubicación adecuada del cuerpo, luego fueron ampliadas entre tres y cuatro veces y posteriormente se midieron los parámetros morfométricos con un curvímetro de apreciación 0,5 cm, para rangos de longitud entre 20 y 40 cm. Considerándose una distribución normal de los datos, se determinaron los parámetros estadísticos y se aplicó una prueba de comparación múltiple de Tukey (p<0,05), no pareada con correcciones de Welch, utilizando el software estadístico GraphPad Instat versión 3.06, para Windows [16].
Resultados
En las figuras 1 a 10 se muestran las micrografías de T. vivax tomadas con MEB pertenecientes a los diferentes aislados de tripanosomas estudiados, donde se describen los aspectos morfológicos y morfométricos, a partir de las cuales se realizaron las caracterizaciones y las respectivas comparaciones.
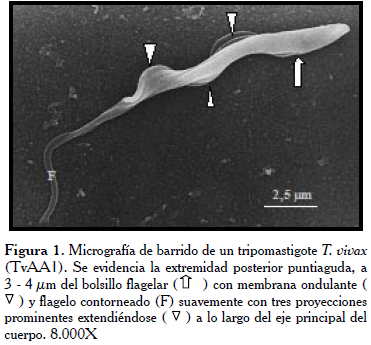
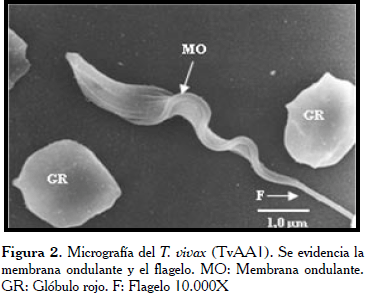
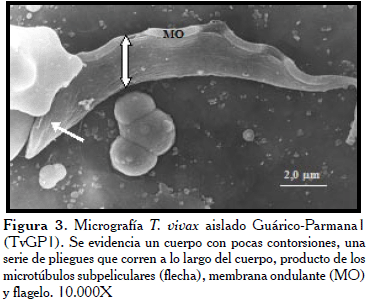
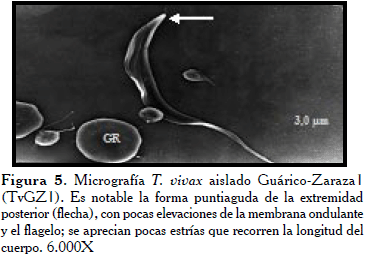
En un primer análisis global de todas las micrografías estudiadas, se observaron las características generales indistintamente del aislado, tales como su forma lanceolada con un flagelo prominente el cual inicia en la bolsa flagelar (BF) a 3-4 µm del extremo terminal, este recorre el cuerpo del tripanosoma de manera ondulante sin llegar a rodearlo por completo. En la parte anterior del parásito, el flagelo se proyecta aproximadamente un tercio de su tamaño en forma libre (Fl), otorgándole al parásito mayor longitud. El extremo posterior puede terminar de forma roma y bulbosa, la cual puede variar desde agudo a más aplanado.
En todos los casos se observó una membrana ondulante (MO) poco desarrollada, esto hace que el flagelo se observe adherido al cuerpo. La membrana externa luce ligeramente rugosa y presenta pliegues o surcos que recorren al parásito longitudinalmente. A bajos aumentos, se observó una distribución de los parásitos en pequeños grupos, ubicados al azar entre los glóbulos rojos con marcada interacción entre ellos. Estos últimos lucen poco redondeados en todas las micrografías, asumiendo a veces formas muy irregulares.
Al realizar las mediciones de cada micrografía obtenida, se pudo determinar la longitud total promedio desde el extremo del FL hasta el extremo posterior de cada parásito evaluado. El promedio de los cinco aislados evaluados fue de 20,99 µm de largo con una DE de 2,10 µm.
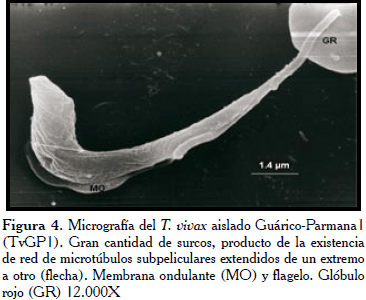
En el parásito del aislado Apure TvAA1 (Figura 1), es apreciable la forma puntiaguda en la extremidad posterior, con semi giro en la parte media sobre su propio eje (flechas), donde sobresale la MO. En la figura 2, se observó el tripanosoma con la superficie de la extremidad posterior ligeramente rugosa y puntiaguda. Mientras, en toda la extensión del cuerpo de los tripanosomatídeos del aislado Guárico-Parmana TvGP1 (Figuras 3 y 4), se observaron pocas ondulaciones con surcos paralelos (flechas) que recorren longitudinalmente en ligera espiral, mostrando la existencia de los microtúbulos del citoesqueleto en su interior.
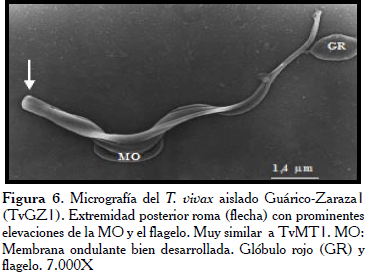
En el caso de algunos parásitos del aislado Guárico-Zaraza TvGz1 (Figura 5), se evidenció que morfológicamente fueron indistinguibles de otros pertenecientes a los aislados TvAA1 y TvLIEM176 y presentaron también la extremidad posterior en forma puntiaguda (flecha). Mientras desde otro ángulo la extremidad posterior luce aplanada con la MO bien desarrollada (Figura 6).
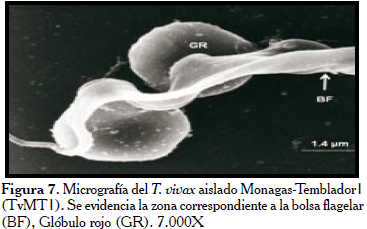
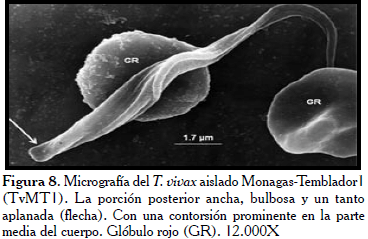
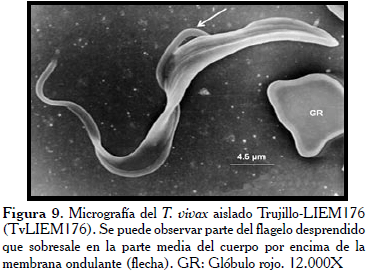
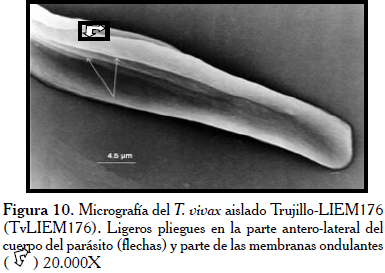
En la Figura 7, los hemoparásitos del aislado Monagas (TvMT1), evidencian la zona correspondiente a la BF hacia la extremidad posterior del parásito (flecha) y su extremo posterior bulboso y ligeramente puntiagudo, igualmente se muestra este parásito adherido a dos glóbulos rojos en la micrografía. Mientras, en la Figura 8, se observan como características relevantes la extremidad posterior aplanada y ancha (flecha). Por otra parte, se observó como el flagelo contornea al parásito sin llegar a rodearlo trazando un recorrido en forma de zigzag. Llamó la atención en esta micrografía el poco desarrollo de la MO. Los tripanosomas del aislado procedente del estado Trujillo (TvLIEM176), mostraron un cuerpo con la superficie medianamente lisa (Figura 9) con algunas sutiles rugosidades. Frecuentemente, se observaron formas en división con los dos flagelos y las MO ligeramente manifiestas (Figura 10).
Las diferencias entre sus medias y la DE, además de la prueba de comparación múltiple de Tukey, revelaron diferencias estadísticas significativas (p<0,05), entre las longitudes de los hemoparásitos pertenecientes a TvGP1 y TvLIEM176, mientras que TvGZ1 y TvMT1; y TvGZ1 y TvLIEM176 resultaron con diferencias estadísticas altamente significativas (P<0,01) como se observa en el Cuadro 1.
Discusión
Los resultados obtenidos en la presente investigación, demuestran una mayor variabilidad e indican heterogeneidad en el tamaño de los aislados en comparación a otro reporte de Venezuela [17], con parásitos procedentes de sangre bovina, donde la L+FL fue de 22,00 µm con oscilaciones entre 17,6 a 28 µm. Para este caso, se encontraron que las medidas de T. vivax en los cinco aislados comparados oscilaron entre 17,7 a 29,9 µm. Sin embargo, es importante destacar que los valores promedios obtenidos en ambos trabajos fueron casi similares, encontrándose una diferencia de 1,01 µm.
Otras investigaciones morfométricas con aislados de T. vivax procedentes de Bolivia y Brasil en bovinos naturalmente infectadose, observaron también diferencias en la L+FL entre los aislados [18, 19] y la asociación con la fase de la infección, donde los hemoparásitos de menor tamaño están presentes en la fase aguda y los de mayor tamaño correspondiente a la fase crónica. En el caso de este trabajo, todos los parásitos provenían de infecciones agudas al evaluar solamente los tripanosomas del primer pico de la infección.
Por otra parte, Linhares et al. [20] evaluaron en Brasil morfologías de tripanosomosis en bovinos con infecciones activas, detectando la presencia de numerosas formas tripomastigotas sanguíneas, las cuales revelaron formas típica con valores morfométricos dentro de los parámetros de referencia para la especie T. vivax descritos por Hoare [12].
En este sentido, Nogueira et al. [21] en Brasil, también reportaron la morfometría para T. vivax en frotis sanguíneos teñidos, aislados de un becerro infectado naturalmente. Los resultaron revelaron un rango en longitud entre 15,38 a 24,26 µm (incluyendo el flagelo libre de 3,06 a 8,63 µm con un promedio de 6,01 µm). En contraste a esto, Gonzales et al. [22] en la región del Pantanal boliviano, determinaron un promedio de longitud total de los parásitos de 13,72 µm ± 2,04, para la provincia Ángel Sandoval. Mientras que en la provincia Germán Busch estos mismos autores observaron un promedio en la longitud de 17,08 µm ± 2,26, para los tripanosomas. Por otra parte, Cuglovici et al. [23] señalaron las características morfométricas de formas tripomastigotas una longitud media total de 19,89 µm ± 2,15, en un brote de T. vivax en el estado de Minas Gerais en Brasil, similar al tamaño promedio del aislado Monagas TvMT1.
Estos trabajos realizados en Latinoamérica, demuestran, la variabilidad de valores morfométricos de aislados de Brasil similares a los descritos en este trabajo. En este sentido, Desquesnes [10], refiere la morfometría para estos protozoarios en Suramérica, consistente con los datos reportados por Hoare [12], señalando una longitud promedio en los parásitos de Guayana Francesa (20,3 µm), Venezuela (21,5 µm) y Brasil (18,7 µm), sin observar diferencias morfológicas entre los aislados.
En Venezuela se han realizado pocos trabajos sobre T. vivax para caracterizar los aislados mediante MEB; sin embargo, Bretaña et al. [15] estudiaron muestras de sangre a través de esta técnica en infecciones múltiples de bovinos esplenectomizados e inoculados con sangre de bovinos de campo y describieron la presencia de T. vivax con una superficie rugosa, un flagelo que emerge del bolsillo flagelar y un tripanosoma en división activa, al mostrar dos flagelos.
Por otra parte, cuando se compararon las medidas de T. vivax registradas en esta investigación, con otras especies del género presentes en Latinoamérica como Trypanosoma evansi, provenientes de diferentes hospedadores tales como: equinos, coati y caninos [24], se evidenció que la longitud total de estos parásitos, es similar a las medidas señaladas para T. vivax. Incluso al comparar estas medidas frente a T. evansi encontrado en un brote de España [25].
Otros hemoflagelados presente en animales domésticos en Latinoamérica son el Trypanosoma theileri, el cual es de mayor tamaño con medidas entre (69 a 109 µm) y el Trypanosoma cruzi que igualmente se puede encontrar en rumiantes, caninos, caballos, gatos y en humanos, tiene dos medidas la rechoncha de 8 a 10 µm y la alargada de 16 a 22 µm [10].
En la presente investigación, se encontraron diferencias estadísticas significativas en las longitudes totales entre los aislados evaluados, lo cual demostró pleomorfismo del parásito, al menos en Venezuela. Sin embargo, diversos autores han señalado a este protozoario como monomórfico, como es el caso de Rivera [7]. Hoare [12] indicó que es monormórfico pero pudiera ser dimórfico, debido a la aparición de dos tipos de T. vivax en las muestras, la rechoncha o la alargada, señalando incluso que esto podría estar asociado con el momento de la infección si es aguda o crónica, respectivamente. En este estudio, las muestras fueron todas evaluadas en el primer pico de infección, o sea, entre los 7 y 9 días posteriores a la inoculación, así que no se puede señalar la existencia de estas dos poblaciones, debido al carácter comparativo realizado en el trabajo.
De manera similar, T. vivax y T. evansi eran considerados como monormórfico [12]. Sin embargo, este punto fue discutido ampliamente en el trabajo de Tejero et al. [26] quienes señalaron la existencia de pleomorfismo en T. evansi, basados en la comparación de tres aislados de este protozooario durante una infección experimental realizada en roedores. Estos autores señalaron que el pleomorfismo de T. evansi ocurre tanto entre aislados como intra aislados, debido a las variabilidades estadísticas observadas en la longitud de los parásitos.
Al revisar los trabajos realizados sobre la morfometría de T. vivax, la mayoría fueron efectuados sobre un solo aislado diagnosticado en un momento determinado. En esta investigación, se evaluaron cinco aislados y su morfometría fue comparada, de esta forma se demostró la variabilidad existente en el tamaño de este protozoario. Adicionalmente, de la observación básica, se lograron identificar características de longitud de los diferentes aislados de T. vivax. Posteriormente, estos resultados permitirán asociar estas características evaluadas a otras, tales como la expresión de virulencia o patogenicidad de los aislados y otras evaluaciones entre ellas genéticas, clínicas, inmunológicas y bioquímicas, las cuales permitirán comprender de manera global la biología de la tripanosomosis.
Conclusiones
En el presente estudio, se encontraron diferencias morfométricas entre los cinco aislados de T. vivax comparados, indicando pleomorfismo existente en el tamaño de las poblaciones de estos hemoflagelados en el país.
Al evaluar las medidas se determinó una longitud total (L+Fl) de 20,99 ± 2,10 µm, con variaciones medias entre 18,12 ± 4,42 µm en los de menor tamaño y 24,35 ± 5,55 µm en la mayor longitud, respectivamente.
Las medidas y variaciones evidenciadas por MEB aportan datos relevantes, que conjuntamente a las futuras aplicaciones de técnicas bioquímicas, patológicas y moleculares, permitirían caracterizar e identificar los diferentes aislados de T. vivax existentes en Venezuela.
Referencias
1. Sandoval E, Espinoza E, Valle A. Leucopenia y trombocitopenia en ovejas infectadas experimentalmente con Trypanosoma vivax. Vet Trop. 1996; 20(1): 19-33. [ Links ]
2. Osório A, Madruga CR, Desquesnes M, Oliveira Soares C, Rios Ribeiro LR, Gonçalves Da Costa SC. Trypanosoma (Duttonella) vivax: its biology, epidemiology, pathogenesis, and introduction in the New World-A Review. Mem Inst Oswaldo Cruz. 2008; 103(1):1-13. [ Links ]
3. Da Silva AS, Garcia Perez HA, Costa MM, Raqueli TF, De Gasperi D, Zanette RA, et al. Horses naturally infected by Trypanosoma vivax in southern Brazil. Parasitol Res. 2011; 108:23-30. [ Links ]
4. Anosa VO, Isoun T. Haematological studies in Trypanosoma vivax infection of goats and intact splenectomized sheep. J Comp Pathol. 1980; 90:155-68. [ Links ]
5. Losos G. Trypanosomiasis. In: Infectious tropical Diseases of Domesticated Animal. Canadá: Longman Scientifical and Technical. 1986. p. 182-318. [ Links ]
6. Gardiner P. Recent studies of the biology of Trypanosoma vivax. Adv Parasitol. 1989; 28: 229-315. [ Links ]
7. Rivera M. Hemoparasitosis Bovinas. Consejo de Desarrollo Científico y Humanístico UCV. Caracas. Venezuela: Colección estudios. 1996. [ Links ]
8. Contreras J. Enfermedades de los Bovinos Diagnóstico Tratamiento y Control. 2a ed. Barquisimeto, Venezuela; 2000. [ Links ]
9. Suárez C, García F, Baldizán G, Mujica F. Comportamiento parasitológico, clínico y hematológico en ovinos infectados experimentalmente con un aislado venezolano de Trypanosoma vivax. Vet Trop. 2003; 28(1):79-92. [ Links ]
10. Desquesnes M. Livestock Trypanosomes and their Vectors in Latin America. Paris: Edited by OIE; 2004. [ Links ]
11. Valera Z, Parra O, Alvarado M, Barboza G, Escalona F, Ramírez R. Efecto de la infección experimental con Trypanosoma vivax sobre parámetros hematológicos en ovinos. Rev Cientif FCV-LUZ. 2005; XV (5): 412-20. [ Links ]
12. Hoare C. The Trypanosomes of Mammals. A Zoological Monograph. Oxford and Edinburg: Blackwell Scientific Publications; 1972. [ Links ]
13. Woo PTK. The Haematocrit centrifuge for detection of trypanosomes in blood. Can J Zool. 1969; 47: 921-23. [ Links ]
14. Gómez-Piñeres E, Tavares-Marques L, Reyna-Bello A. Tiempo de supervivencia in vivo y criopreservación de Trypanosoma vivax. Rev. FCV-LUZ. 2009; XIX (3): 225-29. [ Links ]
15. Bretaña A, Ñañez B, Contreras-Bretaña M, Giardina S. Multiple infections in bovines from the tropics: observation of blood parasites by scanning and transmission electron microscopy. Parasitología. 2002; 3:173-78. [ Links ]
16. GraphPad Instat. Software, versión 3.06. San Diego California, EUA; 2005. [ Links ]
17. Kubes V. El Trypanosoma vivax Americano. Caracas: Ed. Grafolit; 1944. [ Links ]
18. Silva RAMS, da Silva J, Schneider R, Freitas J, Mesquita D, Mesquita T, et al. Outbreak of Trypanosomiasis due to Trypanosoma vivax (Ziemann, 1905) in bovines of the Pantanal, Brazil. Mem. Inst. Oswaldo Cruz. 1996; 91(5): 561-62. [ Links ]
19. Dávila A, Ramirez L, Silva R. Morphological and biometrical differences among Trypanosoma vivax Isolates from Brazil and Bolivia. Mem. Inst. Oswaldo Cruz. 1997; 92(3): 357-58. [ Links ]
20. Linhares GFC, Dias FCF, Fernandes PR, Duarte SC. Tripanossomíase em bovinos no município de Formoso do Araguaia, Tocantins (relato de caso). Ciênc. Anim. Bras. 2006; 7(4): 455-60. [ Links ]
21. Nogueira de Candanedo R, Feitosa A, Pereira H, Abreu-Silva A, Gomes dos Santos A. Biometry of Trypanosoma vivax found in a calf in the state of Maranhão, Brazil. Ciênc Rural. 2008; 38(3): 833-35. [ Links ]
22. Gonzales JL, Chacón E, Miranda M, Loza A, Siles LM. Bovine trypanosomosis in the Bolivian Pantanal. Vet Parasitol. 2007; 146:9-16. [ Links ]
23. Cuglovici DA, Bartholomeu DC, Reis-Cunha JL, Carvalho AU, Ribeiro MFB. Epidemiologic aspects of an outbreak of Trypanosoma vivax in a dairy cattle herd in Minas Gerais state, Brazil. Vet Parasitol. 2010; 169: 320-26. [ Links ]
24. Ramirez L, Dávila A, Silva R, Trajano V, Jansen A. Measurements of Trypanosoma evansi from the Pantanal. Mem. Inst. Oswaldo Cruz. 1997; 92(4): 483-84. [ Links ]
25. Tamarit A, Tejedor-Junco MT, González M, Alberola J, Gutiérrez C. Morphological and biometrical features of Trypanosoma evansi isolates from an outbreak in mainland Spain. Vet Parasitol. 2011; 177:152-56. [ Links ]
26. Tejero F, Roschman-González A, Perrone-Carmona TM, Aso PM. Trypanosoma evansi: A quantitative approach to the understanding of the morphometry-hematology relationship throughout experimental murine infections. J Protozool Res. 2008; 18: 34-47. [ Links ]