Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Veterinarias
versión impresa ISSN 0258-6576
Rev. Fac. Cienc. Vet. vol.57 no.1 Maracay jun. 2016
Evaluación de una Vacuna Inactivada Oleosa del Virus de la Encefalitis Equina del Esteen Cobayos (Cavia porcellus)
Evaluation of an Oil Inactivated Vaccine of Eastern Equine Encephalitis Virus in Guinea Pigs (Cavia porcellus)
María C. González*,1, Gladys Medina**, Víctor Bermúdez*** y Santiago Armas****
*Laboratorio Clínico, División de Servicio Médico Asistencial y Preventivo Campus Maracay, Universidad Central de Venezuela.**Laboratorio de Arbovirus, Sanidad Animal, Centro Nacional de Investigaciones Agropecuarias, Instituto Nacional de Investigaciones Agrícolas, ***Cátedra de Patología, Departamento de Patología Veterinaria y ****Cátedra de Bioestadística, Departamento de Producción e Industria Animal, Facultad de Ciencias Veterinarias, Universidad Central de Venezuela
1 A quien debe dirigirse la correspondencia (To whom correspondence should be addressed)
Correo-E: mclemengm@gmail.com
Resumen
Se evaluó la inmunogenicidad y seguridad de una vacuna oleosa contra el virus de la encefalitis equina del Este, inactivada con etilenimina binaria, en tres formulaciones: Formulación I (F1): antígeno-fase oleosa; Formulación II (F2): antígeno-fase oleosa-medio de mantenimiento; Formulación III (F3): antígeno-fase oleosa-antígeno. Se evaluó la inmunidad durante un año (21, 30, 90, 160, 250, 305 y 365 d), utilizándose 70 cobayos (Cavia porcellus) de 3 a 4 meses de edad y 250 a 300 g de peso vivo, distribuidos al azar en 7 grupos de 10, para un total de siete tratamientos, a saber: Tratamiento 1 (T1): vacunados con una dosis de F1; Tratamiento 2 (T2): vacunados con dos dosis de F1; Tratamiento 3 (T3): vacunados con una dosis de F2; Tratamiento 4 (T4): vacunados con dos dosis de F2; Tratamiento 5 (T5): vacunados con una dosis de F3; Tratamiento 6 (T6): vacunados con dos dosis de F3; Tratamiento 7 (T7): no vacunados. Los cobayos se desafiaron a los 355 d post-vacunación vía intraperitoneal. Se detectó títulos de anticuerpos por inhibición de la hemoaglutinación (IH) ≥20 y por seroneutralización (SN) ≥40, a los 21 d post-vacunación cuando se usó una dosis. El ascenso máximo de anticuerpos por IH se observó a los 90 d, persistiendo e incrementándose en el desafío con una y dos dosis, a los 365 d post- vacunación. Formulaciones con dos dosis tuvieron mayores títulos en todos los períodos, siendo la F3 la que presentó los mayores títulos, seguida de la F2 y la F1, respectivamente (P<0,01). Los títulos de anticuerpos aumentaron después del desafío, siendo mayores en tratamientos con dos dosis (P<0,01). Los cobayos vacunados no desarrollaron enfermedad neurológica o viremia después del desafío. Se concluye que las formulaciones con una y dos dosis indujeron una respuesta de anticuerpos satisfactoria en cobayos durante un año.
(Palabras clave: Vacuna inactivada; oleoso; encefalitis; cobayos; inmunidad)
Abstract
The immunogenicity and safety of an oil vaccine against the eastern equine encephalitis virus, inactivated with binary ethylenimine in three formulations was evaluated: Formulation I (F1): antigen- oil phase; Formulation II (F2): antigen- oil phase-maintenance medium; and Formulation III (F3): antigen- oil phase-antigen. Seventy guinea pigs (Cavia porcellus) 3 to 4 months of age and 250 to 300 g of live weight were used to assess immunity for a year (21, 30, 90, 160, 250, 305 and 365 days). Animals were distributed at random in 7 groups of 10, for a total of seven treatments, as follows: Treatment: 1: vaccinated with one dose of F1; Treatment 2: vaccinated with two doses of F1; Treatment 3: vaccinated with one dose of F2; Treatment 4: vaccinated with two doses of F2; Treatment 5: vaccinated with one dose of F3; Treatment 6: vaccinated with two doses of F3; and Treatment 7: not vaccinated. The guinea pigs were challenged 355 days postvaccination through theintraperitoneal route. Antibodies titers were detected by hemoagglutination inhibition (HI) ≥ 20 and serum neutralization (SN) ≥40 to 21 days postvaccination with one dose. The maximum rise of antibodies with the HI was observed at 90 days, which persisted and increased in the challenge with one and two doses, 365 d postvacccination. Formulations with two doses showed the highest titers in all periods, being F3 the one which higher titles, followed by F2 and F1, respectively (P<0.01). Antibody titers increased after challenge, beinf higher with two doses. (P<0.01). Vaccinated guinea pigs did not develop neurologic disease or viremia after challenge. It is concluded that formulations with one and two doses, induced a satisfactory antibody response in guinea pigs for one year.
(Key words: Inactivated vaccine; oil; encephalitis; guinea pigs; immunity)
Recibido: 00/00/15 - Aprobado: 00/00/16
Introducción
El virus de la encefalitis equina del este (VEEE) es zonoótico, de la familia Togaviridae, género Alfavirus, el cual causa encefalitis fatal y secuelas neurológicas permanentes de diversa gravedad en humanos, equinos y otros animales domésticos [1-3]. De los cuatro linajes de VEEE, el linaje I es endémico en Norteamérica y el Caribe, y muchos casos humanos se registran anualmente en los EEUU; los linajes II y III en Centro y Suramérica causan principalmente enfermedad en equinos, pero el hombre también puede verse afectado [4-6]. Aunque en Suramérica los brotes de la enfermedad son limitados, la mortalidad suele ser elevada [4]. Las cepas de VEEE venezolanas presentan polimorfismo genético y se agrupan en el linaje III de la variante Suramericana con dos sub poblaciones virales distintas, los clados IIIA y IIIB. La cepa EE VE02 EL PAO, utilizada para desarrollar la vacuna inactivada oleosa evaluada en esta investigación pertenece al clado IIIA [7, 8]. A su vez, esta cepa mostró más diferencia con la cepa Norteamericana EE PE-6, con la cual se preparan vacunas comerciales que se usan en Venezuela [7, 8]. González et al. [8], desarrollaron la vacuna inactivada oleosa y los anticuerpos inducidos neutralizaron in vitro a virus vivos. Por otra parte, grupos de cobayos vacunados y desafiados, unos por vía intracerebral y otros por vía intraperitoneal no desarrollaron viremia ni enfermedad neurológica, además la vacuna cumplió con todas las pruebas de control de calidad. Este estudio se condujo para evaluar una vacuna inactivada oleosa del virus de la encefalitis equina del este en Cavia porcellus durante un año para tener una visión más amplia del alcance del poder inmunogénico de la misma en el tiempo.
Materiales y Métodos
Se evaluó la inmunogenicidad e inocuidad de una vacuna oleosa e inactivada con etilenimina binaria (BEI) contra el VEEE en tres formulaciones: formulación I (F1): antígeno-fase oleosa; formulación II (F2): antígeno-fase oleosa-medio mantenimiento y formulación III (F3): antígeno-fase oleosa-antígeno, en cobayos durante un año. La vacunación se realizó a los 90 d despúes de la elaboración de las formulaciones, las cuales fueron mantenidas a 4° C y protegidas de la luz hasta su uso. Se utilizaron 70 cobayos de 3 a 4 m de edad y de 250 a 300 g de peso vivo (PV), los cuales se distribuyeron al azar en siete tratamientos. Cada tratamiento contó con 10 cobayos. El protocolo de tratamientos fue el siguiente: Tratamiento 1: vacunados con una dosis de F1, tratamiento 2: vacunados con dos dosis de F1, tratamiento 3: vacunados con una dosis de F2, tratamiento 4: vacunados con dos dosis de F2, tratamiento 5: vacunados con una dosis de F3; tratamiento 6: vacunados con dos dosis de F3 y tratamiento 7: no vacunados. Se aplicó 1 mL de vacuna por vía subcutánea (SC) en la región retroescapular. En los grupos con dos dosis, el esquema de vacunación fue el siguiente: cada tratamiento fue inoculado con dos dosis de 1 mL con 21 d de intervalo. Los cobayos fueron sangrados por vía intracardíaca a los 21, 30, 90, 160, 250, 305 y 365 d post-vacunación. Los sueros colectados a los 21 d post-vacunación fueron titulados por seroneutralización (SN) e inhibición de la hemoaglutinación (IH), citadas por Rovozzo y Burke [9] y en los siguientes períodos solo por IH. La prueba de SN se hizo en microplacas de 96 pozos, fondo plano, con cultivo de células Vero (riñón de mono verde africano), se colocó 50 µL de cada dilución de la mezcla suero-virus y se incubó a 37° C por 48 h. Se consideraron positivos los sueros diluidos ≥ 1/40 capaces de neutralizar 1000 dosis infectiva 50 en cultivo de tejido (DICT50%/mL). En la SN, se utilizó la cepa EE VE75 CATATUMBO de VEEE como antígeno y se realizaron diluciones de los sueros hasta 1/80. En la IH, se utilizó como antígeno la cepa EE VE84 TUCACAS de VEEE y la cepa TC-83 de virus de encefalitis equina venezolana (VEEV) con ocho unidades hemoaglutinantes; se realizaron diluciones de los sueros hasta 1/40 a los 21 d post-vacunación y en los períodos siguientes hasta 1/160. En esta prueba, algunos sueros (~ 30% de cada tratamiento en cada período) fueron analizados con las cepas EE VE02 EL PAO, EE VE76 EL DELIRIO y EE VE96 MLLANO de VEEE. La IH se realizó en microplacas de 96 pozos con fondo U. Se usaron glóbulos rojos de ganso con densidad óptica de 0,75 y pH 6,2 y se consideró el título como el recíproco de la máxima dilución del suero que inhibió completamente la hemoaglutinación. Por otra parte, los cobayos fueron monitoreados para ver reacciones adversas.
Para evitar que los cobayos desarrollaran de nuevo escorbuto, se les suministró diariamente alimento para conejos, muy importante el pasto fresco o lechuga, col, archicoria, zanahorias, remolachas, pimientos rojos y píldoras efervescentes de vitamina C en el agua de bebida o en su defecto zumo de limón. La manipulación experimental de los mismos se llevó de acuerdo al Código de Bioética y Bioseguridad del Ministerio del Poder Popular para Ciencia y Tecnología e Industrias Intermedias [10].
A los 355 d post-vacunación, a los cobayos (adultos de ~1 ½ año), se les realizó el desafío con 0,1 mL que contenía 1100 dosis letal 50 ratón lactante intraperitoneal (DLRLIP50%/mL) de VEEE patógeno (EE VE84 TUCACAS) por vía intraperitoneal (IP) y se evaluaron los niveles de anticuerpos (Ac), así como síntomas neurológicos y sobrevivencia a los 10 d post desafío. Dado que los animales adultos son menos susceptibles a las infecciones [11] y el reto es poco eficaz, se llevó a cabo una prueba simultánea de desafío en cobayos pequeños susceptibles a las infecciones, para validar la prueba de desafío en los cobayos adultos a los 355 d post-vacunación. Para ello, se utilizaron 10 cobayos de 3 a 4 m de edad de 250 a 300 g (PV) para cada formulación y 10 cobayos sin vacunar. Se suministraron dos dosis de 1 mL por vía SC con 7 d de intervalo, a los 21 d después de la segunda dosis se realizó el desafío con 0,1 mL que contenía 1100 DLRLIP50%/mL de cepa patógena de VEEE (EE VE84 TUCACAS) por vía IP; los cobayos se observaron y a los 10 d post-desafío se evaluaron los niveles de anticuerpos por IH y sobrevivencia durante 16 d. Además, se realizó una titulación simultánea del inóculo en ratones lactantes cepa BALCBc de 3 d de edad con la cepa EE VE84 TUCACAS para comprobar que se inocularon IP las 1100 DLRLIP50%/mL a los cobayos en las pruebas de potencia. La viremia se detectó a través del aislamiento e identificación del virus por hemoaglutinación. El virus fue aislado a partir de muestras de suero tomadas durante 10 d continuos, después del desafío. Diluciones decimales de los sueros (250 µL) fueron inoculados en frascos de 25 cm2 con cultivo de células Vero, incubándose a 37°C por 72 h. Los títulos virales fueron expresados como el recíproco de la máxima dilución del suero dónde se observó efecto citopático y fue calculado por el método de Reed y Muench (DICT50%/mL) [9]. Para el estudio estadístico, los títulos de anticuerpos fueron comparados y analizados por el método de diferencia de proporciones, análisis de varianza y el análisis de Kruskal Wallis mediante el programa Statistix 8.0 (Analytical Software de IBM).
Resultados y Discusión
En el Cuadro 1, se presenta la respuesta de AC a los 21 d post-vacunación contra el VEEE y VEEV por IH, rango de títulos de anticuerpos por IH contra el VEEE y respuesta de anticuerpos contra el VEEE por SN en cobayos vacunados y no vacunados, con una dosis. El análisis de Kruskal Wallis, para los resultados en la SN a los 21 d post-vacunación, mostró que no hubo diferencias en la detección de Ac entre las formulaciones (P>0,05), pero con respecto a los títulos de anticuerpos hubo diferencias entre ellas, siendo la F3 la que presentó mayores títulos (P<0,01), pero no hubo diferencias entre la F2 y F3 (P>0,05). La IH no mostró diferencias en la detección de anticuerpos entre las formulaciones (P>0,05), pero con respecto a los títulos hubo diferencias entre ellas, siendo la F3 la que presentó mayores títulos, seguida de la F2 y la F1 (P<0,01).
En la prueba estándar de inmunidad de acuerdo a Scherer et al. [12] y al Código de Regulaciones Federales [13], a los 30 d post-vacunación con dos dosis de vacuna clásica (antígeno inactivado con formalina y adyuvante hidróxido de aluminio) y 14 d de intervalo, los títulos de anticuerpos por IH deben ser ≥ 20 y por SN ≥ 40 para una respuesta positiva a la inmunización. Una inspección en salud animal [14] utilizando la vacuna contra la encefalomielitis equina del este, oeste y venezolana, a virus muerto, toxoide tetánico en cobayos a los 42 d post-vacunación con dos dosis y 21 d de intervalo, obtuvo resultados similares a los encontrados en este estudio a los 21 d post-vacunación con una dosis. De modo que, con las tres formulaciones a los 21 d post-vacunación con una dosis se obtuvo una respuesta inmune positiva a la vacunación, debido a que se obtuvo títulos de anticuerpos por SN ≥40 y por IH ≥20. Además, Flint et al. [15] señalan que la protección de las vacunas inactivadas está correlacionada con la concentración de anticuerpos por SN e IH en el suero contra proteínas virales.
En los Cuadros 2, 3, 4, 5, 6 y 7 se presenta la repuesta inmune a los 30, 60, 160, 250, 305 y 365 d post-vacunación al VEEE y al VEEV, rango de títulos de anticuerpos inhibidores de la hemoaglutinación contra el VEEE en cobayos vacunados y no vacunados con una o dos dosis, respectivamente.
A los 30 d post-vacunación (Cuadro 2), el tratamiento 6 presentó mayores títulos, seguido del 2, 4, 3, 1 y 5 (P<0,01). No hubo diferencias entre los tratamientos con una y dos dosis (P>0,01).
A los 90 d post-vacunación (Cuadro 3), el tratamiento 6 presentó mayores títulos, seguido del 4 y 2 (P<0,01), no encontrándose diferencias entre los tratamientos con una dosis (P>0,01). Los tratamientos con dos dosis tuvieron mayores títulos (P<0,01).
A los 127 d post-vacunación los cobayos presentaron escorbuto, por nutrición inadecuada (solo se les suministraba alimento para conejos), dado que se tuvo acceso limitado al mismo durante este período. Los síntomas de escorbuto fueron: pelaje erizado y áspero, sangrado por las encías, diarrea líquida o hemorrágica, vómitos, debilidad general, deshidratación, anorexia, trastorno locomotriz, postración y muerte. Por consiguiente, se les aplicó el tratamiento adecuado [16], se les mejoró su alimentación y condiciones sanitarias. Una vez recuperados del escorbuto se realizó la sangría de los 160 d post-vacunación. El escorbuto es una enfermedad causada por un déficit prolongado de vitamina C, la cual es importante en la formación y conservación del colágeno [16, 17]. Los primates y cobayos son incapaces de sintetizar la vitamina C a partir de la D-glucosa, por una deficiencia de la L-gluconolactona oxidasa (GULO, por sus siglas en Inglés). Esta enzima cataliza la biosíntesis final de la vitamina C y su pérdida en estos mamíferos se debe a múltiples mutaciones en los genes GULO [16-19]. Estas especies se han adaptado a la pérdida de la síntesis natural por consumir vegetales con ascorbato y las mismas sirven como modelo para el estudio de la deficiencia de esta vitamina y su privación produce defectos graves del funcionamiento motor [18,19]. Por lo tanto, la vitamina C es indispensable para su supervivencia y deben ingerir cantidades adecuadas en la ración, si no enferman y mueren [18,19].
A los 160 d post-vacunación (Cuadro 4), el tratamiento 4 presentó mayores títulos, seguido del 6, 2, 3, 1 y 5 (P<0,01). No hubo diferencias entre el 3 y 2 ni entre el 1 y 5 (P>0,01). En este lapso de tiempo los cobayos tenían aproximadamente unos 20 d que se habían recuperado del escorbuto. Se puede observar que los títulos de anticuerpos disminuyeron con respecto a los 90 d post-vacunación. Hubo diferencias en la disminución de los títulos de anticuerpos en los tratamientos entre estos dos períodos (P<0,01); sin embargo, mantuvieron los títulos de anticuerpos IH ≥ 20.
A los 250 d post-vacunación (Cuadro 5), el tratamiento 6 presentó mayores títulos, seguido del 4, 3, 2, 1 y 5 (P<0,01). No hubo diferencias entre el 3 y 2, ni entre el 1 y 5 (P>0,01).
A los 305 d post-vacunación (Cuadro 6), el tratamiento 6 presentó mayores títulos, seguido del 4, 2, 5, 1 y 3 (P<0,01). No hubo diferencias entre el 6 y 4, entre el 2 y 5, y entre el 1 y 3 (P>0,01).
A los 365 d post-vacunación (Cuadro 7), los tratamientos 6, 4 y 2 (tratamientos con dos dosis) fueron los que presentaron mayores títulos (P<0,01), sin presentar diferencias entre ellos, luego siguen el 3, 5 y 1, no habiendo diferencias entre el 5 y 1 (P>0,01). Los anticuerpos se incrementaron después del desafío con cepa patógena y fueron más elevados en los cobayos vacunados que en los controles no vacunados (P<0,01). A los 365 d post-vacunación y 10 d post-desafío, se puede observar que los títulos aumentaron notablemente con respecto a los 305 d post-vacunación. Hubo un incremento en los títulos de anticuerpos en todos los tratamientos entre estos dos períodos (P<0,01) (Cuadros 6 y 7).
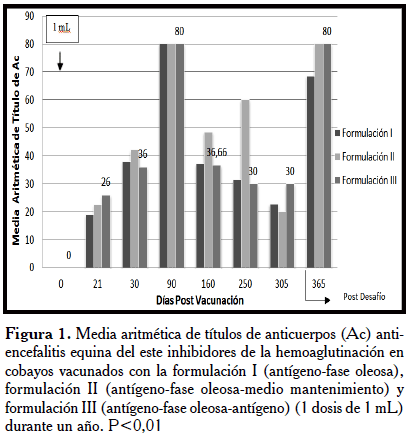
En las Figuras 1 y 2, se presentan los resultados de la media aritmética de títulos de anticuerpos anti-encefalitis equina del este inhibidores de la hemoaglutinación en cobayos vacunados con la formulación I, II y III con una y dos dosis de 1 mL durante un año. Las formulaciones exhibieron un rápido incremento de anticuerpos a los 21 d post-vacunación, con un ascenso máximo a los 90 d, los cuales persistieron y se incrementaron en el desafío a los 365 d post-vacunación, con una y dos dosis. Estos resultados son similares a los reportados por Clark et al. [20], con una vacuna inactivada con formalina contra el VEEE en grullas blancas, las cuales tenían anticuerpos SN preexistentes, aparentemente por una infección natural. Estas grullas tuvieron un rápido incremento, lo cual originó los altos títulos de anticuerpos a los 470 d.
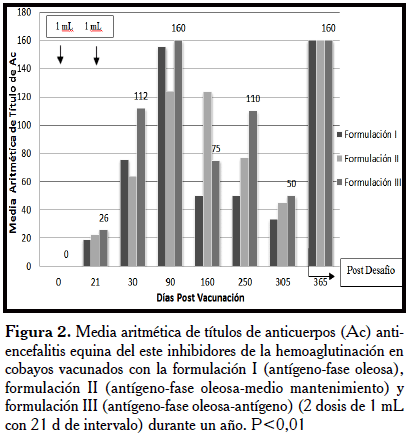
Los cobayos vacunados presentaron anticuerpos en todos los períodos, no mostraron signos clínicos de encefalitis e incrementaron sus niveles de anticuerpos a los 365 d post-vacunación y 10 d post-desafío. A diferencia de los no vacunados, de los cuales el 14,28% (1/7) presentó síntomas neurológicos de encefalitis (trastorno locomotor), en tanto el 85,71% (6/7) no evidenció síntomas y presentó títulos entre ≥ 40 y ≥ 160. Sin embargo, este último resultado es común, dado a que en una infección natural, ciertos animales desarrollan una respuesta rápida de anticuerpos y células activas que controlan la infección [12]. Por otra parte, los cobayos en este período eran animales adultos (~1 ½ año) con un sistema inmune maduro y por lo tanto menos susceptibles a las infecciones, con pesos entre 800 y 1500 g PV y con buenas condiciones de salud, por lo que presentaron una respuesta inmune eficiente, incluso la mayoría de los no vacunados. Este punto de la investigación es crítico, pues indica que el reto, en los cobayos adultos no fue eficaz, debido a la elevada sobrevivencia de los no vacunados. Por ello, adicionalmente, se desarrolló una prueba simultánea de desafío control en cobayos pequeños, de 3 a 4 meses de edad y de 250 a 300 g PV, dónde se observó como era de esperar que el 100% (10/10) de los vacunados, no presentó síntomas de encefalitis y tuvo títulos de anticuerpos por IH ≥ 20 y en el grupo control, sin vacunar, el 80% (8/10) presentó síntomas de encefalitis a los 10 d y no tuvo anticuerpos, mientras que el 20% (2/10) no presentó síntomas y tuvo títulos de anticuerpos IH ≥20. Esta prueba de potencia en cobayos pequeños por vía IP mostró ser eficaz, ya que el 100% de los vacunados sobrevivieron y el 80% de los no vacunados murieron entre los 12 y 16 d. Con este resultado se observó que la edad y la madurez del sistema inmune son determinantes para un resultado eficaz en las pruebas de desafío, validando que la vacuna es efectiva, protegiendo así a los cobayos pequeños contra los efectos patógenos del virus. De hecho, la prueba estándar de desafío de vacunas comerciales contra los Alfavirus de encefalitis equina se realizan en cobayos de 3 a 4 m de edad, por vía intracerebral y en ratones blancos lactantes [13, 14]. El ratón blanco lactante es sensible a la infección, la cual se presenta entre 24 a 48 h post-infección. Además, los virus de encefalitis son capaces de multiplicarse en cobayos, hámster y pollos de 1 d de nacidos [21]. Lo importante, es que la inoculación por vía intraperitoneal con respecto a la vía intracerebral es menos traumática tanto para el animal como para el investigador en las pruebas de desafío. Pandia et al. [22], han utilizado satisfactoriamente la vía IP para el desafío con cepas de VEEE en ratones. Reed et al. [23] con una vacuna de replicones, individual y combinada contra el VEEE, VEEV y virus de encefalitis equina del oeste, indujeron anticuerpos neutralizantes eficaces contra los Alfavirus respectivos, en ratones y macacos. Una buena vacuna debe ser eficaz, segura, estable y de bajo costo, siendo la duración de la respuesta también importante [12].
Los cobayos presentaron reactividad cruzada con el VEEV a los 21 d post-vacunación con una dosis, luego se observó solo en los tratamientos con dos dosis a los 30 d post-vacunación y en los siguientes períodos en los tratamientos con una y dos dosis, excepto a los 305 d post-vacunación, cuando no se observó en ninguno de los tratamientos, potenciándose luego a los 365 d post-desafío en todos los tratamientos. Es común observar reactividad cruzada con otros Alfavirus, ya que comparten antígenos comunes y los virus muestran reacciones cruzadas en los ensayos serológicas [24]. Las formulaciones con una y dos dosis indujeron una respuesta de anticuerpos en cobayos durante un año, teniendo la duración de la respuesta inmune una importancia suprema [17], siendo este resultado satisfactorio. Los tratamientos con dos dosis tuvieron mayores títulos en todos los períodos (P<0,01). Además, los cobayos no presentaron ningún efecto adverso con esta vacuna, solo con la F3, se observó un nódulo transitorio en el sitio de la inyección, la cual subsanó sin ninguna complicación. Se recomienda utilizar cobayos hembras, cuando se realizan pruebas por largos períodos, como la prueba de evaluación de inmunidad durante un año, debido a que las hembras tienen un comportamiento pacífico en hacinamiento, a diferencia de los machos que se estresan y se agreden incluso hasta producirse la muerte.
Conclusiones
Las formulaciones con una y dos dosis de la vacuna inactivada oleosa del virus de la encefalitis equina del este en Cavia porcellus proporcionaron una respuesta de anticuerpos rápida, segura y activa durante un año, sin efectos adversos.
Agradecimientos
Los autores agradecen al Laboratorio de Arbovirus y al Bioterio de, Sanidad Animal, Centro Nacional de Investigaciones Agropecuarias, Instituto Nacional de Investigaciones Agrícolas (CENIAP-INIA), especialmente a Irineo Matheus, Enrrique Pérez y Zenobia Vargas del laboratorio de Arbovirus (CENIAP-INIA) por la colaboración técnica prestada.
Declaración de Conflicto de Interés
No existe ningún conflicto de interés, real o potencial, incluyendo cualquier relación financiera, personal o de otro tipo, con personas u organizaciones, lo cual no sesga o no es percibido como un factor que influya indebidamente en esta investigación.
Aporte de los Autores al Trabajo
MCG: Realización del trabajo en todas sus etapas, procesamiento de muestras, pruebas, análisis de datos, transcripción y otros. GM: Apoyo en la utilización de las instalaciones, equipos, suministro de reactivos e insumos del Laboratorio de Arbovirus, Sanidad Animal del Centro nacional de Investigaciones agrícolas (CENIAP-INIA) y asesoramiento en el trabajo de investigación. VB: Asesoramiento en el trabajo de investigación. SA: Aplicación de las pruebas estadísticas empleadas.
Referencias
1. Aguilar PV, Leung LW, Wang E, Weaver SC, Basler CF. A five-amino-acid deletion of the eastern equine encephalitis virus capsid protein attenuates replication in mammalian systems but not in mosquito cells. J Virol. 2008; 82(14):6972-83. [ Links ]
2. Paessler S, Weaver SC. Vaccines for Venezuelan equine encephalitis. Vaccine. 2009; (Suppl. 4):D80-5. [ Links ]
3. Pérez N, Plaza N, Medina G, Matheus I, Siger J. Encefalitis equina: epidemiología, diagnóstico y su interpretación. Revista Digital CENIAP HOY. [acceso: 18 de septiembre de 2014]. Disponible en: http://www.sian.inia.gob.ve/repositorio/revistas-tec/ceniaphoy/articulos/ne/arti/perez-n.htm. [ Links ]
4. Aguilar PV, Robich RM, Turell MJ, OGuinn ML, Klein TA, Huaman A, et al. Endemic eastern equine encephalitis in the Amazon region of Peru. Am J Trop Med Hyg. 2007; 76(2):293-8. [ Links ]
5. Centers for Disease Control and Prevention. 2010. Eastern Equine Encephalitis. [acceso:15 de febrero de 2014]. Disponible en: http://www.cdc.gov/EasternEquineEncephalitis/tech/virus.html. [ Links ]
6. Go YY, Balasuriya UBR, Lee CK. Zoonotic encephalitides caused by arboviruses: transmission and epidemiology of alphaviruses and flaviviruses. Clin Exp Vaccine Res. 2014; 3(1):58-77. [ Links ]
7. González MC, Herrera F, Correia H, Ruíz J. Análisis filogenético de cepas venezolanas del virus de la encefalitis equina del este. Rev Fac Cs Vets. 2012; 53(1):49-60. [ Links ]
8. González MC, Pérez N, Bermúdez V. Desarrollo de una vacuna inactivada oleosa con cepa venezolana del virus de la encefalitis equina del este. Rev Fac Cs Vets. 2014; 55(2):78-87. [ Links ]
9. Rovozzo GC, Burke CN. A Manual of Basic Virological Techniques. Prentice Hall, Inc. Englewood Cliffs. New Jersey. 1973; p. 94-107. [ Links ]
10. Ministerio del Poder Popular para la Ciencia y Tecnología e Industrias Intermedias. Fondo Nacional de Ciencia, Tecnología e Innovación. Código de Bioética y Bioseguridad. 3a ed. Caracas, Venezuela. 2008; p. 33-5. [ Links ]
11. Madigan MT, Martinko JM. Brock Biology of Microorganisms. 11th ed., Pearson Prentice Hall, United States America. 2006; p. 752-54. [ Links ]
12. Scherer WF, Mackenzie RB, Eddy GA, Cole FE, Pedersen CF, Spertzel RH, et al. Recomendaciones para la producción de vacunas contra las encefalitis equinas. En: Conferencia Internacional Sobre Vacunas Contra las Encefalitis Equinas. Centro Panamericano de Zoonosis, Organización Panamericana de la Salud y Organización Mundial de la Salud. Maracay, Venezuela. 1974; p. 15-25. [ Links ]
13. Code of Federal Regulations. Animals and animal products. Killed virus vaccine. Special Edition. The Office of The Federal Register National Archives and Records Administration, Washington D. C. USA. 1998; p. 590-97. [ Links ]
14. Fort Dodge Animal Health. Encephalomyelitis vaccine, eastern, western & venezuelan, killed virus, tetanus toxoid (Triple ET Innovator). Division of American Home Products Corporation, USA. 2001; p. 1-7. [ Links ]
15. Flint SJ, Enquist LW, Krug RM, Roncaniello VR, Skalka AM. Principles of Virology Molecular biology. Pathogenesis and control. American Society for Microbiology Press. Washington DC. 2000; p. 674-5. [ Links ]
16. Foro Mascotas. El escorbuto o deficiencia de vitamina C en la cobaya. Disponible en: http://www.foromascotas.com/8-articulos/47-escorbuto-o-deficiencia-vitamina-c-cobaya.html. [Consulta: 4 de septiembre de 2015]. [ Links ]
17. Yang H. Conserved or lost molecular evolution on the key gene GULO in vertebrate vitamin C biosynthesis. Biochm Genet. 2013; 51(5-6):413-25. [ Links ]
18. Alexander J, Michel S, Balz F. Myths, artifacts and fatal flaws: Identifying limitations and opportunities in vitamin C research. Nutrients. 2013; 5(12):5161-92. [ Links ]
19. Pierce MR, Diasio DL, Rodriguez LM, Harrison FE, May JM. Combined vitamin C and E deficiency induce motors defects in gulo (-/-)/SVCT2 (+/-) mice. Nutr Neurosci. 2013; 16(4):160-73. [ Links ]
20. Clark GG, Dein JF, Crabbs LC, Carpenter JW, Watts MD. Antibody response of sandhill and whooping cranes to an eastern equine encephalitis virus vaccine. J. Wildlife Dis. 1987; 23(4):539-44. [ Links ]
21. Pandia J, Gorchakov R, Wang E, Lealy G, Weaver SC. A vaccine candidate for eastern equine encephalitis virus based on IRES-mediated attenuation. Vaccine. 2012; 30(7):1276-82. [ Links ]
22. Gleiser CA, Gochenour WS Jr, Berge TO, Tigert WD. The comparative pathology of experimental venezuelan equine encephalomyelitis infection in different animal hosts. J Infect Dis. 1962; 110:80-97. [ Links ]
23. Reed DS, Glass PJ, Bakken RR, Barth JF, Lind CM, da Silva L, et al. Combined alphavirus replicon particle vaccine induces durable and cross-protective immune responses against equine encephalitis viruses. J Virol. 2014; 88(20):12077-86. [ Links ]
24. Walton TE, Jochim MM, Barber TL, Thompson LH. Cross-protective immunity between equine encephalomyelitis viruses in equids. Am J Vet Res. 1989; 50(9):1442-6. [ Links ]