Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Gaceta Médica de Caracas
Print version ISSN 0367-4762
Gac Méd Caracas vol.110 no.1 Caracas Jan. 2002
Oclusión percutánea de los defectos del tabique interauricular: nueva estrategia de tratamiento
Drs. Juan S. Muñoz R*, Simón Muñoz A**, Francisco Tortoledo R***, Leonardo Izaguirre B***, Cesar Perozo H*
*Instituto "Dante Pazzanese" de Cardiología, São Paulo- Brasil.
**Servicio de Cardiopatías Congénitas del Hospital Universitario de Caracas, Caracas – Venezuela.
***Laboratorio de Exploraciones e Intervenciones Cardiovasculares del Instituto Médico La Floresta, Caracas – Venezuela.
INTRODUCCIÓN
Dentro de las cardiopatías congénitas que cursan con cortocircuito arteriovenoso, encontramos entre las más frecuentes a la comunicación interauricular (CIA), que se caracteriza por la presencia de un defecto estructural en el tabique interauricular, que puede variar desde un pequeño orificio hasta una aurícula única, siendo también posible encontrar más de una comunicación (1,2). Constituye, aproximadamente, el 10-15% de todas las cardiopatías congénitas. Es la cardiopatía más frecuente en el adulto, y predomina en el sexo femenino, en razón de 2:1 (1,2).
La clasificación de las comunicaciones interauriculares, está basada en la localización anatómica del defecto. 1. El defecto localizado a nivel de la fosa oval, o defecto de tipo fosa oval, comúnmente llamado en la literatura anglosajona con el nombre de comunicación interauricular tipo ostium secundum, 2. El defecto tipo ostium primum, 3. El defecto tipo seno venoso.
El defecto tipo fosa oval es el más frecuente (75%). Está localizado en la región de la fosa oval, como consecuencia de un defecto de la membrana de la fosa oval (3,4). El ostium secundum se forma en una región cefálica a la fosa oval, por lo cual la designación de los defectos con esta localización con el nombre de defecto tipo ostium secundum es incorrecta desde el punto de vista embriológico (3,4). El defecto tipo ostium primum representa el 15% de las CIA y está situado en la porción inferior del tabique interauricular. Suele formar parte de los defectos atrioventriculares. El defecto tipo seno venoso (10% de los casos), localizado por arriba de la fosa oval e inmediatamente debajo de la desembocadura de la vena cava superior, está generalmente asociado al drenaje anómalo de las venas pulmonares derechas.
Las consecuencias fisiopatológicas de la CIA van a depender de la cantidad, magnitud y duración del flujo que pasa por la comunicación, desde la circulación sistémica hasta la pulmonar; y del comportamiento del lecho vascular pulmonar, demostrándose que, en la mayoría de los casos, la sintomatología se incremente con la edad. En la evolución y la historia natural se observa que, a partir de la tercera y cuarta décadas de la vida, el desarrollo de hipertensión arterial sistémica, enfermedad arterial coronaria y miocardiopatías degenerativas sirven como sustrato para elevación de la presión diastólica final del ventrículo izquierdo (VI), y de la presión intra-auricular izquierda, lo que determina aumento gradual del cortocircuito de izquierda a derecha a nivel auricular, con relación flujo pulmonar (FP)/flujo sistémico (FS) mayor de 1,5, lo que trae como consecuencia una sobrecarga volumétrica de las cámaras derechas, insuficiencia cardíaca derecha, desarrollo de hipertensión arterial pulmonar y, a largo plazo, la presencia de arritmias frecuentes, especialmente arritmias supraventriculares (taquicardia supraventricular, fibrilación auricular) (1,2). Por estas razones, se justifica el tratamiento precoz de la CIA en pacientes sintomáticos o asintomáticos, que tengan un flujo pulmonar 1,5 veces mayor que el flujo sistémico, con edad menor de 5 años; o con edades mayores, si son sintomáticos.
Justificación
El abordaje quirúrgico ha sido el método convencional de tratamiento curativo de las comunicaciones interauriculares (5,6); y a pesar de necesitar un corto período de circulación extracorpórea, se demostró que es un procedimiento seguro con índices de mortalidad < 1-3%, con mejoría de la clase funcional, reducción importante del riesgo de embolización paradójica, estadía hospitalaria posoperatoria relativamente corta (3-4 días) y cosméticamente aceptable, a través de una incisión submamaria bilateral (7) . Los problemas de este procedimiento son: la presencia de cortocircuitos residuales significativos, estimándose en 2% la tasa de reintervención; las complicaciones cerebrales que pueden ocurrir en la cirugía como resultado de trombo o émbolo durante el bypass cardiopulmonar, poco frecuente, y la poca efectividad en la disminución de la incidencia de las arritmias auriculares (8).
En los últimos diez años, el cierre vía percutánea, suscitó un interés particular como alternativa de tratamiento definitivo, no quirúrgico, de la CIA. La indicación aceptada para la oclusión percutánea es la presencia de CIA tipo fosa oval, situada en la porción central del tabique interauricular, con bordes gruesos y de dimensiones suficientes para la sustentación del dispositivo de oclusión. En los otros tipos de comunicación interauricular (ostium primum y seno venoso) el tratamiento quirúrgico representa la opción de elección (8,9).
Desde la introducción de la atrioseptostomía por catéter-balón, introducida por William Rashkind, en 1966 (10), muchas cardiopatías congénitas han sido tratadas a través de la cardiología intervencionista por catéter. La oclusión percutánea de la CIA fue realizada, inicialmente, por King y Mills, en 1974; sin embargo, el sistema desarrollado no se popularizó, como consecuencia del alto perfil del calibre de los introductores necesarios para el implante (11). Rashkind también creó un tipo de umbrella para el cierre de la CIA, que se fijaba en el tabique a través de minúsculos ganchos o anzuelos (12). Esa particularidad dificultaba el posicionamiento adecuado del dispositivo, además de predisponer complicaciones, por lo que fue abandonado.
En el final de la década de los 80, Lock y col. modificaron la umbrella doble de Rashkind diseñada para la oclusión percutánea del conducto arterioso persistente, creando la Clamshell double umbrella (13), consistente en dos umbrellas que cierran como una "concha de almeja". Ese dispositivo, después estudiado extensivamente en modelos experimentales, fue colocado en la práctica clínica con resultados promisores (13,14). Sin embargo, un gran estudio multicéntrico reveló que, en el seguimiento, algunas prótesis presentaban fracturas en las astas de sustentación. A pesar de que este hallazgo no estuvo asociado a complicaciones clínicas, la Food and Drugs Administration (FDA) suspendió la utilización de esa prótesis hasta la solución de estos problemas técnicos.
Tipos de prótesis.
Actualmente, se usan cinco tipos prótesis con resultados variables. A continuación los enumeraremos, discutiendo su estructura, modo de funcionamiento, resultados, ventajas y desventajas.
Prótesis Amplatzer (Amplatzer device).
Figura 1. Prótesis de Amplatzer
(disponible en el site www.agamedical.com en 25/09/2000)
Características técnicas.
La prótesis de Amplatzer (Figura 1) está constituida de dos discos autoexpansibles, conectados a un pequeño núcleo central (cintura), cuyo diámetro corresponde al diámetro estirado de la CIA. El material con el que está fabricado el dispositivo es una red metálica flexible de nitinol, relleno internamente por un refuerzo de poliéster para aumentar su poder oclusivo. Esos refuerzos son cosidos a la red metálica por monofilamentos del mismo material. Los diámetros disponibles de las prótesis (correspondientes a la cintura) van de 4 a 26 mm. Los discos son mayores que la cintura en 16 y 10 mm, respectivamente, para el disco distal y proximal. Las prótesis hasta 10 mm son implantadas a través de catéteres portadores de calibre 6 french o 7 french, y las de 10 a 17 mm a través de catéteres portadores de calibre 8 french (8).
Este tipo de prótesis está indicado en las comunicaciones interauriculares tipo fosa oval, cuyo diámetro no sea mayor de 20 mm con una distancia de por lo menos 4 a 5 mm entre los márgenes del defecto y el seno coronario, válvulas aurículoventriculares y la vena pulmonar superior derecha, para evitar la posibilidad de lesión de estas estructuras con los discos de la prótesis.
Este dispositivo tiene la gran ventaja de su estabilidad, debida a su núcleo metálico central (cintura), que queda colocado en el defecto como un stent, lo cual elimina la necesidad de brazos o esqueletos metálicos para tal finalidad. La optimización del poder oclusivo es realizada por los dos discos localizados a cada lado de la cintura, amoldándose al lado izquierdo y derecho del tabique interauricular, soportando el núcleo central (estabilizador) y obstruyendo el flujo transseptal (8).
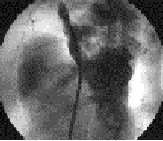
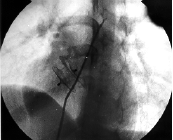
El cierre percutáneo de la CIA tipo fosa oval con la prótesis de Amplatzer ha sido demostrado como procedimiento seguro, con elevado índice de eficacia y pocas complicaciones per y posprocedimiento (15) (Figura 2.A-B).
Figura 2. A: CIA tipo fosa oval en situación media del tabique interauricular (flecha). Angiografía en vena pulmonar superior derecha en proyección hepato-clavicular. B: Aspecto de la prótesis en el tabique interauricular después de la liberación final (flecha). Proyección hepato-clavicular. (Instituto Dante Pazzanese de Cardiología, Sao Paulo, Brasil).
RESULTADOS
La prótesis de oclusión septal Amplatzer fue descrita en 1996 por Sharafuddin y col. (16). Una de sus principales ventajas es el menor tamaño de la prótesis a ser utilizada para el cierre del defecto, cerca de 1,0 a 1,5 veces el tamaño de la comunicación (otras necesitan un diámetro 2 a 2,5 veces mayor) (14,17-20). La neoendotelización e incorporación fibrosa de la prótesis es completa dentro de 1 a 3 meses posterior al implante (16).
En la serie inicial de Wilkinson y Goh (21), 27 pacientes fueron sometidos a colocación de la prótesis; sin embargo, dos fueron retiradas al final del procedimiento por inestabilidad (inclusive con embolización de una). En 61% de los pacientes fue demostrado ausencia de cortocircuito al ecocardiograma transesofágico (ETE) inmediatamente después del procedimiento; pasado 1 mes, ocurrió oclusión total en 88% y en los siguientes 3 meses, 91%.
Thanopoulos y col, también realizaron un estudio inicial con Amplatzer (22). En 16 pacientes con CIA tipo fosa oval sometidos al procedimiento no fueron observadas complicaciones. Después del implante de la prótesis, apenas 3 (18,7%) presentaban cortocircuito residual, 2 de los cuales habían desaparecido en 3 meses.
En un estudio más amplio, involucrando 250 pacientes (Ziyad M. Hizaji, datos no publicados), el índice de oclusión alcanzó 95% después de 3 meses de seguimiento. En los casos que permanecían con cortocircuito, éste era mínimo, sin repercusión hemodinámica, pero con necesidad de terapia profiláctica para endocarditis infecciosa. En apenas 11 pacientes (4,2%), hubo complicaciones, como embolización con retirada quirúrgica o percutánea, arritmias, necesidad de marcapaso y ataque isquémico transitorio (Cuadro 1).
Resumen de los principales estudios utilizando la prótesis de Amplatzer
| Estudio | Nº de pacientes | Éxito en el implante | Tiempo de seguimiento | Ausencia de cortocircuitos significativos* | Complicaciones |
| Wilkinson y Goh (21) | 27 | 26 (96%) | 3 m | 23 (91%)** | 1 (4%)** |
| Thanopoulos (22) | 18 | 16 (88%) | 3 m | 15 (94%)** | - |
| Hizajie | 261 | 234 (90%) | 1a | 234 (100%)** | 11 (5%)** |
* ausencia de defecto residual significativo (< 2 mm de diámetro). ** porcentaje en relación con los pacientes que tuvieron éxito en el implante. e datos no publicados de Zihad Hizaji.
La prótesis de Amplatzer ha sido también utilizada para oclusión de múltiples CIA (23), con tasa de éxito en el implante de 100% (22 pacientes, con colocación de 45 prótesis). El porcentaje de pacientes sin cortocircuito residual o insignificante fue de 97,5%.
En América del Sur, Brasil representa uno de los países con mayor casuística en este campo; hasta 1998, en la experiencia inicial del Instituto "Dante Pazzanese" de Cardiología, 13 pacientes, con edad entre 3 y 65 años (24) fueron sometidos a este procedimiento, todos con éxito. Uno de los pacientes era portador de 2 CIA y de conducto arterioso permeable, precisándose la implantación de dos dispositivos y la oclusión concomitante del conducto arterioso, procedimiento hasta entonces inédito en la literatura (25).
Características técnicas.
La prótesis Angel Wing (Figura 3) consiste en 2 estructuras cuadradas de hilos de nitinol, cada una de ellas reforzadas en su periferia por una extensión hecha con dacrón. Las dos estructuras están suturadas centralmente una con la otra, formando el "anillo de unión". Mediante control manual se libera el cuadrado distal en el lado izquierdo del defecto; luego el dispositivo es reposicionado a través del defecto en el lado derecho del mismo, donde se libera el cuadrado proximal, que, por unión que tiene con el otro cuadrado, a nivel del "anillo de unión", ofrece una oclusión considerablemente segura (9,26,27).
Figura 3. Prótesis Angel Wing (disponible en el site www.microvena.com en 25/09/2000)
RESULTADOS
Esta prótesis fue desarrollada por Das, en 1993 (28). En estudios experimentales y clínicos iniciales la tasa de oclusión estuvo alrededor de 95% (28,29). El examen histopatológico realizado en esas prótesis cerca de 8 semanas después de su implante, mostró crecimiento endotelial y ausencia de trombos en su superficie (28). Los estudios clínicos de Fase I realizados por la FDA utilizaron 65 pacientes, con 86% de éxito (30). En 7 (10%) pacientes el implante no fue ideal, precisando solución quirúrgica. El seguimiento por 5 a 6 meses mostró cortocircuitos clínicamente insignificantes o ausencia de estos en 93,6%. En una serie menor, fueron sometidos 20 pacientes al procedimiento, con resultado satisfactorio en 19 (95%); 1 paciente (5%) mostró cortocircuito residual importante (27). Ocurrieron complicaciones menores, como embolia gaseosa coronaria mínima, arritmias (fibrilación auricular, bloqueo AV completo, entre otros). Sin embargo, todos respondieron favorablemente al tratamiento clínico (anticoagulación y antiarrítmicos). En dos pacientes (10%) ocurrió la fractura de las astas de la prótesis, sin consecuencias clínicas.
En un estudio multicéntrico realizado en Alemania (31), 75 pacientes fueron sometidos a implante, con éxito en 96% de los casos. En 3 pacientes el dispositivo no quedó satisfactoriamente implantado, precisando su retirada quirúrgica. Se observó presencia de cortocircuito residual en 20 pacientes (27%), persistiendo en apenas 3 (4%); tras el seguimiento de 12 meses hubo complicaciones mayores en 2 pacientes (taponamiento pericárdico causado por el asta del dispositivo y formación de trombo en aurícula derecha). Complicaciones menores ocurrieron en 5 pacientes, sin repercusión clínica importante. En otro estudio (32), la tasa de éxito fue de 93%, con falla en una CIA grande, en la cual fue necesario intervención quirúrgica para retirar la prótesis. Los defectos residuales fueron clasificados según Boutin y col. (33) (Cuadro 2).
El Cuadro 3 muestra un resumen de los principales estudios hechos con la prótesis tipo Angel Wing.
Clasificación de los cortocircuitos residuales después implante de prótesis para oclusión de CIA por vía percutánea, según Boutin y col. (33)
| Medida del defecto residual | Diámetro del defecto residual por Doppler |
| Ausente | Sin flujo |
| Mínimo | 1 mm |
| Discreto | > 1 mm y 2 mm |
| Moderado | > 2mm y 4 mm |
| Importante | > 4 mm |
Sistema de oclusión del defecto del septo auricular (prótesis ASDOS)
Características técnicas
La prótesis ASDOS está compuesta por 2 umbrellas separadas, cada una constituida por cinco brazos o hilos de nitinol preformado, cubiertos por una fina capa de poliuretano. Son diseñadas para ser liberadas y unidas por medio de un catéter-guía, que presenta un cono de metal en el medio, actuando como separador y fijador de ambas umbrellas (9,27).
Resumen de los principales estudios utilizando la prótesis Angel Wing
| Estudio | Nº de pacientes | Éxito en el implante | Tiempo de seguimiento | Ausencia de cortocircuitos significativos | Complicaciones |
| Das | 65 | 57(86%) | 6 m | 30(90%)* | 1(1,5%) |
| Mendelsohn | 20 | 19(95%) | 24 m | 19(100%)** | 3(15%) |
| Rickers | 75 | 72(96%) | 1-17 m | 69(96%)** | 8(10,6%) |
| Banerjee | 70 | 65(93%) | 6 m | 60(92,3%)** | _____ |
*Porcentaje en relación al número de pacientes que tuvo seguimiento (32).
**Porcentaje en relación con los pacientes que tuvieron éxito en el implante.
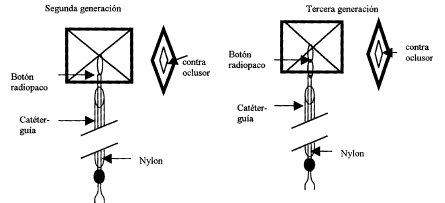
Figura 4. Representación esquemática del dispositivo abotonable de Sideris (adaptado) (35).
RESULTADOS
Descrita por Babic (20) en 1991, existe una pequeña experiencia publicada en la literatura, con resultados semejantes a los de otras prótesis (9). Sin embargo, posee una técnica más complicada, lo que limita su uso. En los pocos estudios realizados, la tasa de éxito fue de 80%, con 60% de cierre inmediato (8). Sin embargo, el cortocircuito residual a los 6 meses fue alrededor de 40%, y el índice de complicaciones severas (como deformación de la prótesis, desconexión del sistema y perforación auricular) varió de 20% (8) hasta 75% (34).
Características técnicas.
La prótesis abotonable (Figura 4) está constituida por 3 componentes (35): el oclusor o "botón", localizado en el lado izquierdo del defecto (aurícula izquierda), que está constituido por una lámina cuadrada de espuma de poliuretano, plegable, soportada por dos brazos independientes, que se cruzan diagonalmente, en forma de X; el contraoclusor u "ojal del botón", colocado paralelamente al oclusor, en el lado derecho del defecto (aurícula derecha), que es "abotonado" por un lazo en situación central al oclusor; y el sistema liberador, formado por un catéter portador de calibre 8-9 french (9,27). Este dispositivo se caracteriza por tener menor rigidez y fuerza que las otras prótesis. El tamaño nominal de cada prótesis, está dado por la longitud del contraoclusor y la longitud diagonal del oclusor (25, 30, 35, 40, 45, 50 mm). Son indicados para las comunicaciones interauriculares tipo fosa oval, con un diámetro de 10 mm o mayor.
Figura 5. Prótesis CardioSEAL.
(disponible en el site www.nmtmedical.com en 25/09/2000).
RESULTADOS
Estudios iniciales con el dispositivo abotonable para oclusión de CIA mostraron una buena eficacia. Lloyd y col., consiguieron la implantación en 50 (88%) de 57 pacientes, con oclusión eficaz en 46 (80%) (19). La prevalencia de cortocircuitos después del procedimiento fue de 65%, disminuyendo a 27% en 5 años (36). Complicaciones precoces que requirieron cirugía de urgencia se presentaron en 4 pacientes, y embolización del dispositivo en otros 3, con extracción percutánea (36). Fue descrita en otro estudio la ocurrencia de insuficiencia mitral por deslizamiento de la prótesis en dirección a la válvula (37).
En un estudio multicéntrico (35) con 200 pacientes, utilizando prótesis hasta la 3ª generación, la tasa de implante fue de 90%, con éxito en el cierre en 166 (92% de los implantes). Después de 12 meses, 97,2% de los pacientes estaban sin cortocircuitos significativos. En 14 pacientes (8%), ocurrió deslocación de la prótesis. Solamente en 4 pacientes fue posible la retirada por vía endovascular.
Recientemente, P. S. Rao y E. B. Sideris (datos no publicados), relataron el uso de prótesis abotonables de 4ª generación en 423 pacientes, con tasa de "desabotonamiento" y embolización de apenas 0,91%. La 4ª generación posee 2 "botones" fijadores, en lugar de 1, lo cual disminuye el "desabotonamiento", relativamente común en las versiones anteriores. Las tasas de oclusión y de reintervención fueron semejantes a las obtenidas con las generaciones anteriores.
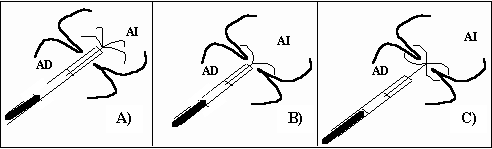
Figura 6. Esquema de implante de la prótesis CardioSEAL (adaptado) (38). AD: aurícula derecha. AI: aurícula izquierda.
Prótesis CardioSEAL (CardioSEAL device)
Características técnicas.
La prótesis CardioSEAL (Figura 5), originada a partir de la versión de la prótesis Clamshell (13), está constituida por dos sistemas funcionales: el sistema oclusor está representado por 2 umbrellas cuadradas, cubiertas por dacrón y unidas una a la otra en el centro. La longitud diagonal de cada umbrella, determina el tamaño de la prótesis que puede ser desde 17 mm, y hasta 40 mm. Las umbrellas, una dirigida a la aurícula izquierda y la otra a la aurícula derecha, están sustentadas por 4 brazos que se irradian desde el centro de la prótesis hasta la periferia de cada umbrella; y a lo largo de cada brazo se encuentran dos espirales liberadores de presión. El sistema liberador transcatéter, comprende un catéter de calibre 8 french, por medio del cual pasan los diversos elementos guías y de liberación, conectado a una asta-control (38,39) (Figura 6).
Esta prótesis se utiliza, fundamentalmente, en las comunicaciones interauriculares tipo fosa oval, con un diámetro no mayor de 20 mm (38). Son contraindicaciones al uso de esta prótesis: pacientes con vasculatura muy pequeña para alojar el sistema liberación, tamaño auricular pequeño, que dificulta la apertura satisfactoria de la prótesis y presencia de trombos intra-auriculares (39).
La prótesis CardioSEAL, se originó a partir de una re-estructuración de la prótesis tipo Clamshell, manteniendo el concepto físico y espacial de la misma, pero disminuyendo la posibilidad de fracturas de los brazos, que representó la complicación más frecuente (39).
Este objetivo fue alcanzado a través de: la constitución de los brazos de soporte por un metal (MP35N) más resistente a la fractura por fatiga y la inclusión de 2 espirales articuladores en cada brazo, que permiten reducir la presión mecánica en áreas críticas de los brazos.
Esta prótesis es derivada de la prótesis Clamshell (Bard Clamshell Septal Occluder), que a su vez, proviene de modificaciones de la prótesis de Rashkind para oclusión del conducto arterioso permeable (Rashkind PDA duble umbrella) (13). Más de 500 pacientes fueron sometidos al implante de este tipo de prótesis entre 1989 y 1991 (40). La tasa de éxito fue de 94%, con una incidencia de complicaciones severas de 6%. El porcentaje de oclusiones completas (sin cortocircuito residual) inmediatamente después del procedimiento y con 3, 6, y 12 meses de evolución fue de 9%, 35%, 47% y 55%, respectivamente (40). Sin embargo, en 1991, la prótesis fue abandonada debido al alto índice de fracturas en uno o más de sus brazos.
RESULTADOS
A partir de 1996, se iniciaron los estudios con la prótesis CardioSEAL. En una serie iniciada en 1997, Latson describió la implantación exitosa en 56 (78%) de 72 pacientes estudiados (16 fueron excluidos por CIA amplia, múltiples defectos, y bandas inadecuadas de tejido alrededor del defecto) (38). De los 56 pacientes, en 54 (96%) el procedimiento tuvo éxito. El cierre completo sin cortocircuito ocurrió en 30% de los pacientes; 5% mostraron cortocircuito de moderado a importante. En una nueva revisión del mismo autor, 86% presentó oclusión completa después de 6 meses, sin embargo 12% tenía fractura de uno de los brazos de la prótesis (38,41).
En 1999 se publicó el desarrollo de una versión de la prótesis CardioSEAL con un mecanismo flexible, auto-centralizador, que utilizaba un introductor menor, y fue llamada prótesis STARFlex (STARFlex occluder) (42). En un estudio utilizando ambas prótesis (Mario Carminati, datos no publicados), fueron incluidos 334 pacientes, con la mayoría de CIA tipo fosa oval (73%). Fue realizada la implantación en 325 pacientes (97,3%). Un cortocircuito residual fue detectado en 41% inmediatamente después del procedimiento, con disminución a 31% en la alta hospitalaria, 24% en 1 mes y 21% en 6 meses. Después de un año la oclusión completa o persistencia de cortocircuito discreto se obtuvo en 92,5% de los pacientes. Embolización precoz de la prótesis ocurrió en 13; en 3 hubo recuperación por vía endovascular y 10 pacientes fueron sometidos a cirugía. Durante el seguimiento, 2 pacientes fueron sometidos a cirugía: uno por mal posicionamiento de la prótesis y otro por embolización tardía. La fractura de brazo de la prótesis se presentó en 6,1% de los casos, sin complicaciones (Cuadro 4).
Conclusiones
A pesar del poco tiempo desde su primera descripción (por King y Mills, en 1976 (11), el uso de prótesis para el cierre de la CIA ha evolucionado considerablemente y hoy aparece como una importante alternativa al tratamiento quirúrgico, todavía considerado como patrón de referencia. A pesar de ser un cuerpo extraño, la prótesis pasa por un proceso de endotelización que elimina la trombogenicidad de la superficie de la prótesis, necesitando sólo terapia antiplaquetaria (ácido acetilsalicílico: 75 a 100 mg/día) por tiempo corto, de 6 - 12 meses. Aun cuando se llegue a formar un trombo, en la mayoría de las veces no tiene repercusión clínica y desaparece en los 6 primeros meses (43). En todos los casos se aplica antibióticoterapia preventiva de la endocarditis infecciosa.
Una complicación presente con todas las prótesis fue la embolización de la misma. Sin embargo, tal situación se debe, en parte, a la curva de aprendizaje con cada dispositivo; y tiende a disminuir con la mayor experiencia en su uso. Además, la utilización de prótesis con capacidad de recuperación del dispositivo y su reposicionamiento por vía endovascular disminuye la incidencia de esta complicación y facilita su manejo.
Resumen de los principales estudios utilizando la prótesis CardioSEAL y STARFlex.
| Estudio | Nº de pacientes | Éxito en el implante | Tiempo de seguimiento | Ausencia de cortocircuitos significativos* | Complicaciones |
| Latson | 56 | 54 (96%) | 6 m | 51 (95%)** | 7 (12%)** |
| Carminatie | 334 | 325 (97%) | 1a | 301 (93%)** | 20 (6%)** |
* ausencia de defecto residual significativo (< 2 mm de diámetro).
** porcentaje en relación con los pacientes que tuvieron éxito en el implante.
e datos no publicados de Mario Carminati.
La oclusión transcatéter mejora los parámetros electrofisiológicos no invasivos en pacientes con CIA de modo más eficaz que el procedimiento quirúrgico (6,34,44), por lo cual las alteraciones del ritmo son mucho menos frecuentes en comparación con el tratamiento quirúrgico.
Cerca del 50% de los pacientes con CIA tipo fosa oval son elegibles para la implantación de prótesis por intervención percutánea. Sin embargo, todavía persisten dudas en cuanto al mejor dispositivo (7). La prótesis ideal debe llenar las características citadas en el Cuadro 5 (27,45). Existen todavía otras variables involucradas, como la experiencia del equipo intervencionista y de ecocardiografía, el tipo de defecto, su tamaño, la localización y el tamaño de los márgenes libres del tabique alrededor del defecto. El número de pacientes incluido en los estudios de cada dispositivo no permite todavía identificar los tipos de defectos que más se adaptarían a una prótesis en particular. Aún precisamos conocer mejor cuales defectos del tabique interauricular deben ser cerrados percutáneamente y cual sería la prótesis más indicada (7).
Características ideales de las prótesis para oclusión de CIA (adaptado de Rocchini y col. (27).
| Durante la oclusión: |
| 1. Introductores pequeños |
| 2. Ajustable y recuperable antes de la liberación |
| 3. Mecanismo flexible de auto-centralización |
| 4. Ajustable a varias topografías del tabique |
| 5. Costo accesible |
| 6. Facilidad de implantación |
| Después de la oclusión sin éxito: |
| 1. Mínimo stress hemodinámico en caso de embolización |
| 2. Facilidad de recuperación después de su liberación |
| Después de la oclusión con éxito: |
| 1. Buen encaje en el tabique con bajo perfil |
| 2. Prótesis cubierta con material que promueva una endotelización completa |
| 3. Integridad confiable hasta total endotelización |
| 4. Mínima sobreposición para proteger estructuras adyacentes |
La prótesis Amplatzer aparentemente muestra algunas ventajas sobre las demás, como introductores de menor calibre, menor tamaño del dispositivo en relación con el defecto, método de implantación de fácil aplicación y menor tiempo de fluoroscopia; además de la facilidad para la recuperación y reposicionamiento por vía endovascular (30,46,47); posee mecanismo de autocentralización (16), y presencia de un núcleo central o cintura, que permanece insertado en el defecto como un stent, dando estabilidad al dispositivo (eliminando la presencia de brazos metálicos, que pueden fracturarse y causar disfunción de la prótesis o perforación de estructuras adyacentes) (8). La tasa de éxito en el implante y la ocurrencia de cortocircuitos residuales son equivalentes al de otras prótesis. La baja ocurrencia de complicaciones, además de las características descritas anteriormente, hacen de esta prótesis la preferida actualmente en los grandes centros.
En algunos pocos estudios comparativos (17,46), la prótesis de Amplatzer se mostró más eficaz que el dispositivo abotonable (Cuadro 6) y que la prótesis Angel Wing, además de requerir un menor tiempo de fluoroscopia.
Comparación de las prótesis de Amplatzer y Sideris en estudio de Walsh y col. (17).
|
| Dispositivo abotonable de Sideris | Amplatzer |
| Tiempo de fluoroscopia | 23,7 min | 13,4 min |
| Número de implantes | 28/33 | 37/39 |
| Oclusión completa con: |
|
|
| 1 mes | 37% | 89% |
| 3-6 meses | 44% | 92% |
| 1 año | 44% | 93% |
Todavía es difícil responder cual es el mejor tratamiento: si el quirúrgico o intervención percutánea. La mortalidad en el tratamiento quirúrgico disminuyó bastante; sin embargo, la morbilidad todavía está presente, con mayor tiempo de internación (26), además de mayor tiempo de restricción física y persistencia de cicatriz quirúrgica por el resto de la vida del paciente (9). También debe mencionarse la menor ocurrencia de arritmias después de la corrección de CIA con prótesis, tanto a corto como a largo plazo (6,48,49). Sin embargo, el tratamiento quirúrgico ya está bien establecido, con una experiencia de casi 50 años (6), y todavía es el único tratamiento posible para defectos muy grandes o próximos a las válvulas auriculoventriculares, al seno coronario y a las venas cavas superior e inferior. En un estudio comparativo entre la oclusión percutánea utilizando la prótesis de Amplatzer y el tratamiento quirúrgico (15), las tasas de oclusión fueron idénticas, y las complicaciones con los dos métodos, comparables, siendo un poco mayor con la solución quirúrgica (Cuadro 7); presentando menor morbilidad y tiempo de internación para el procedimiento percutáneo (media, 3 días contra 8 días).
Comparación de las complicaciones de la oclusión de CIA por cirugía y por vía transcatéter con prótesis de Amplatzer, según estudio de Berger y col. (15)
|
| Cirugía (n = 61) | Amplatzer (n = 61) |
| Flutter auricular | 5 | 2 |
| Fibrilación auricular | 2 | 0 |
| Cortocircuito residual > 48h | 1 | 1 |
| Taquicardia ventricular sustentada intermitente | 0 | 1 |
| Derrame pericárdico | 2 | 0 |
| Infección de herida operatoria | 1 | 0 |
| Perforación de úlcera duodenal | 1 | 0 |
| Embolia de la prótesis | 0 | 1 |
El factor costo es difícil de ser analizado, pues varios estudios internacionales no se refieren al valor de las prótesis; muchas veces porque las mismas son provistas por los fabricantes a precios especiales para investigación (46). Con seguridad, estos costos hoy todavía son elevados, aunque con la utilización en mayor escala de los dispositivos de cierre no quirúrgico los precios deben disminuir.
Con su baja incidencia de complicaciones, altas tasas de éxito y poca morbilidad, la intervención percutánea es hoy un tratamiento muy promisorio. Con el desarrollo de nuevas prótesis y el perfeccionamiento de las ya existentes, debe aumentar su espectro de indicaciones; y en un futuro próximo puede llegar a ser la terapéutica de elección para corrección de las comunicaciones interauriculares.
REFERENCIAS
1. Lorga AM, Jacob JLB, Garzon SAC. Comunicação Interatrial. En: Macruz R, Snitcowsky R, editores. Cardiología Pediátrica. 1ª edición. São Paulo: Edit. Sarvier; 1983.p.296-314. [ Links ]
2. Friedman W. Comunicación interauricular. En: Braunwald E, editor. Tratado de Cardiología. 5ª edición. vol I. México: Edit. McGraw-Hill Interamericana; 1999.p.974-981. [ Links ]
3. De la Cruz MV, Muñoz Armas S, Muñoz Castellanos L. Development of the chick heart. Baltimore: The Jonhs Hopkins University Press; 1972. [ Links ]
4. De la Cruz MV, Cayre R. Desarrollo embriológico del corazón y de las grandes arterias. En: Sánchez PA, editor. Cardiología Pediátrica Clínica y Cirugía. Vol I. Barcelona: Editorial Salvat; 1986.p.10-18. [ Links ]
5. Ikari NM, Ebaid M. Considerações clínicas sobre intervenção hemodinâmica e cirurgia cardíaca: como optar? Rev Soc Cardiol Estado de São Paulo 1999;9(5):749-756. [ Links ]
6. Meijboom F, Hess J, Szatmari A. Long-term follow-up (9 to 20 years) after surgical closure of atrial septal defect at a young age. Am J Cardiol 1993;72:1431-1432. [ Links ]
7. Magee AG, Qureshi AS. Closure of atrial septal defects by transcatheter devices. Pediatr Cardiol 1997;18:326-327. [ Links ]
8. Fontes VF, Pedra CAC, Fontes-Pedra SRF. Experiência inicial no fechamento percutâneo da comunicação interatrial com a prótese de Amplatzer. Arq Bras Cardiol 1998;70(3):147-153. [ Links ]
9. Latson LA, OLaughlin MP, Rao PS. Per-catheter ASD closure. Pediatr Cardiol 1998;19:86-94. [ Links ]
10. Rashkind WJ, Miller WW. Creation of an atrial septal defect without thoracotomy: A palliative approach to complete transposition of great vessels. J Am Med Ass 1966;196:991-992. [ Links ]
11. King TD, Mills NL. Secundum atrial septal defects: Non operative closure during cardiac catheterization. J Am Med Ass 1976;235:2506-2509. [ Links ]
12. Rashkind WJ. Transcatheter treatment of congenital heart disease. Circulation 1983;67:711-716. [ Links ]
13. Lock JE, Rome JJ, Davis R. Transcatheter closure of atrial septal defects: Experimental studies. Circulation 1989;79:1091-1099. [ Links ]
14. Rome JJ, Keane JF, Perry SB, Spevak PJ, Lock JE. Double umbrella closure of atrial septal defects. Initial clinical aplications. Circulation 1990;82:751-758. [ Links ]
15. Berger F, Vogel M, Alexi-Meskishvili V, Lange PE. Comparison of results and complications of surgical and Amplatzer device closure of atrial septal defects. J Thorac Cardiovasc Surg 1999;118:674-679. [ Links ]
16. Sharafuddin MJ, Gu X, Titus JL. Transvenous closure of secundum atrial septal defects: Preliminary results with a new self-expanding nitinol prosthesis in a swine model. Circulation 1997;95(8):2162-2168. [ Links ]
17. Walsh KP, Tofeig M, Kitchiner DJ. Comparison of the Sideris and Amplatzer septal occlusion devices. Am J Cardiol 1999;83:933-936. [ Links ]
18. Hausdorf G, Schneider M. Transcatheter closure of secundum atrial septal defects with the atrial septal defect occlusion system: Initial experience in children. Heart 1996;75:83-88. [ Links ]
19. Lloyd TR, Rao PS, Beekman III RH. Atrial septal defect occlusion with the buttoned device (a multi- institutional U.S. trial). Am J Cardiol 1994;73:286-291. [ Links ]
20. Babic UU. Double-umbrella device for transvenous closure of patent ductus arteriosus and atrial septal defects. First experience. J Intervent Cardiol 1991;4:283-294. [ Links ]
21. Wilkinson JL, Goh TH. Early clinical experience with the use of the Amplatzer septal occluder device for atrial septal defect. Cardiol Young 1998;8:295-302. [ Links ]
22. Thanopoulos BD,Laskari CV, Tsaousis GS. Closure of atrial septal defects with the Amplatzer occlusion device: Preliminary results. J Am Coll Cardiol 1998;31:1110-1116. [ Links ]
23. Cao QL, Radtke W, Berger F. Transcatheter closure of multiple atrial septal defects: Initial results and value of two and three-dimensional transesophageal echocardiography. Eur Heart J 2000;21:941-947. [ Links ]
24. Fontes-Pedra SRF, Pedra CAC, Assef JE, Fontes VF. Fechamento percutâneo da comunicação interatrial. Papel da ecocardiografia. Arq Bras Cardiol 1999;72(1):59-64. [ Links ]
25. Pedra CAC, Fontes-Pedra SRF, Esteves CA. Multiple atrial septal defects and patent ductus arteriosus: Successful outcome using two amplatzer (TM) septal occluders and gianturco coils. Catheterization and Cardiovascular Diagnosis 1998;45:257-259. [ Links ]
26. Mendelsohn AM, Banerjee A, Schwartz DC, Das GS. Transcatheter atrial septal defect closure with the Das Angel Wings transcatheter ASD occlusion device: The Cincinnati-Rochester experience. J Interv Cardiol 1998;11(5):495-500. [ Links ]
27. Rocchini A, Lock JE. Defect closure: Umbrella devices. En: Lock JE, editor. Diagnostic and interventional catheterization in congenital heart disease. 2ª edición. Cincinnati: Edit Kluwer Academic Publishers; 2000.p.179-198. [ Links ]
28. Das GS, Voss G, Jarvis G, Wyche K, Gunther R, Wilson R. Experimental atrial septal defect closure with a new, transcatheter, self-centering device. Circulation, 1993;88:1754-1764. [ Links ]
29. Das GS, Shrivastava S, OLaughlin MP. Intermediate term follow-up of patients after percutaneous closure of atrial septal defects with the Das Angel Wings device. Circulation 1996;94:56-62. [ Links ]
30. Das GS, Hizaji Z, OLaughlin MP. Initial results of the PFO/ASD closure trial. J Am Coll Cardiol 1996;27:119-123. [ Links ]
31. Rickers C, Hamm C, Stern H. Percutaneous closure of secundum atrial septal defect with a new self centering device ("angel wing"). Heart 1998;80:517-521. [ Links ]
32. Bernajee A, Bengur Ar, Li JS. Echocardiographic characteristics of successfull deployment of the Das Angel Wings atrial septal defect closure device: Initial multicenter experience in the United States. Am J Cardiol 1999;83:1236-1241. [ Links ]
33. Boutin C, Musewe NN, Smallhorn JF. Echocardiographic follow-up of atrial septal defect after catheter closure by double-umbrella device. Circulation 1993;88:621-627. [ Links ]
34. Bohm J, Bittigan K, Kohler F. Surgical removal of atrial septal defect occlusion system-devices. Eur J Card Thorac Surg 1997;12:869-872. [ Links ]
35. Rao PS, Sideris Eb, Hausdorf G. International experience with secundum atrial septal occlusion by buttoned device. Am Heart J 1994;128:1022-1035. [ Links ]
36. Zamora R, Rao PS, Lloyd TR. Intermediate-Term results of phase I food and drug administration trials of buttoned device occlusion of secundum atrial septal defects. J Am Coll Cardiol 1998;31:674-676. [ Links ]
37. Gildein HP, Dabritz S, Geibel A. Transcatheter closure of atrial septal defects by the "buttoned" device: Complications and need for surgical revision. Pediatr Cardiol 1997;18:328-331. [ Links ]
38. Latson LA. The cardioseal device: History, techniques, results. J Interv Cardiol 1998;11(5):501-505. [ Links ]
39. The Cardio SEAL Septal Occluder System. Device descripion and instructions for use. Appendix B. Editora: Nitinol Medical; Boston 1998 [ Links ]
40. Prieto LR, Foreman CK, Cheatham JP, Latson LA. Intermediate-term outcome of transcatheter secundum atrial septal defect closure using the bard clamshell septal umbrella. Am J Cardiol 1996;78:344-346. [ Links ]
41. Kaulitz R, Paul T, Hausdorf G. Extending the limits of transcatheter closure of atrial septal defects with the double umbrella device (CardioSEAL). Heart 1998;80:54-59. [ Links ]
42. Hausdorf G, Kaulitz R, Paul T. Transcatheter closure of atrial septal defect with a new flexible, self-centering device (the STARFlex Occluder). Am J Cardiol 1999;84:1113-1116. [ Links ]
43. Rosee KL, Deutsch HJ, Schnabel P. Thrombus formation after transcatheter closure atrial septal defect. Am J Cardiol 1999;84:356-359. [ Links ]
44. Bolens M, Friedli B. Sinus node function and conduction system before and after surgery for secundum atrial septal defect: An electrophysiologic study. Am J Cardiol 1984;53:1415-1420. [ Links ]
45. Masura J, Lange PE, Wilkinson JL. US/International multicenter trial of atrial septal catheter closure using the Amplatzer septal occluder. Initial results. J Am Coll Cardiol 1998;45:57-59. [ Links ]
46. Formigari R, Santoro G, Rossetti L. Comparision of three different atrial septal defect occlusion devices (brief report). Am J Cardiol 1998;82:690-692. [ Links ]
47. Rao PS. Transcatheter closure of trial septal defect: Are we there yet? J Am Coll Cardiol 1998;31:1117-1119. [ Links ]
48. Ferreira SM, Ho SY, Anderson RH. Morphological study of defects of the atrial septum with the oval fossa: Implications for transcatheter closure of left-to-right shunt. Br Heart J 1992;67;316-320. [ Links ]
49. Bjornstad PG. The role of devices in the closure of atrial septal defects in the oval fossa (editoral comment). Cardiol Young 1998;8:285-286. [ Links ]
viene de la pág 18.
Sociedad Venezolana de Medicina Familiar
Dirección:
Avda. José Ma. Vargas, Torre Colegio de Médicos, piso 2 Ofic. 2-E-2 Urb. Santa Fe Norte.
Sociedad Venezolana de Medicina Física y Rehabilitación
Dirección:
Avda. José Ma. Vargas, Torre Colegio de Médicos, Piso 2, Urb. Santa Fe Norte.
Sociedad Venezolana de Médicos Higienistas
Dirección:
Centro Simón Bolívar, Edf. Sur, piso 8, Ofc. 826
Sociedad Venezolana de Medicina Interna
Dirección:
Avda. José Ma. Vargas, Torre Colegio de Médicos, Urb. Santa Fe Norte.
Sociedad Venezolana de Microbiología
Dirección:
Ciudad Universitaria, Instituto de Medicina Tropical, Cátedra de Microbiología, Salón 120.
Sociedad Venezolana de Neurología
Dirección:
Avda. El Golf. Qta. Setenta y seis, Urb. El Bosque
Sociedad Venezolana de Nutrición
Dirección:
Avda. Los Samanes, Centro Clínico Nutricional Menca de Leoni, Urb. Nuevo Prado. El Cementerio.
Sociedad de Obstetricia y Ginecología de Venezuela
Dirección:
Maternidad Concepción Palacios, PB.
Sociedad Venezolana de Oftalmología
Dirección:
Centro Empresarial Los Ruices, Ofc. 507.
Sociedad Venezolana de Oncología
Dirección:
Avda. José Ma. Vargas, Torre Colegio de Médicos, Ofic. C Piso 2, Urb. Santa Fe Norte.
Sociedad Venezolana de Otorrinolaringología
Dirección:
Avda. El Golf. Qta. Setenta y seis, Urb. El Bosque.
Sociedad Venezolana de Psiquiatría
Dirección:
Avda. El Golf. Qta. Setenta y seis, Urb. El Bosque.