Interciencia
versión impresa ISSN 0378-1844
INCI v.27 n.3 Caracas mar. 2002
0378-1844/02/03/104-06
Recibido: 04/09/2001. Modificado: 13/11/2001. Aceptado: 20/12/2001
EFECTO TÓXICO DEL CADMIO SOBRE MICROALGAS AISLADAS
DEL NORORIENTE DE VENEZUELA
Yollys Romero, César Lodeiros, Mercedes Esclapés, Nellys Marín, Miguel Guevara y Ever Morales
PALABRAS CLAVES / Cadmio / Microalga / Xenobiotico / Contaminación / Metales Pesados /
Yollys Romero. Licenciada en Biología, Universidad de Oriente (UDO). Laboratorio de Acuicultura, Departamento de Biología Pesquera, Instituto Oceanográfico de Venezuela (IOV-UDO).
César Lodeiros. Ph.D. en Ecología Aplicada, Universidad Laval, Canada. Profesor Asociado, Departamento de Biología Pesquera, IOV-UDO. Dirección: Instituto Oceanográfico de Venezuela, Cumaná 6101, Venezuela. e-mail: clodeiro@sucre.udo.edu.ve
Mercedes Esclapés. M.Sc. en Ecología Acuática, University of Maryland, EEUU. Especialista, Departamento de Ecología y Ambiente, INTEVEP, PDVSA.
Nellys Marín. Master en Ciencias Marinas, UDO. Biólogo jubilado, IOV-UDO.
Miguel Guevara. Master en Ciencias Marinas, UDO. Investigador, IOV-UDO.
Ever Morales. Doctor en Ciencias Biológicas, Universidad de Santiago de Compostela, España. Profesor Titular, Departamento de Biología, Facultad de Ciencias, Universidad del Zulia, Venezuela.
Resumen
Se evaluó el efecto tóxico del cadmio en dos especies de microalgas, Chaetoceros sp. (A1) y Tetraselmis sp. (G1), aisladas en el nororiente de Venezuela. Un primer experimento consistió en exponer cultivos de las microalgas, en fase logarítmica de crecimiento, a diferentes concentraciones de Cd (0; 0,01; 0,05; 0,1; 5; 10; 50 y 100mg/l) durante 96h, para determinar el efecto tóxico mediante un recuento celular cada 12h. En otro experimento se evaluó el efecto tóxico mediante la inoculación de las microalgas en medios sin y con Cd a una concentración subletal de 0,05mg/l durante 14 días; en este caso, además del recuento celular se determinaron índices fisiológicos (volumen celular, componentes bioquímicos y concentración de pigmentos) en tres fases del crecimiento de los cultivos. El primer experimento mostró que los valores de la dosis letal al 50% de la población fueron de 0,63 y 0,56mg/l para Tetraselmis sp. (G1) y Chaetoceros sp. (A1), respectivamente. En el biensayo de exposición al Cd durante 14 días, en ambas especies se observó una disminución del crecimiento y de los pigmentos, así como un aumento del volumen celular. Los componentes bioquímicos, en ambas especies, se mantuvieron, en general, constantes en las fases de crecimiento, en contraste con sus respectivos controles, que mostraron un aumento progresivo. Se evidenció que Chaetoceros sp. (A1) fue la especie más afectada fisiológicamente, siendo la más sensible al contaminante. Los resultados obtenidos permiten sugerir que el Cd tiene un efecto negativo en el fitoplancton, proponiéndose el empleo de las microalgas como especies modelos para estudios ecotoxicológicos en el nororiente de Venezuela.
Summary
Lethal and sublethal effects of cadmium were studied on two species of microalgae, Chaetoceros sp. (A1) and Tetraselmis sp. (G1), isolated in the northeastern region of Venezuela. In a first experiment, microalgal cultures in logarithmic growth phase were exposed to different concentrations of Cd (0; 0.01; 0.05; 0.1; 5; 10; 50 and 100 mg/l) for 96 hours, determining the toxic effects through cell counts every 12 hours. In another experiment toxic effects were evaluated by microalgae inoculation in media with and without Cd in sublethal concentration of 0.05mg/l for 14 days; cell counts and physiological indicators (cellular volume, biochemical components and pigment concentration) were evaluated in three growth phases of the cultures. The lethal doses (50% of the cultivated population) were 0.63 and 0.56mg/L for Tetraselmis sp. (G1) and Chaetoceros sp. (A1), respectively. Sublethal Cd concentration produced in both algae a decrease in growth and in pigments, and an increase of cell volume. Biochemical components in both species generally remained constant during the growth phases, in contrast with their respective controls, which showed a progressive increase. The study showed that Chaetoceros sp. (A1) was the most affected species physiologically, being the most sensitive one to the contaminant. The results of the study allow us to suggest that Cd has a negative effect on phytoplankton, and to recommend microalgae as model species for ecotoxicological studies in northeastern Venezuela.
Resumo
Foi avaliado o efeito tóxico do cadmio em duas espécies de microalgas, Chaetoceros sp. (A1) e Tetraselmis sp. (G1), isoladas no norte oriente da Venezuela. Um primeiro experimento consistiu em expor cultivos das microalgas, em fase logarítmica de crescimento, a diferentes concentrações de Cd (0; 0,01; 0,05; 0,1; 5; 10; 50 e 100 mg/l) durante 96h, para determinar o efeito tóxico mediante um reconto celular cada 12h. Em outro experimento se avaliou o efeito tóxico mediante à inoculação das microalgas em meios sem e com Cd a uma concentração subletal de 0,05mg/l durante 14 dias; neste caso, além do reconto celular se determinaram índices fisiológicos (volume celular, componentes bioquímicos e concentração de pigmentos) em três fases do crescimento dos cultivos. O primeiro experimento mostrou que os valores da dose letal ao 50% da população foram de 0,63 e 0,56mg/l para Tetraselmis sp. (G1) e Chaetoceros sp. (A1), respectivamente. No experimento de exposição ao Cd durante 14 dias, em ambas espécies se observou uma diminuição do crescimento e dos pigmentos, assim como um aumento do volume celular. Os componentes bioquímicos, em ambas espécies, se mantiveram, em geral, constantes em ambas espécies nas fases de crescimento, em contraste com seus respectivos controles, que mostraram um aumento progressivo. Foi evidenciado que Chaetoceros sp. (A1) foi a espécie mais afetada fisiologicamente, sendo a mais sensível ao contaminante. Os resultados obtidos permitem sugerir que o Cd tem um efeito negativo no fitoplancton, propondo-se o emprego das microalgas como espécies modelos para estudos ecotoxicológicos no norte oriente de Venezuela.
El medio acuático y en especial el marino, es uno de los ambientes más expuestos a los contaminantes, debido a que las descargas, sean por vías terrestres, acuático-terrestres o atmosféricas, tienen al mar como receptáculo final al mar. En estos sistemas acuáticos el principal componente es el fitoplancton, por lo que un cambio, sea cualitativo o cuantitativo podría repercutir drásticamente en el ecosistema (Walsh et al., 1987). De esta manera, las especies de microalgas son consideradas de gran importancia para ser utilizadas en "tests" de toxicidad (Couture et al., 1985; Klaine y Lewis et al., 1994; Nalewajko y Olaveson, 1998).
Muchos metales a concentraciones bajas, juegan un papel esencial en el metabolismo de las microalgas; tal es el caso del Zn y Cu (Tadros et al., 1990); sin embargo, cuando las concentraciones son altas, dan origen a condiciones de contaminación del medio que provocan desbalances metabólicos en el fitoplancton (Rodríguez y Rivera, 1995). Por ejemplo, cuando el fitoplancton es expuesto a concentraciones elevadas del xenobiótico, se produce una inhibición del crecimiento y cambios morfológicos, generados como una respuesta fisiológica a la exposición del metal, que tienen como consecuencia una menor capacidad de respuesta de las poblaciones al ambiente (Sunda y Lewis, 1978; Rand y Petrocelli, 1985; Walsh et al., 1987; Visviki y Rachlin, 1994).
El Cd es un elemento no necesario para el normal desarrollo de los organismos. Su emisión global hacia el medio ambiente proviene en su mayor parte de fuentes antropógenas, estando asociado a la explotación del Zn y a desechos de la industria de plásticos, pinturas, aleaciones metálicas y otras operaciones industriales. Este escenario, junto con la alta demanda en productos de confección artificial en nuestra sociedad sugieren al Cd como un contaminante importante en los ecosistemas costeros marinos. El principal problema es su no biodegradabilidad, por lo que la captación por el fitoplancton puede ser de gran significación ecológica (Jennings y Rainbow, 1978). Por ello, estudios relacionados con el efecto de este metal sobre las microalgas podrían aportar información importante al área de ecotoxicología. El presente trabajo evalúa el efecto tóxico del Cd sobre dos especies de microalgas aisladas del fitoplancton de aguas del nororiente de Venezuela.
Materiales y Métodos
Las microalgas utilizadas corresponden a dos cepas autóctonas del nororiente de Venezuela, Tetraselmis sp. (G1) y Chaetoceros sp. (A1), aisladas de aguas costeras del Golfo de Cariaco y del canal de entrada a las salinas de Araya, respectivamente. Estas especies pertenecen al cepario de microalgas del Laboratorio de Acuicultura del Instituto Oceanográfico de Venezuela de la Universidad de Oriente (IOV-UDO) y ambas son utilizadas como alimento en el cultivo de invertebrados (Marín et al., 1994; Nuñez 2000).
Para los experimentos, las microalgas fueron cultivadas en el medio f/2 de Guillard (1974) bajo condiciones controladas de temperatura (25 ±1°C), iluminación continua (2000 lux) y salinidad de 3,6%. Para determinar el efecto letal del cadmio [(CHCOO)2Cd H2O], se expusieron por triplicado 50ml de cultivos de las microalgas en fase de crecimiento logarítmico, a una serie de concentraciones determinadas en escala logarítmica e intercalando concentraciones medias entre los valores logarítmicos (0; 0,01; 0,05; 0,1; 5; 10; 50 y 100mg/l). Para cada una de las microalgas, un cultivo monoalgal aclimatado (condiciones de laboratorio) sirvió para obtener inóculos, en función de realizar cultivos por triplicado de 800ml en matraces de 1l. Cuando los cultivos alcanzaron la fase logarítmica de crecimiento (4-5 días de cultivo), se extrajo una alícuota de 50ml para cada concentración del tóxico y se distribuyeron en matraces de 100ml, los cuales contenían la solución de exposición respectiva. El experimento tuvo una duración de 96h, y cada 12h se hicieron medidas de recuento celular con la ayuda de una cámara de Neubauer (hematocitómetro). En el recuento, las células sin pigmentación no fueron contabilizadas, considerándose muertas. En función de minimizar el error generado por la variabilidad del número celular de las réplicas, la evaluación se estableció transformando los datos en porcentaje de incremento o decrecimiento celular con respecto a la densidad celular en el tiempo inicial del experimento. Considerando la mortalidad de células antes señalada, la prueba sirvió para determinar la dosis letal del 50% de la población del cultivo (DL50%) y sus límites de confianza al 95%. Estos valores se estimaron utilizando un programa estadístico diseñado para microcomputadora (Stephan, 1977, Esclapés, 1999). A partir de este análisis se seleccionó la concentración que no causó un efecto sobre el crecimiento (0,05mg/l), para realizar un segundo experimento. En esta prueba, el tóxico se adicionó al medio antes de la inoculación de las microalgas, y se determinó el crecimiento y otros índices fisiológicos al cabo de un período de 14 días. Estas mismas evaluaciones fueron determinadas, a manera de comparación, en un medio de cultivo bajo las mismas condiciones, pero sin el tóxico (control). Todos los tratamientos fueron establecidos por triplicado.
El crecimiento se determinó mediante recuento celular diario y el resto de los índices (volumen celular, pigmentos y componentes bioquímicos) fueron determinados en tres fases del crecimiento, representativas de las fases exponencial (I), post-exponencial (II) y estacionaria (III) en cultivo normal, por lo que las observaciones se realizaron a los 4, 8 y 14 días, respectivamente.
Con la ayuda de un microscopio y a partir de un pequeño alícuota del cultivo, se determinaron longitudes de las células con ocular micrométrico (>30 células en cada réplica) a una magnificación de 400X, lo cual permitió estimar su volumen celular considerando la forma elipsoidal del género Tetraselmis y cilíndrica de Chaetoceros, según las recomendaciones de Chislienko (1968).
Para la determinación de los pigmentos y los componentes bioquímicos (proteínas y carbohidratos), una alícuota de 10ml del cultivo se filtró con la ayuda de un equipo Millipore de filtración al vacío, reteniendo las muestras en filtros Whatman GFF (0,7µm de diámetro de poro). La determinación de la concentración de pigmentos se realizó siguiendo la metodología en Strickland y Parsons (1972), la concentración de proteínas se estimó por el método de Lowry et al. (1951), utilizando suero bovino para la calibración estándar, y los carbohidratos por el método de fenol-ácido según Dubois et al. (1956).
Para la evaluación de los parámetros determinados, se realizó un análisis de varianza de tres factores, siguiendo las recomendaciones en Zar (1984) y considerando el tipo de alga, la fase de crecimiento y la concentración de Cd como factores.
Resultados
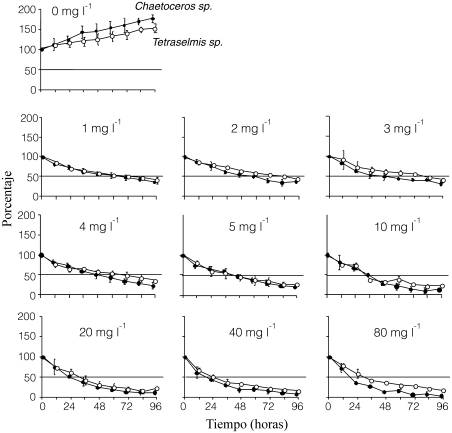
Los niveles de mortalidad con respecto a la densidad celular al comienzo del experimento (porcentaje de densidad celular inicial) en ambas microalgas disminuyeron al aumentar las concentraciones de Cd, siendo mayores los efectos ocurridos antes de las 24h (Figura 1). Posteriormente, las densidades celulares tendieron a mantenerse constantes, siendo este comportamiento más evidente en las concentraciones menores del xenobiótico (1 a 3mg/l). Chaetoceros sp. (A1) a pesar de presentar mayor tasa de crecimiento en los cultivos controles (sin tóxico). Se determinó una mayor sensibilidad, ya que el porcentaje de densidad celular inicial fue siempre menor que los de Tetraselmis sp. (G1).
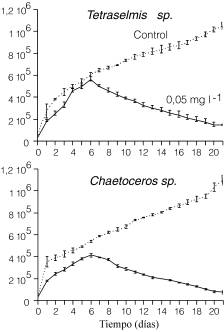
La DL 50% del tóxico a las 96h fue de 0,63 y 0,56mg/l para Tetraselmis sp. (G1) y Chaetoceros sp. (A1), respectivamente. Estas dosis mostraron intérvalos inferiores del límite de confianza al 95% de 0,31 y 0,17, lo cual sustentó la selección de una concentración de exposición menor para el experimento de mayor duración, eligiéndose la concentración de 0,05mg/l. En este experimento, la microalga Chaetoceros sp. (A1), a pesar de tener mayor tasa de crecimiento (comparar cultivos controles en Figura 2) que Tetraselmis sp. (G1), resultó ser más sensible a la exposición al Cd, observándose que los mayores efectos del tóxico se produjeron a partir del sexto día del experimento.
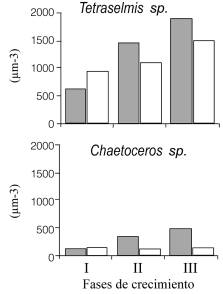
Ambas especies mostraron un aumento del volumen celular cuando fueron expuestos al Cd (Figura 3). Tetraselmis sp. (G1) presentó un aumento del volumen en ambos cultivos con las fases de crecimiento, siendo los expuestos al tóxico los que alcanzaron mayores volúmenes en comparación con los controles. Los mayores volúmenes alcanzados en la fase III fue de 1900µm3 para el tratamiento con tóxico y de 1523µm3 para el tratamiento sin tóxico. El volumen celular de Chaetoceros sp. (A1) aumentó sólo en los cultivos expuestos al tóxico en el transcurso de las fases, alcanzando valores de 515µm3 en la fase III. Los cultivos controles no mostraron variaciones en el volumen celular en ninguna de las fases de crecimiento, obteniendo valores promedios de unos 180µm3.
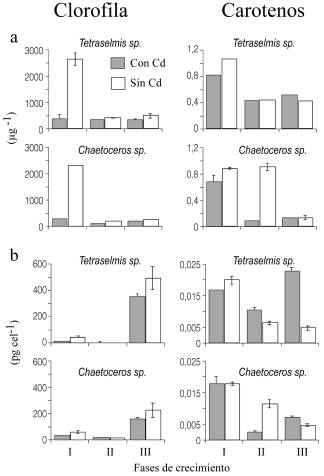
En los cultivos de ambas especies, tanto las concentraciones de clorofila a como carotenos totales, revelaron diferencias significativas (ANOVA, P<0,001) entre los tratamientos de las fases, algas y tóxico, con interacciones entre dichos factores, como consecuencia de la variabilidad de respuestas de las algas al tóxico en las diferentes fases de crecimiento. Los resultados de clorofila a mostraron un comportamiento similar en las fases de crecimiento para ambas microalgas (Figura 4a). En la primera fase existió una notable diferencia entre el control y el cultivo con el tóxico, siendo la concentración de clorofila a superior en un 400% en el cultivo sin tóxico. Para la segunda y tercera fase, la concentración de clorofila a disminuyó con respecto a la primera en el control; no obstante, en los tratamientos con el tóxico en Tetraselmis sp. (G1) este pigmento se mantuvo prácticamente constante y en Chaetoceros sp. (A1) disminuyó. Una tendencia contraria fue evidenciada en la concentración de clorofila a a nivel celular (Figura 4b). En este caso, las mayores concentraciones se establecieron en la fase III. En general, el contenido de clorofila a fue mayor en el control, aunque la diferencia entre las algas con y sin tóxico fue de una magnitud menor (generalmente <100%) a la registrada en la concentración de clorofila a en el cultivo. En la Figura 4a también se observa que la concentración de carotenos en Tetraselmis sp. es mayor en la fase I, siendo los valores del pigmento mayores para el tratamiento sin tóxico; luego en la fase II la concentración del pigmento disminuyó y se mantuvo igual en ambos tratamientos (con y sin tóxico), con un ligero aumento con el tóxico en la fase III. En Chaetoceros sp. (A1), la respuesta en la fase I fue similar a la señalada con Tetraselmis sp. (G1); sin embargo, en la fase II existió una marcada disminución de la concentración de carotenos en los cultivos con el tóxico. Las concentraciones de carotenos totales en las células muestran una misma tendencia que la concentración en el cultivo, excepto para el alga Tetraselmis sp. en las fases II y III, donde se observa un aumento notable en la concentración del pigmento en los cultivos con tóxico (Figura 4b).
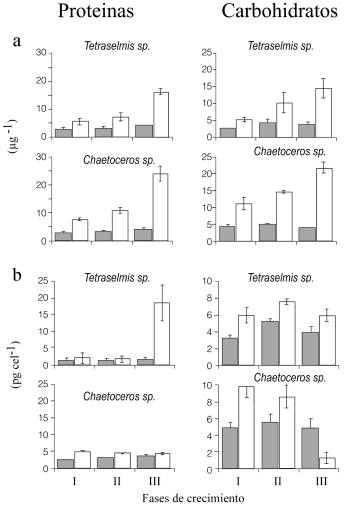
Para las proteínas, los análisis de varianza revelaron diferencias altamente significativas (ANOVA, P<0,001) entre los factores, excepto entre las algas. Se observó un aumento del contenido proteico a medida que transcurrían las fases de crecimiento, produciéndose interacciones entre los factores, debido a los diferentes comportamientos expresados como una respuesta ante el medio.
Ambas microalgas mostraron la misma tendencia en todas las fases de crecimiento, con un aumento de las concentraciones de proteínas por volumen en el transcurso de las fases en los cultivos controles, siendo Chaetoceros sp. (A1) la que presentó los valores mas altos de proteínas: 7,77 a 24,34µg/ml y de 5,05 hasta 4,35pg/cel, exceptuando la última fase de crecimiento, en la cual Tetraselmis sp. (G1) aumentó el contenido de proteínas por células llegando a alcanzar un valor de 16,6pg/cel (Figura 5). Los cultivos con el tóxico no mostraron variaciones notables en el contenido proteico, tanto por volumen como por células entre las fases, manteniendo valores casi constantes, donde los más elevados los presentó igualmente la microalga Chaetoceros sp. (A1), dichos valores oscilaron entre 2,89 y 4,35µg/ml y entre 2,49 y 3,62pg/cel.
En cuanto a los carbohidratos en el cultivo, los análisis de varianza mostraron que sólo existió diferencias significativas (P<0,001) entre las algas; sin embargo, el contenido de carbohidratos a nivel celular mostró variaciones significativas (ANOVA, P<0,001) en todos los factores con interacciones entre ellos, como consecuencia de las diferentes respuestas expresadas por las microalgas ante el tóxico.
En los carbohidratos por volumen (Figura 5a) se produjo un aumento progresivo en los cultivos controles de ambas especies, donde los valores mas altos los presentó la microalga Chaetoceros sp. (A1) de 12,6 hasta 20,75µg/ml, mientras que en los cultivos expuestos al cadmio no hubo variaciones significativas en el contenido de carbohidratos, manteniéndose valores similares en ambas microalgas, 4,35µg/ml para Tetraselmis sp. (G1) y de 4,95µg/ml para Chaetoceros sp. (A1); sin embargo, estos mismos cultivos mostraron variación en el curso de las fases de crecimiento en cuanto a las concentraciones por célula (Figura 5b), observándose los valores más elevados (6,7pg/cel) en Chaetoceros sp. (A1). Esta misma tendencia de variación fue presentada por los controles, donde Chaetoceros sp. (A1) mostró también una mayor cantidad de carbohidratos (9,09 y 8,64pg/cel), para las primeras fases del cultivo y en la fase III disminuye drásticamente; en contraste, Tetraselmis sp. (G1) mantuvo su concentración aproximada a 6,0pg/cel.
Discusión
Los organismos unicelulares, a diferencia de muchos pluricelulares, poseen una capacidad limitada de estrategias fisiológicas para controlar los efectos causados por perturbaciones ambientales. Estas estrategias suelen implicar solamente cambios cuantitativos en algún componente celular, y sólo en casos drásticos se produce un cambio cualitativo en la estructura de la célula o su función (Reiriz et al., 1994).
Entre los parámetros que pueden indicar un efecto tóxico de los agentes contaminantes sobre los organismos, el más estudiado y utilizado es la densidad algal. En ambas microalgas, la exposición a las diferentes concentraciones de Cd durante 96h, revelaron una disminución notable del porcentaje de la densidad celular, relativo al inicio de la exposición al tóxico, siendo Chaetoceros sp. (A1) la que alcanzó los más bajos niveles, a pesar de presentar mayor tasa de crecimiento en los cultivos controles (sin tóxico), lo cual muestra una mayor sensibilidad de esta microalga ante el Cd.
El efecto sobre el crecimiento al cabo de 24h fue menor, la densidad de las algas tuvo una tendencia de mantenerse constante, sobre todo a la exposición de Cd en las concentraciones menores, lo cual sugiere el establecimiento de adaptaciones fisiológicas de las células a las condiciones ambientales, probablemente por mecanismos metabólicos de restricción de la reproducción o división celular. Estos resultados coinciden con los reportados por Sathya y Balakrishnam (1988), quienes mostraron que Chlorela pyrenoidosa, detiene su crecimiento en exposición a 1,3mg/l de Cd, de igual manera Sunda y Lewis (1978) evidencian efectos similares del Cu sobre la tasa de división de Monochysis lutheri.
Silva y Jay (1996) indicaron que las tasas de crecimiento en Chaetoceros sp. y Nitzschia sp., disminuyeron a altas concentraciones de Cu; atribuyendo este evento a la alta afinidad que posee el Cu por los grupos suilfídrilos (SH), los cuales regulan la división celular en los vegetales. De igual manera Reiriz et al. (1994) en un estudio del efecto del Cu en la diatomea Phaeodactylum tricornutum, sugiere una disminución de la incorporación del sílice a las membranas celulares, lo que trae como consecuencia que la división celular se interrumpa. La diferencia de crecimiento con respecto al control, la cual fue notablemente mayor en Chaetoceros sp. (A1) (diatomea), sugiere que posiblemente el Cd pudo haber interferido en el metabolismo a nivel de la membrana celular en una manera similar al Cu.
Un cambio en la morfología celular fue evidenciado en el estudio debido a la exposición del Cd, determinado por un aumento en el volumen celular, particularmente en las fases II y III. El mayor volumen o cambio morfológico de las microalgas cuando son expuestas al Cd también fue reportado por Bolaños et al. (1992), quienes mostraron un notable deterioro y aumento de tamaño de células de la cianobacteria Anabaena sp. después de 96h de exposición a 1,5mg/l de Cd. De igual manera, Stokes et al. (1973) observaron cambios morfológicos de aumento de tamaño en Chlorella sp. y Scenedesmus sp., Stauber y Florence (1987) en la diatomea Nitzschia (Cylimdrotheca) closterium, y Rodríguez y Rivera (1995) en las clorofíceas Tetraselmis suecica y Dunaliella salina, cuando son expuestas a soluciones de Cu. Estas similitudes en cuanto a los efectos del Cd y el Cu, probablemente se deban a la acción de estos metales en actuar a nivel de la membrana citoplasmática, uniéndose a ésta por el carácter de atracción polar produciendo un desacoplamiento en la permeabilidad al K y/o al Cl que provocan un aumento en el volumen celular (Riisgard et al., 1980; Sigg, 1987; Whitfield y Turner, 1987; Visviki y Rachlin, 1994; Rodriguez y Rivera 1995). Observaciones de efectos a nivel molecular, con la utilización de microscopia electrónica, en función de visualizar los efectos del metal en las estructuras celulares tales como organelos citoplasmáticos y membrana celular, conducirían a dilucidar las hipótesis antes señaladas.
La concentración de Cd necesaria para producir una reducción del 50% de la densidad celular inicial (DL50), fue similar en las dos microalgas utilizadas, aunque ligeramente superior en Tetraselmis sp. (G1). Esta mayor tolerancia o resistencia al estrés tóxico de Tetraselmis sp. (G1) probablemente esté relacionado con mecanismos de exclusión o procesos internos de desintoxicación. Se ha demostrado que las microalgas son capaces de efectuar desintoxicaciones internas empleando agentes que quelan a los metales con ligandos orgánicos, secuestrándolos en complejos intracelulares (Sicko-Goad y Stroermer, 1979). Los estudios sobre la acción de proteínas tipo metalotioninas en dichas microalgas podrían contribuir a entender la aparente mayor resistencia en Tetraselmis sp. (G1) que en Chaetoceros sp. (A1).
Otro efecto del Cd podría asociarse a la disminución de la capacidad fotosintética de las microalgas, debido a la disminución significativa de las concentraciones de clorofíla a, principalmente en Chaetoceros sp. (A1). El menor efecto en la disminución de la concentración de la clorofila a nivel celular en Tetraselmis sp. (G1) coincide con la mayor proporción de carotenos de esta microalga, sobre todo en la fase III. Ello evidencia que los carotenos pueden estar actuando como protectores de la fotoxidación de la clorofila, ante un estrés tóxico, tal como ocurre con Dunaliella salina cuando es sometida a estrés ambiental (Marín et al., 1998).
El efecto del tóxico, a nivel celular, fue también evidenciado por el contenido de carbohidratos y proteínas, donde los tratamientos de exposición al Cd, generalmente mostraron las menores concentraciones.
Los resultados indican una evidente influencia del Cd en la condición fisiológica de Chaetoceros sp. (A1) y Tetraselmis sp. (G1), pertenecientes a importantes grupos constituyentes del fitoplancton en ecosistemas marinos (diatomeas y clorofíceas, respectivamente). El efecto negativo que tiene el Cd a bajas concentraciones y largos períodos de exposición en el fitoplancton, sugerido en el presente estudio, conduce a recomendar la realización de evaluaciones de impacto ambiental en la que se incluya su análisis en ecosistemas acuáticos, potencialmente influenciados por actividades industriales o descargas de aguas servidas.
Debido al fácil mantenimiento y manipulación de las especies de microalgas analizadas, la cual es relativamente sencilla en el laboratorio, además de la importancia de estas microalgas en la alimentación de organismos acuáticos (Marín et al. 1994), ambas especies son sugeridas para ser utilizadas en la caracterización de los efectos tóxicos por xenobióticos en ecosistemas marinos. Particularmente se recomienda el empleo de Chaetoceros sp. (A1), debido a que su mayor tasa de crecimiento y su mayor sensibilidad ante la presencia del tóxico en el medio, podría indicar un alerta temprano de las condiciones contaminantes. La certificación de Chaetoceros sp. (A1) como una especie de calidad comprobada para ser utilizada en actividades de acuicultura en el trópico (Núñez, 2000) contribuyen a sustentar su utilización como especie modelo en estudios ecotoxicológicos.
AGRADECIMIENTOS
El estudio fue parcialmente financiado por el Departamento de Biología Pesquera del Instituto Oceanográfico de Venezuela de la Universidad de Oriente, por PDVSA INTEVEP y el FONACYT.fig1
Figura 1. Efecto de la exposición de diferentes concentraciones de Cd sobre la densidad celular de cultivos de las microalgas autóctonas Chaetoceros sp. (A1) y Tetraselmis sp. (G1) en fase de cultivo exponencial.
Figura 2. Crecimiento de las cepas Tetraselmis sp. G1 y Chaetoceros sp. A1, expuestos a 0,05 mg/l de Cd. Control sin Cd.
Figura 3. Volumen celular de las cepas Tetraselmis sp. G1 y Chaetoceros sp. A1, expuestos durante 14 días a 0,05 mg/l de Cd (gris) o sin Cd (blanco).
Figura 4. Concentración de clorofila a y carotenos totales en el cultivo (a) y en la célula (b) de las cepas Tetraselmis sp. G1 y Chaetoceros sp. A1, expuestos durante 14 días a 0,05 mg/l de Cd (gris) o sin Cd (blanco).
Figura 5. Concentración de proteínas y carbohidratos en el cultivo (a) y en la célula (b) de las cepas Tetraselmis sp. G1 y Chaetoceros sp. A1, expuestos durante 14 días a 0,05 mg/l de Cd (gris) o sin Cd (blanco).
REFERENCIAS
Bolaños L, García GM, Mateo P, Bonilla I (1992) Differential toxicological response to cadmium in Anabaena strain PCC 7119 grown with No3 and NH4 as nitrogen source. J. Plant. Physiol. 140: 345-349.
Couture P, Visser SA, Vancoillie R, Blaise C (1985) Algal bioassays their significance in monitoring water quality with respect to nutrients and toxicants. Schweiz. Z. Hydrol. 47:127-158.
Chislienko LL (1968) Nomogramy dlya opredeleniya vesa vodyknorganismo por razmeran porme tela. Leningrado. Izdatelstro. "Nauka". 105 pp.
Dubois M, Guilles J, Reber P, Smith, F (1956) Colorimetric method for determination of sugars and related substances. Anal. Chem. 28: 2350-2356.
Esclapés M (1999) Protocolos estándares para bioensayos de toxicidad con especies acuáticas y terrestres. Versión 2.0. Gerencia General de Tecnología, Departamento de Ecología y Ambiente. INTEVEP. Caracas. 215 pp.
Guillard RL (1974) Culture of phytoplankton for feeding marine invertebrate animals. Prenum Press. New York. 129pp.
Jennings J, Rainbow P (1978) Accumulation of cadmium by Dunaliella tertioleta. Butcher. J. Plank. Res. 191: 67-73.
Klaine SJ, Lewis MA (1994) Algal and plant toxicity testing, En Hofman DJ, Rattner BA, Bourton GA and Cairns J (Eds) Handbook of ecotoxicology. CRC Press. Boca Raton. Chap. 8. [ Links ]
Lowry O, Rosebrough N, Farr A, Randall R (1951) Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193:256-275.
Marín N, Lodeiros C, Verginelli R (1994) Cultivo de Microalgas y el rotífero Brachionus pliacatilis en gran escala. Acta cient. Venez. 45: 226-230.
Marín N, Morales F, Tamigneaux E, Lodeiros C (1998) Effects of nitrate concentrations on the growth and pigment synthesis of a wild strain of Dunaliella salina preadapted to different salinities and cultivated under low illumination. J. Appl. Phycol. 10: 405-411.
Nalewajko C, Olaveson MM (1998) Ecophysiological considerations in microalgal toxicity test. En Wells PG, Lee K and Blaise Ch (Eds). Microscale testing in aquatic toxicity: advances, technical and practice. CRC Press. Boca Raton. pp. 289-309. [ Links ]
Nuñez (2000) Evaluación de dietas de microalgas nativas en la alimentación de larvas del camarón blanco Penaeus vannamei. Trabajo de grado. Escuela de Ciencias. Universidad de Oriente. 43 pp.
Rand G, Petrocelli S (1985) Fundamentals of aquatic toxicology. Hemisphere Publishing Corporation. Washington. 665 pp.
Riisgard HV, Nielsen KN, Sogaard-Jensen B (1980) Further studies on volume regulation and effects of copper in relation to pH and EDTA in the naked marine flagellate Dunaliella marina. Mar. Biol. 56: 267-276.
Reiriz S, Cid A, Torres E, Abalde J, Herrero C (1994) Different responses of the marine diatom Phaeodactylum tricornutum to copper toxicity. Microbiología 10: 263-272.
Rodríguez L, Rivera D (1995) Efecto del cobre y cadmio en el crecimiento de Tetraselmis suecica y Dunaliella salina. Estud. Oceanol. 14: 61-74.
Sathya KS, Balakrishnam KP (1988) Physiology of phytoplankton in relation to metal concentration. Effect of cadmium on Scenedesmus bijugatusand and Nitzschia palea. Water Air. Soil. Poll. 38: 283-297.
Sicko-Goad L, Stoermer EF (1979) A morphometric study of lead and copper effects in Diatoma tenue (Bacillriophyta). J. Phycol. 15: 316-331.
Sigg L (1987) Surface chemical aspects of the distribution and fate of metalions in lakes. En Stumm W (Ed) Aquatic surface chemistry, chemical processes at the particle-water interface. Wiley-Interscience. New York. pp. 319-349. [ Links ]
Silva S, Jay J (1996) Crecimiento de Chaetoceros sp. y Nitzschia sp. en cultivo uni y bialgal a diferentes concentraciones de cobre. Ciencia 4:207-218.
Stauber JL, Florence TM (1987) Mechanism of toxicity of ionic copper and copper complex to algae. Mar. Biol. 94: 511-519.
Stephan CE (1977) Methods for calculating LC50. En Mayer FL, Hamelink JL (Eds) Aquatic Toxicology and hazard evaluation. ASTM SPT 634. American Society for Testing Materials. pp. 65-84. [ Links ]
Stokes PM, Hutchinson TC, Krauter K (1973) Heavy-metal tolerance in algae isolated from contaminated lakes near Sudbury, Ontario. Can. J. Bot. 51: 2155-2168.
Strickland JDA, Parsons TR (1972) Manual of sea water analysis. Bull. Fish. Res. Bd. Canada 125: 310 pp.
Sunda W, Lewis M (1978) Effects of complexation by natural organic ligands on the toxicity of copper on a unicellular algae. Monochysis lutheri. Limn. and Oceanogr. 23: 870-876.
Tadros M, Bulthia P, Smith W (1990) Differential response of marine diatoms to trace metal. Bull. Environ. Contam. Toxicol. 44: 826-831.
Visviki Y, Rachlin W (1994) Acute and chronic exposure of Dunaliella salina and Chlamydomonas bullosa to copper and cadmium: Effects on ultrastructure. Archv. Environ. Contam. Toxicol. 26: 1554-1562.
Walsh G, Yoder M, Laughlin L, Lores E (1987) Responses of marine unicellular algae to brominated organic compound in six growth media. Ecotoxicol. Envir. Safety 14: 215-222.
Whitfield M, Turner DR (1987) The role particles in regulating the composition of sea water. En Stumm W (Ed) Aquatic surface chemistry, chemical processes at the particle-water interface. Wiley-Interscience. New York. pp. 457-493. [ Links ]
Zar JH (1984) Biostatistical analysis. Prentice Hall, Englewoods Cliff, New Jersey. 699 pp.












 uBio
uBio