Interciencia
versión impresa ISSN 0378-1844
INCI v.29 n.2 Caracas feb. 2004
DINÁMICA ENERGÉTICA DEL CRECIMIENTO EN UNA POBLACIÓN DEL MEJILLÓN Modiolus squamosus EN EL GOLFO DE CARIACO, VENEZUELA
Antulio S. Prieto, Lilia J. Ruiz e Hildemar Hernández
Antulio Servio Prieto Arcas. Maestría en Ciencias Marinas, Instituto Oceanográfico de Venezuela (IOV). Profesor, Escuela de Ciencias e IOV, Universidad de Oriente (UDO), Venezuela. Dirección: Departamento de Biología, Escuela de Ciencias, UDO. Apartado 245, Cumaná 1061, Venezuela. e-mail: plica4@yahoo.com
Lilia J. Ruiz. Maestría en Ciencias en Biología Marina, Universidad Nacional Autónoma de México. Profesora, Departamento de Biología, Escuela de Ciencias, UDO. e-mail: liruiz@sucre.udo.edu.ve
Hildemar Hernández. Licenciada en Biología, UDO.
Resumen
Se estudió la producción de gónadas, tejido somático, materia orgánica de la concha y biso en individuos de una población del mejillón Modiolus squamosus en Tocuchare, Golfo de Cariaco, Venezuela, en muestras mensuales recolectadas desde julio 95 hasta julio 96. La biomasa específica de cada componente se evaluó usando ecuaciones mensuales longitud-peso seco, un modelo de crecimiento y el índice gonosomático. Los pesos secos de los tejidos somáticos (ps) y gónada (pg) presentaron valores altos desde febrero hasta agosto y mínimos entre setiembre y enero. La producción somática (Ps), de biso (Pb) y matriz orgánica de la concha (Pc) fueron máximas a los dos años. La producción de gónadas (Pg) evaluada por la pérdida de peso (g) en los tres principales períodos de desove (agosto-setiembre 95, febrero-marzo 96, junio-julio 96) se incrementa con la longitud (Lt, mm) y la edad, desde un valor de 0,10g a un año hasta 1,53g a los 5 años, de acuerdo con la ecuación Pg=1,82·10-7Lt3,58 (r2=0,96; P<0,05). El esfuerzo reproductivo Pg/(Pg+Ps)·100 mostró también un aumento con la edad desde 8% a los 0,5 años. La producción total (P) aumenta con la edad; sin embargo, la relación Producción/Biomasa (P/B) disminuye. Los tejidos somático y gonadal de M. squamosus presentaron un crecimiento estacional, a pesar de desovar varias veces.
Summary
The quantity of biomass produced in gonads, somatic tissue, byssus and shell organic matrix was studied throughout a year (July 95-July 96) in individuals of Modiolus squamosus collected at Tocuchare, Gulf of Cariaco, Venezuela. The specific biomass of each component was evaluated using monthly length-dry weight equation, a model of population growth and the gonosomatic index. The dry weight of somatic and gonadal tissue was maximal from February through August and minimal between September and January. The production of somatic (Ps), byssus tissues (Pb), and organic matrix of shell (Pc) reached a maximum at 2 years of age. Gonad production (Pg) evaluated by weight loss (g) in three principal periods of spawning (August-September 95, February-March 96 and June-July 96) increased with length (Lt, mm) and age, from a value of 0.10g at one year to 1.53g at 5 years of age, according to the equation Pg=1.82·10-7Lt3.58 (r2=0.96; P<0.05). Reproductive effort Pg/(Pg + Ps)·100, showed a progressive increase with age, from 8% at 0.5 years of age. Total production (P) also increased with age; however, the ratio production/biomass (P/B) decreased with age of the population. The gonad and somatic tissue presented a seasonal growth in spite of M. squamosus being a multiple spawner.
Resumo
Estudou-se a produção de gônadas, tecido somático, matéria orgânica da concha e bisso em indivíduos de uma população do mexilhão Modiolus squamosus em Tocuchare, Golfo de Cariaco, Venezuela, em amostras mensais recolhidas desde julho 95 até julho 96. A biomassa específica de cada componente avaliou-se usando equações mensais longitude-peso seco, um modelo de crescimento e o índice gonossomático. Os pesos secos dos tecidos somáticos (ps) e gônada (pg) apresentaram valores altos desde fevereiro até agosto e mínimos entre setembro e janeiro. A produção somática (Ps), de bisso (Pb) e matriz orgânica da concha (Pc) foram máximas aos dois anos. A produção de gônadas (Pg) avaliada pela perda de peso (g) nos três principais períodos de desova (agosto-setembro 95, fevereiro-março 96, junho-julho 96) incrementa-se com a longitude (mm) e a idade, desde um valor de 0,10g a um ano até 1,53g aos 5 anos, de acordo com a equação Pg= 1,82·10-7Lt3,58 (r2= 0,96; P<0,05). O esforço reprodutivo Pg/(Pg+Ps)·100 mostrou também um aumento com a idade desde 8% aos 0,5 anos. A produção total (P) aumenta com a idade; no entanto, a relação Produção/Biomassa (P/B) diminui. Os tecidos somático e gonadal de M. squamosus apresentaram um crescimento estacional, apesar de desovar várias vezes.
PALABRAS CLAVE / Bivalvia / Dinámica Energética / Esfuerzo Reproductivo, Modiolus squamosus / Molusco /
Recibido: 09/09/2003. Modificado: 16/02/2004. Aceptado: 17/02/2004.
El género Modiolus comprende un importante grupo de bivalvos de la familia Mytilidae, de amplia distribución en diferentes ambientes y hábitats marinos. La especie Modiolus modiolus es un mitílido de hábitos intermareales templados, distribuido en costas escocesas (Comely, 1978) y noruegas (Wilborg, 1946), donde por su relativa abundancia es explotado para consumo local. Esa especie, conocida localmente como mejillón de fondo, es de hábitos sublitorales, siendo muy común en algunas localidades del Golfo de Cariaco, donde vive sobre fondos arenosos y fangosos cubiertos por la fanerógama Thalassia testudinum, en una comunidad relativamente compleja en organización (Prieto et al., 1999a). De esta especie se conocen estudios sobre la reproducción (Flores, 1981; Prieto et al., 1999b) así como producción somática poblacional y crecimiento en una localidad del Golfo de Cariaco (Prieto et al., 1985; Pereira et al., 1988).
Los estudios sobre productividad en bivalvos son muy abundantes en especies de zonas templadas (Hughes, 1970; Burke y Mann, 1974; Dare, 1976; Hibbert, 1977; Bayne y Worrall, 1980; Griffiths, 1980; Kautsky, 1982; Thompson, 1984) pero muy escasos en especies de zonas tropicales (Prieto et al., 1985; Tata y Prieto, 1991; Prieto et al., 1999c y Urban, 2000). Los primeros estudios sobre productividad se basaron en estimaciones globales; sin embargo existe una tendencia progresiva a calcular la productividad de cada componente (soma, gónada, concha) en las diferentes clases de edades en bivalvos (MacDonald y Thompson, 1986; MacDonald y Bourne, 1987; Pouvreau et al., 2000). En los estudios de flujo de materia se considera la energía utilizada en el crecimiento y la reproducción, denominada en forma general P, como la variable de mayor importancia cuando se trata de estimar el éxito de una población en el medio ambiente, ya que representa una respuesta integral de cada uno de sus individuos y, además, porque permite, por una parte, evaluar la biomasa disponible hacia otros niveles tróficos o de importancia económica y, por la otra, analizar la distribución específica de la energía dentro de los diferentes grupos de edades de una población.
Hasta el momento no existe en Venezuela información sobre la potencialidad de la producción de biomasa para diferentes tejidos de Modiolus squamosus, por lo que el presente trabajo establece un patrón de distribución de la energía en los compartimientos específicos de la producción de la especie en la población de Tocuchare y evalúa el esfuerzo reproductivo en individuos de diferentes edades.
Materiales y Métodos
Las muestras de Modiolus squamosus se obtuvieron mensualmente desde julio '95 hasta julio 96 en la ensenada de Tocuchare, situada en el Golfo de Cariaco, Estado Sucre a 10º26'40''N y 64º00'50''W (Figura 1). Las características ecológicas de esta área han sido descritas por Prieto (1980). Los ejemplares se recolectaron mediante buceo simple a profundidades de 1 a 5m y se colocaron en contenedores isotérmicos con agua de mar, por un tiempo no menor de 6 horas, a fin de eliminar el exceso de sedimento contenido en el tracto digestivo. Posteriormente se trasladaron al laboratorio donde se congelaron hasta su procesamiento. Cada organismo fue limpiado cuidadosamente de adherencias en la concha y determinada su longitud total (Lt) desde la charnela hasta el borde ventral de la concha con un vernier con apreciación de 0,05mm; luego se separó la masa visceral de las conchas para extraer cuidadosamente de cada mejillón las partes blandas de gónada, tejido somático (músculo, hepatopáncreas, branquias y manto) y biso (este último fue separado desde la porción interior hasta el borde de la concha). Una vez separados cada uno de los componentes, se sometieron a deshidratación en una estufa a 70ºC por 48h, a fin de obtener el peso seco libre de ceniza en una balanza con apreciación de 0,0001g. El contenido de ceniza se obtuvo de una submuestra mensual (n= 8), después de quemar cada componente en una mufla a 450ºC por 8h. El contenido de materia orgánica de la concha (pc) y del biso (pb) se obtuvo introduciendo ambas partes previamente disecadas en una mufla a 450ºC por 2h y obteniendo el peso seco por diferencia (Barker-Jorgensen, 1976).
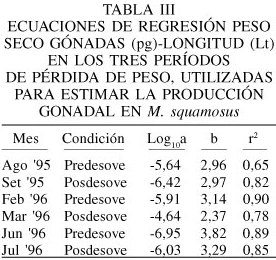
Los valores obtenidos en cada recolecta para los pesos secos del tejido somático (ps), gonadal (pg) y biso (pb) se relacionaron con la longitud total (Lt) de cada bivalvo, ajustándose por la ecuación p= aLtb que fue transformada en una ecuación lineal convirtiendo ambas variables a logaritmo según el modelo Log10p = Log10a + blog10Lt; donde Lt: longitud de la concha (mm), p: peso seco de cada una de las variables, a y b: parámetros de las ecuaciones de regresión que fueron analizadas usando los métodos señalados por Snedecor y Cochram (1972).
Las ecuaciones mensuales del peso seco de cada tejido vs. longitud en los bivalvos se construyeron con un número de individuos que osciló entre 60 y 80, repartidos en todas las tallas de acuerdo con las indicaciones de Crisp (1971), utilizándose luego para predecir los pesos a cada longitud.
La producción total individual (P) se evaluó a partir de la suma de cada uno de los componentes como P= Ps+Pg+Pc+Pb, donde Ps: energía invertida en tejido somático, Pg: energía invertida en la reproducción, Pc: energía invertida en la formación de materia orgánica de la concha, y Pb: energía invertida en la formación del biso. Las estimaciones de Ps, Pc y Pb se obtuvieron por los incrementos de peso entre dos clases de edades sucesivas a intervalos de seis meses (pt+1-pt). La producción de gónadas (Pg) para cada clase de edad se calculó a partir de la pérdida de peso de la gónada predesovada según MacDonald y Bourne (1987), utilizando las ecuaciones mensuales Lt-pg a cada longitud, en los tres períodos principales de desove de la especie (Prieto et al., 1999b) y expresándolos sobre una base semestral. La longitud a cada edad se calculó utilizando un modelo de von Bertalanffy determinado con los datos de incrementos de longitud informados por Pereira et al. (1988) en la misma población de Tocuchare. En muestras adicionales recolectadas (10 bivalvos por grupo) se calculó un índice gonosomático mensual (IG) en individuos de dos grupos de tallas, I (20,00 - 40,00mm) y II (40,01 - 60,00mm), utilizando la expresión IG= pg/(pg+ps)·100, donde pg: peso seco de la gónada y ps: peso seco del soma. Los pesos individuales de cada uno de estos tejidos permitieron también analizar su variación mensual, utilizando un ANOVA de una vía.
Debido a la necesidad de disponer de un modelo de crecimiento para el cálculo de la producción individual por edades, se utilizó la ecuación de crecimiento en longitud aportada por Pereira et al. (1988) sobre la misma población de Tocuchare, para intervalos anuales (t= 1 año), dada por Lt= 80,30(1-e-0,61t).
En cada ocasión de muestreo se determinaron la temperatura del agua, O2 disuelto y salinidad con un conductímetro YSI, con precisiones de 0,2ppm, 0,7ºC y 1%, respectivamente.
Resultados
De acuerdo a la ecuación: Lt= 80,30(1-e-0,61t), los mejillones alcanzaron 38,6mm de longitud total a la edad de un año, con una longevidad teórica máxima de 5 años.
Las regresiones mensuales entre la longitud de la concha (Lt) y el peso seco (ps) del tejido somático fueron altamente significativas (P<0,001) con valores de b que fluctuaron entre 1,39 en enero y 2,48 en mayo '95, con valores altos del coeficiente de determinación (0,78-0,85). Un análisis de covarianza indicó que existieron diferencias significativas entre las pendientes (P<0,05).
Las relaciones Lt-pg también presentaron valores altos de correlación (0,65-0,72) y la pendiente b presentó una variación que osciló entre 5,48 en mayo '96 y 1,90 en abril del mismo año. Un análisis de covarianza indicó que estas fueron significativamente diferentes (P<0,001). En las relaciones Lt-pc se obtuvieron valores alométricos minorantes y la pendiente b osciló entre 2,06 en diciembre '95 y 2,77 en febrero '96.
Las regresiones Lt-pb resultaron ser significativas, con coeficientes de determinación que oscilaron entre 0,60 y 0,98. La pendiente máxima (3,20) se observó en marzo '96 y las mínimas en octubre y noviembre '95 (2,7 y 2,83, respectivamente).
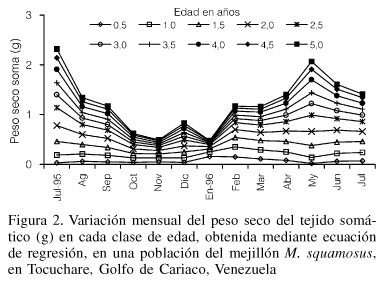
La variación del peso seco del soma (ps) para cada clase de edad, obtenido por las ecuaciones de conversión, indican que las clases de edad de 5,0; 4,5; 4,0; 3,5 y 3,0 presentaron un descenso desde julio hasta noviembre '95 seguido de un ligero aumento en diciembre, para disminuir en enero y aumentar hasta mayo '96, con un descenso en junio y julio '96. La variación en los mejillones más jóvenes (0,5; 1,0 y 1,5) mostró un comportamiento diferente con un aumento en enero de 1996 y una disminución en mayo del mismo año (Figura 2).
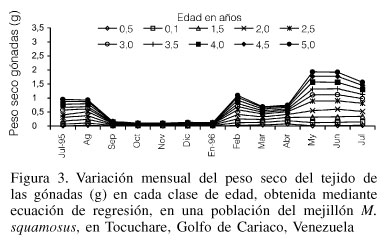
El peso seco de las gónadas (pg), obtenido por las ecuaciones, registró un aumento ligero en julio-agosto '95, con un descenso pronunciado en setiembre '95, seguido de valores bajos hasta enero '96. A partir de febrero se observó un incremento, con leve descenso en marzo-abril y un fuerte incremento en mayo y junio Las clases de 0,5; 1,0 y 1,5 tuvieron un comportamiento ligeramente diferente (Figura 3).
La variación de peso seco del tejido somático y las gónadas (masa visceral) en el grupo I (20,00-40,00mm) mostró un comportamiento similar con valores bajos desde setiembre '95 hasta enero '96, y altos desde febrero a julio '96. Resultados similares se obtuvieron al evaluar los promedios de peso seco (gónada y soma) en individuos del grupo II (40,01-60,00mm), donde se observó un pronunciado descenso en agosto '95, con un mínimo en noviembre y ascendiendo progresivamente a partir de junio.
Se detectaron diferencias altamente significativas entre los promedios mensuales de los pesos secos de la masa visceral en individuos con longitudes entre 20,00 y 40,00mm (Fs= 28,54; P<0,001). Un análisis a posteriori de las medias permitió separar dos grupos sobrepuestos con promedios altos y tres grupos con promedios bajos. También se detectaron diferencias altamente significativas en los promedios mensuales de los pesos secos gonadales en los individuos del grupo II (40,00-60,00mm; Fs= 80,60; P<0,001). Un análisis a posteriori de Duncan (Snedecor y Cochram, 1972) permitió separar un gran grupo de meses con promedios bajos (setiembre '95 - enero '96) y varios grupos con promedios altos.
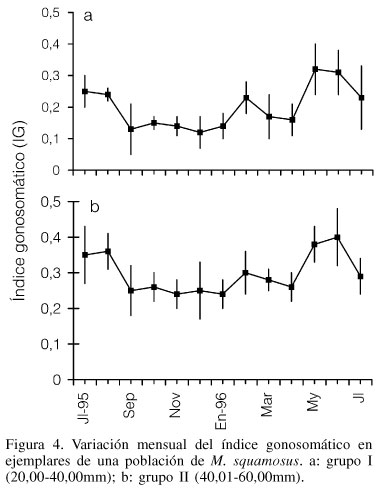
Las variaciones mensuales del índice gonosomático (IG) evaluado conjuntamente entre machos y hembras mostró en ambos grupos (I y II) un comportamiento similar, con valores altos en julio-agosto '95 y mayo-junio '96; y valores bajos desde setiembre '95 hasta enero '96. Las disminuciones observadas son debidas principalmente a emisión de gametos y secundariamente a reabsorción de tejidos (Figuras 4a y b).
El peso seco de la materia orgánica de la concha (pc) presentó amplias variaciones durante el período estudiado y el promedio de materia orgánica (conquiolina) representó el 6,34 ±5,48% del peso seco de la concha. La variación mensual del peso seco de la materia orgánica de la concha, utilizando las ecuaciones de regresión, indica que su contenido aumenta con la longitud de la concha, registrándose un descenso pronunciado de setiembre a octubre '95 en todas las edades, aumentó en diciembre '95, y se mantuvo constante hasta julio '96. El peso seco de la materia orgánica del biso presentó una escasa variación mensual y su producción se incrementó de 0,5 años (0,04g) hasta los 2 años (0,07g), disminuyendo en edades superiores.
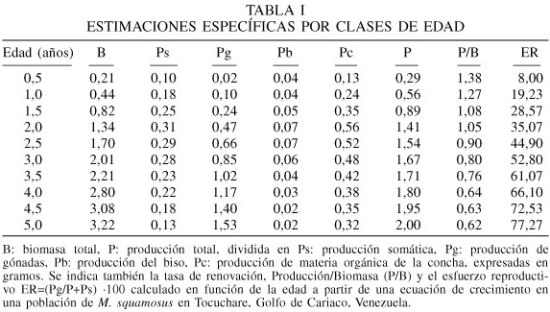
La producción de tejido somático (Ps) incrementó desde las primeras edades, hasta alcanzar un valor máximo a los dos años (0,31g), a partir del cual comenzó a declinar, alcanzando un valor mínimo a los 5 años de edad (0,13g; Tabla I). La producción de gónadas (Pg) aumentó progresivamente desde un valor inicial de 0,02g a los 0,5 años. Los períodos de crecimiento de tejido reproductivo ocurrieron entre enero-febrero '96 y abril-junio del mismo año.
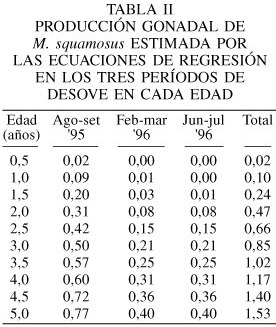
Si se toman en consideración los periodos agosto-setiembre '95, febrero-marzo y junio-julio '96 (Tabla II) como aquellos de mayor pérdida de tejido reproductivo (pg) en la población analizada, un mejillón con un año de edad y una longitud total de 38,45mm, exporta anualmente una cantidad de 0,10gps, que es equivalente al 7,80% de su producción total y al 22,3% del peso total a esa edad (Tabla III). Esta pérdida de tejido reproductivo se incrementa con la longitud (Lt) y está representada por la ecuación Pg= 1,82·10-7·Lt3,58 (r2= 0,96; P<0,05). El esfuerzo reproductivo (ER), que es la fracción total de la biomasa derivada hacia la reproducción, estimada sobre una base anual, excluyendo la producción del biso varió de 19,23% en la edad de 1 año hasta 77,27% en la edad de 5 años. El modelo asintótico que relaciona estos parámetros, asumiendo que el ER tiende a 0 en los reclutas y que alcanza un valor máximo de 78,00% en mejillones más viejos, está representada por la ecuación: ER= 78,00/1+e(2,71-1,25t) donde t: edad en años (r2= 0,93; P<0,05)
La biomasa total (B) y el esfuerzo reproductivo Pg/(P+Ps)·100 en promedios mensuales guardaron una relación directamente proporcional con la edad, mientras que la tasa de renovación (P/B) disminuyó con la edad (Tabla I).
Discusión
El crecimiento de Modiolus squamosus es inferior al citado para otras especies de mitílidos tropicales como Perna perna y P. viridis, por lo que puede considerarse como una especie de crecimiento lento, comparable con el crecimiento registrado para mitílidos de la zonas templadas, tales como Modiolus demissus (Kuenzler, 1961) y Mytilus edulis (Wallace, 1980). Los altos valores de biomasa individual registrados desde febrero hasta julio '96, revelan la presencia de un periodo de excelente condición fisiológica de la especie.
La variación mensual del peso seco de las gónadas en M. squamosus, cuando se analizó con base en ecuaciones de conversión peso-longitud para cada edad (Figura 3), o por los promedios de los pesos en ejemplares procesados en dos grupos de tallas (I y II), mostró la presencia de un período marcado de formación de gametos que transcurrió desde enero hasta junio '96, con ligeras disminuciones de peso que probablemente correspondieron a desoves parciales de la especie, y otro periodo de agosto a diciembre '95, caracterizado por valores muy bajos del peso de la gónada. Estos resultados confirman lo observado por Flores (1981) y Prieto et al. (1999b) quienes analizando la madurez sexual y el índice de condición de la especie, señalaron que aunque tiene una actividad reproductiva continua durante todo el año, el período enero-agosto se caracteriza por presentar altas frecuencias de estadios de maduración y desoves parciales, mientras que de setiembre a diciembre son más frecuentes los estadios de regresión gonadal. Las diferencias observadas en la variación del peso seco del tejido gonadal entre bivalvos mayores y menores de 2 años (Figura 3) puede explicarse tanto por un error en la predicción de la ecuación de conversión como por diferencias en el comportamiento reproductivo de las edades, tal como se ha informado en ostras (Pouvreau et al., 2000). Hacen falta, sin embargo, estudios bioquímicos e histológicos para analizar tal variación. Berry (1978) ha señalado que en P. perna de Sudáfrica, las cohortes pueden presentar dinámicas bioenergéticas diferentes.
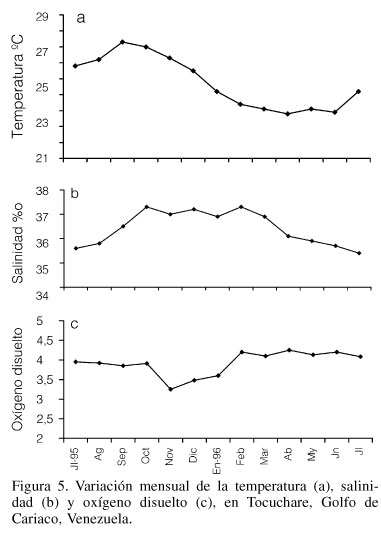
El periodo de mayor acumulación de biomasa reproductiva y somática, que ocurrió desde enero hasta julio '96 coincide con el periodo de máxima productividad primaria en el área, que se corresponde con el período de surgencias costeras dentro del Golfo de Cariaco, caracterizado por aguas de bajas temperaturas y altos valores de nutrientes, O2 y biomasa fitoplanctónica (Griffiths y Simpson, 1972; Ferraz-Reyes, 1989; Figura 5). La fuerte incidencia de vientos durante este lapso aumenta la intensidad del oleaje, aportando un subsidio energético adicional que contribuye a la formación de detritus, acelera el flujo de agua y mantiene en suspensión partículas que sirven de alimento a muchos filtradores, en estos ambientes someros de macrofitas (Kiorboe et al., 1981; Lodeiros et al., 1993).
Las disminuciones del peso seco de las gónadas ocurridas en junio-julio '96 indicarían la existencia de un desove parcial y coinciden con el periodo de transición a la estación de lluvias, aumentos de temperatura y disminución de la salinidad (Figura 5). Los valores altos observados en agosto '95 concuerdan con un incremento de la biomasa reproductiva debido al aumento de la maduración, que podría explicarse con base en la utilización de las reservas energéticas acumuladas en la glándula digestiva y otros tejidos en períodos previos, como ha sido señalado en pectínidos (Barber y Blake, 1981).
En el presente trabajo se observó a partir de febrero '96 un incremento de tejido gonádico, con un desove parcial en marzo '96, relacionado probablemente con la elevada disponibilidad de alimento y preparándose para el desove de julio '96, observado principalmente en los mejillones más grandes, los cuales invierten mayor cantidad de energía con un alto esfuerzo reproductivo. Langton et al. (1987) han sugerido que los bivalvos adultos poseen una mayor estabilidad fisiológica, debido a que disponen de una cantidad superior de reservas energéticas en condiciones de ser movilizadas con mayor facilidad para soportar alteraciones del medio ambiente.
Los bajos valores de tejido gonadal y somático registrados de setiembre '95 a enero '96, se relacionan con los valores menores del índice gonosomático observados en los dos grupos de tallas y coinciden con los bajos índices de condición de la especie, determinados con el procedimiento de Baird (1958) por Prieto et al. (1999b) en una zona del Golfo con altas temperaturas y baja disponibilidad de fitoplancton (Ferraz-Reyes, 1980; Figuras 5a, b y c).
La similitud observada en la valoración mensual en los tejidos somáticos indicaría que probablemente no existe movilización de sustratos energéticos somáticos para la formación de tejido reproductivo, tal como se ha observado en especies de pectínidos (Taylor y Venn, 1979; Bricelj et al., 1987; Marcano, 1989), aunque hacen falta estudios bioquímicos para llegar a esta conclusión.
Los estudios de reproducción en bivalvos señalan que la maduración de gametos es controlada principalmente por dos factores, la temperatura y el alimento, y secundariamente por la salinidad y el fotoperíodo. En ambientes templados, la temperatura es el principal factor regulador (Mann, 1979; Vélez y Epifanio, 1981), pero en ambientes tropicales se ha hecho énfasis en la disponibilidad de alimento como regulador del ciclo reproductivo en muchas especies (Frenkiel et al., 1997; Lodeiros et al., 1993; Prieto et al., 1999c). En algunos mitílidos se ha logrado establecer relaciones entre los efectos de la temperatura y el alimento sobre el crecimiento (Widdows, 1978; Bayne y Worrall, 1980; Kautsky, 1982; Sprung, 1984); sin embargo, la influencia sobre el costo reproductivo es menos conocida (Griffiths, 1980).
La producción somática en M. squamosus alcanzó su máximo en el segundo año (0,18g), disminuyendo posteriormente en edades más avanzadas; en cambio la producción de gónadas exhibió un aumento constante con la edad, representando a los 5 años el 81% de la producción total. Este comportamiento puede constituir una estrategia adecuada de la especie para sobrevivir en un ambiente somero, inestable y de alta diversidad (Tabla I).
En otras especies de mitílidos de zonas templadas como Mytilus edulis, en Inglaterra, la máxima producción somática se alcanza a los 6 años (Bayne y Worrall, 1980) y a los 5 años en ambientes subárticos (Thompson, 1984). Esto indica que M. squamosus desarrolla una estrategia energética tendiente a desviar a menores edades gran parte de su energía asimilada hacia el componente reproductivo, a pesar de no presentar escasa longevidad como las especies P. perna y P. viridis, también de áreas tropicales y subtropicales, pero con crecimientos explosivos.
La producción del biso alcanzó un valor máximo también a los 2 años, disminuyendo posteriormente. En bivalvos se ha sugerido que este aumento en la generación de biso en las primeras edades favorece la fijación del mejillón al sustrato permitiendo la realización de sus procesos vitales; sin embargo, su disminución en los bivalvos más viejos se debe a que estos dedican mayor cantidad de energía para el soporte del metabolismo y la maduración sexual (MacDonald y Bourne, 1987).
La producción de materia orgánica de la concha (Ps) alcanzó su máximo a los 2 años (0,21g), oscilando entre 9,8 y 35%, sobre una base anual. Estos valores son menores que los reportados para P. perna (Prieto et al., 1999), y para M. edulis (25%) por Kautsky (1982).
El promedio de materia orgánica determinado con relación al peso seco de la concha en M. squamosus (6,34%) es muy semejante al obtenido por Prieto et al. (1999b) para P. perna (6,50%) y ligeramente superior al de mitílidos de zonas templadas (Barker-Jorgensen, 1976) como M. demissus (5,4 a 6,0%) y M. edulis (4,3%). Se ha indicado que la temperatura del agua influye sobre el tipo de cristal en la concha de moluscos, debido a que origina cambios en la actividad secretora del manto que se reflejan en los componentes orgánicos del fluido extrapalial (Price et al., 1976). La salinidad puede afectar también la composición orgánica de la concha y, por lo general, las especies marinas y estuarinas presentan un contenido de materia orgánica en la concha mayor que las especies de agua dulce (Vinogradov, 1953).
El esfuerzo reproductivo en M. squamosus, evaluado como la fracción de la energía metabólica asimilada, derivada hacia la formación de gónadas, excluyendo el crecimiento del biso, fue una función creciente de la edad de los individuos, incrementándose desde el 10% en el primer año al 40% a los 5 años. Esta tendencia parece ser una norma en la mayoría de las especies estudiadas. Los máximos valores obtenidos de ER son menores que los citados para algunas especies de las zonas templadas como M. edulis (0,94) en Bellevue, Canadá (Griffiths y King, 1979); sin embargo, son comparables a las informadas para C. varia (Lucas, 1982), Ostrea edulis (Rodhouse et al., 1984) y Crassostrea gigas (Deslous-Paoli y Heral, 1988). MacDonald y Thompson (1986) señalaron que la liberación de altos porcentajes de tejido reproductivo constituye una estrategia para especies de agua fría y alta longevidad. En especies tropicales existe poca información, pero se ha informado que en P. perna de Sudáfrica varía entre 50 y 60% al segundo año de edad (Berry, 1978; Berry y Schleyer, 1983); en cambio, en la misma especie del oriente de Venezuela puede alcanzar valores más altos (Prieto et al., 1999a). En P. viridis de Hong Kong, oscila entre 0 y 67% (Cheung, 1993). Bayne y Worrall (1980), en estudios realizados en diferentes poblaciones de M. edulis en Inglaterra, han sugerido que ER es variable aún entre poblaciones cercanas de una misma región geográfica, y que factores como el estrés, tasa alimenticia y otros pueden afectar su variación.
Este estudio revela que a pesar de presentar un patrón de actividad reproductiva continua como la mayoría de las especies tropicales, M. squamosus ha desarrollado una estrategia energética basada en un crecimiento estacional de los tejidos somáticos y reproductivo, que responde básicamente a la variación de los principales factores ambientales de la zona, como son la temperatura y la disponibilidad de alimento. Hace falta, sin embargo, estudios experimentales sobre tasas de filtración y otros aspectos fisiológicos que permitan evaluar en detalle su relación con los parámetros ambientales.
AGRADECIMIENTOS
Este estudio fue financiado parcialmente por el Departamento de Biología, Escuela de Ciencias, Universidad de Oriente y por el Consejo de Investigación, Núcleo de Sucre, UDO (Proyecto CI/5-1001-1094/02)
REFERENCIAS
1. Baird RH (1958) Measurement of condition in mussels and oyster. J. Conseil Int. Exp. La Mer. 25: 247-257. [ Links ]
2. Barber B, Blake J (1981) Energy storage and utilization to gametogenesis in Argopecten irradians concentricus (Say). J. Exp. Mar. Biol. 52: 124-133. [ Links ]
3. Barker-Jorgensen CB (1976) Growth efficiences and factors controling size in some mylitids bivalves, especially Mytilus edulis (L): review and interpretations. Ophelia 5: 175-192. [ Links ]
4. Bayne BL, Worrall CM (1980) Growth and production of mussels Mytilus edulis from two populations. Mar. Ecol. Prog. Ser. 3: 313-328. [ Links ]
5. Berry, PF (1978) Reproduction, growth and production in the mussel Perna perna (L) on the east coast of South Africa. S. Afr. Ass. Mar. Ecol. Res. Oceanogr. Res. Inst. Rep. 48: 1-28. [ Links ]
6. Berry PF, Schleyer MH (1983) The brown mussel, Perna perna on the Natal Coast, South Africa: utilization of available food and energy budget. Mar. Ecol. Prog. Ser. 13: 201-210. [ Links ]
7. Brea J (1986) Variaciones estacionales en la composición bioquimica de Pecten ziczac (L.1758) en relación al metabolismo energético, crecimiento y reproducción. Tesis. Universidad de Oriente. Cumaná, Venezuela. 97 pp. [ Links ]
8. Bricelj V, Epp J, Malouf RE (1987) Intraspecific variation in reproductive and somatic growth cycles of bay scallops Argopecten irradians. Mar. Ecol. Prog. Ser. 356: 123-137. [ Links ]
9. Burke MV, Mann KH (1974) Productivity and production: biomass ratios of bivalves and gastropods populations in an eastern Canadian estuary. J. Fish. Res. Bol. Can. 31: 167-177. [ Links ]
10. Cheung SG (1993) Population dynamics and energy budgets of green-lipped mussel Perna viridis (Linnaeus) in a polluted harbour. J. Exp. Mar. Biol. Ecol. 168: 1-24. [ Links ]
11. Comely C (1978) Modiolus modiolus from the Scottish west coast. Ophelia 17: 167-193. [ Links ]
12. Crisp DJ (1971) Energy flow measurements. En Holme, NA, MacIntyre AD (Eds.) Methods for the study of marine benthos. IBP Handbook Nº16. Blackwell. Oxford, RU. pp. 197-279. [ Links ]
13. Dare RF (1976) Settlement, growth and production of the mussel Mytilus edulis (L) in Morecambe Bay, England. Fish. Invest. London. Ser. III 28: 1-25. [ Links ]
14. Delous-Paoli JM, Heral M (1988) Biochemical composition and energy value of Crassostrea gigas (Tunberg) cultured in the bay of Marennes-Oleron. Aquat. Living Resour. 1: 239-249. [ Links ]
15. Ferraz-Reyes E (1980) Productividad primaria del Golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez. 26: 97-110. [ Links ]
16. Ferraz-Reyes E (1989) Influencia de los factores físicos en la distribución vertical de la biomasa fitoplanctónica en el Golfo de Cariaco (Venezuela). Bol. Inst. Oceanog. Venez. 28: 47-56. [ Links ]
17. Flores M (1981) Ecología reproductiva del mejillón de fondo Modiolus squamosus (Beauperthuy, 1967) (Bivalvia: Mytilidae). Tesis. Universidad de Oriente. Cumaná, Venezuela. 104 pp. [ Links ]
18. Frankiel L, Gross O, Moueza M (1997) Storage tissue and reproductive strategy in Lucina pectinata (Gmelin), a tropical lucinid bivalve adapted to a reducing sulfurrich, mangrove environment. Invertebr. Rep. Dev. 31: 199-210. [ Links ]
19. Griffiths RJ (1980) Ecophysiology of the black mussel Chloromytilus meridionalis (Kr). Thesis University of Cape Town. South Africa. [ Links ]
20. Griffiths RJ, King JA (1979) Energy expended on growth and gonad output in the riwbed mussel Aulacomya ater. Mar. Biol. 53: 217-222. [ Links ]
21. Griffiths RJ, Simpson JG (1972) Afloramiento y las características oceanográficas de las aguas costeras del noreste de Venezuela. Serie Recursos y Explotación Pesquera. MAC/PNUD/FAO 2: 1-72. [ Links ]
22. Hibbert RN (1977) Biomass and production of a bivalve community in an intertidal mud-flat. J. Exp. Mar. Biol. Ecol. 4: 77-84. [ Links ]
23. Hughes RN (1970) An energy budget for a tidal flat population of the bivalve Scrobicularia plana (Da Costa). J. Anim. Ecol. 39: 354-369. [ Links ]
24. Kautsky N (1982) Quantitative studies on gonad cycle, fecundity, reproductive output and recruitment in a Baltic Mytilus edulis population. Mar. Biol. 68: 143-160. [ Links ]
25. Kiorboe T, Möhlenberg F, Nohr O (1981) Effect of bottom material on growth and energetic in Mytilus edulis. Mar. Biol. 61: 283-288. [ Links ]
26. Kuenzler EJ (1961) Structure and energy flow of a mussel population in a Georgia salt marsh. Limnol. Oceanogr. 6: 191-204. [ Links ]
27. Langton RW, Robinson W, Schick D (1987) Fecundity and reproductive effort of sea scallop Placopecten magellanicus from the Gulf of Maine. Mar. Ecol. Prog. Ser. 37: 19-25. [ Links ]
28. Lodeiros C, Freites L, Núñez M, Himmelman J (1993) Growth of the Caribbean scallop Argopecten nucleus (Born 1780) in suspended culture. J. Shellfish Res. 12: 291-294. [ Links ]
29. Lucas A (1982) Evaluation of reproductive effort in bivalve mollusks. Malacologia 22: 183-187. [ Links ]
30. MacDonald BA, Bourne F (1987) Growth, reproductive output, and energy partitioning in weathervane scallop, Patinopecten caurinus from British Columbia. Can. J. Fish. Aquat. Sci. 44: 152-160. [ Links ]
31. MacDonald BA, Thompson RJ (1986) Production, dynamic and energy partitioning in two populations of the giant scallop Placopecten magellanicus. J. Exp. Mar. Biol. Ecol. 101: 285-299. [ Links ]
32. Mann R (1979) Some biochemical aspects of growth and gametogenesis in Crassostrea gigas and Ostrea edulis grown at sustained elevated temperatures. J. Mar. Biol. Assoc. U.K. 59: 95-110. [ Links ]
33. Marcano L (1989) Composición bioquímica de algunos tejidos e índice gonosomático, y capacidad oxidativa mitocondrial de la glándula digestiva de Pecten ziczac (L), bajo condiciones controladas. Tesis. Universidad de Oriente. Cumaná, Venezuela. 111 pp. [ Links ]
34. Pereira R, Prieto A, Flores M (1988) Notas sobre el crecimiento en una población del mejillón Modiolus squamosus en Tocuchare, Golfo de Cariaco, Venezuela. Acta Cient. Venez. 39: 281-288. [ Links ]
35. Pouvreau S, Gangnery A, Tiapari J, Lagarde F, Garnier M, Bodoy A (2000) Gametogenic cycle and reproductive effort on the tropical blacklip pearl oyster, Pinctada imbricata (Bivalvia: Pteriidae), cultivated in Takapoto atoll (french Polynesia). Aquatic Living Resour. 13: 37-48. [ Links ]
36. Price HA (1982) An analysis of factors determining seasonal variation in the bissal attachment strength of Mytilus edulis. J. Mar. Biol. Ass. U. K. 62: 147-155. [ Links ]
37. Price TJ, Thayer GW, LaCroiz MW, Montgomery GP (1976) The organic content of shell and soft tissues of selected estuarine gastrops and pelecipods. Proc. Shellfish. Assoc. 85: 26-31. [ Links ]
38. Prieto AS (1980) Some ecological aspects of the bivalve Anadara notabilis (Roding, 1798) in two areas from the Gulf of Cariaco, Venezuela. Bol. Inst. Oceanogr. Venezuela 19: 119-124. [ Links ]
39. Prieto AS, Pereira, R, Manrique, R (1985) Producción secundaria del mejillón Modiolus squamosus (Beauperthuy, 1967) en Tocuchare, Golfo de Cariaco. Venezuela. Acta Cient. Venez. 36: 258-264. [ Links ]
40. Prieto AS, Graterol A, Campos I (1999a) Diversidad de moluscos en dos localidades del Golfo de Cariaco, Estado Sucre, Venezuela. Mem. Soc. Cienc. Nat. Fund. La Salle 90: 117-131. [ Links ]
41. Prieto AS, Flores M, Lodeiros C (1999b) Madurez sexual e índice de condición en una población del mejillón de fondo Modiolus squamosus (Mollusca: Bivalvia) en Tocuchare, Golfo de Cariaco, Venezuela. Ecotrópicos 12: 83-90. [ Links ]
42. Prieto AS, Vásquez M, Ruiz L (1999c) Dinámica energética en una población del mejillón Perna perna (Filibranchia: Mytilidae) en el noreste del Estado Sucre, Venezuela. Rev. Biol. Trop. 47: 499-410. [ Links ]
43. Rodhouse PG, Roden CM, Burnell GM, Hensey MP, McMahon T, Ottway B, Ryan TH (1984) Food resource, gametogenesis and growth of Mytilus edulis on a shore and in suspended culture: Killary Harbour, Ireland. Mar. Biol. 64: 513-529. [ Links ]
44. Snedecor GW, Cochram WG (1972) Statistical Methods. Iowa State University Press. EEUU. 605 pp. [ Links ]
45. Sprung M (1984) Physiological energetic of mussel larvae Mytilus edulis. I . Shell growth and biomass. Mar. Ecol. Prog. Ser. 17: 283-293. [ Links ]
46. Tata A, Prieto A (1991) Producción secundaria en una población del bivalvo tropical Tivela mactroides (Veneridae) en el oriente de Venezuela. Carib. J. Sci. 21: 28-34. [ Links ]
47. Taylor A, Venn T (1979) Seasonal variation in the weight and biochemical composition of the tissues of the queen scallop Chlamys opercularis from the Clyde Sea Area. J. Fish. Res. Bd. Can. 34: 2184-2116. [ Links ]
48. Thompson RJ (1984) Production, reproductive effort, reproductive value and reproductive coast in a population of the blue mussel Mytilus edulis from a subartic environment. Mar. Ecol. Prog. Ser. 16: 249-257. [ Links ]
49. Urban HG (2000) Potencial culture of the pearl oyster (Pinctada imbricate) from the Caribbean. I. Gametogenic activity, growth, mortality and production of a natural population. Aquaculture 189: 361-373. [ Links ]
50. Vélez A, Epifanio E (1981) Effects of temperature and ration on gametogenesis and growth in the tropical mussel Perna perna (L). Aquaculture 22: 21-26. [ Links ]
51. Vinogradov AP (1953) The elementary chemical composition of marine organisms. Memoir Nº11. Sears Fundation for Marine Research. Yale University. New Haven, CO, EEUU. 647 pp. [ Links ]
52. Wallace JC (1980) Growth rates of different populations of the edible mussel Mytilus edulis in North Norway. Aquaculture 19: 302-311. [ Links ]
53. Widdows J (1978) Combined effects of body size, food concentration and season on the physiology of Mytilus edulis. J. Mar. Biol. Ass. U. K. 58: 109-124. [ Links ]
54. Wilborg KL (1946) Undersokelser over oskjellet, Modiolus modiolus (L) Foskeridiz. S. K. R. Ser Havunders 8: 1-85. [ Links ]












 uBio
uBio