Interciencia
versión impresa ISSN 0378-1844
INCI v.30 n.11 Caracas nov. 2005
Requerimiento de fósforo de los Microorganismos ruminales: una revisión.
Aurora H. Ramírez-Pérez y François Meschy
Aurora H. Ramírez-Pérez. Médica Veterinaria y Zootecnista, Maestría en Producción Animal, Universidad Nacional Autónoma de México. Doctorante, Institut National Agronomique Paris-Grignon, Francia. Dirección: 16 rue Claude Bernard, 75005 Paris, Francia. e-mail: aurora.ramirez@contact.asso.fr
François Meschy. Ph.D. en Bioquímica Nutricional, Université de Dijon, Francia. Investigador, Institut National de la Recherche Agronomique, Francia.
Resumen
Se describe el efecto del fósforo (P) sobre la actividad microbiana y la utilización de nutrientes por los rumiantes, ya que recomendaciones recientes sobre alimentación mineral reducen el aporte dietario de ese elemento. Este aporte deberá satisfacer las necesidades de la microflora ruminal, ya que de ella depende el aprovechamiento de la ración, y sus requerimientos de P están en función de su actividad, siendo mayores para la celulolisis respecto a la proteosíntesis (6,9 vs 4,3g P disponible/kg de materia orgánica fermentable en rumen). La utilización bacteriana de P depende del aporte dietario, de su disponibilidad, del aporte endógeno a través de la saliva, así como de la respuesta de los microorganismos ante las variaciones de P en el contenido ruminal, por lo que deberá realizarse mayor investigación al respecto. La disminución en la excreción del elemento como respuesta a la disminución del P en la dieta del rumiante impactará favorablemente en el medio ambiente.
Summary
The effect of phosphorus (P) on microbial activity and the use of nutrients by the ruminant are described. Recent recommendations on mineral feeding reduce dietary P concentration. Phosphorus supply must satisfy the requirements of ruminal microbes in order to ensure an adequate fermentation process. Microbial P requirements are greater for cellulose breakdown than for protein synthesis (6.9 vs 4.3g available P/kg of fermentable organic matter in the rumen). Phosphorus utilization by bacteria depends on its dietary content, availability, and endogenous contribution through saliva, as well as on the microbial response to P variations in the ruminal content. Due to these complexities, further investigation is needed. Furthermore, any decrease in excreted P because of a reduction in its intake will have a positive effect on the environment.
Resumo
A influência do fósforo (P) na atividade microbiana e na utilização de nutrientes pelos ruminantes é descrita. As recentes recomendações em nutrição mineral visam diminuir a concentração de P dietético. O fornecimento de P deve satisfazer as exigências dos microrganismos rumenais de modo a manter, em níveis adequados, os processos de fermentação. Os requisitos microbianos de P para a quebra da celulose são superiores aos da síntese protéica (6,9 vs 4,3g de P disponível por kg de matéria orgânica fermentável no rúmem). A utilização de P pelas bactérias depende da quantidade fornecida pela alimentação, da sua biodisponibilidade e da contribuição endógena via saliva, bem como da resposta microbiana às variações de P no conteúdo rumenal. Devido a essa complexidade, mais estudos são necessários. Além disso, qualquer diminuição do P excretado em consequência da redução do seu consumo será positiva para o meio-ambiente.
PALABRAS CLAVE / Actividad Microbiana / Bacterias / Fósforo / Rumiantes /
Recibido: 11/01/2005. Aceptado: 23/09/2005.
El fósforo (P) junto con el nitrógeno (N) son nutrientes que favorecen el desarrollo vegetal, incluyendo el de las algas cianofitas en lagos y ríos (Satter, 2003), lo cual contribuye a la eutroficación de las aguas (Komisarczuk et al., 1987b; Bravo y Meschy, 2003). Reportes recientes indican que algunos lagos contienen 25µg o más de P por litro de agua, por lo que se les considera como eutrofizados (Ekelund, 2003). Aunque el exceso de este elemento no impacta directamente en la salud humana, como es el caso de la contaminación del agua con compuestos nitrogenados, sí afecta los ecosistemas acuáticos, disminuyendo la disponibilidad de O2 y poniendo en riesgo el equilibrio ecológico. Si bien en algunos países la agricultura genera solo el 20% de la contaminacion por P (la actividad humana es responsable del 60% y la industria del 20% restante; Hénin y Sebillote, 1990), el uso de fertilizantes fosfatados en la producción de cultivos constituye otra fuente de contaminación para los cuerpos acuícolas. Adicionalmente, el manejo inadecuado de las excretas animales en las producciones pecuarias contribuye (Ekelund et al., 2003; Satter, 2003) al depósito de este elemento en el suelo.
Satter (2003) señala algunos factores que han propiciado la sobrealimentación con P, al menos en el ganado lechero. Entre ellos están la asociación de un mejor desempeño reproductivo a elevados consumos del mineral y la ausencia de pruebas de lactación que presenten la cantidad mínima de P requerida para soportar una producción láctea alta o moderada. López et al. (2004) afirman que la alimentación con cantidades en exceso respecto a las recomendadas por el NRC (2001) no tuvieron un efecto detectable en el desempeño reproductivo de vacas en lactación. El problema se ha exacerbado por la incorporación de cantidades importantes de granos en las dietas de los animales sometidos a una intensa presión de producción, como es el caso del ganado lechero, que llega a consumir raciones que incluyen hasta 50% de esos alimentos (Godoy y Meschy, 2001), lo que resulta en una sobrealimentación del mineral. Por otra parte, el crecimiento demográfico y la urbanización han contribuido a la intensificación de la producción (mayor número de animales por unidad de superficie) y las áreas de cultivo donde se realizaba el depósito de excretas han disminuido. Esto ha resultado en la aplicación de excretas en cantidades superiores a las utilizadas por los cultivos, llevando en ocasiones a incrementos en el contenido de P en el suelo; el agua de riego o de la lluvia puede arrastrar el mineral, con su consecuente acumulación tanto en el suelo como en los cuerpos de agua (Satter, 2003).
De manera contrastante, la deficiencia de P en los rumiantes y en otros animales es un problema en algunas regiones del mundo, principalmente en los países tropicales, donde los forrajes tienen bajos contenidos (<0,15%) del elemento (Underwood y Suttle, 1999). La deficiencia de este macromineral es la causa de bajos índices productivos (McDowell et al., 1993).
El consumo recomendado para cubrir las necesidades de P de los rumiantes varía desde 1,2g/kg de materia seca (MS) para bovinos productores de carne en crecimiento (NRC, 1996) hasta 4g/kg de MS para vacas lecheras en producción (NRC, 1989). Las recomendaciones recientes proponen consumos menores de P para la vaca lechera (NRC, 2001; Meschy, 2003; Valk y Beynen, 2003; Tabla I) y existe variación entre diferentes países.

Las cantidades de P que deberá aportar la ración alimenticia deben ser calculadas como la suma de los requerimientos netos a ser absorbidos para el mantenimiento, el crecimiento, la gestación y la lactación, divididos entre el coeficiente de absorción real (CAR) del P proveniente de la dieta (NRC, 2001), para lo cual es necesario utilizar P marcado (32P). El CAR se calcula como
![]()
El NRC (2001) toma como base los resultados de las investigaciones realizadas a partir de 1991 para modificar el CAR de 0,50 para todos los alimentos a 0,64 para los forrajes y 0,70 para los concentrados, en tanto que para las fuentes minerales propone de 0,30 (rocas fosfóricas) a 0,90 (fosfato monocálcico y ácido fosfórico). Este nuevo sistema es utilizado para calcular el P dietario. No obstante, los valores de CAR aún no están especificados para los diferentes alimentos (cereales, pastas y otros subproductos agroindustriales).
Los rumiantes excretan más del 95% del P a través de las heces, en formas relativamente solubles e insolubles (Satter, 2003). La pérdida inevitable del mineral es la suma del P de los residuos microbianos, células muertas y secreciones intestinales, las cuales son iguales a 1g/kg de MS ingerida (Spiekers et al., 1993) y posiblemente 25-50% del P fecal proviene de los residuos microbianos originados de la fermentación digestiva (Wu et al., 2000; NRC, 2001). Cuando el elemento es incluido en exceso en la dieta, los animales utilizan la orina como vía de excreción secundaria para mantener la fosfatemia dentro de límites fisiológicos. Asi, vacas que reciben cantidades adecuadas de P dietario excretan en la orina menos de 1g de P/día, en tanto los animales sobrealimentados con 20-30% de P excretan 3-5g de P/día. La reducción en la dieta y, como consecuencia, la reducción del elemento excretado por el ganado es una herramienta de manejo que puede ser efectiva para disminuir el efecto de contaminación por P (Valk et al., 2000; Godoy y Meschy, 2001; Satter, 2003). Sin embargo, para disminuir los aportes dietarios del elemento es necesario verificar las necesidades de los microorganismos ruminales, quienes son los encargados directos de lograr un aprovechamiento eficiente de los nutrimentos contenidos en la dieta.
En general, los alimentos son los encargados de mantener la simbiosis con los microorganismos ruminales y sólo indirectamente con el rumiante, y se sugiere que los requerimientos de P de los microorganismos son mayores a los del mismo huésped (Komisarczuk et al., 1987b). Las investigaciones recientes en cuanto a la alimentación mineral de los rumiantes han conducido a la reducción en los aportes del alimento en la dieta de los animales; sin embargo, los requerimientos de P de las bacterias ruminales se estudiaron hace más de una década. El objetivo de este artículo es resumir los resultados que existen sobre las necesidades de P de las bacterias ruminales, así como los efectos de la variación en la concentración del elemento y su efecto sobre la utilización de los nutrimentos por el animal.
El Fósforo y los Microorganismos Ruminales
El fósforo es esencial para el desarrollo de todos los microorganismos. Interviene en diferentes sistemas enzimáticos y es particularmente importante en la fermentación de los carbohidratos estructurales (Durand et al., 1983; Komisarczuk y Durand, 1991), principalmente de la celulosa (Komisarczuk et al., 1986, 1987a; Broudiscou et al., 1999); forma parte del material celular, como ácidos nucleicos, ATP, fosfolípidos de la membrana celular y ácido teicoico de las paredes celulares de las bacterias Gram+ (Durand et al., 1983; Komisarczuk y Durand, 1991). El contenido de P en los microorganismos ruminales es muy variable, entre 2 y 6% de la MS, o bien de 2 a 2,8% en bacterias de cultivo puro, mientras que estudios in vivo señalan un contenido entre 1 y 2% (Durand et al., 1983).
En el rumiante, los minerales que entran al tracto digestivo tienen efecto sobre el metabolismo de los microorganismos directa o indirectamente. Directamente, actúan como cofactores enzimáticos, elementos precursores de síntesis, o cambiando el pH y la osmolaridad del medio; indirectamente modifican la fisiología del hospedero, por ejemplo, alterando el tiempo de permanencia de la digesta o la velocidad de absorción de los metabolitos (Broudiscou et al., 1998).
Necesidades de Fósforo de los Microorganismos Ruminales
La determinación de la producción microbiana puede estimarse mediante la incorporación de isotopos a partir de un reservorio extracelular marcado de algún precursor inorgánico (X) de cierto constituyente microbiano. A partir del conocimiento de la cantidad incorporada de X; la cantidad de N incorporado puede expresarse utilizando la proporción N/X en la producción bacteriana (Van Nevel y Demeyer, 1977). Czerkawski (1976) encontró en la fase líquida del contenido ruminal un valor promedio N/P para los protozoarios (Entodinium sp., Holotrichum sp. y otros géneros) y grandes bacterias (Ovalos de Quin, Selenomonas sp. y Oscillospira sp.) de 7,14, y para bacterias pequeñas el valor fue de 3,85. Tomando como referencia la misma relación, existe un valor promedio de 8,37 ±0,75 en el caso del contenido ruminal obtenido de corderos en ayuno y para las muestras obtenidas a diferentes tiempos a lo largo del día (Durand et al., 1983). La relación N/P no permanece constante, ya que en el comprimido bacteriano obtenido por centrifugación se presentaron durante el día variaciones en el contenido del elemento, incluso en su distribución (P inorgánico, P lipídico y P nucleico; Van Nevel y Demeyer, 1977).
La incorporación de P y N dependen en gran medida de la producción de energía de la fermentación (Van Nevel y Demeyer, 1977); a mayor producción de energía, mayor incorporación de los minerales. Por esta razón, las necesidades de P de los microorganismos se relacionan mejor con la materia orgánica fermentable en rumen (MOFR) o con la materia orgánica digestible (MOD) que con la MS. Por ello MOD y MOFR son valores utilizados para expresar los requerimientos de P de los microorganismos ruminales. La MOD corresponde a la pérdida neta de la materia orgánica entre la entrada y la salida del flujo de la digesta a través del tracto digestivo, en tanto que la MOFR corresponde a la pérdida entre la entrada y la salida de la digesta a través del rumen. La MOFR contiene productos finales de la fermentación, como ácidos grasos volátiles (AGV) o adiciones endógenas, y precisamente por no tener en cuenta a la materia orgánica fermentada incorporada por las bacterias, se califica como materia orgánica aparentemente fermentada en el rumen (MOAFR), y se puede estimar a partir de la producción de AGV (Van Nevel y Demeyer, 1977).
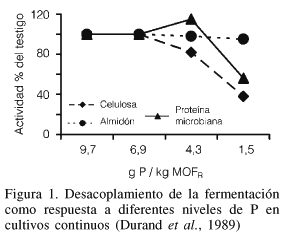
Para dilucidar las necesidades de los microorganismos ruminales de ciertos elementos, entre ellos el P, se han utilizado métodos tales como los cultivos microbiológicos o los sistemas de fermentación artificial, ya sean de flujo continuo o semi-continuo (RUSITEC). En general, las necesidades de P para los microorganismos in vitro son variables y se sitúan con más frecuencia entre 0,2 y 0,1g de P por litro de medio de incubación. Beaumatin (1981) utilizó 32P para medir la actividad microbiana ruminal y su relación con el P inorgánico (Pi), encontrando correlaciones positivas (r= 0,9) entre los diferentes parámetros utilizados. Las ecuaciones de regresión (Tabla II) obtenidas en ese trabajo sirvieron para calcular la utilización del N amoniacal (NH3-N), la síntesis de N proteico y la producción de AGV, encontrándose que aun sin existir la desaparición de NH3-N o sin síntesis proteica puede presentarse la incorporación del P. Este fenómeno puede producirse en experimentos en los cuales los medios de incubación son deficientes en algún nutriente (azúcares o azufre), lo que ocasiona un desacoplamiento de las fermentaciones (Figura 1) y las bacterias en estado de latencia producirán AGV, sin crecimiento bacteriano. El P incorporado entonces se utilizaría para cubrir necesidades enzimáticas, o se encontraría en forma inorgánica, pero no sería utilizado en la síntesis proteica.

Al no existir mayor información, y con base en las ecuaciones de Beaumatin (1981), se han hecho algunas estimaciones de la necesidad de P ("total" o "neta") de los microorganismos in vitro e in vivo. La incorporación del mineral obtenida mediante la utilización del 32P corresponde al crecimiento total ("necesidad total"). Por otra parte, de acuerdo con los trabajos de Van Nevel y Demeyer (1977), las bacterias pueden lisarse en los medios de incubación y liberar el NH3-N, en tanto otras bacterias proliferan e incorporan a sus proteínas el N liberado. Así, las cantidades de NH3-N o de N proteico sintetizado corresponden a la diferencia entre el crecimiento total y la lisis bacteriana, lo cual únicamente reflejaria un crecimiento neto ("necesidad neta"). Kumaresan (1976) y Beaumatin (1981) encontraron que las cantidades de NH3-N utilizadas variaron entre 20 y 40mg N/100ml de medio, lo cual dependió de la edad de los animales donadores del inóculo (adultos o corderos, respectivamente). Con base en esta producción, las necesidades totales de P fueron de 4-7,2mg/100ml y las necesidades netas de 3,2-6,4mg/100ml del medio para una incubación de 3h. El tiempo de duración de los experimentos de Beaumatin (1981) fue de 3h, por lo que de acuerdo con su explicación, posiblemente no se produjo la lisis bacteriana; así, las estimaciones corresponderían a la incorporación de 32P para el crecimiento neto. La cantidad de AGV producida en esos mismos medios fue de 8,5-10mmoles·l-1, y la variación dependió también de la edad de los donadores. De esta manera, las incorporaciones de P se situaron entre 5 y 5,9mg/100ml de medio para el mismo tiempo de incubación.
Sin embargo, existen reportes sobre mayores necesidades del elemento. Por ejemplo, la adición de P (30mg/100ml) al inóculo proveniente de animales carentes del elemento y cuyo contenido era de 6,5mg de P/100ml de inóculo aumentó la actividad fermentadora. Un efecto similar se encontró al adicionar 10mg de P por cada 100ml de medio con la concentración inicial de 7mg de P/100ml, o cuando las dietas carecían del elemento, lo que favoreció la utilización de NH3-N en un 15% y la producción de AGV en 5% (Durand et al., 1983).
Durand et al. (1986) utilizaron un sistema RUSITEC para conocer el efecto de la adición de P (120mg·l-1) sobre la digestión microbiana de paja tratada con amoniaco, y encontraron que en los medios a los cuales se les añadió P, la fermentación de la fibra mejoró significativamente, asi como las producciones de AGV y de gas, pero no existió un efecto marcado sobre la síntesis de proteína. La adición de urea al medio enriquecido fue sinérgica con el P y, además, contribuyó a mejorar la síntesis proteica. Este efecto no se presentó en los medios carentes de P. Por otra parte, el incremento de la fermentación de la celulosa favoreció la producción de acetato en todos los medios enriquecidos con P, efecto que no se observó con la adición de urea, lo que fue concluyente para identificar el papel primordial del P en la digestión de los componentes de las paredes celulares de los vegetales. También, la actividad de la endoglucanasa de la bacteria Gram+ Fibrobacter succinogenes mostró una depresión en su actividad sólo cuando la concentración de P fue de 5mg·l-1; en el caso del Ruminococcus flavefaciens (Gram-), la actividad de la endoglucanasa aumentó 29% cuando la concentración de P fue de 15mg·l-1. En referencia a la fermentación de la hemicelulosa y del almidón, se requiere menor cantidad de P respecto a la necesaria para la fermentación de la celulosa (Komisarczuk y Durand, 1991).
Komisarczuk et al. (1987a) determinaron el efecto del P en la actividad microbiana ruminal (crecimiento, composición química y concentración de ATP) de las fases líquida y sólida, y encontraron que la deficiencia del mineral redujo la síntesis proteica en 45%. El N bacteriano directamente incorporado a los aminoácidos dietarios o péptidos fue mayor en las bacterias asociadas a los sólidos (BAS) que en las bacterias asociadas a los líquidos (BAL) (46 y 19%, respectivamente). En ese experimento, el P proporcionado en el medio deficiente (16mg·l-1) fue de origen dietario y, al parecer, fue la forma preferencialmente utilizada por BAS. La producción microbiana se asoció con los residuos sólidos y fue menos afectada que la fase líquida. La deficiencia de P tuvo un efecto significativo en la utilización por BAS y BAL del NH3-N, pero no se pudo dilucidar cómo afectó el elemento la asimilación del compuesto nitrogenado por los organismos. En otro trabajo, realizado en un fermentador continuo, se examinaron simultáneamente algunas características asociadas con los procesos de degradación (de la materia orgánica y de la pared celular vegetal) y síntesis (AGV, producción de gas) en el rumen. Todos esos indicadores fueron afectados negativamente debido a que la actividad celulolítica depende principalmente de BAS y esta actividad es la más afectada por la deficiencia de P (Komisarczuk et al., 1987b).
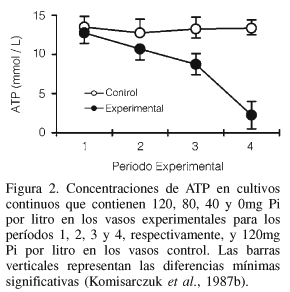
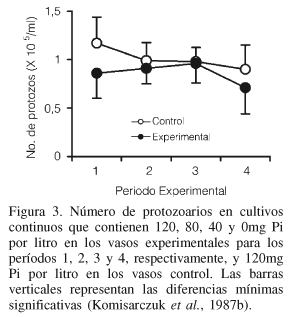
En estudios también realizados en un fermentador continuo (Komisarczuk et al., 1984) se observó que la depleción de Pi en el medio de incubación de 369mg a 21mg de Pi·l-1 propició la reducción de la población de protozoarios (de 2×104 a 8×103/ml), así como la disminución de la producción de AGV (de 78mmol a 50mmol·l-1) y de la concentración de ATP (de 5,9mg a <1mg·l-1). Todos estos cambios estuvieron asociados con un incremento en el pH (de 6,5 a 7,1) y una acumulación del NH3-N (de 9mmol a 15-20mmol·l-1; Komisarczuk et al., 1984; Petri et al., 1988). Komisarczuk et al. (1987a) trabajaron con el mismo tipo de sistema de fermentación y encontraron que las concentraciones de ATP (Figura 2) disminuyen drásticamente en los últimos tres periodos experimentales en los vasos de fermentación con fuerte carencia (66,7% menos respecto al control) de P, y este efecto no puede atribuirse ni a los protozoarios, ya que su población no se vió reducida significativamente (Figura 3), ni a la disminución del Pi intracelular de la bacteria. El ATP es esencial para el metabolismo bacteriano; contiene cerca de 180g de P por kg y es el primer índice afectado por la depleción del elemento en el medio. La disminución de las concentraciones de ATP fue atribuida a la reducción del tamaño de la población bacteriana, con la consecuente reducción de su actividad catabólica. En otro periodo del experimento, se incorporó P a los vasos que habían estado carentes del elemento y se observó una recuperación de la actividad microbiana y crecimiento muy cercano al nivel inicial, es decir, la carencia del elemento no presentó efectos irreversibles. La tendencia hacia la recuperación de la síntesis de proteína microbiana (BAS), así como la disminución en la concentración de ATP y en la proporción N/P en BAS y BAL indicaron una probable selección para una población con bajas necesidades de P durante el primer periodo del estudio, cuando hubo deficiencia del mineral. Al parecer la síntesis de proteínas se mantuvo con concentraciones reducidas de ATP y posiblemente el P proveniente de este compuesto pudo contribuir a mantener la síntesis de los ácidos nucleicos (Komisarczuk et al., 1987b).
En lo referente a la producción de metano (0,58 ±0,02mol/mol de hexosa; Durand et al., 1988) se encontró que en los fermentadores in vitro ésta se elevó especialmente cuando se utilizaron forrajes de baja calidad. Probablemente, las bacterias metanogénicas tengan necesidades menores de P (y azufre) que las bacterias celulolíticas (Komisarczuk et al., 1987b; Durand et al., 1987). De esta manera, en un inóculo deficiente en estos nutrientes su metabolismo no se afectaría. Esto explicó el incremento en la proporción de este compuesto en la generación de gas en estos medios (Durand et al., 1987).
Se han calculado diferentes requerimientos para la síntesis proteica y para la celulolisis: 4,3 y 6,9g de P disponible (Pd) por kg de MOFR, respectivamente. Estos hallazgos coinciden con las estimaciones en las que el valor promedio de la relación bacteriana de N/P es 7, y la media de la producción microbiana es de 30g de N/kg de MOFR, tomando como referencia la relación N/P la recomendación es de 4,3g de Pd/kg de MOFR. Suponiendo que el 65% de la materia orgánica se degrada en el rumen, el valor es de 2,8g de Pd/kg de MOD (2,1g de P/kg de MS). Sin embargo, el requerimiento de P disponible estimado en esta forma parecía subestimar los requerimientos para la actividad celulolítica, la cual fue estimada de alrededor de 4,5g de Pd/kg de MOD (Durand y Kawashima, 1980; Komisarczuk et al., 1987a; Komisarczuk y Durand, 1991).
Desafortunadamente los sistemas de fermentación, continuos y semicontinuos, no toman en cuenta la adaptación de los microbios a variaciones en la concentración del P ante las cuales probablemente sean capaces de almacenar el elemento cuando se encuentra en exceso, para su posterior utilización en periodos de carencia. Otra limitante de los sistemas es la ausencia de algún dispositivo que efectúe el reciclaje de P como tiene lugar en el rumen del animal a través de la saliva. Cuando los ensayos se han hecho in vivo, se ha encontrado que la cantidad de N microbiano sintetizado en el rumen es aproximadamente de 30g/kg de MAOFR (Jarrige et al., 1978; ARC, 1980). Al adoptar este valor promedio y utilizando las ecuaciones de Beaumatin (1981), las necesidades netas de P para las bacterias del rumen pueden ser de 4,9g y las necesidades totales de 5,0g/kg de MAOFR. Como ya se indicó, el 65% de la MOD en el rumen corresponde a MOAFR (Jarrige et al., 1978; ARC, 1980). Esto lleva a estimar las necesidades netas de P en relación con la MOD en 3,2g/kg (2,4g/kg de MS) y las necesidades totales en 3,25g/kg (2,44g/kg de MS). Sin embargo, algunas veces se ha observado rendimientos de síntesis proteica más elevados. Por ejemplo, en el caso de la producción de 40g de N/kg de MOAFR, las necesidades netas y totales de P serian de 4,3g/kg de MOD (3,2g/kg de MS; Durand et al., 1983). De este modo queda demostrado que las necesidades de P dependen directamente de la energía de la dieta. Los requerimientos de P expresados con base en la MS se hicieron considerando 75% de digestibilidad.
De acuerdo a las investigaciones recientes, las necesidades reportadas sobreestiman las necesidades de los microorganismos, ya que en bovinos alimentados con 1,2g de P/kg de MS, la concentración de P en el líquido ruminal fue superior a 200mg de P por litro (NRC, 2001), y puede ser alcanzada a través del reciclaje salival, del aporte de las dietas adecuadas para cubrir las necesidades del rumiante (NRC, 2001; Satter, 2003) y del reservorio óseo. Sin embargo, la secreción salival está en función de varios factores, como es el contenido y el consumo de MS, el porcentaje que conforma el forraje dentro de la dieta y el tamaño de la partícula del mismo.
Cabe señalar que la principal fuente endógena de P para los microorganismos ruminales es la saliva, donde se encuentra principalmente como fosfatos de Na y K (NRC, 2001). En el carnero la secreción salival diaria está entre 8 y 16 litros (Komisarczuk, 1985; Barlet et al., 1995) y su concentración de P varia ampliamente, desde 62 hasta 1858mg·l-1 (Cook, 1995). Si la dieta contiene más de 3g de P/kg MS, el contenido en la saliva se encuentra entre 500 y 900mg·l-1 (Komisarczuk, 1985; Barlet et al., 1995). En el bovino se reciclan diariamente entre 30 y 90g de P (NRC, 2001; Satter, 2003). Aun cuando el contenido de P salival tiene una relación positiva con el P plasmático (Komisarczuk, 1985; Barlet et al., 1995), se han encontrado respuestas diferentes ante una misma condición experimental. En un estudio de larga duración, Valk et al. (2002) alimentaron durante dos lactaciones y dos periodos secos tres grupos de vacas lecheras con el 100, 87 y 67% de P de acuerdo a lo recomendado por el sistema holandés (3,2-3,9; 2,6-2,9 y 2,2-2,6g/kg de MS, respectivamente). Durante los primeros días del primer periodo de lactancia, el grupo alimentado con el 67% de los requerimientos de P presentó una concentración del elemento en la saliva y en el plasma 30% menor respecto al grupo alimentado con 100%. Durante la segunda lactación, se desarrolló hipofosfatemia (2,4 a 2,7 mg de Pi/dl). En contraste, el contenido de P salival no fue diferente entre los tres grupos de vacas durante el mismo periodo. Estos resultados no sólo presentan a la concentración sanguínea de P como un indicador más sensible del status de P en el animal, sino también la capacidad del organismo animal para movilizar el mineral del reservorio óseo (Valk et al., 2002), donde se encuentra el 80% del P total del organismo, y reciclarlo a través de la saliva.
Los protozoarios pueden tener algun efecto sobre el flujo salival o sobre la absorción intestinal del P ya que en ovinos carentes de protozoarios ruminales, la cantidad de P secretada al estómago proveniente de la saliva fue 18,1% mayor que en los ovinos con población de protozoarios. Esta secreción de P estuvo balanceada por una absorción neta en el intestino delgado de los ovinos sin protozoarios ruminales 17,6% mayor respecto a los ovinos con protozoarios ruminales (Viera, 1986; Chaudray y Srivastava, 1994).
Disponibilidad del Fósforo para el Metabolismo Bacteriano
Otro aspecto a considerar en la utilización del P por parte de las bacterias ruminales es la disponibilidad del elemento en la fuente utilizada. Así, Martínez de Acurero et al. (1993) evaluaron la disponibilidad de diferentes fuentes de Pi a través de su efecto en la digestión de la celulosa in vitro y encontraron un marcado incremento en la digestión de este carbohidrato estructural cuando se utilizó fosfato diamónico (55,14%), ortofosfato de Ca (53,78%) y superfosfato triple (52,57%), en tanto la digestibilidad fue menor para fosfato dicálcico (41,88%) y fosfato defluorinado (37,98%). Es decir, las fuentes más solubles del elemento fueron las que lograron la mayor degradación de la celulosa. Sin embargo, al generarse estos resultados in vitro, existe la incertidumbre del efecto de la disponibilidad del P sobre los parámetros ruminales in vivo, ya que hay reciclaje salival del mineral y posiblemente existe la capacidad de la flora ruminal para adaptarse a las variaciones en la concentración de P en el medio ruminal a lo largo del día.
En referencia al P contenido en los alimentos, principalmente en los granos, éste se encuentra en forma de fitato (mio-inositol hexaquifosfato), el cual es poco disponible para los animales, sobre todo para los monogástricos. En contraste, diferentes autores señalan que en los rumiantes, el 90% del P fítico es hidrolizado por las bacterias ruminales cuando la proporción en esta forma es menor al 50% del P total contenido en la ración. Esta hidrólisis del fitato puede no ser tan eficiente en las nuevas formas de alimentación con dietas ricas en granos y, además, las diferentes sales de ácido fítico encontradas en los alimentos, como el fitato de Na contenido en el maíz y en el arroz, o el fitato de Ca de la harinolina, pueden no ser hidrolizadas con la misma eficiencia por los microorganismos ruminales (Godoy y Meschy, 2001). Yanke et al., (1998) reportaron que la actividad de la fitasa producida por las bacterias ruminales podía compararse favorablemente con las reportadas por diferentes autores para Aspergillus ficuum (600U/ml), Bacillus subtilis (44U/ml) y E. coli (5600U/ml). Bravo et al. (2000) utilizaron la técnica de la bolsa de nylon y encontraron diferencias en la velocidad de la disponibilidad del P de los granos de destilería en el rumen, siendo más rápidamente disponible el proveniente del trigo respecto al de maíz. Konishi et al. (1999), Park et al. (1999) y Bravo et al. (2000) encontraron que la liberación del P de los alimentos disminuye marcadamente cuando han sido sometidos a ciertos tratamientos, como el calentamiento o la aplicación de formaldehído.
Efectos de la Deficiencia de Fósforo de los Microorganismos Ruminales sobre el Animal
En el caso de dietas no balanceadas, es decir, que contengan un exceso de energía y sean deficientes en proteína o en P (o azufre), las bacterias consumen rápidamente esta energía, pero la síntesis microbiana es baja. A este fenómeno se le conoce como "desacoplamiento de las fermentaciones" (Durand et al., 1989; Figura 1) y finalmente se producen cantidades altas de AGV sin crecimiento bacteriano. El desperdicio de energía resultante está ligado a la existencia de reacciones improductivas generadoras de calor y pone en marcha ciclos metabólicos inútiles. Parte de la energía producida podría ser utilizada incluso para la hidrólisis del ATP. En algunos casos, la baja producción de energía puede compensarse con mayor eficacia en su utilización. Por ejemplo, cuando las dietas son ricas en glúcidos rápidamente fermentables, las bacterias productoras de ácido láctico desplazan a las generadoras de acetato, ya que durante la síntesis del primero se genera menor cantidad de ATP. Debido a su elevada capacidad de crecimiento, las bacterias lácticas pueden fabricar mayores cantidades de ATP por unidad de tiempo y competir por los sustratos con las bacterias productoras de acetato. La generación de lactato conducirá al rápido descenso del pH ruminal, con la consecuente disminución de la población y de la actividad de las bacterias productoras de acetato (Jouany et al., 1995) y la presentación de acidosis en el animal.
Petri et al. (1988), al estudiar la respuesta de cabras lecheras (11-12 semanas de lactación) a un bajo consumo de P (71,4% menor al testigo), encontraron un incremento significativo en el pH ruminal, mientras que la digestibilidad de la MO y la síntesis de la proteína microbiana disminuyeron. La producción neta de proteína se redujo de 34,1 a 13,7g de N/día, lo que se reflejó en una menor contribución de N de origen bacteriano a la proteína de la leche, la cual bajó de 5,3 a 2,7g/día, mientras que la proteína de la leche de origen no bacteriano permaneció sin cambio (5,7g/día).
Si el contenido de P en el rumen disminuye, la actividad microbiana se reduce y esto se acompaña por reducciones en el consumo de alimento (Underwood y Suttle, 1999). Valk y ebek (1999) al igual que otros autores, encontraron una disminución en el consumo de alimento y en la producción láctea al alimentar con dietas pobres en P (2,4g/kg de MS) a vacas lecheras durante un periodo prolongado. La disminución en la concentración del elemento en la saliva afectó el aporte del mineral para los microorganismos, afectando la degradación normal de la fibra. Sin embargo, la disminución del P salival solo se presentó al final de la segunda lactación, cuando la resorción ósea no fue capaz de mantener la concentración de P en la saliva. Ekelund et al. (2003) sugieren utilizar este fenómeno como posible estrategia en la alimentación de la vaca lechera, es decir aportar en la dieta cantidades bajas de P durante la lactación temprana (cuando el animal tiene reservas óseas adecuadas) y combinar con cantidades mayores al final de la lactancia (y volver a formar reservorios).
Conclusión
Los estudios realizados con respecto al requerimiento de P de los microorganismos ruminales demuestran la existencia de necesidades diferentes para cada actividad específica. El P aportado por la dieta deberá satisfacer los requerimientos más elevados de los microorganismos ruminales para que puedan realizar sus funciones metabólicas adecuadamente. El contenido alimentario de P y su liberación a nivel ruminal, así como el P endógeno reciclado principalmente por la saliva y la capacidad de las bacterias para manejar las variaciones en la concentración de este mineral en el contenido ruminal, constituyen las formas principales en que las bacterias pueden disponer del elemento. Así, en el marco de las nuevas recomendaciones alimentarias de P para el ganado lechero en los diferentes países, los requerimientos del mineral de los microorganismos ruminales no presentan problemas para ser satisfechos. En cuanto al ganado bovino productor de carne cuya alimentación está basada principalmente en alimentos concentrados, condición que favorece la presencia de flora amilolítica, las necesidades de este tipo de flora serían cubiertas fácilmente debido a su menor necesidad de P, pero es necesario tomar en cuenta la alteración del medio ambiente ruminal a consecuencia de una disminución del pH debida al tipo de alimentación. Se requieren más investigaciones sobre los factores que afectan estas fuentes del elemento como son el CAR, la disponibilidad en el rumen del P en los ingredientes de la dieta y los factores que modifican la producción de saliva, además de la capacidad de las bacterias para modificar su actividad y ajustarla a las concentraciones variables del elemento. El efecto contaminante del ganado como gran aportador de P al medio ambiente, podrá reducirse a través de la inclusión adecuada del elemento en la dieta, sin afectar la eficiencia de los microorganismos ruminales. Es también indispensable continuar investigando el papel que desempeña el P en el metabolismo de los otros microorganismos presentes en el rumen (protozoarios y hongos), para conocer su efecto sobre el funcionamiento ruminal, sobre el animal y sobre la producción pecuaria sostenible.
Agradecimientos
Los autores agradecen a Silvia E. Buntinx Dios, Departamento de Nutrición Animal y Bioquímica, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, por la revisión y corrección de este trabajo.
REFERENCIAS
1. ARC (1980) The nutrient requirements of ruminant livestock. Agricultural Research Council. Commonwealth Agricultural Bureau. Londres, RU. 351 pp. [ Links ]
2. Barlet JP, Davicco MJ, Coxam V (1995) Physiologie de labsorption intestinale de phosphore chez lanimal. Reprod. Nutr. Dev. 35: 475-489. [ Links ]
3. Beaumatin P (1981) Influence du phosphore alimentaire sur la digestion et la proteosynthése microbiennes dans le rumen du mouton. Tesis. Université Paul Sabatier. Toulouse, Francia. 110 pp. [ Links ]
4. Bravo D, Meschy F (2003) Vers une révision des recommandations dapports en phosphore chez le ruminant. INRA Prod. Anim. 16: 19-26. [ Links ]
5. Bravo D, Meschy F, Bogaert C, Sauvant D (2000) Ruminal phosphorus availability from several feedstuffs measured by the nylon bag technique. Reprod. Nutr. Dev. 40: 149-162. [ Links ]
6. Broudiscou LP, Papon Y, Broudiscou AF (1998) Effets de la supplémentation minérale sur le métabolisme azoté des micro-organismes du rumen, étude en fermenteur à effluent double. Renc. Rech. Ruminants. 5: 249. [ Links ]
7. Broudiscou LP, Papon Y, Broudiscou AF (1999) Effects of minerals on feed degradation and protein synthesis by rumen micro-organisms in a dual effluent fermenter. Reprod. Nutr. Dev. 39: 255-268. [ Links ]
8. Cook DI (1995) Salivary secretion in ruminants. En Engelhardt WV, Leonhard-Marek S, Breves G, Giesecke D (Eds.) Proc. 8th Int. Symp. on Ruminant Physiology. Stuttgart, Alemania. pp 153-170. [ Links ]
9. Chaudray LC, Srivastava A (1994) Effect of rumen protozoa on calcium and phosphorus utilization in male buffalo calves. Ind. J. Anim. Sci. 64: 893-895. [ Links ]
10. Czerkawski JW (1976) Chemical composition of microbial matter in the rumen. J. Sci. Food Agric. 27: 621-632. [ Links ]
11. Durand M, Kawashima R (1980) Influence of major minerals in rumen microbial digestion. En Ruckebusch Y, Thivend P (Eds.) Digestive Physiology and Metabolism in Ruminants. MTP Press. Lancaster, Inglaterra. pp 375-408. [ Links ]
12. Durand M, Beaumatin P, Dumay C (1983) Estimation in vitro à laide du phosphore radioactif des besoins en phosphore des microorganismes du rumen. Reprod. Nutr. Dev. 23: 727-739. [ Links ]
13. Durand M, Beaumatin Ph, Dumay C, Meschy F, Komisarczuk S (1986) Influence de laddition de phosphore sur la digestion dune paille traitée à lamoniac par les microorganismes du rumen en fermenteur semi-continu. Reprod. Nutr. Dev. 26(1B): 297-298. [ Links ]
14. Durand M, Stevani J, Komisarczuk S (1987) Effect of some major minerals on rumen microbial metabolism in a semi-continuos fermentor (RUSITEC). Med. Fac. Landbouww. Rijkksuniv. Gent. 52: 1655-1663. [ Links ]
15. Durand M, Dumay C, Beaumatin P, Morel MT (1988) Use of the rumen simulation technique (RUSITEC) to compare microbial digestion of various by-products. Anim. Feed Sci. Technol. 21: 197-204. [ Links ]
16. Durand M, Komisarczuk-Bony S, Meschy F (1989) Phosphorus requirement for rumen microbial activity. En Recent Progress on Mineral Nutrition and Mineral Requirements in Ruminants. Kyoto, Japon. pp 27-34. [ Links ]
17. Ekelund A (2003) Phosphorus on the dairy cow. Influence of intake level, source and stage of lactation on apparent digestibility and bone turnover. Tesis. Universidad de Suecia de Ciencias Agrícolas. Uppsala, Suecia. 42 pp. [ Links ]
18. Ekelund A, Spörndly R, Valk H, Murphy M (2003) Influence of feeding various phosphorus sources on apparent digestibility of phosphorus in dairy cows. Anim. Feed Sci. Technol. 109: 95-104. [ Links ]
19. Godoy S, Meschy F (2001) Utilisation of phytate phosphorus by rumen bacteria in a semi-continuous culture system (RUSITEC) in lactating goats fed on different forage to concentrate ratios. Reprod. Nutr. Dev. 41: 259-265. [ Links ]
20. Hénin S, Sebillote S (1990) Phosphate et environnement. Comp. Rend. Acad. Agric. France 76: 25-28. [ Links ]
21. Jarrige R, Journet M, Verite R, Champredon C, Pion R (1978) Azote. En Alimentation des Ruminants. INRA. París, Francia. pp 89-128. [ Links ]
22. Jouany JP, Broudiscou L, Prins RA, Komisarczuk-Bony S (1995) Métabolisme et nutrition de la population microbienne du rumen. En Jarrige R, Ruckebusch Y, Demarquilly C, Farce MH, Journet M (Eds.) Nutrition des Ruminants Domestiques. Ingestion et Digestion. INRA. París, Francia. pp. 349-382. [ Links ]
23. Komisarczuk S (1985) Etude de linfluence du phosphore sur lactivité fermentaire, la proteosynthése et les teneurs en ATP des contenus de rumen dans différents systèmes de culture continus. Tesis. Université de París, Francia. 200 pp. [ Links ]
24. Komisarczuk S, Durand M (1991) Nutrient requirement of rumen microbes. Proc. 3rd Int. Symp. on Nutrition of Herbivores. Penang, Malasia. pp. 133-141. [ Links ]
25. Komisarczuk S, Merry RJ, McAllan AB, Smith RH, Durand M (1984) Use of a continuous culture system to study phosphorus requirements in the rumen. Can. J. Anim. Sci. 64(Supl): 35-36. [ Links ]
26. Komisarczuk S, Durand M, Durnay C, Morel T (1986) Use of a semicontinuous culture system (RUSITEC) to study the effects of phosphorus deficiency on rumen microbial digestion. Biol. Anaer. Bact. pp. 47-53. [ Links ]
27. Komisarczuk S, Durand M, Beaumatin Ph, Hannequart G (1987a) Effects of phosphorus deficiency on rumen microbial activity associated with the solid and liquid phases of a fermentor (RUSITEC). Reprod. Nutr. Dev. 27: 907-919. [ Links ]
28. Komisarczuk S, Merry RJ, McAllan AB (1987b) Effect of different levels of phosphorus on rumen microbial fermentation and synthesis determined using a continuous culture tecnique. Br. J. Nutr. 57: 279-290. [ Links ]
29. Konishi C, Matsui T, Park X, Yano H, Yano F (1999) Heat treatment of soybean meal and rapeseed meal suppresses rumen degradation of phytate phosphorus in sheep. Anim. Feed Sci. Technol. 80: 115-122. [ Links ]
30. Kumaresan A (1976) Interactions entre le zinc et les microorganismes du rumen chez le mouton recevant de lurée comme source unique dazote. Tesis. Université Paul Sabatier. Toulouse, Francia. 96 pp. [ Links ]
31. López H, Kanitz FD, Moreira VR, Satter LD, Wiltbank MC (2004) Reproductive performance of dairy cows fed two concentrations of phosphorus. J. Dairy Sci. 87: 146-157. [ Links ]
32. Martínez de Acurero M, Capó E, Chicco CF, Godoy de León S, Acurero G, Quintana H (1993) Digestibilidad in vitro de la celulosa utilizando diferentes fuentes de fósforo. Zootech. Trop. 11: 3-12. [ Links ]
33. McDowell LR, Conrad JH, Glen-Hembry F (1993) Minerals for grazing Ruminants in Tropical Regions. 2ª ed. Animal Science Center for Tropical Agriculture. University of Florida. Gainesville, FL, EEUU. 77 pp. [ Links ]
34. Meschy F (2003) Re-assessment of dietary allowances: absorbed phosphorus requirements in ruminants. En Garnsworthy PC, Wiseman J (Eds.) Recent Advances in Animal Nutrition. Nottingham, RU. pp 175-189. [ Links ]
35. NRC (1989) Nutrient requirements of domestic animals. Nutrient requirements of dairy cattle. 6a ed. National Research Council. National Academy of Sciences. Washington DC, EEUU. 157 pp. [ Links ]
36. NRC (1996) Nutrient requirements of domestic animals. Nutrient requirements of beef cattle. 7a ed. National Research Council. National Academy of Sciences. Washington DC, EEUU. 248 pp. [ Links ]
37. NRC (2001) Nutrient requirements of domestic animals. Nutrient requirements of dairy cattle. 7a ed. National Research Council. National Academy of Sciences. Washington DC, EEUU. 381 pp. [ Links ]
38. Park WY, Matsui T, Konishi C, Kim SW, Yano F, Yano H (2000) Heat treatment of rapeseed meal increases phytate flow into the duodenum of sheep. Anim. Feed Sci. Technol. 88: 31-37. [ Links ]
39. Petri A, Münschen H, Breves G, Ritcher O, Pfeffer E (1988) Reponse of lactating goats to low phosphorus intake 2. Nitrogen transfer from rumen ammonia to rumen microbes and proportion of milk protein derived from microbial amino acids. J. Agr. Sci. 110: 265-271. [ Links ]
40. Satter LD (2003) Phosphorus management in cattle production systems. En Garnsworthy PC, Wiseman J (Eds.) Recent Advances in Animal Nutrition. Nottingham, RU. pp. 157-174. [ Links ]
41. Spiekers H, Brintrup R, Balmelli M, Pfeffer E (1993) Influence of dry matter intake on faecal phosphorus losses in dairy cows fed rations low in phosphorus. J. Anim. Physiol. Anim. Nutr. 69: 37-43. [ Links ]
42. Underwood EJ, Suttle NF (1999) The Mineral Nutrition of the Livestock. 3ª ed. CABI. Nueva York, EEUU. 614 pp. [ Links ]
43. Valk H, Beynen AC (2003) Proposal for the assessment of phosphorus requirements of dairy cows. Liv. Prod. Sci. 79: 267-262. [ Links ]
44. Valk H, Sebek LBJ (1999) Influence of long-term feeding of limited amounts of phosphorus on dry matter intake, milk production, and body weight of dairy cows. J. Dairy Sci. 82: 2157-2163. [ Links ]
45. Valk H, Metcalf JA, Whiters PJA (2000) Prospects for minimising P-excretion in ruminants by dietary manipulation. J. Envir. Qual. 29: 28-36 [ Links ]
46. Valk H, Sebek LBJ, Beynen AC (2002) Influence of phosphorus intake on excretion and blood plasma and saliva concentrations of phosphorus in dairy cows. J. Dairy Sci. 85: 2642-2659. [ Links ]
47. Van Nevel CJ, Demeyer DI (1977) Determination of rumen microbial growth in vitro from 32P-labelled phosphate incorporation. Br. J. Nutr. 38: 101-114. [ Links ]
48. Viera DM (1986) The role of ciliate protozoa in nutrition of the ruminant. J. Anim. Sci. 63: 1547-1560. [ Links ]
49. Wu Z, Satter LD, Sojo R (2000) Milk production, reproductive performance, and faecal excretion of phosphorus by dairy cows fed three amounts of phosphorus. J. Dairy Sci. 83: 1028-1041. [ Links ]
50. Yanke LJ, Bae HD, Selinger LB, Cheng KJ (1998) Phytase activity of anaerobic ruminal bacteria. Microb. 144: 1565-1573. [ Links ]












 uBio
uBio 
